不同类型水生植物对富营养化水体氮转化及环境因素的影响
张 芳, 易 能, 张振华, 刘新红, 严少华, 高 岩, 唐婉莹
(1.南京理工大学化工学院,江苏 南京 210094;2.江苏省农业科学院农业资源与环境研究所,江苏 南京 210014)
水体富营养化已经成为中国水环境亟待解决的重大问题[1-3]。在现有的污染水体治理技术中,有化学除藻、加入微生物菌种和底泥疏浚等治理措施,可是实际效果并不理想,水质改善进展十分迟缓[4-5]。水生植物修复技术作为一种污水生态处理技术,和传统污水二级生化处理工艺相比较,有着工艺设备简单、投资运行成本低、氮磷去除能力强、对水力及污染负荷的抗缓冲力强、生态效益明显、对环境干扰小等特点,收获的植物还可作为食品和饲料回收再利用[6-8]。因此,水生植物修复技术适合于城市生活污水的第二级处理、风景区景观水体的处理和湖泊河流的修复,特别是对1×108m3以上水量和总氮含量在20 mg/L以下的水体更是经济有效。
不同类型水生植物净化水体氮、磷的效率和能力有差异,净化机制也有所不同[9-10]。然而,以往研究多侧重于水生植物吸收、提取氮元素的效果和机理,忽略了不同类型水生植物介导下其他净化途径的比较[11],如微生物驱动的氮转化过程、硝化反硝化等,其中硝化、反硝化等生物脱氮过程可将水体氮转化为气态产物(N2O、N2)进入到空气中,这对减缓水体生态系统中过量氮负荷带来的负面效应具有重大意义。
本研究通过静态水培试验,考察不同生活型水生植物对富营养化水体中氨态氮、硝态氮、总氮的去除能力,以及对水体释放N2O、N2等及理化环境因素的影响,期望为揭示种植不同类型水生植物条件下富营养化水体氮转化规律和机理,以及为筛选净化各类污水的适宜植物提供理论依据。
1 材料与方法
1.1 试验用水生植物
选取适合本地区亚热带季风气候类型4种不同生活型的代表性水生植物作为试验物种,即:大型漂浮水生植物凤眼莲(Eichhornia crassipes),又名水葫芦,采自江苏省农业科学院2号富营养化蓄水塘;浮叶植物菱角(Trapa),采自江苏省农业科学院宜兴基地;沉水植物黑藻(Hydrilla verticillata),采自江苏省农业科学院六合基地养鱼塘;多年生浮叶植物睡莲(Nymphaea tetragona),采自江苏省农业科学院南侧水塘。
1.2 试验用富营养化水体
采用人工配置的污水,在自来水中加入一定量的KNO3、NaH2PO4、葡萄糖,使水体硝态氮(NO-3-N)含量为10 mg/L,总磷(TP)含量为2 mg/L,总有机碳含量为20 mg/L。
1.3 试验设计
试验分2个阶段开展,分别于8月份和10-11月份进行,分别代表植物生长旺盛期和植物生理活动减弱期。设置分别种植4种水生植物的4个处理和未种植水生植物的对照,各处理重复4次,采用随机区组分布排列。试验在20个独立水泥池中进行,水泥池长152 cm,宽137 cm,深120 cm。四周和底部铺有黑色防水布,底部铺有30 cm厚底泥。池中底泥本底值为:总氮(TN)含量为4.5 mg/g,TP含量为1.3 mg/g,有机质含量为41.3 mg/g,pH值为7.05。提前移栽4种水生植物培养,8月初试验开始时各处理植物覆盖度为100%。
1.4 数据采集和分析
试验开始前配置试验用污水,配水过程中不断轻轻搅动,将加入的养分混合均匀,配水后稳定一段时间,取水样、植物样测定各种指标的初始值。由于试验初期各项指标的变化迅速,因此采集水样较为频繁,配水后12 h、24 h、48 h各取1次水样,之后每隔1 d取1次水样,取样量为100 ml。取样方式为多点取样,于5 L的聚乙烯桶中混匀,用塑料瓶取100 ml带回试验室立即测定铵态氮含量测定采用酚二磺酸光度法含量测定采用纳氏试剂光度法,TN含量测定采用过硫酸钾氧化-紫外分光光度法。
在试验期间于固定时间(下午4∶00)用多功能水质测定仪(YSI ProPlus)现场测定各处理水体表层(水面以下5 cm)和水体底层(底泥上5 cm)环境参数[温度(T)、酸碱度(pH)、溶解氧(DO)浓度]。
在天气晴朗的条件下,每隔2 d采集1次气体,如遇阴雨天,适当延长间隔时间。气体采集装置为本研究室设计的气体收集装置[12-14],装置有4个小罩子,用2个三通阀连接1个采气瓶。用气相色谱仪测定水体释放气体的总量及N2、N2O和O2等分量,具体分析方法参照参考文献[12]、[13]、[14]。
1.5 数据处理
用Excel和Spass18.0进行数据整理和方差分析,用Sigmaplot作图。统计检验显著性概率为P<0.05。
2 结果与分析
2.1 不同类型水生植物对水体氮去除能力的影响

图1 种植不同水生植物水体中NH4+-N含量变化Fig.1 Changes of NH 4+-N concentrations in the water with or without cultivation of different types of aquatic plants
如图1所示,在2个试验阶段(8月份、10-11月份),各处理NH+4-N浓度呈波动变化,但试验结束时,均有明显的下降。8月份植物生长旺盛时期,试验过程中,睡莲处理的NH4-N浓度基本保持最高,变幅为(2.94±0.48)mg/L至(1.32±0.22)mg/L,其次是菱角处理,变幅为(2.11±0.06)mg/L至(0.38±0.06)mg/L,黑藻处理为(2.06±0.44)mg/L至(0.16±0.01)mg/L,对照为(1.82±0.43)mg/L至(0.22±0.01)mg/L,凤眼莲处理NH+4-N浓度变幅为(1.00±0.12)mg/L至(0.15±0.01)mg/L,最终浓度最低。10-11月在植物凋亡期,试验过程中,睡莲处理的NH+4-N浓度依旧最高,变幅为(4.72±0.27)mg/L至(1.24±0.27)mg/L,其次是对照和黑藻处理,变幅分别为(1.91±0.73)mg/L至(0.22±0.03)mg/L和(1.58±0.18)mg/L至(0.24±0.04)mg/L,菱角和凤眼莲处理差异不大,两者NH+4-N浓度最低。

图2 种植不同水生植物水体中NO3--N含量变化Fig.2 Changes of NO 3--N concentrations in the water with or without cultivation of different types of aquatic plants
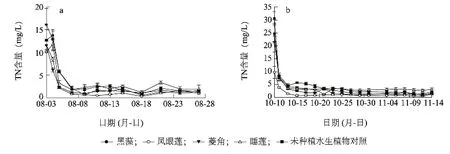
图3 种植不同水生植物水体中总氮(TN)的含量变化Fig.3 Changes of total nitrogen concentrations in the water with or without cultivation of different types of aquatic plants
由图3可知,在2个试验阶段,各处理TN浓度都在试验开始后迅速降低,之后趋于平稳。8月份各处理TN浓度下降的速率高于10-11月份。在2个试验阶段,各处理间TN浓度的降低速率及程度表现出明显的差异。8月份,试验开始后2 d,凤眼莲处理的TN浓度下降最快,降低到 (2.12±0.16)mg/L,其次是菱角处理,降低到 (2.34±0.21)mg/L,黑藻和对照的 TN浓度降低的速率最小;10-11月份,凤眼莲处理的TN浓度降低速率最大,降低到(1.35±0.14)mg/L,其次是黑藻处理,降低到(3.18±0.24)mg/L,对照降低速率最小。分别在8月份和10-11月份试验结束时,各处理TN最终浓度也表现出一定的差异,凤眼莲处理的TN最终浓度均最低,分别为 (0.98±0.21)mg/L和 (1.16±0.11)mg/L,其他处理间差异不大,最终浓度分别为(1.14±0.16)mg/L至(1.91±0.88)mg/L和(1.46±0.10)mg/L至(3.14±2.01)mg/L。
2.2 不同类型水生植物对水体释放气体规律的影响
水体释放气体测定结果(表1)显示,在2个试验阶段各处理气体释放总量、浓度及通量差异较大。8月份植物生长旺盛期试验期间水体释放气体的总量显著高于10-11月份植物缓慢生长期(P<0.05),在2个试验阶段黑藻处理释放气体总量最大,分别为 (3 272.68±950.21)ml和 (1487.91±628.56)ml,其余依次为:对照、睡莲处理、菱角处理、水葫芦处理。在2个试验阶段,各处理释放气体的浓度也表现出明显的差异。除O2外,各处理释放的N2、N2O浓度基本上表现为8月份植物生长旺盛期显著高于10-11月份植物生长缓慢期(P<0.05),在2个试验阶段,各处理释放的N2浓度最大,N2O浓度最小。
从各处理释放气体的通量来看,8月份植物生长旺盛期显著高于10-11月份植物生长缓慢期(P<0.05)。同一试验阶段不同处理间释放各类气体的通量存在很大差异,其中黑藻处理在2个试验阶段释放各类气体的通量均为最大,凤眼莲最小。8月份各处理释放N2通量大小顺序为:黑藻处理>睡莲处理>对照>菱角处理>凤眼莲处理;10-11月份各处理释放N2、O2通量大小顺序皆为:黑藻处理>对照>菱角处理>睡莲处理>凤眼莲处理;8月份各处理释放O2、N2O通量大小顺序皆为:黑藻处理>对照>睡莲处理>菱角处理>凤眼莲处理;10-11月份各处理释放N2O通量无差别。

表1 不同类型水生植物处理水体释放的气体总量、浓度及通量Table 1 The amount,concentrations and flux of gas released by four types of aquatic plants in two growth periods
2.3 不同类型水生植物对水体理化指标的影响
8月份水体表层和底层温度、酸碱度(pH)、溶解氧(DO)都高于10-11月份(表2)。2个试验阶段同一处理水体表层和底层温度无明显差别,不同处理之间水温表现出一定的差异。在8月份,黑藻处理水体表层水温与对照表层温度相近,平均温度分别为31.03℃和31.23℃,并且均显著高于其他处理(P<0.05);凤眼莲处理的水体表层温度最低,平均温度为29.42℃,显著低于其他处理(P<0.05);种植水生植物的水体底层温度 (27.3~30.6℃)显著低于对照的水体底层温度(31.23℃)(P<0.05)。10-11月份,各处理间水温差异不显著(P >0.05)。
在2个试验阶段,同一处理水体表层DO浓度整体高于底层。不同处理间水体DO浓度表现出明显差异,8月份对照水体表层DO浓度平均为10.41 mg/L,显著高于黑藻处理的表层 DO浓度(P<0.05),水体表层DO浓度大小顺序为:对照>黑藻处理>菱角处理≈睡莲处理>凤眼莲处理;底层DO浓度大小顺序为:对照>黑藻处理>凤眼莲处理>菱角处理>睡莲处理。10-11月份,各个处理表层和底层DO浓度大小顺序均为对照>菱角处理>黑藻处理>凤眼莲处理>睡莲处理。
8月份水体表层和底层pH均高于10-11月份。同一处理水体表层pH基本上稍高于底层,8月份黑藻处理表层pH平均值为9.72,底层为8.17。8月份,黑藻处理表层和底层水体pH值与对照差异不大,黑藻处理和对照均显著高于凤眼莲处理、菱角处理和睡莲处理,而凤眼莲处理、菱角处理和睡莲处理的表层间和底层间pH值差异均不显著。
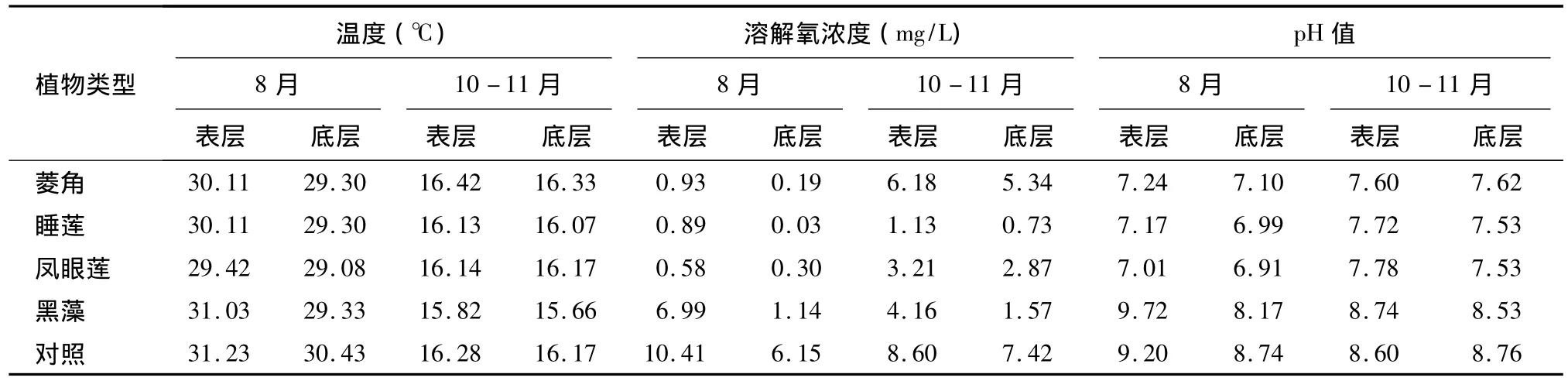
表2 不同类型水生植物处理的水体温度、溶解氧浓度、pH值的变化Table 2 Changes of temperature,dissolved oxygen(DO)and p H value of water with four types of aquatic plants
3 讨论
在静态模拟试验中发现,随着试验时间的延长,漂浮植物凤眼莲、浮叶植物菱角和睡莲、沉水植物黑藻4种水生植物对富营养化水体中都有不同程度的净化作用。虽然未种植水生植物的对照中各形态氮含量也呈下降趋势,但其下降幅度明显低于种植水生植物的处理。根据前期研究结果,未种植水生植物的水体主要通过硝化、反硝化等生物脱氮过程损失氮素[15]。水生植物对氮素的去除能力与植物本身的生物学特性和生态类型有关,如凤眼莲生长过程中分蘖迅速,生物量增加快,其发达的根系与水体的接触面积很大[16],使得对水体中氮素的吸收能力增强[17]。因此,凤眼莲对水体中氮素的表观去除率较高,且能吸收低浓度的氮素[18]。而且凤眼莲易于收获处置,不会造成二次污染。菱角茎上长有大量须根,与水体的接触面积较大,对水体养分的吸收能力也较强,但其净化能力次于凤眼莲。目前,已有利用菱角修复富营养化水体的生态修复工程[19]。菱角可同时从底泥中吸收氮磷养分,降低底泥内源养分释放的风险,但菱角不易收获,大面积种植条件下无法实现机械化快速打捞,根茎腐烂后具有引起二次污染的风险。黑藻根系扎于底泥,植物体沉于水中,与水体的接触面积也较大,但黑藻吸收水体营养元素的同时,也吸收底泥中的养分,黑藻处理对水体养分的吸收能力次于菱角。黑藻茎叶脆弱,容易损伤,根系扎根于底泥,须根发达且细弱,是实现人工或机械收获难度最大的植物。浮叶植物睡莲与菱角类似,但没有菱角的须根,也不像黑藻植株沉在水中,仅依靠根系从底泥中吸收养分,所以其净化水体的能力最弱。
4种水生植物对水体微生物硝化、反硝化的调节作用不同是导致其对富营养水体氮素净化能力差异的另一原因[20]。本研究通过利用新方法收集水体中各种生物反应释放的气体,发现种植不同水生植物的水体释放气体的总量和各气体组分(N2、N2O、O2)的释放通量具有很大差别,总体上水体中气体产生量的大小顺序为:黑藻处理>睡莲处理≈对照>菱角处理>凤眼莲处理。黑藻植株沉于水下,能通过光合作用向水体释放气体[21],增强水体中通过光合作用释放气体的量,从而增加了水体释放气体的总量及各气体组分(N2、N2O、O2)的释放通量;而睡莲、菱角及凤眼莲的叶片覆盖于水面,抑制水体中的光合生产力,同时抑制大气向水体复氧,导致水体中气体产量较黑藻减少,特别是凤眼莲,遮光作用使水体中藻类浓度急剧降低,抑制藻类生长[22],因而藻类光合作用释放的气体也较少,故种植凤眼莲的水体气体产生量最少。
种植水生植物的处理中硝化、反硝化生物脱氮释放的气态产物均以N2为主,N2O中间产物浓度很低,这与稻田等生态系统排放大量温室气体N2O的情况不同[23]。黑藻处理中,水体释放N2通量显著高于其他处理,黑藻的根扎于底泥中,底泥中氮含量通常是水体中氮含量的上千倍[24],黑藻可能主要通过促进底泥中反硝化脱氮过程加强了水体系统的反硝化作用[25],如促进底泥颗粒物的分解,造成缺氧环境促进反硝化作用[26-27],根系脱落物增加反硝化作用的碳、氮源,改变沉积物及沉积物-水界面间的硝化-反硝化过程,促进铵的硝化过程,甚至也促进硝化与反硝化的耦合作用[28]等;另外,黑藻处理光照充足,茎叶为各类微生物的生长和繁殖提供了良好的附着表面[29],也能够在一定程度上促进水体中的反硝化作用。凤眼莲处理水体释放的N2通量最小,硝化、反硝化速率较其他处理慢,这与凤眼莲促进反硝化作用[15]的结论相反,这可能是因为凤眼莲繁殖速度快,植株密度很大,阻碍水气界面的气体交换,水体中产生的气体无法直接从水面排出,但凤眼莲具有发达的通气组织,茎叶基部膨大的气囊具有发达的海绵组织,水体中硝化、反硝化过程产生的气体可能会通过通气组织向空气中扩散。有大量研究结果表明,很多湿地植物如水稻、芦苇等能够通过发达的通气组织传输水体及底泥产生的N2O和CH4[30-34]。另一方面可能是由于本试验是静态模拟实验,期间水体无外源氮补充,凤眼莲吸收养分的速率极快,在3~5 d内就使水体中的总氮含量降低到小于1 mg/L,在大生物量凤眼莲存在的条件下氮素含量显著降低使硝化、反硝化反应过程缺少底物,从而使得硝化、反硝化脱除的氮对TN去除的贡献最小。菱角和睡莲虽然对水面也具有明显的覆盖遮阴作用,但繁殖速率及覆盖密度略低于凤眼莲,且根系扎于底泥,能够促进底泥中的硝化、反硝化作用,因此这2种植物对水体释放生物脱氮气体的通量略高于凤眼莲。
本试验发现不同类型水生植物对环境因素的影响有所差异,凤眼莲能明显降低水体的DO浓度、pH值和温度。大量试验结果也已经证实[35-37],影响水体DO的因素主要是水体中藻类光合作用放氧、大气复氧及水体有机物分解耗氧。凤眼莲的遮光作用,减少了藻类光合作用的放气量[38],也阻断了大气向水体复氧,此外凤眼莲根系的呼吸作用也消耗水体的DO,所以凤眼莲处理的DO浓度在8月份最低,而10-11月份凤眼莲处理的DO浓度变大,可能是因为凤眼莲在10-11月份生长缓慢,覆盖度下降,光的透过率增加,使得大气向水体复氧,故DO浓度变大。凤眼莲的生长特性使得其处理的水体温度低于对照温度,同时繁茂的植株可以为水体保温。凤眼莲处理中pH值的降低是因为藻类对水体CO2的吸收利用减少,一些有机物在凤眼莲根际的分解产生大量有机酸,凤眼莲根系及水生动物呼吸作用产生CO2等。对照水体中含有大量的浮游藻类,浮游藻类进行光合作用放氧,使水体溶氧量升高,同时由于对照中光被遮挡较少,底层溶氧也较高。黑藻由于沉水特性,自身的光合作用释放氧气,吸收二氧化碳,故水体DO浓度较高,由于叶片的遮挡效应,底层叶片的光合作用较弱,因此表层水体的溶氧变化幅度大于底层水体。黑藻处理与对照间水体DO浓度无显著差异,但显著高于其他3个处理。沉水植物能显著提高水体的pH值,与文献[27]报道一致,主要原因是沉水植物的光合作用消耗水中的。菱角和睡莲处理对光的遮挡大于对照和黑藻处理,小于凤眼莲处理,大气复氧能力强于凤眼莲处理,弱于黑藻处理和对照,故DO浓度高于凤眼莲处理,低于黑藻处理和对照;10-11月份试验阶段由于温度降低,菱角大量凋亡,菱角处理的水体溶氧量逐渐接近对照。菱角和睡莲处理中藻类生长能力也介于凤眼莲、黑藻处理与对照之间,故pH也呈现相同的规律。这一规律可以用于指导富营养化水体的管理,特别是需要保持较高溶氧量的生态系统中,如果环境条件(水深、底泥、养分等等)适宜,采用黑藻较为合适。在温暖的气候下,这4种植物都适于治理水体。但在低温条件下水生植物对营养物的去除能力均有所下降,这是生物修复的主要弊端,这时可以考虑采用其他的修复技术,例如生物电化学和物理电化学技术。
[1] 赵永宏,邓祥征,战金艳,等.我国湖泊富营养化防治与控制策略研究进展[J].环境科学与技术,2010,33(3):92-98.
[2] 高爱环,李红缨,郭海福.水体富营养化的成因,危害及防治措施[J].肇庆学院学报,2005,26(5):41-44.
[3] 高柳青,晏维金.富营养化对三湖水环境影响及防治探讨[J].资源科学,2002,24(3):19-25.
[4] FREEDMAN B.Environmental ecology[M].Sandiego:Academic Press,2002.
[5] 王国祥,濮培民.若干人工调控措施对富营养化湖泊藻类种群的影响[[J].环境科学,1999,20(7):71-74.
[6] 张 艺,许文年,方艳芬,等.三峡库湾香溪河生态环境研究进展[J].三峡大学学报:自然科学版,2007,29(1):20-24.
[7] 刘 盼,宋 超,朱 华,等.3种水生植物对富营养化水体的净化作用研究[J].水生态学杂志,2011,32(2):69-73.
[8] 李安峰,潘 涛,杨 冲,等.水体富营养化治理与控制技术综述[J].安徽农业科学,2012,40(16):9041-9044,9062.
[9] 万晓红,李旭东,王雨春,等.不同水生植物对湿地无机氮素去除效果的模拟[J].湖泊科学,2008,20(3):327-333.
[10]魏东慧,张江汀,魏学智.4种水生植物对富营养化水体氮磷去除效果的研究[J].中国野生植物资源,2012,31(5):12-17.
[11]黄 亚,傅以钢,赵建夫.富营养化水体水生植物修复机理的研究进展[J].农业环境科学学报,2005,24(增刊):379-383.
[12] GAO Y,LIU X H,YIN,et al.Estimation of N2and N2Oebullition from eutrophic water using an improved bubble trap device[J].Ecological Engineering,2013,57:403-412.
[13]刘新红,严少华,张志勇,等.一种水体底泥释放气体的收集装置:中国,201220549038.0[P].2013-04-24.
[14]高 岩,刘新红,马 涛,等.水体释放气体的研究:收集装置描述及收集气体成分研究[C]//中国农业生态环境保护协会.第五届全国农业环境科学学术研讨会论文集.天津:中国农业生态环境保护协会,2013:578-586.
[15]高 岩,易 能,严少华,等.凤眼莲对富营养化水体硝化、反硝化脱氮释放N2O的影响[J].环境科学学报,2012,32(2):349-359.
[16]郑 翀,王洪艳.不同类型水生植物在人工湿地中的净化效果研究进展[J].广东化工,2009,36(7):121-123.
[17]张迎颖,吴富勤,张志勇,等.凤眼莲有性繁殖与种子结构及其活力研究[J].南京农业大学学报,2012,35(1):135-138.
[18]常会庆,李 娜,徐晓峰.三种水生植物对不同形态氮素吸收动力学研究[J].生态环境,2008,17(2):511-514.
[19]叶 月,徐文娟,威 鹏,等.菱角对富营养化水体净化效果的研究[J].长江蔬菜:学术版,2012(16):63-65.
[20]田如男,朱 敏,孙欣欣,等.不同水生植物组合对水体氮磷去除效果的模拟研究[J].北京林业大学学报,2011,33(6):191-195.
[21]邹国林,王全金,朱 平,等.低温下沉水植物塘对农村污染水体的净化作用[J].武汉工程大学学报,2012,34(3):39-41,69.
[22] KIM Y,KIM W.Roles of water hyacinths and their roots for re-ducing algal concentrations in the effluent from waste stabilization ponds[J].Water Res,2000,34:3285-3294.
[23]马义虎,顾道健,刘立军,等.玉米秸秆源有机肥对水稻产量与温室气体排放的影响[J].中国水稻科学,2013,27(5):520-528.
[24]童昌华,杨肖娥,濮培民.水生植物控制湖泊底泥营养盐释放的效果与机理[J].农业环境科学学报,2003,22(6):673-676.
[25] KARJALAINEN H,STEFANSDOTTIR G,TUOMINEN L,et al.Do submersed plants enhance microbial activity in sediment[J].Aquatic Botany,2001,69:1-13.
[26] HAMERSLEY M R,HOWESB L.Control of denitrification in a sept age treating artificial wetland:the dual role of particulate organic carbon[J].Water Res,2002,36:4415-4427.
[27]王东启,陈振楼,许世远,等.长江口潮滩沉积物反硝化作用及其时空变化特征[J].中国科学B辑:化学,2007,37(6):604-611.
[28] CAFFREY T M,KEMPW M.Nitrogen cycling in sediments with estuarine populations of Potamogeton perfoliatus and Zoetera marina[J].Mar Ecol Prog Ser,1999,66:147-160.
[29]李聪聪,吴振东,周 青,等.植物-微生物共代谢系统在湖泊修复中的作用[J].上海环境科学,2012(31):240-244.
[30]成水平,吴振斌,夏 宜.水生植物的气体交换与输导代谢[J]. 水生生物学报,2003,27(4):413-417.
[31]胡 泓,王东启,李杨杰,等.崇明东滩芦苇湿地温室气体排放通量及其影响因素[J].环境科学研究,2014(2):43-50.
[32]傅志强,朱华武,陈 灿,等.水稻根系生物特性与稻田温室气体排放相关性研究[J].农业环境科学学报,2012,30(12):2416-2421.
[33]王东启,陈振楼,王 军,等.夏季长江口潮间带CH4、CO2和N2O通量特征[J].地球化学,2007,36(1):77-88.
[34]王洪君,王为东,卢金伟,等.湖滨带温室气体氧化亚氮(N2O)排放研究[J].生态环境,2006,15(2):270-275.
[35] GIRALDOE,GARZON A.The potential for water hyacinth to improve the quality of Bogota River water in the Muña Reservoir:comparison with the performance of waste stabilization ponds[J].Water Science and Technology,2002,42:103-110.
[36] ROMMENSW,MAESJ,DEKEZA N,et al.The impact of waterhyacinth(Eichhornia crassipes)in a eutrophic subtropical impoundment(Lake Chivero,Zimbabwe).I.Water quality[J].Archiv of Hydrobiologie,2003,158:373-388.
[37]蔡雷鸣.福建闽江水口库区飘浮植物覆盖对水体环境的影响[J].湖泊科学,2006(18):250-254.
[38] MEERHOFF M,MAZZEO N,MOSS B,et al.The structuring role of free-floating versus submerged plants in a subtropical shallow lake[J].Aquatic Ecology,2003,37:377-391.
[39]王传海,李宽意,文明章,等.苦草对水中环境因子影响的日变化特征[J].农业环境科学学报,2007,26(2):798-800.
[40]王 智,张志勇,张君倩,等.两种水生植物对滇池草海富营养化水体水质的影响[J].中国环境科学,2013,33(2):328-335.

