内生真菌HL-1的除草活性及对作物的安全性
程 亮, 郭青云
(1.青海省农林科学院植物保护研究所/青海省农业有害生物综合治理重点实验室,青海 西宁 810016;2.农业部西宁作物有害生物科学观测实验站,青海 西宁 810016)
农田杂草是农业生产和农产品质量的重要影响因 子之一,化学除草剂可有效去除农田杂草并在提高农作物产量方面起到不可低估的作用。但从20世纪70年代中期以来,抗药性杂草种类不断上升,环境污染问题日益显现。微生物除草剂因其对目标杂草以外的植物影响小、环境负效应小、安全性高等优势而成为近年来杂草生物防治研究中的一个较为活跃的领域。
近年在生防真菌的新菌株筛选、致病力和寄主专一性测定、扩散与流行规律、商品化产品开发等方面的研究取得了显著进展 。强胜等通过对杂草病原代谢产物的研究,先后成功研制出2种微生物源除草剂[4]。李俊、杨叶、李永龙等先后研究了有关病原微生物代谢产物的除草活性[5-7]。强胜、王惠、李荣金等对除草活性物质开展了分离纯化等研究[8-10]。Schulz等对从不同植物中分离到的6 500株内生真菌进行活性测定,发现80%~83%具有抗细菌、抗真菌和除草活性[11]。
内生真菌代谢途径及代谢物的多样性不仅与其种属有关,还与其所处的微生态环境有关。青藏高原独特的环境条件孕育了独特的微生物群落,但青海在杂草病原菌的收集及生防研究领域的相关工作较少。我们从2010年开始从青海共分离获得53株微生物,其中在刺儿菜叶上获得一株具有强致病力的植物内生菌HL-1菌株。
本研究拟对菌株HL-1进行菌饼致病性和发酵滤液除草活性等研究,并对其生防安全性进行初步评估,旨在为今后深入研究、开发微生源除草剂提供理论依据。
1 材料与方法
1.1 病样的采集及病原菌的分离纯化
从青海省化隆县采集发病的刺儿菜(Cirsium setosum)叶片,将其分装于自封袋中,实验室内对发病症状进行记录、拍照,并于4℃冰箱保存备用。参照文献[12]对刺儿菜叶片病害标本进行分离和培养,每个PDA培养基平板上放置5个组织块,培养4 d后病组织表面出现菌丝,接种针挑取菌丝进行病原菌的纯化并编号。
1.2 HL-1菌株的致病性测定
1.2.1 菌饼的致病性测定 采集野外健康新鲜的猪殃殃(Galium aparine L.)、藜(Chenopodium album L.)、冬葵(Malva crispa L.)、酸模叶蓼(Polygonum lapathifolium L.)幼叶,用无菌水冲洗3次后自然晾干,放置于垫有无菌滤纸的培养皿(Φ=9 cm)内,在培养7 d的菌落边缘取菌饼(Φ=8 mm)接种到叶片正面,以接种无菌的PDA培养基块为对照,置于(25±1)℃光照培养箱中保湿培养,分别于接种后3 d、5 d观察叶片发病情况。
1.2.2 代谢产物的致病性测定 在培养7 d后的菌落边缘取菌丝块接种到装有200 ml PD的培养瓶中,每瓶接5块,25℃、150 r/min培养14 d,培养液真空抽滤,滤液再用微孔滤膜(Φ=0.45μm)过滤获得不含菌体的代谢产物滤液,将滤液喷雾接种于7~10叶期健康盆栽猪殃殃、藜、冬葵、酸模叶蓼植株上,接种量为每盆20 ml。接种后的杂草植株置于28℃、12 h光暗交替的人工气候箱中用塑料袋套袋保湿培养。每处理重复4次,以只接种无菌PD培养液的植株作为空白对照。分别于处理后3 d、5 d和7 d后观察杂草的发病情况,发病程度分级参照文献[13]。处理7 d后计算发病率、病情指数和鲜质量防效。计算公式如下:发病率=发病叶片数/调查叶片总数×100%;病情指数=Σ(各级病叶数×各级代表值)/(调查总叶数×最高级代表值)×100;鲜质量防效=(对照杂草鲜质量-处理杂草鲜质量)/对照杂草鲜质量×100%。
1.3 HL-1菌株对作物安全性测定
将HL-1菌株发酵滤液以每盆20 ml分别喷雾接种于3~4叶期的小麦(Triticum aestivum L.)、油菜(Brassica napus L.)、蚕豆(Vicia faba L.)、豌豆(Pisum sativum L.)、青稞(Hordeum vulgare L.)上,培养方法同方法1.2.2。每处理重复4次,以只接种无菌PD培养液的植株作为空白对照。7 d后调查作物发病情况。按以下标准记载发病程度:NS表示无症状(无病斑,植株正常生长);LS表示轻微感病(叶片分布零星斑点,生长略受抑制);MS表示中等感病(1/5~1/4的叶面积出现病斑,生长受抑制);SS表示严重感病(1/4以上叶片面积出现病斑,生长受到严重抑制)。
1.4 HL-1菌株的鉴定
1.4.1 形态鉴定 将菌株HL-1于PDA培养基上培养,光学显微镜下观察其菌丝、孢子形态。将直径为8 mm菌丝块接种于培养基平皿(Φ=9 cm),25℃培养,每天定时观察菌落生长形态,显微镜观察其菌丝和孢子形态。
1.4.2 分子鉴定 菌株DNA提取参照文献[13]。选取通用引物ITS4扩增基因组DNA的 ITS区,ITS4:5'-TCCTCCGCTTATTGATATGC-3',ITS5:5'-GGAAGTAAAAGTCGTAACAAGG-3'。PCR扩增反应体系(50.0μl)如下:4.0μl dNTP mixture(2.5 mmol/L),ITS4(20.0 μmol/L)和 ITS5(20.0 μmol/L)各1.0μl,6.0μl的10×Taq缓冲液,1.0μl Taq DNA 聚合酶(2.5 U/μl),2.0 μl模板 DNA,35.0μl无菌去离子水。PCR反应条件为:94℃预变性5 min;94℃变性1 min,51℃ 退火1 min,72℃延伸1 min,共设35个循环;最后72℃延伸10 min。扩增产物在1.0%的琼脂糖凝胶中电泳分离后,用溴化乙锭溶液(0.5μg/ml)染色15 min,通过Bio-Rad Gel Doc 2000成像系统显示记录电泳结果。收集PCR产物送上海生工生物工程技术服务有限公司测序。测序结果用chromas.exe软件进行序列修正后,从NCBI Blast检索与目标序列同源性高的DNA序列,与本序列分别进行菌株种内比对。利用MEGA 5.0软件采用近邻归群法(Neighbor-joining)构建系统发育树,各分支的置信度自举检测(Bootstrap)1 000次。
2 结果与分析
2.1 HL-1菌株对杂草的致病性
菌株HL-1菌饼接种到猪殃殃、藜、冬葵、酸模叶蓼3 d后,杂草叶片上可观察到轻微病变,菌饼四周长出大量菌丝,围绕菌饼四周形成一圈褐色斑纹,其中,冬葵叶片出现轻微发黄、失绿现象;藜叶片接种部位可见白色菌丝体,同时,菌丝穿透整个叶片,布满叶背部,5 d后菌丝扩展至整个杂草叶片;猪殃殃、冬葵整叶枯死;酸模叶蓼、藜叶片变黑腐烂。接种无菌PDA培养基的4种对照杂草叶片完好,没有出现病变症状。菌饼致病性测定结果表明,HL-1菌株对这4种杂草离体叶片均表现为强致病性。
喷施发酵滤液3 d后,在供试杂草上出现不同程度的受害症状,猪殃殃、藜明显表现出萎蔫、叶片卷曲的症状,冬葵叶片出现黄色斑点,叶尖变黄,有零星病斑产生,酸模叶蓼部分叶片出现黄色斑点。5 d后,猪殃殃表现为茎叶发黑、枯死,藜表现为茎弯曲,叶片枯死,冬葵1/2叶片发黑,症状由叶到茎逐渐扩展,酸模叶蓼出现大面积病斑,约1/2植株枯死。7 d后,猪殃殃、藜发病率高达98.10%和90.20%。发酵滤液对猪殃殃、藜、冬葵的平均鲜质量防效分别达到69.31%、71.83%、65.54%,显著高于发酵滤液对酸模叶蓼的平均鲜质量防效(P<0.05)(表1)。病情指数(表1)表明,猪殃殃、藜对菌株发酵滤液最敏感,杂草接种病菌7 d后始终无复苏现象,病情不断加重,直至整盆植株枯死(图1)。无菌PD培养液(对照)对上述4种杂草叶片没有影响(图1)。表明,该菌株发酵滤液对猪殃殃和藜具有较好的防除效果。
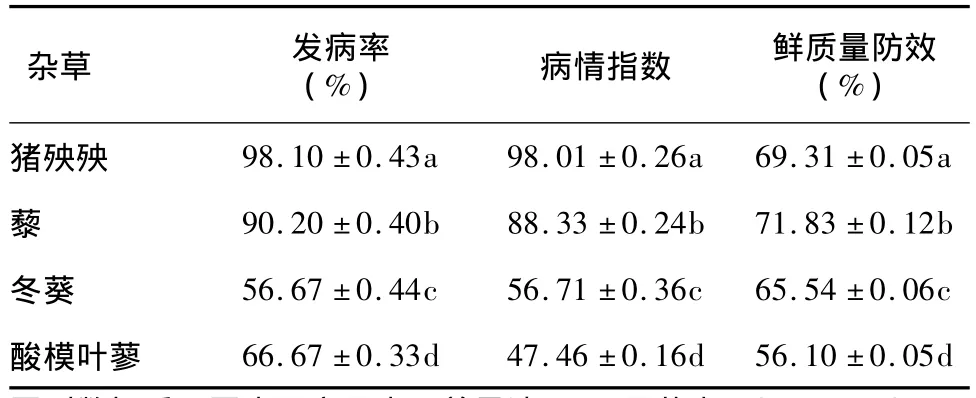
表1 菌株HL-1发酵滤液对4种杂草致病力比较(7 d)Table 1 Comparison of the pathogenicities of metabolites produced by strain HL-1 against four weeds(7 d)
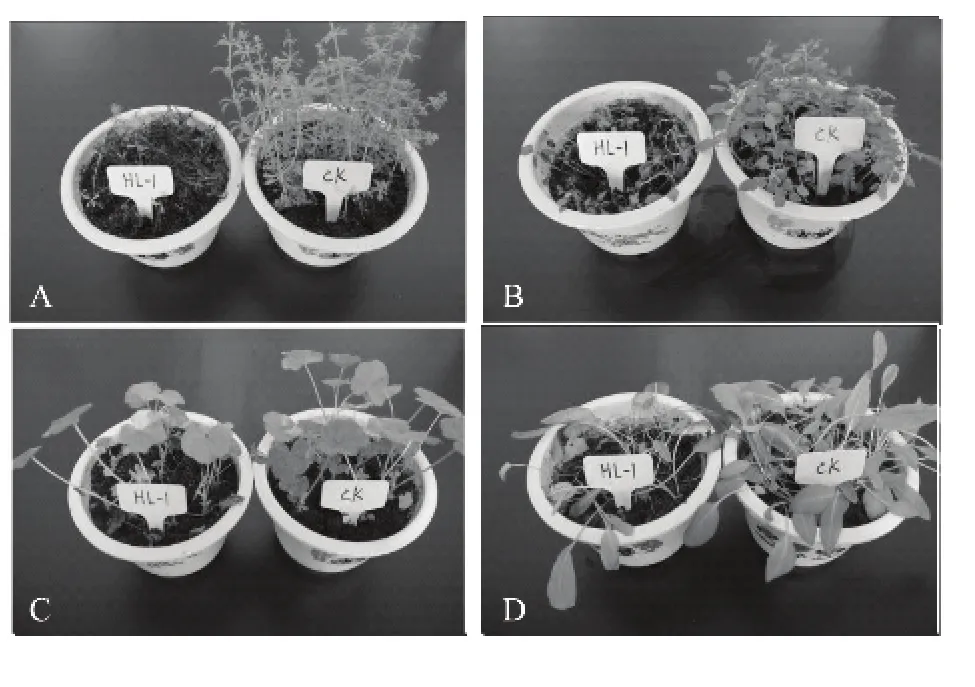
1 菌株HL-1发酵滤液的致病性(7 d)ig.1 Pathogenicity of metabolite produced by strain HL-1(7 d)
2.2 HL-1菌株对作物的安全性
菌株HL-1发酵滤液对春小麦和蚕豆均无致病性,作物长势及株高未受影响,表现为不感病(NS);春油菜表现为轻微感病(LS),5%叶片叶缘出现黑色斑点,植株无萎蔫现象,后期病斑不扩展;青稞表现为轻微感病(LS),少部分叶片叶脉部位有零星斑点,叶片发黄,后期病斑不扩展;豌豆表现为轻微感病(LS),株高抑制率为5.8%(表2)。
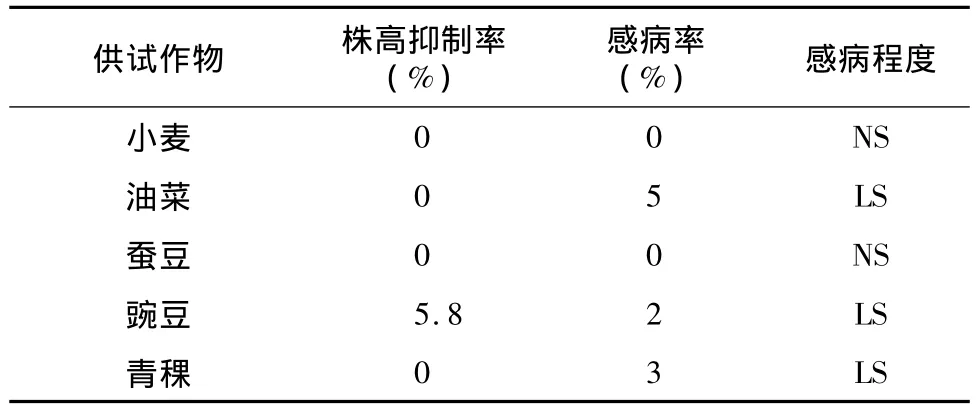
表2 供试作物对菌株HL-1的敏感性Table 2 Sensitivities of the crops to strain HL-1
2.3 HL-1 菌株鉴定
2.3.1 形态特征 PDA平板上HL-1菌落呈同心圆生长,生长速度快,一周后满皿。气生菌丝发达,初期为白色,后期渐变为褐色,最后变为黑色(图2A)。菌丝有隔,中间部位凹缩(图2B)。分生孢子有明显的横纵隔,孢子平面呈椭球形,不易萌发(图2C)。
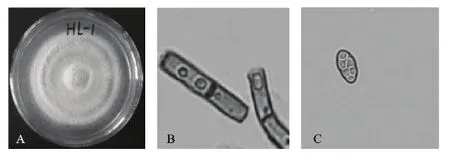
图2 HL-1的形态特征(×1 000)Fig.2 Morphological characteristics of strain HL-1(×1 000)
2.3.2 分子鉴定 从用近邻归群法构建的系统发育树(图3)可见,菌株HL-1的ITS与植物内生菌属的ITS高度相似,其中与内生真菌 FJ450003.1、FJ450011.1和JN986768.1的匹配度均达到 99%。结合形态观察,鉴定菌株HZ-1为内生真菌。

图3 基于ITS r DNA序列的菌株HL-1的系统发育树Fig.3 Phylogenetic tree of strain HL-1 based on ITS r DNA sequence
3 讨论
植物病原毒素是植物病原产生的次生代谢产物,在病原菌侵染寄主的过程中起着重要的作用,常常能加强病原菌的侵染危害程度。目前对具有除草活性的微生物代谢产物的报道很多,如Arshad 2011年[14]从木霉属4个种的培养滤液中获得的粗毒素可以明显减少小麦田杂草小子虉草(Phalaris minor L.)和齿果酸模(Rumex dentatus L.)的根茎长度和生物量;Phattanawasin[15]发现费希尔曲霉(Aspergillus fischeri TISTR 3272)产生的代谢产物对刺轴含羞草(Mimosa pigra)和稗草(Echinochloa crus-galli)的胚根和芽长抑制率达到80%以上;王静[16]从紫茎泽兰内生菌中提取的粗毒素对油菜和高粱胚根、胚芽的伸长有较强的抑制作用;Dor[17]发现 Fusarium oxysporum f.sp.orthoceras的发酵滤液产生的镰刀菌酸和9,10-dehydrofusaric acid(DFA)能引起 Helianthus annuus、Orobanche cuman、Sonchus oleraceus植株失绿和萎蔫。本研究从发病的刺儿菜叶中分离得到HL-1菌株,其发酵滤液对试验靶标杂草幼苗具有不同程度的致死作用,对猪殃殃和藜具有很强的致病性,喷施于植株后可导致其叶片发黄枯萎甚至整株枯死。
植物内生真菌开发成为微生物除草剂,多数是利用它们的次生代谢生物,在应用时首先应该考虑的是对作物不致病。菌株HL-1从自然发病的刺儿菜叶上分离获得,代谢产物对春小麦和蚕豆很安全,虽可使油菜和青稞幼苗感病,但只产生斑点型病害,病斑不扩散,不影响青稞、蚕豆后期生长,但对豌豆植株株高有轻微的抑制作用。可见,该菌的代谢产物对多数杂草有抑制作用的同时对作物相对安全,可以在以猪殃殃和藜为优势杂草的春小麦和蚕豆田中安全使用。
利用微生物代谢产物开发的微生物源除草剂既有化学农药易加工、使用方便的特点,又有生物农药安全易降解的特性。此外,还可以对其代谢产物进行提纯和结构鉴定,通过仿生合成等途径开发新型除草剂。因此,内生真菌HL-1菌株代谢产物的应用前景很大,可进一步加强有关制剂开发及活性成分的结构鉴定。
[1] KELLY N B,GARY P,THOMASM W,et al.Spray retention for liquid and mycoherbicide inoculums in three weed-biocontrol systems[J].Biocontrol Science and Technology,2006,16(8):815-823.
[2] GRAEME W B,DAVID J S.Bioherbicide safety zones and the plant disease-inoculums density relationship[J].Weed Technology,2010,24:193-196.
[3] BARTON J.Predictability of pathogen host range in classical biological control of weeds:an update [J].Biological Control,2012,57:289-305.
[4] 强 胜.杂草学[M].2版.北京:中国农业出版社,2011.
[5] LI J,YE Y H,WANGX Y,et al.Herbicidal activity of curvulinic acid isolated from Nimbya alternantherae[J].Natural Product Communications,2012,7(1):51-52.
[6] 杨 叶,王兰英,胡美姣.牛筋草离孺孢生物学特性及代谢产物活性测定[J].微生物学通报,2009,36(5):666-671.
[7] 李永龙,程 亮,朱海霞,等.出芽短梗霉菌菌株PA-2的除草活性及对作物的安全性[J].中国生物防治学报,2014,30(2):232-238.
[8] 王 惠,董金皋,商鸿生.灰葡萄孢毒素的生物活性测定和除草活性成分分离研究[J].中国农业科学,2004,37(2):233-237.
[9] 李荣金,强 胜.百日草链格孢菌除草活性物的分离、纯化与结构鉴定[J].化学与生物工程,2006,23(3):59-62.
[10] QIANG S,WANG L,WEI R,et al.Bioassay of the herbicidal activity of AAC-toxin produced by Alternaria alternate isolated from Ageratina adenophora [J].Weed Technology,2010,24:197-201.
[11] SCHULZ B,BOYLE C,DRAEGER S,et al.Endophytic fungi,a source of biologically active secondary metabolites[J].Mycological Research,2002,106:996-1004.
[12]方中达.植病研究方法[M].北京:中国农业出版社,1998.
[13]王彦芹,席琳乔.棉花根际促生菌基因组DNA的提取及其鉴定[J].基因组学与应用生物学,2010,29(5):1005-1008.
[14] ARSHAD J,SAJJAD A.Herbicidal activity of culture filtrates of Trichoderma sp.against two problematic weeds of wheat[J].Natural Product Research,2011,25(7):730-740.
[15] PHATTANAWASIN P,POJCHANAKOM K,SOTANAPHUN U,et al.Weed growth inhibitors from Aspergillus fischeri TISTR 3272[J].Natural Product Research,2007,21(14):1286-1291.
[16]王 静,罗国玖,蒙远涛,等.紫茎泽兰内生菌的分离及其代谢物的除草活性[J].江苏农业科学,2013,41(5):99-101.
[17] DOR E,EVIDENTE A,AMALFITANO C,et al.The influence of growth conditions on biomass,toxins and pathogenicity of Fusarium oxysporum f.sp.orthoceras,a potential agent for broomrape biocontrol[J].Weed Research,2007,47:345-352.

