胰岛素对糖尿病大鼠下颌骨成骨细胞体外生物学活性的影响
陈 新,谭新伟,刘洪臣,冯 岩
(1.空军总医院口腔科,北京 100036;2.新疆维吾尔自治区巴州人民医院口腔科 841000;3.解放军进修学院口腔医学研究院口腔科 ,北京 100036)
·临床研究·
胰岛素对糖尿病大鼠下颌骨成骨细胞体外生物学活性的影响
陈 新1,谭新伟2,刘洪臣3,冯 岩1
(1.空军总医院口腔科,北京 100036;2.新疆维吾尔自治区巴州人民医院口腔科 841000;3.解放军进修学院口腔医学研究院口腔科 ,北京 100036)
目的 探讨糖尿病大鼠应用胰岛素对下颌骨成骨细胞体外生物学活性的影响。方法 将20只7周龄的SD大鼠分为对照组(8只)与实验组(12只),实验组大鼠注射四氧嘧啶建立糖尿病大鼠模型,建模后获取下颌骨进行培养并提取成骨细胞,设置对照组并根据胰岛素剂量设置各实验组,采用噻唑蓝(MTT)法检测大鼠成骨细胞的增殖率,采用对硝基苯磷酸盐(PNPP)法检测骨细胞碱性磷酸酶(ALP)水平,并进行下颌骨成骨细胞糖摄取检测,比较分析各组检测结果。结果 加药后48 h与72 h各不同剂量胰岛素实验组标本的吸光度值与对照组和实验组比较差异均有统计学意义(P<0.05),其中以10-6mol/L剂量组的吸光度值最高。加药后3、7、14 d各不同剂量胰岛素实验组标本的ALP水平与实验组及对照组比较差异均有统计学意义(P<0.05);加药后21 d 10-6mol/L及10-7mol/L胰岛素实验组与对照组比较差异均有统计学意义(P<0.05)。2-NBDG加入20 min时吸光度值从高到低依次为10-6mol/L胰岛素+对照组、10-6mol/L胰岛素+实验组、实验组、对照组;40 min时吸光度值从高到低依次为实验组、10-6mol/L胰岛素+对照组、对照组、10-6mol/L胰岛素+实验组。结论 糖尿病大鼠应用胰岛素后可改善其上颌骨成骨细胞的分化功能,同时对糖摄取量也具有明显的抑制作用。
糖尿病; 胰岛素; 下颌骨; 成骨细胞; 体外生物活性
糖尿病可对患者的骨整合形成产生明显的影响,以往通常采用羟基磷灰石涂层进行改善,但常存在溶解及感染等不良事件,导致实施效果受到限制[1]。由于大部分糖尿病患者都需要长期注射胰岛素[2],临床医师在人工种植牙过程中逐渐丰富给药思路,在通过颌骨局部给药确保血糖控制的同时发挥其改善骨整合的作用[3]。而骨整合的良好改善与成骨细胞的作用密切相关[4-5],目前关于糖尿病患者颌骨成骨细胞的临床报道较为少见,本研究通过对糖尿病大鼠与健康大鼠开展相关研究,观察其上颌骨成骨细胞分化与糖摄取量的相关表现,为下颌骨局部应用胰岛素提供良好的依据,现报道如下。
1 资料与方法
1.1 实验动物与分组 选取7周龄的SD大鼠20只,其中雌性、雄性大鼠各10只,体质量190~250 g,平均(223.7±5.3)g。将大鼠随机分为对照组(8只)与实验组(12只)。
1.2 糖尿病动物模型的建立 对照组大鼠经腹腔注射生理盐水,剂量为100 mg/kg;实验组大鼠经腹腔注射20 mg/mL的四氧嘧啶,剂量为200 mg/kg。待腹腔注射3 d后,检测实验组大鼠血糖,若空腹血糖为7.8 mmol/L或以上则糖尿病大鼠建模成功。所有实验大鼠均根据《关于善待实验动物的指导性意见》开展相关处理与操作。
1.3 方法
1.3.1 下颌骨成骨细胞培养 对照组大鼠无需测量血糖水平,将下颌骨成骨细胞培养于5.5 mmol糖培养基。实验组大鼠在建模成功后10 d内均给予标准喂养,第11天将大鼠处死,应用酶消法联合组织块法对获取的标本进行培养。将大鼠处死后置入乙醇中浸泡消毒5 min,依据无菌操作标准取出下颌骨,再次置于乙醇中浸泡消毒,然后于氯酸钠内放置1 min。应用0.01 mol/L的磷酸盐缓冲液(PBS)连续清洗标本3次,放至培养基中剔除标本组织的筋膜、肌肉、神经等,将全部牙齿拔除,再将处理标本清洗3次。将获取标本剪成1 mm3小块,注入其5倍体积的胰蛋白酶以有效地去除消化液。相同方式反复进行5次,离心处理后在所获得的白色沉淀物中加入培养基与胎牛血清(FBS),再置于培养瓶内。采用FBS抑制标本再消化,旋松培养瓶口后放置孵箱中培养。培养3 d后针对酶消法所获得的细胞组织进行换液,7 d后针对组织块进行换液,此后每3天进行1次换液。
1.3.2 下颌骨成骨细胞分化检测 针对大鼠标本进行合理的分组,建立对照组(健康大鼠)、实验组(糖尿病大鼠)、10-5mol/L胰岛素实验组、10-6mol/L胰岛素实验组及10-7mol/L胰岛素实验组。采用噻唑蓝(MTT)法检测大鼠成骨细胞的增殖率,采用对硝基苯磷酸盐(PNPP)法检测骨细胞碱性磷酸酶(ALP),并将2项检测结果进行统计学比较分析。
1.3.3 下颌骨成骨细胞葡萄糖摄取检测 针对大鼠标本进行合理分组,建立对照组(健康大鼠)、10-6mol/L胰岛素+对照组、实验组(糖尿病大鼠)、10-6mol/L胰岛素+实验组。荧光标记2-脱氧葡萄糖(2-NBDG)的配置方法为0.01 mol/L PBS中加入2-NBDG粉末,浓度为200 μmol/L,将标本第5代细胞接种于玻片上,通过培养液反复处理后应用荧光显微镜进行观察,再采用处理软件获取荧光积分吸光度值。

2 结 果
2.1 大鼠下颌骨成骨细胞增殖率比较 MTT法检测结果显示,在加药后24、48、72 h不同剂量胰岛素实验组标本的吸光度与对照组和实验组比较差异均有统计学意义(P<0.05);胰岛素实验组中,以10-6mol/L剂量组的吸光度最高。见表1。
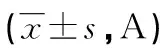
表1 大鼠下颌骨成骨细胞吸光度比较
注:与对照组比较,aP<0.05;与实验组比较,bP<0.05。
2.2 大鼠下颌骨成骨细胞ALP水平比较 PNPP法检测结果显示,在加药后3、7、14 d时不同剂量胰岛素实验组标本的ALP水平与实验组和对照组比较差异均有统计学意义(P<0.05),21 d时10-6mol/L及10-7mol/L胰岛素实验组与对照组比较差异均有统计学意义(P<0.05),10-5mol/L胰岛素实验组与对照组比较差异无统计学意义(P>0.05)。在不同水平胰岛素实验组中ALP水平在3 d时以10-7mol/L胰岛素实验组最高,7、14 d时以10-6mol/L胰岛素实验组最高,21 d时以10-5mol/L胰岛素实验组最高。各组标本ALP水平在14 d内均随时间延长而提高,14 d后均呈现下降。见表2。

表2 大鼠下颌骨成骨细胞ALP水平比较金氏单位)
注:与对照组比较,aP<0.05;与实验组比较,bP<0.05。
2.3 大鼠下颌骨成骨细胞葡萄糖摄取量比较 各组大鼠标本均呈现出荧光表现随时间延长而增强的特征,将2-NBDG加入20、40 min时各组积分吸光度比较差异均有统计学意义(P<0.05),其吸光度值从高到低依次为10-6mol/L胰岛素+对照组、10-6mol/L胰岛素+实验组、实验组、对照组;40 min时吸光度值从高到低依次为实验组、10-6mol/L胰岛素+对照组、对照组、10-6mol/L胰岛素+实验组,见表3。
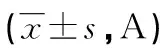
表3 大鼠下颌骨成骨细胞荧光积分吸光度比较
3 讨 论
1型糖尿病在青少年中发病时会明显抑制骨骼发育,在成人中发病还会影响骨密度,使骨质疏松的发生概率上升,造成各种骨折的发生并影响愈合速度[6]。而2型糖尿病的发生会升高患者的骨密度,但明显降低骨强度[7]。上述差异主要是由于1型糖尿病患者处于胰岛素绝对缺乏状态,而2型糖尿病患者主要表现为胰岛素抵抗[8]。通过不同的表现可以判断,在骨骼的生长过程中胰岛素可发挥合成代谢效用。本研究对大鼠成骨细胞的分化状况进行检测后发现,应用胰岛素的实验组大鼠其成骨细胞增殖率与ALP水平均提高,并且10-5~10-7mol/L胰岛素剂量组具有不同程度的改善。在24~72 h中,10-6mol/L胰岛素的促增殖效果最佳并且伴随用药时间的延长,细胞内ALP水平存在一定的剂量依赖性表现,提示长期应用胰岛素后成骨细胞可能存在耐药表现,敏感性下降。
相对于健康人群,糖尿病患者骨转换率下降与骨量减少高发[9],主要由患者血糖控制状况所致,以往血糖控制较好者其不良事件的发生情况会受到明显抑制[10]。本研究针对不同大鼠开展了成骨细胞糖摄取的相关实验,结果显示各组标本的荧光表现均随时间延长而增强。在2-NBDG加入20 min时各组别荧光积分吸光度比较差异有统计学意义(P<0.05),吸光度值从高到低依次为10-6mol/L胰岛素+对照组、10-6mol/L胰岛素+实验组、实验组、对照组;2-NBDG加入40 min时各组别荧光积分吸光度比较差异有统计学意义(P<0.05),吸光度值从高到低依次为实验组、10-6mol/L胰岛素+对照组、对照组、10-6mol/L胰岛素+实验组。表明在胰岛素的作用下糖尿病大鼠成骨细胞糖摄取会受到限制,进而改善患者成骨细胞的状态。
综上所述,糖尿病大鼠应用胰岛素后可改善上颌骨成骨细胞的分化功能,同时对糖摄取量也具有明显的抑制作用。
[1]吴璇,刘洪臣,鄂玲玲,等.胰岛素对糖尿病大鼠下颌骨成骨细胞分化的影响[J].口腔医学研究,2014,30(5):407-410.
[2]左旭阳,章秋.骨骼是2型糖尿病中胰岛素抵抗的一个部位[J].中华糖尿病杂志,2013,5(3):191.
[3]吴璇,刘洪臣,吕娇,等.胰岛素对糖尿病大鼠下颌骨成骨细胞糖摄取的影响[J].口腔医学研究,2010,26(3):346-348.
[4]Bronoosh P,Tanideh N,Noorafshan A,et al.Effects of low-intensity pulsed ultrasound on healing of mandibular bone defects: an experimental study in rabbits[J].Int J Oral Maxillofac Surg,2015,44(2):277-284.[5]Zhang YB,Wang L,Jia S,et al.Local injection of substance P increases bony formation during mandibular distraction osteogenesis in rats[J].Br J Oral Maxillofac Surg,2014,52(8):697-702.
[6]吴璇,刘洪臣,鄂玲玲,等.糖尿病大鼠下颌骨成骨细胞葡萄糖转运蛋白-1及胰岛素受体α1的表达[J].华西口腔医学杂志,2011,29(4):348-350.
[7]Schleicher I,Parker A,Leavesley D,et al.Surface modification by complexes of vitronectin and growth factors for serum-free culture of human osteoblasts[J].Tissue Eng,2005,11(12):1688-1698.
[8]Fujii H,Hamada Y,Fukagawa M.Bone formation in spontaneously diabetic Torii-newly established model of non-obese type 2 diabetes rats[J].Bone,2008,42(2):372-379.
[9]万贤风,兰泽栋,曾琳,等.人重组骨形成蛋白-4与人重组胰岛素样生长因子-1联合应用对鼠成骨细胞的影响[J].广东牙病防治,2013,21(3):127-130.
[10]何玉玲,周后德,隋国良,等.胰岛素受体底物1在前成骨细胞分化过程中的表达[J].中国医科大学学报,2012,41(9):769-772.
10.3969/j.issn.1672-9455.2015.06.050
A
1672-9455(2015)06-0836-02
2014-08-22
2014-12-29)

