某院2006~2013年腹水患者细菌耐药监测
俞宏松
(重庆医科大学附属第一医院第一分院检验科,重庆 400016)
·论 著·
某院2006~2013年腹水患者细菌耐药监测
俞宏松
(重庆医科大学附属第一医院第一分院检验科,重庆 400016)
目的 了解某院腹水患者临床分离菌的分布及耐药情况。方法 收集2006~2013年某院腹水患者临床分离菌的药物敏感性数据,根据美国临床实验室标准化协会(CLSI)2012版标准,用WHONET5.6软件进行数据分析。结果 共收集腹水患者的临床分离菌1 097株,其中革兰阳性菌占34.2%,革兰阴性菌占65.8%。常见细菌依次为大肠埃希菌、凝固酶阴性葡萄球菌、肺炎克雷伯菌、屎肠球菌、铜绿假单胞菌、粪肠球菌、鲍曼不动杆菌和金黄色葡萄球菌。葡萄球菌属中,耐甲氧西林金黄色葡萄球菌(MRSA)和凝固酶阴性葡萄球(MRCNS) 的检出率分别为45.2%和78.3%,未发现万古霉素和利奈唑胺耐药株。肠球菌属中粪肠球菌对多数测试药物的耐药率比屎肠球菌低,两者均有少数万古霉素耐药株和利奈唑胺耐药株。大肠埃希菌、肺炎克雷伯菌中产超广谱β内酰胺酶(ESBLs)菌株分别占60.3%和37.5%。肠杆菌科细菌对碳青霉烯类抗菌药物仍高度敏感。铜绿假单胞菌对亚胺培南和美罗培南的耐药率分别为25.9%和22.3%,鲍曼不动杆菌对两者的耐药率分别为64.3%和61.6%。结论 腹水患者的细菌耐药状况较为严重,应不断开展耐药监测工作,加强抗菌药物的临床应用管理和医院感染防控。
腹水; 抗菌药物; 耐药性
正常腹水为无菌体液,若腹水中检出细菌则对临床治疗具有很大的价值。因此监测和分析腹水中常见细菌的分布、耐药性等特点具有重要意义,可以为临床腹腔感染的合理用药提供重要依据[1]。本文通过分析某院2006~2013年1 097株腹水标本来源病原菌的分布及耐药情况,为腹水患者的临床用药提供参考。
1 材料与方法
1.1 菌株来源 所有菌株均来自2006 年1 月1 日至2013年12 月31 日某院腹水患者临床分离菌,并排除同一患者同一部位重复菌株的数据。
1.2 方法
1.2.1 细菌鉴定 采用常规方法的细菌鉴定系统API、VITEK等进行细菌鉴定。
1.2.1 药敏试验 采用纸片扩散法(K-B)、仪器MIC法和E-test法进行药敏试验,所监测的抗菌药物包括苯唑西林、青霉素G、氨苄西林、氨苄西林/舒巴坦、头孢唑啉、头孢西丁、头孢呋辛、头孢噻肟、头孢曲松、头孢吡肟、亚胺培南、庆大霉素、阿米卡星、环丙沙星、左氧氟沙星、莫西沙星、复方磺胺甲噁唑、红霉素、阿奇霉素、克林霉素、呋喃妥因、磷霉素、米诺环素、四环素、氯霉素、万古霉素、利福平、替考拉宁和利奈唑胺。
1.3 统计学处理 对审核合格的数据按美国临床实验室标准化协会(CLSI)2012版标准要求[2]使用WHONET5.6软件进行分析。头孢哌酮/舒巴坦参照头孢哌酮折点标准进行分析。
2 结 果
2.1 细菌分布 共分离腹水标本来源致病菌1 097株,其中革兰阴性菌722株(65.8%),革兰阳性菌株375(34.2%),主要菌种分布见表1。
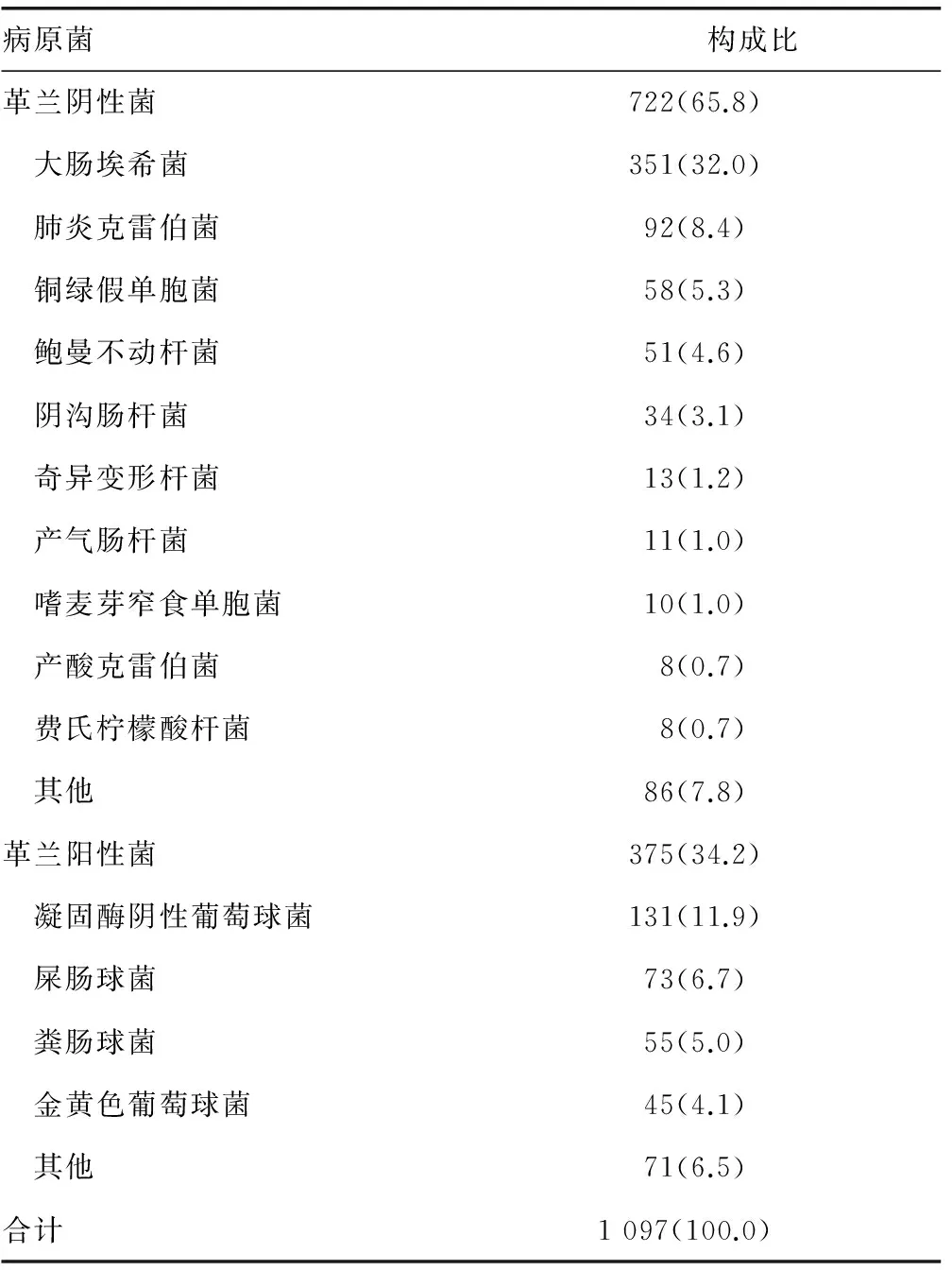
表1 腹水标本来源病原菌分布情况[n(%)]
2 2 葡萄球菌属药敏试验结果 葡萄球菌属中,耐甲氧西林金黄色葡萄球菌(MRSA)和凝固酶阴性葡萄球(MRCNS)的检出率分别为45.2%和78.3%。未发现对万古霉素及利奈唑胺耐药的葡萄球菌,有1.9%的MRCNS对替考拉宁耐药。见表2。
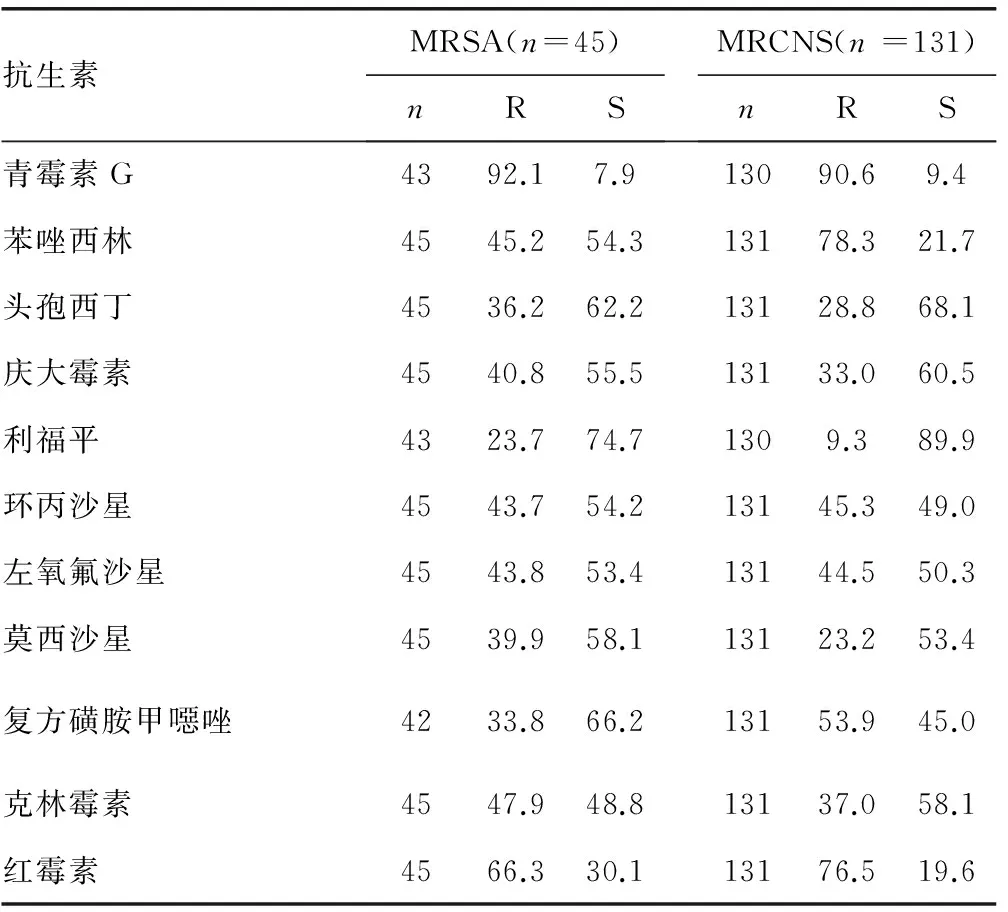
表2 葡萄球菌属的耐药率和敏感率(%)
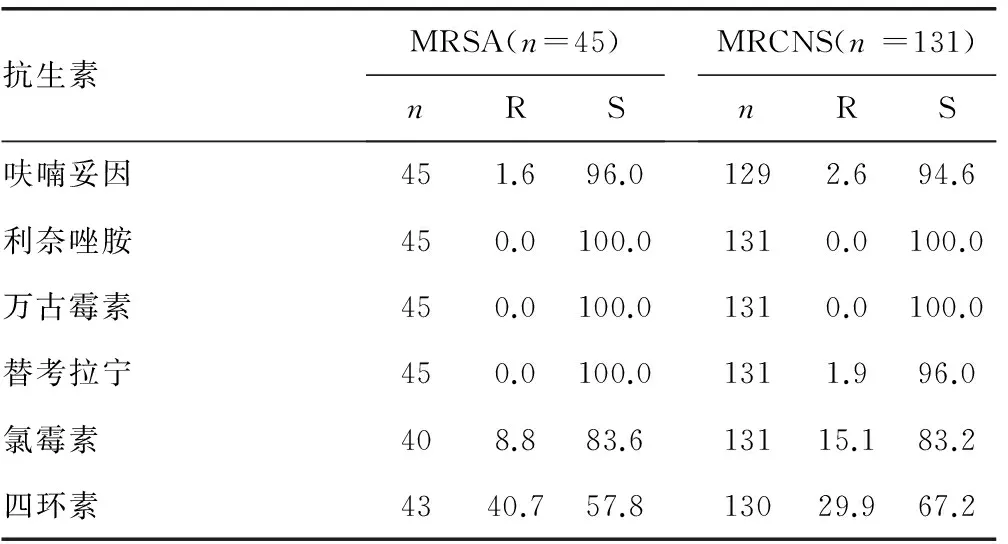
续表2 葡萄球菌属的耐药率和敏感率(%)
注:R为耐药,S为敏感。
2.3 肠球菌属药敏试验结果 共分离出148株肠球菌属细菌,以屎肠球菌(49.1%)和粪肠球菌(37.0%)为主。粪肠球菌对氨苄西林的敏感率为87.6%,明显高于屎肠球菌。粪肠球菌和屎肠球菌对万古霉素的耐药率分别为1.3% 和2.7%,对利奈唑胺的耐药率分别为2.4% 和1.0%。见表3。
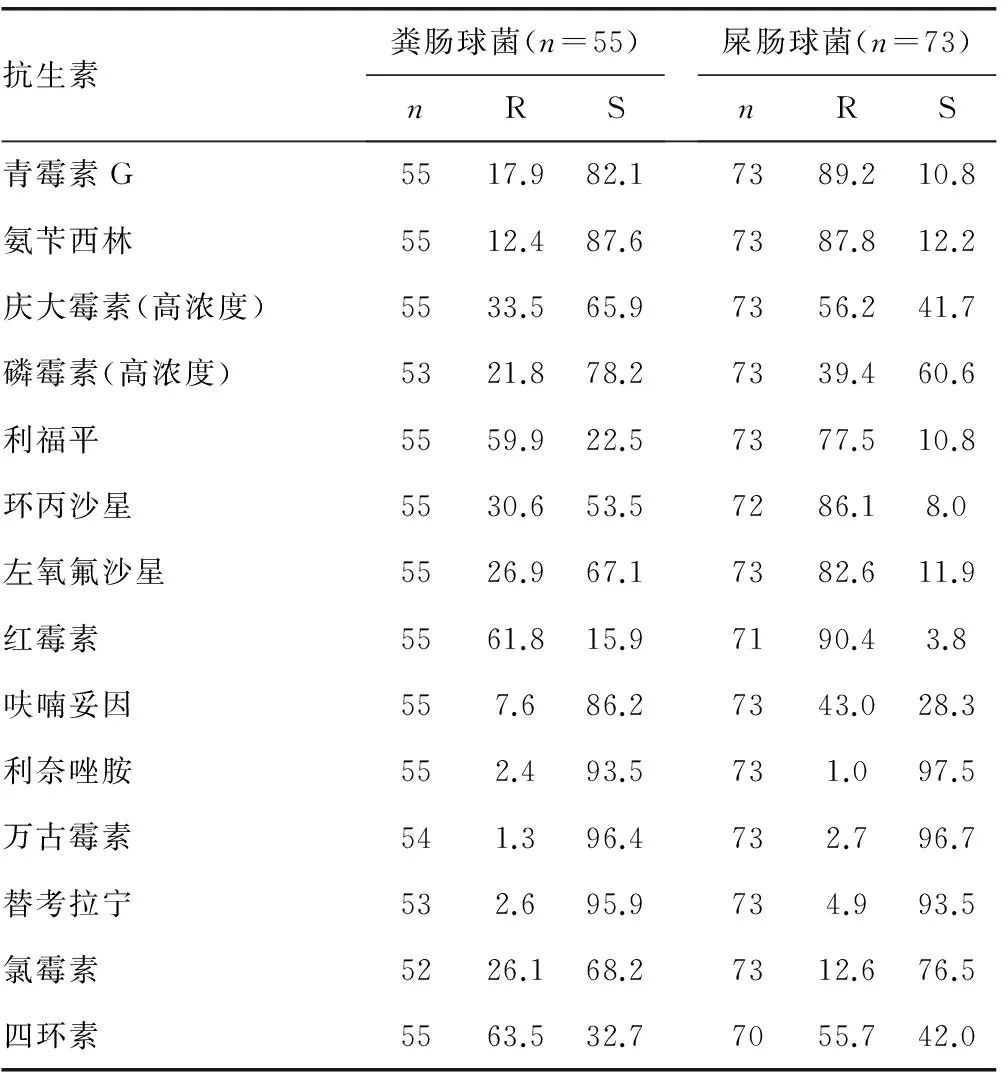
表3 肠球菌属的耐药率和敏感率(%)
注:R为耐药,S为敏感。
2.4 肠杆菌科细菌药敏试验结果 大肠埃希菌和肺炎克雷伯菌产超广谱β内酰胺酶(ESBLs)阳性率分别为60.3%和37.5%。大肠埃希菌对头孢他啶的敏感率为61.8%,而对头孢曲松的敏感率仅29.5%。大肠埃希菌对哌拉西林/他唑巴坦(89.5%)、亚胺培南(96.0%)、美罗培南(96.8%)和阿米卡星(91.3%)均有较高的敏感率。肺炎克雷伯菌对头孢他啶的敏感率为66.8%,对头孢曲松敏感率为51.4%。肺炎克雷伯菌对哌拉西林/他唑巴坦(79.8%)、亚胺培南(87.4%)、美罗培南(89.8%)和阿米卡星(89.2%)均有较高的敏感率。见表4。
2.5 非发酵菌药敏试验结果 多黏菌素B 对铜绿假单胞菌和鲍曼不动杆菌的抗菌活性最强,敏感率均不低于91.9%。铜绿假单胞菌对头孢哌酮/舒巴坦、哌拉西林/他唑巴坦、头孢他啶、美罗培南、阿米卡星、庆大霉素、妥布霉素、环丙沙星和左氧氟沙星的敏感率都大于70%。鲍曼不动杆菌耐药较为严重,对上述药物的敏感率均低于52%。见表5。
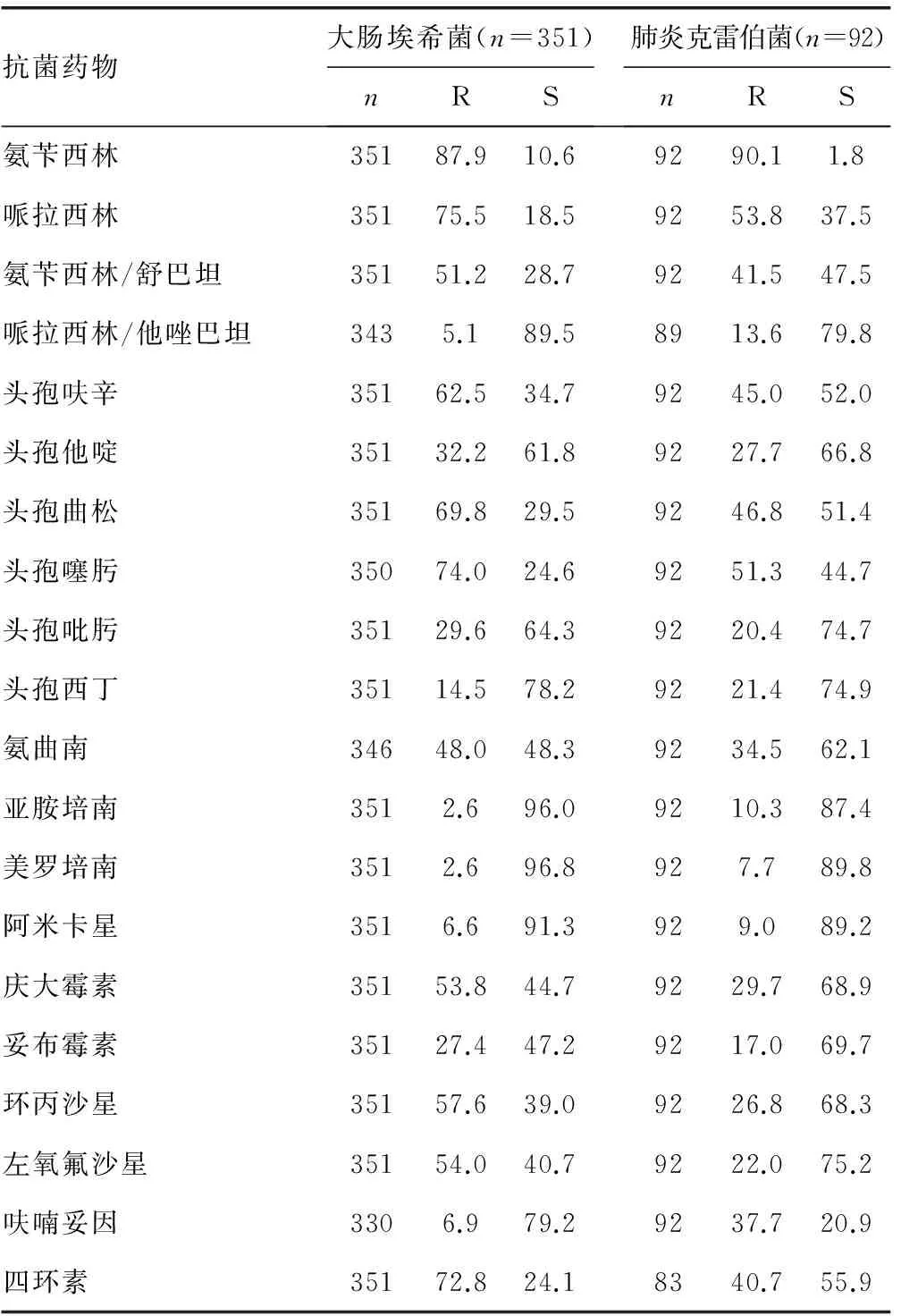
表4 肠杆菌科细菌的耐药率和敏感率(%)
注:R为耐药,S为敏感。
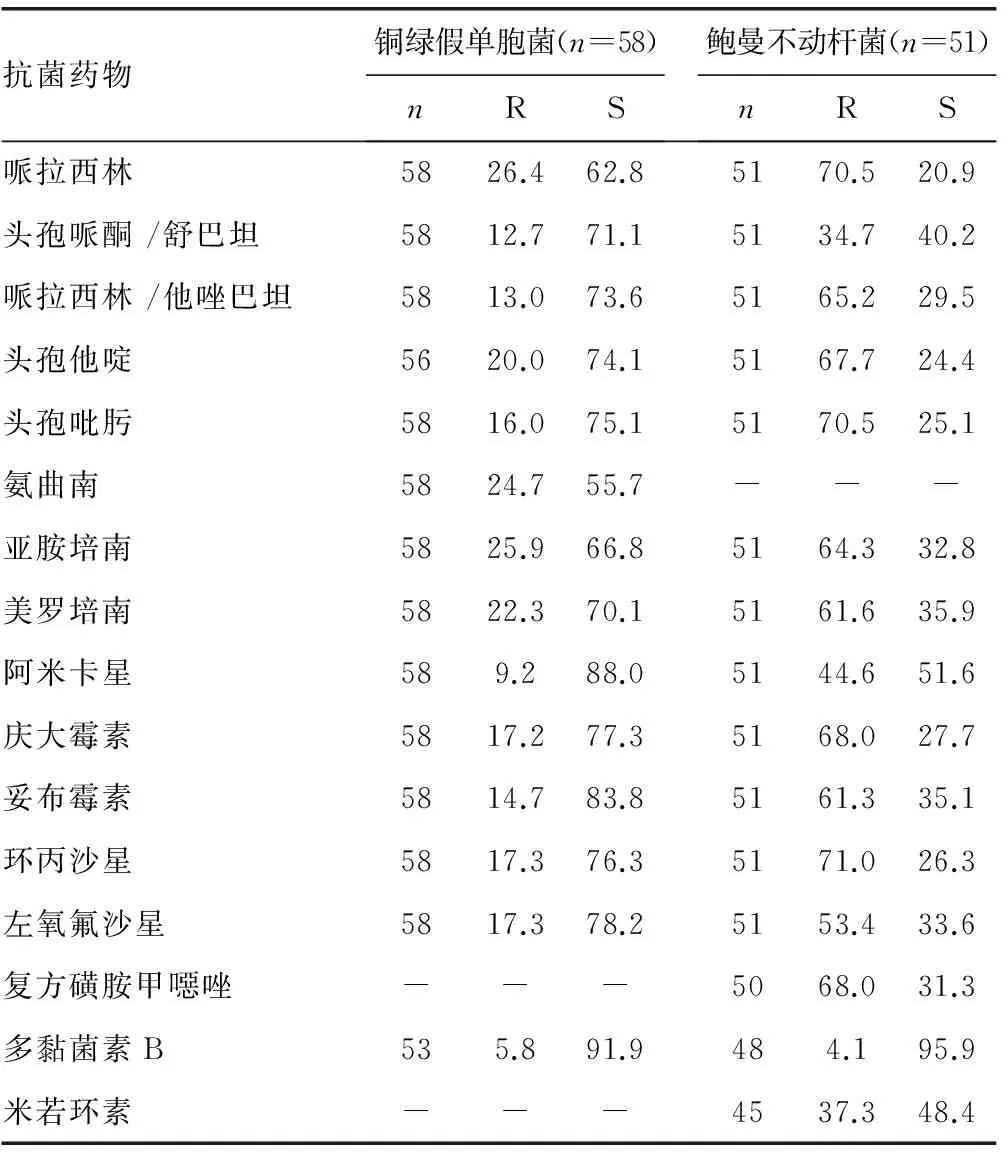
表5 非发酵菌的耐药率和敏感性(%)
注:-表示无数据。
3 讨 论
本研究显示,2006~2013年腹水分离菌中,革兰阴性菌占明显优势,占细菌总数的65.8%,前5位依次为大肠埃希菌、肺炎克雷伯菌、铜绿假单胞菌、鲍曼不动杆菌和阴沟肠杆菌;而革兰阳性菌占细菌总数的34.2%,前5位依次为屎肠球菌、表皮葡萄球菌、粪肠球菌、金黄色葡萄球菌和溶血葡萄球菌。
腹水中大肠埃希菌和肺炎克雷伯菌的ESBLs阳性率分别为60.3%和37.5%,分别高于2011年中国CHINET耐药监测数据(52.3%和28.8%)[3],但是比2011年全国Mohnarin监测数据(71.2%和50.3%)[4]低。肠杆菌科细菌中产ESBLs 和AmpC 酶菌株使头孢菌素和妥布霉素药物的临床应用受到极大的限制。对碳青霉烯类抗菌药物耐药的肠杆菌科细菌,其主要耐药机制是产生的碳青霉烯酶可水解碳青霉烯类抗菌药物[5]。
来自腹水标本的不发酵糖革兰阴性杆菌中,鲍曼不动杆菌所占百分率低于铜绿假单胞菌,呈现多重耐药[6]。本研究中鲍曼不动杆菌对亚胺培南和美罗培南的耐药率分别为64.3%和61.6%,与2011年中国CHINET耐药监测数据(60.4%和61.4%)比较接近,与2011年全国Mohnarin耐药监测数据(56.8%和58.7%)相比较高,因此疑似腹腔鲍曼不动杆菌感染的患者需谨慎选取抗菌药物[7]。鲍曼不动杆菌耐药主要由质粒及染色体等介导,包括耐药酶的产生、药物作用靶位的改变、药物“外排泵”的形成,以及外膜蛋白的减少、缺失或突变和整合子等耐药基因转移元素的参与[8]。铜绿假单胞菌对亚胺培南和美罗培南的的耐药率(25.8%和22.2%)与2011年中国CHINET耐药监测数据(29.1%和25.0%)相比较低,与2011年全国Mohnarin耐药监测数据(23.4%和21.2%)较接近[9]。
腹水中葡萄球菌属及肠球菌属细菌对万古霉素和利奈唑胺依然保持高度的敏感性[10]。腹水中MRSA的检出率为45.2%,稍低于2011年中国CHINET监测数据(50.6%)及2011年全国Mohnarin耐药监测数据(50.5%)。本次监测未发现耐万古霉素的金黄色葡萄球菌(VRSA),屎肠球菌与粪肠球菌对万古霉素的耐药率分别为2.7%、1.3%。研究报道,肠球菌耐药主要由vanA介导[11]。
综上所述,本院2006~2013年腹水患者病原菌耐药监测结果发现,在革兰阳性菌中MRSA、MRCNS的检出率较高;革兰阴性菌中肠杆菌科细菌对第3代头孢菌素耐药,非发酵菌对碳青霉烯类耐药,且多重耐药都较为严重。这对临床医生用药具有一定的指导意义,应不断地开展耐药监测工作,加强抗菌药物的临床应用管理和医院感染防控。
[1]卜昕,张文瑾,范振平,等.肝硬化并发自发性细菌性腹膜炎患者腹水感染161例细菌种类及耐药分析[J].中华临床医师杂志,2012,6(13):3734-3737.
[2]Clinical and Laboratory Standards Institute.Performance standards for antimicrobial susceptibility testing:twenty-second informational supplement.CLSI document M100-S23[S].Wayne,PA:CLSI,2012.
[3]胡付品,朱德妹,汪复,等.2011年中国CHINET细菌耐药性监测[J].中国感染与化疗杂志,2012,12(5):321-329.
[4]肖永红,沈萍,魏泽庆,等.Mohnarin 2011年度全国细菌耐药监测[J].中华医院感染学杂志,2012,22(22):4946-4952.[5]Yang QW,Wang H,Sun HL,et al.Phenotypic and genotypic characterization of Enterobacteriaceae with decreased susceptibility to carbapenems:results from large hospital-based surveillance studies in China[J].Antimicrob Agents Chemother,2010,54(1) :573-577.
[6]习慧明,徐英春,朱德妹,等.2010年中国CHINET鲍曼不动杆菌耐药性监测[J].中国感染与化疗杂志,2012,12(2):98-104.
[7]黎敏,鲁卫平.鲍曼不动杆菌感染分布及耐药性变迁分析[J].重庆医学,2008,37(3):264-265.
[8]Davies J,Davies D.Origins and evolution of antibiotic resistance[J].Microbiol Mol Biol Rev,2010,74(3):417-433.
[9]Joo EJ,Kang CI,Ha YE,et al.Risk faetors for mortaliry in patients with Pseudomonas aeruginosa baeteremia:clinical impact of antmierobial resistanee on outcome[J].Microb Drug Resist,2011,17(2):305-315.
[10]杨青,俞云松,倪语星,等.2010年中国CHINET肠球菌属耐药监测[J].中国感染与化疗杂志,2012,12(2):92-97.
[11]Pourakbari B,Aghdam MK,Mahmoudi S,et al.High frequency of vancomycin-resistant enterococcus faecalis in an Iranian referral children medical hospital[J].Maedica(Buchar),2012,7(3):201-204.
Bacterial drug resistance surveillance among patients with ascites in a hospital during 2006-2013
YUHong-song
(DepartmentofClinicalLaboratory,FirstBranchHospital,FirstAffiliatedHospitalofChongqingMedicalUniversity,Chongqing400016,China)
Objective To understand the distribution and antimicrobial resistance situation of clinical isolated bacteria from the patients with ascites in a hospital.Methods The drug susceptibility data of clinically isolated bacteria from the patients with ascites in a hospital during 2006-2013 were collected and analyzed by the WHONET 5.6 software according to the standard by CLSI 2012.Results A total of 1 097 strains of clinical isolated bacteria were collected from the patients with ascites,in which Gram negative bacteria and Gam positive bacteria accounted for 65.8% and 34.2% respectively.The common bacteria were in turn Escherichia coli,coagulase-negative staphylococcus,Klebsiella pneumoniae,Enterococcus faecium,Pseudomonas aeruginosa,Enterococcus faecalis,Acinetobacter baumannii and Staphylococcus aureus.Methicillin resistant strains in S.aureus (MRSA) and coagulase negative Staphylococcus (MRCNS) accounted for 45.2% and 78.3% respectively.No staphylococcal strain was resistant to vancomycin or linezolid.The resistance rates of E. faecalis strains to most of the tested drugs was much lower than those of E.faecium.Few strains of E.faecium and E.faecalis were found resistant to vancomycin and linezolid.The strains of ESBLs-producing E.coli and Klebsiella pneumoniae accounted for 60.3% and 37.5% respectively.The strains of Enterobacteriaceae were highly susceptible to imipenem and meropenem.The resistance rates of P.aeruginosa to imipenem and meropenem were 25.9% and 22.3% respectively,and the resistance rates of A.baumanii to the two antibacterial drugs were 64.3% and 61.6% respectively.Conclusion The bacterial drug resistance status in the patients with ascites is serious.The drug resistance monitoring should be carried out continuously,the antibacterial drug application management and the hospital infection control should be strengthened.
ascites; antibacterial drugs; resistance
俞宏松,男,本科,检验师,主要从事细菌耐药监测的研究。
10.3969/j.issn.1672-9455.2015.06.015
A
1672-9455(2015)06-0756-03
2014-09-22
2014-12-12)

