复方萘普生钠肠溶-埃索美拉唑镁速释微丸型胶囊剂的研制
沙露平,邹梅娟,程 刚
(沈阳药科大学 药学院,辽宁 沈阳 110016)
复方萘普生钠肠溶-埃索美拉唑镁速释微丸型胶囊剂的研制
沙露平,邹梅娟,程 刚*
(沈阳药科大学 药学院,辽宁 沈阳 110016)
目的制备复方萘普生钠肠溶-埃索美拉唑镁速释微丸。方法通过粉末层积法制备萘普生钠载药微丸,依次包肠溶层(ACRYL-EZE 93F)、埃索美拉唑镁层、隔离层(Opadry YS-1-7027),制备多层微丸。考察了萘普生钠载药微丸的制备工艺、肠溶层耐酸力及埃索美拉唑镁的稳定性。结果粉末层积法制备的目标(700~830μm)萘普生钠微丸具有较高载药量,肠溶层的耐酸力符合要求,埃索美拉唑镁的稳定性较好。结论用多层包衣微丸的形式可以实现萘普生钠肠溶-埃索美拉唑镁速释的释药模式,并且制剂的稳定性较好。
药剂学;多层微丸;粉末层积法;肠溶萘普生钠;速释埃索美拉唑镁
Astrazeneca和Pozen公司联合开发的关节炎治疗药物Vimovo(肠溶萘普生和速释埃索美拉唑镁的复方制剂)已在欧盟获准上市,用于那些使用非甾体抗炎药有发生胃溃疡和(或)十二指肠溃疡风险的关节炎类疾病的治疗。肠溶型萘普生可以避免药物对胃肠道的直接刺激[1],而其因对环氧化酶的抑制而造成的损伤仅仅通过改变剂型是避免不了的。实验表明将肠溶萘普生和质子泵抑制剂联用在降低胃肠道副作用方面效果显著。将埃索美拉唑镁做成速释型一是为了使其快速吸收起效,在萘普生没有达到血药峰浓度之前将胃内pH值提高到4以上;二是为了避免拉唑类肠溶制剂普遍有的夜间酸突破现象[2]。Vimovo为多层包衣片剂,有两种规格:500 mg肠溶萘普生/20 mg速释埃索美拉唑镁、375 mg肠溶萘普生/20 mg速释埃索美拉唑镁。
本研究仿照上市制剂设计思想,将片剂改制成微丸型胶囊剂,因为在释药行为、减轻不良反应以及提高制剂安全性方面较片剂具有优势。本研究选用萘普生钠替换萘普生,因为前者在水中溶解度大,体内吸收速率更快,血药浓度达峰时间更短。萘普生钠和萘普生等效剂量比为1.1:1,作者仿制上市制剂的规格,通过等效换算,也研制了两种规格,即550 mg肠溶萘普生钠/20 mg速释埃索美拉唑镁和412.5 mg肠溶萘普生钠/20 mg速释埃索美拉唑镁。图1为市售制剂的显微镜剖面图,从里到外依次是萘普生片芯、肠溶层、埃索美拉唑镁层、隔离层、抛光层。图2是自制微丸模型图。
1 仪器与材料
UV-2000紫外-可见分光光度计(美国Unico公司),JBZ-300型多功能微丸包衣造粒机(辽宁医联新药研究所),微型流化床包衣机(辽宁医联新药研究所),ZRS-8L 智能溶出试验仪 (天津天大天发有限公司),JASCO-AT 130高效液相色谱仪(日本分光公司)。
微晶纤维素(日本旭化成公司),萘普生钠(武汉欣欣佳丽生物科技有限公司),雅克宜(上海卡乐康包衣技术有限公司),欧巴代(上海卡乐康包衣技术有限公司,型号YS-1-7027),羟丙基甲基纤维素(上海卡乐康包衣技术有限公司,型号E5),聚维酮(天津惠瑞化工科技有限公司),埃索美拉唑镁(济南宏方德医药科技有限公司)。

Fig. 1 The micrograph of Vimovo in section图1 市售制剂显微镜剖面图(×10)

Fig. 2 The model diagram of the self-made pellet图2 自制微丸模型图
2 方法与结果
2.1 粉末层积法制备萘普生钠微丸
2.1.1 萘普生钠微丸处方及其制备工艺
萘普生钠微丸的处方为:微晶纤维素空白丸芯(355~450μm)50 mg;0.014 mol·L-1氯化钠适量;萘普生钠182 g;微晶纤维素18 g。
萘普生钠微丸的制备工艺:采用离心造粒法制备萘普生钠微丸,原料药过154μm筛,称取一定量置于离心造粒机的饲料室中,以50 g (355~450μm)微晶纤维素空白丸核为母核, 0.014 mol·L-1NaCl溶液为润湿剂,设定主机转速300 r·min-1,喷雾压力0.2 Mpa,喷气流量0.1 Nm3·h-1,喷液速度为3.0~3.5 mL·min-1,供粉速度为 1.0~1.2 g·min-1,鼓风流量为12~15 L·min-1,抛光时间为3 min。取出,60℃下烘干0.5 h,用标准筛筛分。收取800~900μm微丸并计算收率。最后测得目标微丸的载药量为67.38%。
2.1.2 润湿剂的选择
将萘普生钠和微晶纤维素(10:1)200 g混合均匀,投入供粉室中,取355~450μm MCC空白丸核 50 g 于造粒锅中,考察不同润湿剂对微丸质量的影响。
通过实验发现萘普生钠遇水发粘,如果用水做润湿剂,微丸粘连非常严重,因此考虑采用适当润湿剂分散药物粘性,并且依靠药物自身粘性使微丸成型。用体积分数40%乙醇做润湿剂时依然会有粘连现象发生,60%乙醇由于挥发过快,药物粉末不易于粘附到微丸表面,导致损失过大。用NaCl溶液做润湿剂时,目标微丸收率要高于乙醇溶液,圆整度前者也要好于后者。而 NaCl 溶液浓度太小时微丸依然会发生粘连,所以最终选择0.014 mol·L-1NaCl溶液做润湿剂。不同类型和相同类型不同比例润湿剂对微丸性状和粒径分布的影响见表1和图3。

Table 1 Formulation and properties of pellets with different types and amounts of wetting agents表1 不同类型和比例润湿剂对微丸性状的影响
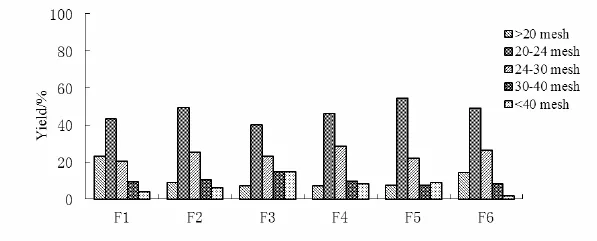
Fig. 3 Size distribution of pellets with different types and amounts of wetting agents图3 不同类型和比例润湿剂对微丸粒径分布的影响
2.1.3 稀释剂的选择
由于萘普生钠易吸潮,流动性不好,影响供粉效果,因此考虑加入少量稀释剂改善药物流动性,进而改善微丸质量。分别考察不加稀释剂、药物和微晶纤维素10:1、药物和淀粉10:1的造粒效果,以目标微丸收率、圆整度和脆碎度作为微丸质量的评价指标。
通过实验发现,不加稀释剂的萘普生钠造粒后微丸不圆整,而且收率较低,粒径分布不均匀。加入一定量微晶纤维素或淀粉后,圆整度和粒径分布明显改善,且收率提高。但是微晶纤维素和淀粉对微丸质量的影响没有较大差异。作者选择微晶纤维素做进一步的考察。稀释剂对微丸性状和粒径分布的影响见表2和图4。

Table 2 Effect of diluents on the quality of pellets表2 稀释剂对微丸性状的影响

Fig. 4 The effect of diluents on size distribution of pellets图4 稀释剂对微丸粒径分布的影响
2.1.4 稀释剂用量的考察
选择药物和微晶纤维素比例为12:1、10:1、8:1进行考察。
由表3和图5所示,微晶纤维素的用量越大、微丸越圆整且收率越高,粒径分布越均匀,兼顾微丸载药量和微丸的质量,决定采用药物和微晶纤维素10:1的比例。

Table 3 Properties of pellets with different ratios of MCC and drug表3 不同微晶纤维素和药物比例对微丸性状的影响

Fig. 5 Size distribution of pellets with different ratios of MCC and drug图5 不同微晶纤维素与药物比例对微丸粒径分布的影响
2.1.5 工艺因素的优化
影响微丸收率的因素主要包括喷液速度(A)、供粉速度(B)、主机转速(C),作者采用三因素三水平正交设计实验,筛选出最优工艺。选择因素水平见表4.
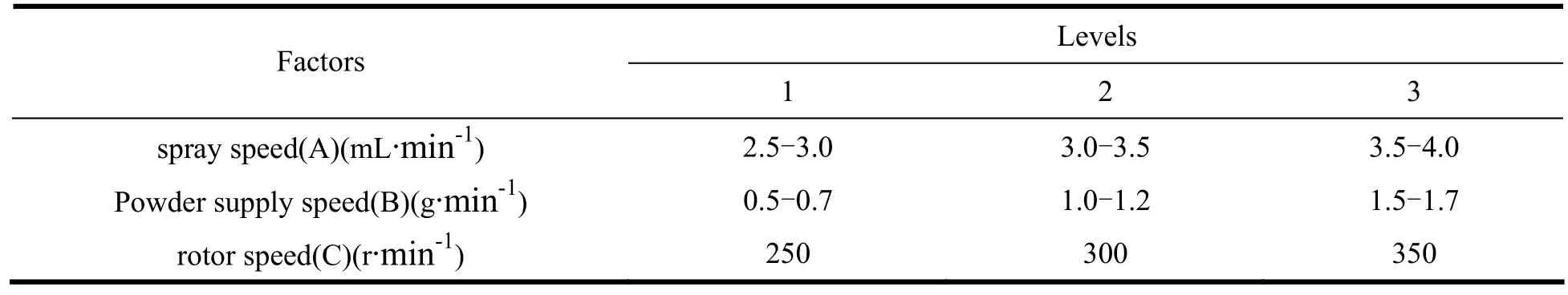
Table 4 Factors and levels of orthogonal test表4 正交设计实验因素水平
将选定的因素水平按 L9(34)正交试验设计表安排试验,以800~900μm微丸收率、圆整度、脆碎度为评价指标,参考文献[3]的评价方法进行实验,括号内标示的百分数为单因素的比较结果,综合评价为各因素百分数的相加值(最大者为最优)。
通过正交实验结果可以看到,喷液速度(A)、供粉速度(B)、主机转速(C)对微丸质量均有影响,影响大小是主机转速>供粉速度>喷液速度。通过综合评分发现Test No.5为最优工艺参数,即喷液速度3.0~3.5 mL·min-1、供粉速度为 1.0~1.2 g·min-1、主机转速300 r·min-1。若喷液速度较供粉速度快,微丸易粘连;若供粉速度较喷液速度快,则药粉飞扬,损失较大;若喷液速度和供粉速度都快,则微丸不圆整;若主机转速过快,则上药层容易剥落,导致细粉多,同样影响收率。由此可见,各因素水平必须协调好才能保证微丸最终质量。正交设计实验结果见表5。

Table 5 The orthogonal design and experimental results表5 正交设计实验结果
2.2流化床包衣制备萘普生钠肠溶微丸
2.2.1 肠溶衣材料的确定
目前常用的肠溶衣材料大都为聚丙烯酸树脂类化合物,大多数肠溶衣材料都需加入增塑剂、抗黏剂、抗静电剂等,且包衣后需老化,给生产带来不便。卡乐康公司的雅克宜 93F19255 是专用的微丸肠溶衣材料,属预混粉末,直接加水配制即可,包衣后不需老化,工艺省时省力,所以本研究予以采用。
2.2.2 肠溶包衣液的配制
以水做溶媒,将雅克宜包衣粉配制成固含量为20%的混悬液,搅拌至少1 h,临用前过450μm筛,在包衣过程中持续搅拌。
2.2.3 肠溶包衣的工艺
使用底喷式流化床进行肠溶包衣。称取30 g萘普生钠微丸于包衣桶中,预热2 min,设定鼓风频率30 Hz、喷枪喷雾压力为 0.2 MPa、恒流泵流速 1.0 mL·min-1、空气流量0.8 Nm3· h-1、进风温度30~35℃。待包衣液全部喷完,取出微丸于60℃下烘干0.5 h,备用。
2.2.4 萘普生钠肠溶微丸释放度的测定
取本品采用溶出度测定法(中华人民共和国药典2010版二部附录XD)第一法装置,以0.1 mol ·L-1盐酸溶液750 mL为溶出介质,转速为100 r·min-1,依法操作,于2 h立即吸取溶液10 mL,经0.45μm微孔滤膜滤过,取续滤液作为供试品溶液。在上述酸液中加入0.2 mol·L-1磷酸钠溶液250 mL,继续运转,于5、10、15、30、45、60 min,分别在规定取样点吸取10 mL溶液(同时补加同温、同体积介质),立即经0.22 μm微孔滤膜滤过,取续滤液,用甲醇稀释3倍,作为供试品溶液。取供试品溶液和对照品溶液各20 μL,注入液相色谱仪,按外标法以峰面积计算每粒的溶出量。限度为30 min内溶出标示量的80%以上。
2.2.5 包衣增重的考察
由于萘普生钠在0.1 mol·L-1盐酸中溶解度非常小,没有包衣的萘普生钠微丸在测定耐酸力时依然保持完整的微丸形状,没有崩解溶出。但是萘普生钠非肠溶制剂在胃中的吸收还是很好的,有文献报道它用pH 7.4的PBS做溶出介质,体内外相关性较好。因此萘普生钠的肠溶层增重还是应该谨慎考察,鉴于目前通过测定耐酸力来确定肠溶层增重的方法对萘普生钠这种酸中溶解度小的药物有一定局限性,作者根据经验将肠溶层增重定到20%,这个限度对一般药物都能买足耐酸力的要求。图6为微丸肠溶层增重到20%时和没有包肠溶层微丸的溶出曲线。可见20%的肠溶层增重对药物释放影响不大。

Fig. 6 Drug release profiles of pellets with and without enteric coating图6 有无肠溶包衣的萘普生钠微丸的溶出曲线
2.3 埃索美拉唑镁速释微丸处方工艺研究
2.3.1 埃索美拉唑镁层的处方及其制备工艺
埃索美拉唑镁层的处方为:萘普生钠肠溶微丸30 g,埃索美拉唑镁1.0 g/1.4 g,羟丙甲纤维素1.4 g,碳酸钠0.8 g,水40 mL。
埃索美拉唑镁层的制备工艺为:使用底喷式流化床进行包衣上药。称取30 g萘普生钠微丸于包衣桶中,预热2 min,设定鼓风频率30 Hz、喷枪喷雾压力为 0.2 MPa、恒流泵流速 1.0 mL·min-1、空气流量0.8 Nm3·h-1、进风温度35~38℃。待包衣液全部喷完,取出微丸于40℃下烘干0.5 h,备用。
2.3.2 埃索美拉唑镁速释层释放度的测定
通过测定埃索美拉唑镁在不同pH溶液下的的稳定性,发现其在酸性条件下迅速降解,在pH 6.8的环境中2 h内基本稳定,pH 7.4条件下8 h内基本稳定,pH 11.0条件下最稳定。所以选择pH 7.4的磷酸盐缓冲液作为埃索美拉唑镁的溶出介质。
取本品采用溶出度测定法(中华人民共和国药典2010版二部附录XD)第一法装置,以pH 7.4 的磷酸盐缓冲液为溶出介质,转速为100 r·min-1,依法操作,于5、10、15、30、45、60 min吸取溶液5 mL,经0.22 μm微孔滤膜滤过,取续滤液作为供试品溶液。取供试品溶液和对照品溶液各20 μL,注入液相色谱仪,按外标法以峰面积计算每粒的溶出量。限度为45 min内溶出标示量的80%以上。
2.3.3 埃索美拉唑镁投料量及其固含量的确定
本研究的埃索美拉唑镁包覆在萘普生钠之外,二者比例是确定的,所以埃索美拉唑镁的起始投料量尤为重要。从表6中可以看出,F1的溶媒最少,因此包上药所用时间最短,但是埃索美拉唑镁的载药量刚超出最低限度不多,这样不能保证每次都会在最低限度以上,有不合格的可能性,而且厂家如果将药物含量仅仅控制在超出最低标示量以上一点点也会被视为故意偷工减料,不能称之为高品质的药物。F4虽然药物收率最多,但是所需上药时间也最长,而且因为F4的溶媒多,干燥较慢,进一步增加了上药的时间。通过综合比较药物收率和载药量,发现F3为最佳。

Table 6 Formulation of EPM loading complied with the high-dose specification表6 高剂量组所对应的埃索美拉唑镁投料量及固含量
从表7中可以看出,F6的药物收率较大,比F5要节省原料药,但是F6的溶媒要比F5多,包衣上药的时间也会增大,由于F6的溶媒多,干燥较慢,包衣上药的速率比F5小,进一步增加了包衣上药的时间。F7同时增加了原料药的投料量和包衣时间,消耗较大。综合考虑决定采用F5的处方做进一步的考察。

Table 7 Formulation of EPM loading complied with the low-dose specification表7 低剂量组所对应的埃索美拉唑镁投料量及固含量
2.3.4 粘合剂的考察
在微丸不粘连的情况下选择高、中、低三种浓度的粘合剂考察其对上药率的影响。通过表 8可以看到,粘合剂用量在2.3%时药物损失大,而粘合剂用量在3.2%和4.4%时对上药率影响不大,所以选择3.2%的粘合剂用量。

Table 8 Formulation of EPM loading with different proportion of binders(low-dose)表8 不同比例粘合剂对埃索美拉唑镁上药收率的影响
图7是埃索美拉唑镁层直接包衣上药后的溶出曲线。实验结果表明粘合剂用量大使溶出稍有滞后,而且粘合剂剂量大,微丸易粘连,上药速率较小,导致上药时间长,所以选择F5中3.2 %的粘合剂用量。

Fig. 7 Drug release profiles of formulation with and without binders图7 加与不加粘合剂的药物溶出曲线
2.3.5 崩解剂的考察
埃索美拉唑镁的溶解度要好于奥美拉唑,但依然是微溶于水,因此考察了崩解剂对其溶出度的影响(见表9)。

Table 9 EPM loading formulation with and without drug disintegrants表9 加与不加崩解剂的埃索美拉唑镁上药处方
图8是埃索美拉唑镁层直接包衣上药后的溶出曲线。通过对崩解剂的考察,发现有无崩解剂对溶出曲线影响不大,所以决定不加崩解剂。

Fig. 8 Drug release profiles of formulation with and without disintegrants图8 加与不加崩解剂的药物溶出曲线
2.4 保护层的制备
2.4.1 保护层材料的确定
埃索美拉唑镁对光照、高湿、高温都不稳定。尤其是当水分从制剂表面渗透到内部后,会使肠溶材料的羧基解离出氢离子,使埃索美拉唑镁严重降解,所以具有防潮避光作用的保护层尤为重要。卡乐康的欧巴代YS-1-7027配制方法简单省时,兼具防潮避光的功能,所以本研究予以选用。
2.4.2 保护层包衣液的配制
若选用纯水分散,包衣速度不能过快,过快微丸易发生粘连,导致包衣效率低下,且需要较高进风温度,这样对埃索美拉唑镁的稳定性有一定影响,所以选择50%的乙醇溶液作为溶媒,固含量配制成5%,搅拌至少1 h,临用前过450 μm筛,包衣过程中不断搅拌。
2.4.3 保护层包衣的工艺
使用底喷式流化床进行保护层包衣。称取30 g上述制备的复方微丸于包衣桶中,预热2 min,设定鼓风频率20 Hz、喷枪喷雾压力为 0.2 MPa、恒流泵流速 0.8~1.0 mL·min-1、空气流量0.8 Nm3·h-1、进风温度46~50℃。待包衣液全部喷完,取出微丸于40℃下烘干0.5 h,备用。包衣增重为5%。
2.4.4 复方多层微丸的扫描电镜图
从图9中可以看到肠溶层、埃索美拉唑镁层、隔离层,说明复方多层微丸在制剂工艺上是可行的,特别是两种药物一种为缓释行为,一种为速释行为。

Fig. 9 SEM cross-section image of the multiple-layer pellets图9 多层微丸剖面电镜扫描图
2.5 复方制剂的稳定性
采用铝塑板复合膜袋包装进行加速试验(40±2℃、RH 75±5%),于1、2、3个月后取样检测。加速试验结果表明,萘普生钠稳定性较好,埃索美拉唑镁稍有降解,总体上说微丸外观、药物溶出度、含量都在合格范围之内。检测结果见表10。

Table 10 Stability of NAP/EPM compound pellets of three batches in accelerate test表10 三批萘普生钠/埃索美拉唑镁复方微丸在加速条件下的稳定性
3 讨论
粉末层积法在制丸过程中加入或摩擦产生的细粉不一定完全被丸核粘附,当喷入润湿剂溶液时,那些细粉可能吸收水分而相互聚集成假核,即与正常核的大小及含药量不同,而增加了体系中的丸核数量。在随后的相同操作中,细粉也会层积在那些新形成的假核上,从而导致形成微丸含量不均匀,制剂过程中应予以重视。
粘性较大的药物在制备微丸的时候有一定难度,可以考虑用乙醇溶液分散粘性[4],由于乙醇溶液挥发较快,分散效果可能不佳,这时还可以选择无机盐溶液[5]。
萘普生钠是水溶性强碱弱酸盐,若有水分渗入到丸芯内部会解离出OH-,使肠溶材料的耐酸力降低,单方萘普生钠肠溶制剂应在包肠溶层之前包隔离层,避免二者相互作用,单方的拉唑类肠溶制剂也是在包肠溶层之前包隔离层。而本制剂在埃索美拉唑镁外包隔离层,阻隔水分子,使埃索美拉唑镁不被肠溶材料解离的H+降解,也使肠溶材料不被萘普生钠解离出的OH-破坏,同样起到了保护作用。
本制剂和原研制剂都是拉唑类药物与肠溶材料直接接触。Vmovo公开的处方并没有碱性调节剂,推断埃索美拉唑镁在包衣上药时使用的是有机溶剂,这样保证了埃索美拉唑镁在溶媒中的稳定性,也避免了肠溶材料中H+的解离,使二者在制剂过程中不会发生相互作用。本制剂中埃索美拉唑镁包衣上药用的是水做溶媒,也没有发生变色,可能是其中的碱性调节剂在一定程度上对抗了肠溶材料的酸性,也可能是包衣过程中水分迅速挥干,不足以使肠溶材料解离。
参考文献:
[1] ODDSSON E, GUDJONSSON H, JODELEIFSSON T H, et al. Endoscopic finding in the stomach and duodenum after treatment with enteric-coated and plain naproxen tabletsin healthy subjects [J].Scand J Gastroenterol, 1991,25(3):231.
[2] KATZ P O, HATLEBAKK J G. Gastric acidity and acid breakthrough with twice-daily omeprazole or lansoprazole. Aliment Pharmacol Ther [J]. 2000, 14:709-714.
[3] 蔡荣刚, 王成润, 金一. 离心造粒法和流化床包衣制备硫普罗宁肠溶微丸[J]. 江苏大学学报(医学版), 2011,21(5):443-445.
[4] 崔福德. 药剂学[M]. 第5版. 北京. 人民卫生出版社, 2004 :114.
[5] NEAU S H, CHOW M Y, DURRANI M J. Fabrication and characterization of extruded and spheronized beads containing Carbopol 974, NF resin[J]. Int J Pharm, 1996, 131: 47- 55.
Study on the compound capsule of enteric-coated naproxen sodium and immediate-release esomeprazole magnesium pellets
SHA Lu-ping, ZOU Mei-juan, CHENG Gang*
(School of Pharmacy, Shenyang Pharmaceutical University, Shenyang 110016)
ObjectiveTo prepare the compound capsule containing enteric-coated naproxen sodium and immediate-release esomeprazole magnesium pellets.Methodnaproxen sodium pellets were developed in coating pan by powder layering technich which were coated with enteric layer (ACRYL-EZE 93F), esomeprazole magnesium, protection layer (Opadry YS-1-7027), sequentially. The preparation procedure of naproxen sodium pellets, the acid resistance of enteric layer and the stability of esomeprazole magnesium were evaluated.ResultsNaproxen sodium pellets had a relatively high drug loading. The acid resistance of enteric layer meet the requirement. Esomeprazole magnesium had a good stability.ConclusionCompound preparation of enteric-coated naproxen sodium and immediate-release esomeprazole magnesium can be realized in the dosage form of multiple-layer pellets.
pharmaceutics; multiple-layer pellets; powder layering technich; enteric-coated naproxen sodium ; immediate-release esomeprazole magnesium
R94
A
(本篇责任编辑:时硕坤)
(2015)01-0001-12
10.14146/j.cnki.cjp.2015.01.001
2014-04-01
沙露平(1988-),女(回族),辽宁抚顺人,硕士研究生,Tel.13840381709,E-mail shaluping1988@163.com;
*通讯作者:程刚(1963-),男(汉族),辽宁康平人,教授,博士,博士生导师,主要从事药剂学研究,Tel. 024-23986326,E-mail chenggang63@hotmail.com。

