肝刺激因子对非酒精性脂肪性肝炎保护作用的初探
史一君,郭 庆,安 威
(首都医科大学细胞生物学系,肝脏保护与再生调节北京市重点实验室,北京100069)
肝脏是以代谢功能为主的人体最大脏器。在体内扮演着消化、吸收、代谢,去除毒素和转运等多种重要角色。由于承担着如此繁重的任务,肝脏很容易被各种致病因素攻击。肝刺激因子(hepatic stimulator substance,HSS)是一种相对分子质量为15~23 000的多肽类物质,热稳定性强,无种属特异性,但有器官特异性[1]。HSS存在于哺乳动物的胚肝以及部分切除后的残余肝脏中[2]。研究表明,HSS可以保护肝细胞免受如四氯化碳、氨基半乳糖和缺氧等毒性因素的损伤[3-4]。非酒精性脂肪性肝病(non-alcoholic fatty liver disease,NAFLD)是一种逐渐被人们认识的慢性肝脏疾病,它是无过量饮酒史,以肝细胞脂肪变性为特征的临床综合征。NAFLD可谓为一个由轻到重的肝脏疾病谱,其病理过程包含3个发病阶段,即单纯性脂肪肝、非酒精性脂肪性肝炎(non-alcoholic steatohepatitis,NASH)、终末期的肝纤维化/肝硬化[5]。本实验室前期研究发现,HSS在蛋氨酸胆碱缺乏饲料饮食喂养的小鼠NASH中起到保护作用,可以减轻肝脏的脂肪堆积[6]。本研究旨在观察油酸(oleic acid,OA)诱导BEL-7402细胞NASH疾病的细胞模型中,HSS是否可以减轻细胞中脂质的堆积。而HSS对NASH疾病保护机制可能与内质网膜上的钙通道相关,这一部分的研究我们仍在进一步探讨中。
1 材料与方法
1.1 主要试剂 BEL-7402细胞,人原发性肝癌细胞系,本实验室保存;DMEM培养基(美国Gibco/BRL公司);胎牛血清(美国Hyclone公司);OA(美国Sigma公司);噻唑蓝[3-(4,5)-dimethylthiahiazo(-z-y1)-3,5-di-phenytetrazoliu-mromide,MTT]粉末(北京天来生物科技有限公司);组织三酰甘油(triglyceride,TG)酶法测定试剂盒(北京普利来基因技术有限公司);油红 O(美国Sigma公司);caspase-3/7活性检测试剂盒(美国Promega公司)。
1.2 细胞培养 野生型BEL-7402细胞、稳定转染空载体和稳定转染HSS的BEL-7402细胞在含10%胎牛血清的DMEM培养基中置于37℃含5%CO2的培养箱中培养。每24~48h传代1次,取处于对数生长期的细胞进行实验。
1.3 MTT法测定细胞活力 BEL-7402细胞按2×104个细胞密度接种于96孔板中,在37℃含5%CO2的培养箱中培养,直至细胞汇合达80%时,更换含有1%胎牛血清的DMEM培养基继续培养细胞5h,以排除血清对细胞的影响。分别向培养基中加入牛血清蛋白(bovine serum albumin,BSA)和浓度为25、50、100、200、400μmol/L的 OA培养24h。随后,每孔加入50μL的2g/L的MTT溶液继续培养3h。随后,将培养基吸出,每孔加入150μL二甲基亚砜,避光条件下振荡混匀10min。用酶标仪在490nm下测光密度(optical density,OD)值。
1.4 细胞内TG的测定 按照普利莱公司组织TG酶法测定试剂盒中说明书的步骤进行操作,用酶标仪在550nm工作波长下测定OD值。
1.5 油红O染色 配置0.5%油红O储存液,之后以3∶2的比例混合稀释油红O储存液和双蒸水,现用现配。待野生型BEL-7402,转染空载体或转染HSS的BEL-7402细胞汇合率达80%时,用中性甲醛固定细胞10min。用过滤后的油红O染液染色10~15min。用60%异丙醇脱色细胞5s,之后用PBS漂洗细胞3次,使用苏木精对细胞核复染10~20s[7]。
1.6 丙氨酸转氨酶(alanine aminotransferase,ALT)的测定 应用日立7180全自动生化分析仪检测细胞培养基上清液中ALT的含量。
1.7 Caspase-3/7活性检测 按照Promega公司caspase-3/7检测试剂盒说明书的步骤操作,用荧光分光光度计检测细胞凋亡情况。
1.8 统计学方法 应用SPSS11.5统计学软件进行数据分析。计量资料以±s表示,分别采用成组设计的t检验、配对t检验、F检验和q检验。P<0.05为差异有统计学意义。
2 结 果
2.1 MTT法检测不同浓度OA对BEL-7402细胞活性的影响 用25、50、100、200、400μmol/L OA处理BEL-7402细胞24h后,用MTT法检测细胞活性。细胞活力随OA浓度升高而下降。当OA浓度为200μmol/L时,与BSA对照组相比,细胞活力出现显著下降;当OA浓度为400μmol/L时,细胞活力下降更为显著(图1)。
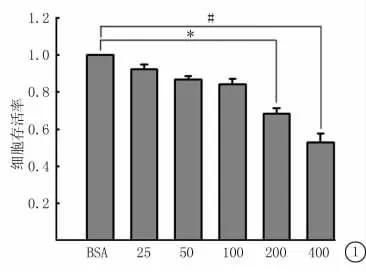
图1 MTT法检测不同浓度OA处理BEL-7402细胞活力*P<0.05 #P<0.01与BSA对照组比较(q检验)Figure 1 The cell activity was determined by MTT treated with different concentrations of OA to BEL-7402cells
2.2 不同浓度OA对BEL-7402细胞内TG含量的影响 用25、50、100、200、400μmol/L OA 分别处理BEL-7402细胞24h后,测定细胞内TG的含量。与BSA组相比,随OA浓度增加,细胞内TG含量逐渐增加,直至OA浓度为100μmol/L时,细胞内TG含量达到顶峰。当OA浓度>200μmol/L时,TG含量逐渐减少(图2)。这可能与OA浓度>200μmol/L时,细胞存活率显著下降有关。
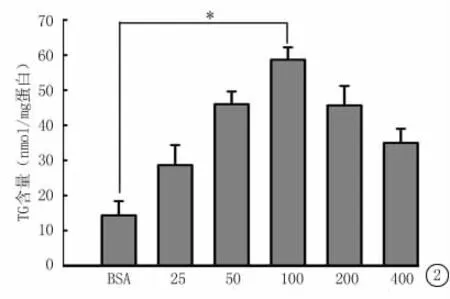
图2 检测不同浓度OA处理BEL-7402细胞内TG的含量*P<0.05与BSA对照组比较(q检验)Figure 2 The TG content in BEL-7402cells treated with different concentrations of OA
2.3 HSS对BEL-7402细胞内TG含量的影响
用100μmol/L浓度OA作用于转染空载体与稳定转染HSS的BEL-7402细胞24h,检测细胞内TG的含量。与空载体组相比,转染HSS组细胞内TG含量减少(图3)。
2.4 HSS对BEL-7402细胞中脂滴堆积的影响
TG聚积在肝细胞内会形成脂质沉积。100μmol/L浓度的OA作用于转染空载体与稳定转染HSS的BEL-7402细胞24h,用油红O染色可以观察到肝细胞内的脂质堆积情况。转染空载体细胞OA处理组,胞内可见大量红色颗粒,脂质沉积明显;稳定转染HSS细胞与转染空载体细胞相比,细胞内红色颗粒明显减少,脂质沉积减轻(图4)。
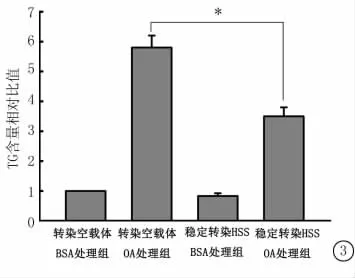
图3 稳定转染HSS可以减少TG在细胞内的堆积*P<0.05与转染空载体细胞的OA处理组比较(q检验)Figure 3 The triglyceride content was significantly decreased in HSS-overexpressing cells
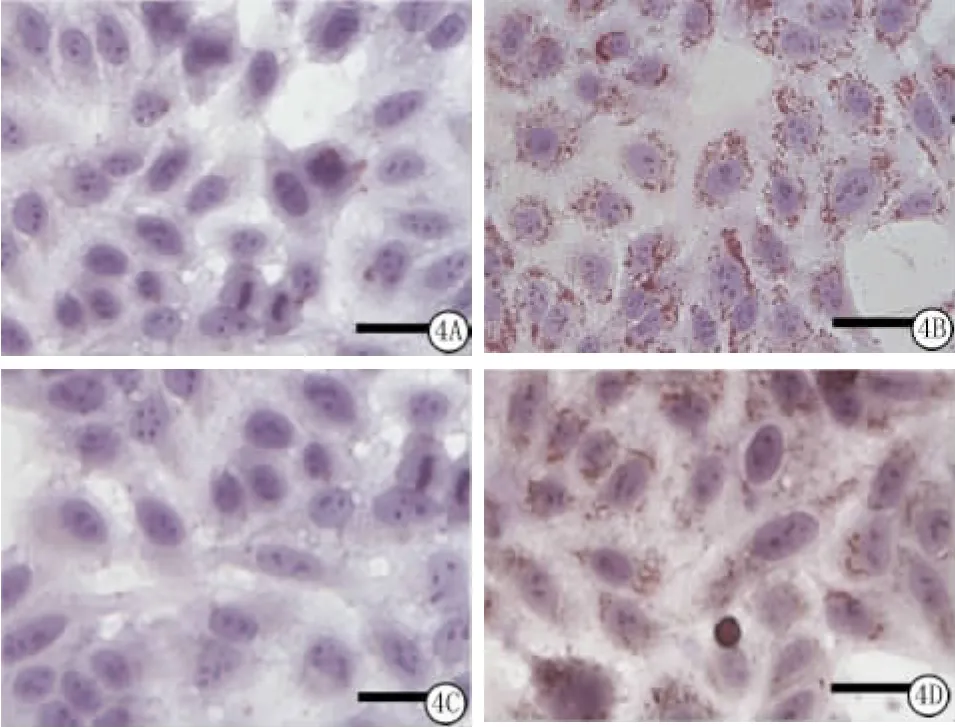
图4 脂质在BEL-7402细胞内的定位,标尺刻度均为50μm(油红O染色 ×40)A.转染空载体细胞BSA处理组油红O染色;B.转染空载体OA处理组油红O染色;C.稳定转染HSS细胞BSA处理组油红O染色;D.稳定转染HSS细胞OA处理组油红O染色Figure 4 The lipid accumulation was determined in BEL-7402 cells.The scale bar indicates 50μm(oil red O staining×40)
2.5 HSS对BEL-7402细胞细胞膜通透性的影响转染空载体OA处理组细胞,漏出胞外的ALT较BSA组明显增多,而稳定转染HSS可以显著减少细胞ALT的漏出,见表1。
表1 2组细胞上清中ALT比较Table 1 The cellular supernatant levels of ALT in two groups(n=9,±s,U/L)
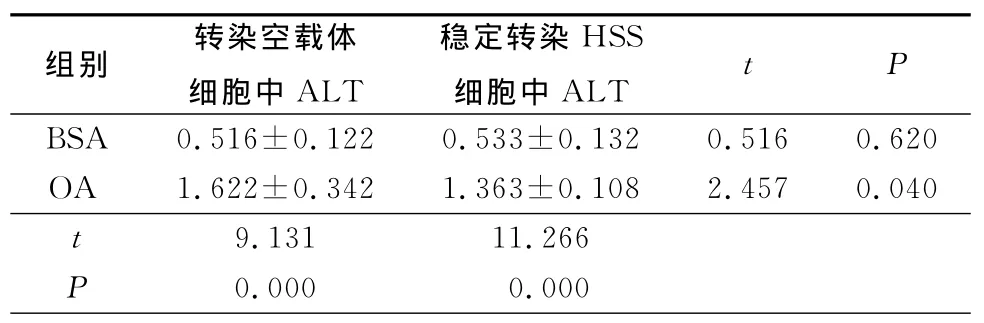
表1 2组细胞上清中ALT比较Table 1 The cellular supernatant levels of ALT in two groups(n=9,±s,U/L)
?
2.6 HSS对BEL-7402细胞凋亡的影响 用100 μmol/L浓度的OA作用于转染空载体与稳定转染HSS的BEL-7402细胞24h,检测细胞内caspase-3/7的活性。空载体OA处理组与BSA对照组相比,caspase-3/7的活性显著增强,而稳定转染HSS细胞的caspase-3/7活性显著减弱(图5)。
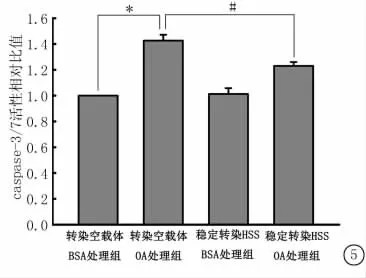
图5 稳定转染HSS可以减轻细胞凋亡*P<0.05与转染空载体的BSA处理组比较 #P<0.05与转染空载体的OA处理组比较(q检验)Figure 5 The caspase-3/7activity was notably decreased in HSS-overexpressing cells
3 讨 论
NAFLD是指除外酒精所致的一种慢性肝脏疾病,发病率日趋增长,引起了学者们的关注和重视。对于NAFLD的发病机制,目前尚未完全明确,广为认可的是由英国学者Day提出的“二次打击”学说。初次打击是指胰岛素抵抗和脂质代谢紊乱所导致的肝细胞内脂质沉积,形成了单纯性脂肪肝;二次打击是指在此基础上其他各种原因所致的氧化应激与脂质过氧化损伤引起的肝细胞损伤乃至凋亡[8]。
对于NASH的发病,肝脏内TG代谢紊乱是主要的发病原因。游离脂肪酸运输至肝脏过多,导致TG合成增多,肝脏脂肪蓄积。故本研究选用了OA不饱和脂肪酸诱导人肝癌细胞系BEL-7402建立体外NASH模型。使用不同浓度的OA处理BEL-7402细胞24h后,MTT法检测细胞活力,采用试剂盒测定细胞内TG的含量。发现当OA浓度达到100μmol/L时,细胞内TG含量最多,细胞生存率高。据文献报道,加入外源性HSS蛋白可以促进肝细胞增殖,甚至部分逆转实验性肝纤维化[9-10]。充分提示HSS是一个促进肝细胞生长的生长因子,同时还能保护肝脏。本研究结果显示,转染了HSS的细胞内TG含量明显减少,用油红O染色法观察细胞内脂质堆积减轻。表明HSS对肝细胞脂质损伤起到了保护作用。ALT主要存在于肝细胞的胞质中,当肝细胞受到损伤时,细胞膜通透性增加,大量ALT释放入细胞外[11]。ALT是临床上检验肝功能是否受损的重要指标。本研究中,检测细胞漏出的ALT含量发现,OA可以诱导细胞分泌ALT增多,而转染了HSS细胞中ALT含量比空载体组明显减少。提示HSS可以维持细胞膜的通透性,使细胞免受脂质损伤。OA诱导细胞发生了细胞凋亡,而转染HSS后,细胞凋亡减轻。说明HSS可以缓解肝细胞凋亡情况。
综上所述,在BEL-7402细胞中稳定转染HSS可以减少肝细胞内脂质的蓄积,保护肝损伤,减轻肝细胞凋亡。而HSS对NASH的保护作用我们也在进一步探索中,其可能机制为HSS通过抑制内质网应激进而减轻肝损伤。这为今后NASH的研究和防治提供了新的思路和依据。
[1] LaBrecque DR, Pesch LA.Preparation and partial characterization of hepatic regenerative stimulator substance(SS)from rat liver[J].J Physiol,1975,248(2):273-284.
[2] Sun GY,Dong LY,An W.Involvement of hepatic stimulator substance in the regulation of hepatoblast maturation into hepatocytes in vitro[J].Stem Cells Dev,2014,23(14):1675-1687.
[3] Jiang SJ,Li W,An W.Adenoviral gene transfer of hepatic stimulator substance confers resistance against hepatic ischemia-reperfusion injury by improving mitochondrial function[J].Hum Gene Ther,2013,24(4):443-456.
[4] Wu Y,Zhang J,Dong L,et al.Hepatic stimulator substance mitigates hepatic cell injury through suppression of the mitochondrial permeability transition[J].FEBS J,2010,277(5):1297-1309.
[5] 冯如剪,马蕊香,张晓博,等.饮食、运动及联合早期干预对青年非酒精性脂肪肝的临床疗效观察[J].河北医科大学学报,2013,34(11):1432-1435.
[6] 任梦,肖卫纯,安威.肝刺激因子在 MCD饮食喂养小鼠非酒精性脂肪性肝炎中的作用[J].中国组织化学与细胞化学杂志,2014,23(5):387-393.
[7] Mehlem A,Hagberg CE,Muhl L,et al.Imaging of neutral lipids by oil red O for analyzing the metabolic status in health and disease[J].Nat Protoc,2013,8(6):1149-1154.
[8] Day CP,James OF.Steatohepatitis:a tale of two"hits"?[J].Gastroenterology,1998,114(4):842-845.
[9] Zhang M,Song G,Minuk GY.Effects of hepatic stimulator substance,herbal medicine,selenium/vitamin E,and ciprofloxacin on cirrhosis in the rat[J].Gastroenterology,1996,110(4):1150-1155.
[10] Gribilas G,Zarros A,Zira A,et al.Involvement of hepatic stimulator substance in experimentally induced fibrosis and cirrhosis in the rat[J].Dig Dis Sci,2009,54(11):2367-2376.
[11] 张子玉,罗文明.超声检出脂肪肝与血脂水平及肝功能关系分析[J].临床荟萃,2012,27(23):2050-2052.

