CD40基因多态性与Graves病相关性的Meta分析*
胡卓清,陈晓铭,李 潍,武 革
(广东医学院附属医院内分泌科,广东湛江524001)
Graves病的确切病因仍不清楚,研究认为其遗传背景是由多个外显率不同的基因所决定,并存在基因-基因及基因-环境交互作用的器官特异性自身免疫性复杂疾病[1-2]。CD40参与淋巴细胞的增殖与分化,是免疫调节的重要分子之一,有研究表明该分子的表达异常与Graves病等多种自身免疫疾病有关。CD40基因Kozak序列的多态性可影响CD40基因mRNA的表达效率,可能是CD40分子结构(功能)、表达异常的重要原因[3-4]。候选基因法、全基因组关联分析及家系连锁分析均认为CD40-1C/T基因多态性(SNP,rs1883832)是 Graves病的遗传易感性风险位点之一[5-7]。基因多态性具有种族差异性已是不可争议的事实,Li等[8]分析表明CD40-1C/T基因多态性与Graves病发病相关联,然而最近不同种族间的研究仍得出CD40-1C/T多态性与Graves病遗传易感性不一致的结论。因此本研究通过此次Meta分析全面分析该多态性与Graves病发病的关系。
1 资料与方法
1.1 文献检索 检索Pubmed、中国生物医学文献数据库(CBM)、维普、万方、中国学术期刊网络出版总库(CNKI)及Cochrane library数据库获取所需文献。采用主题词结合关键词的综合检索策略,中文词有“Graves病”、“格雷夫斯病”、“CD40”、“TNFRSF5”、“肿瘤坏死因子受体超家族5”、“基因多态性”、“多态性现象,遗传”、“CD40”;英文词有“Graves′disease”,“Graves”,“thyroid”,“CD40”,“TNFR-SF5”,“TNF receptor super family member 5”,“genetic polymorphism”,“gene polymorphism”,“polymorphism”,“polymorphism,genetic”。最后一次检索时间为2014年9月1日,检索的文献没有语种限制,辅以文献追朔法及手工检索。
1.2 筛选标准
1.2.1 文献纳入标准 (1)以全文形式发表,有关 CD40-1C/T多态性与Graves病易感性关联分析的研究;(2)研究类型为病例对照研究,且病例组为散发人群,对照组为无关个体;(3)原文提供Graves病组和对照组必要的 Meta分析数据;(4)正常对照组的基因型频率符合Hardy-Weinberg平衡。
1.2.2 文献排除标准 (1)研究设计类型和实验目的与入选标准不符合;(2)全文未提供病例对照组的必要数据;(3)动物实验、综述和重复发表的研究;(4)基于家系数据的研究;(5)低质量的研究报告。
1.3 数据提取 由2个内分泌专业研究员独立进行评估及数据提取,交叉核对,不一致时由第三者评定或双方讨论协商解决。文献摘录的信息如下,(1)收集者的姓名;(2)研究出处及研究者;(3)研究质量;(4)实验的方法:基因多态性分型方法;(5)研究对象:来源、样本量、人口统计学指标、诊断标准、家族史;(6)结局:病例和对照组的各基因型,等位基因的频数、频率,比值比(OR)值及95%可信区间(95%CI);(7)有无明确对照组甲状腺抗体(Ab)阴性,未明确描述的为Ab(±),明确描述的为(Ab-)。
1.4 统计学处理 Meta合并效应量采用RevMan5.2计算等位基因及基因型分布频率在Graves病组与对照组的差异。二分类资料选取OR值为分析统计量,合并效应值用95%CI表示。不同文献在排除临床异质性后,其异质性采用Q检验和I检验。研究齐性时选择固定效应模型(FEM),不齐则选随机效应模型(REM)。当异质性存在,按研究对象种群(高加索人群、亚洲人群)及对照组甲状腺抗体(Ab±、Ab-)分亚组分析,Meta回归分析进一步探索异质性的来源,敏感性分析结果的稳定性。发表偏倚结合采用漏斗图、Egger回归法及非参数剪补法,χ2检验对照组Hardy-weinberg平衡。P值的检验水准取α=0.05,以P<0.05为差异有统计学意义。共性模型3种基因型之间的两两比较P值检验水准校正为:P′=2α/κ(κ-1)=0.0167,P<P′提示差异有统计学意义。
2 结 果
2.1 文献检索结果及纳入文献特征 结合不同渠道的初步检索出中英文文献篇,通过题目及摘要初筛及阅读全文复筛,最后纳入 Meta分析的文献18篇[5,9-25](病例组5 198例,对照组4 417例)筛选流程如图1所示,详细的文献信息见表1。
2.2 Meta定量分析结果
2.2.1 Graves病及正常对照组的CD40-1C/T多态性的分布
定量合成18篇研究显示等位基因在两组的分布频率差异均有统计学意义,等位基因C可增加Graves病发病风险1.27倍(OR=1.27,95%CI=1.14~1.41,P<0.01)。研究之间存在中等异质性(I2=59%,P<0.01),见图2。亚组及回归分析均表明 Ab(±)/Ab(-)是异质性的主要来源(r2=72.62%,P=0.005),高加索与亚洲人群的差别非等位基因合并比较的主要异质性来源,但在高加索人中等位基因C/T的分布频率在两组中差异无统计学意义(P=0.150),见表2。采用3种基因模型进行分析比较结果表明,除共性遗传模型中的CT vs.TT差异有无统计学意义(P=0.04),其他比较均差异统计学意义:CC vs.TT(OR=1.60,95%CI=1.28~2.00,P<0.01);CC vs.CT(OR=1.25,95%CI=1.14~1.37,P<0.01);CC vs.CT+TT(OR=1.34,95%CI=1.17~1.52,P<0.01);CC+CTvs.TT(OR=1.36,95%CI=1.13~1.64,P<0.01)。携带C等位基因的个体有倾向Graves病发病风险,TT基因型者则反之。CC vs.TT(I2=50%,P=0.000 8)、隐形模型(I2=48%,P=0.01)及显性模型(I2=44%,P=0.02)均有中等异质性,亚组及回归分析表明Ab(±)、Ab(-)均为3种基因遗传模型对比中的主要异质性来源(其中显性模型的异质性来源于研究对象种族及对照组Ab二者的差异)。高加索人群中在显性遗传模型及共性模型的CC vs.TT、CTvs.TT对比中显示差异无统计学意义(P=0.66、0.42、0.63),见表2。

图1 各阶段信息收集流程图
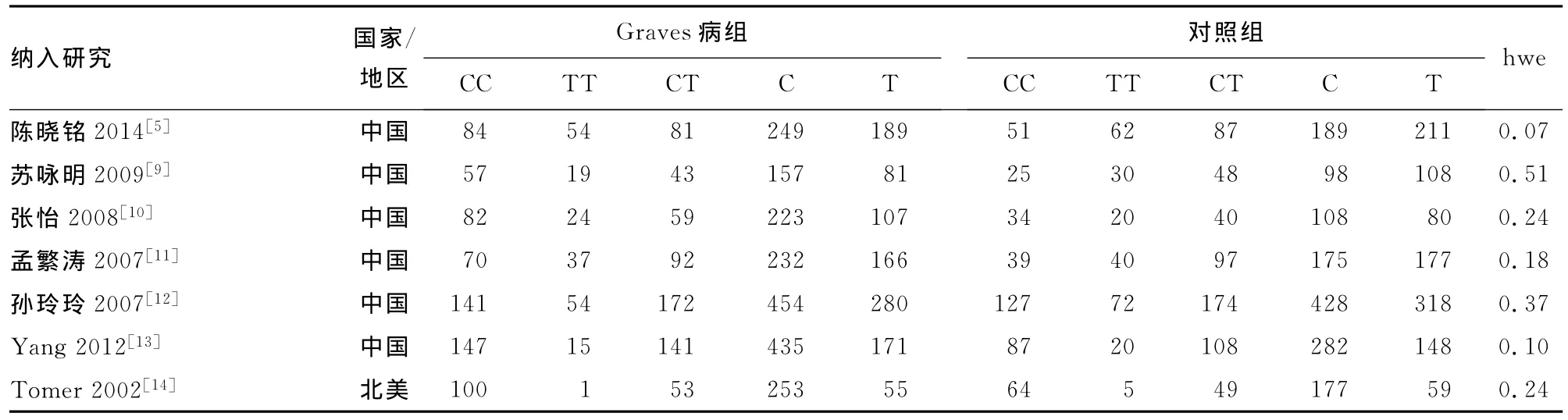
表1 纳入Meta分析文献的主要信息

续表1 纳入Meta分析文献的主要信息

图2 等位基因C VS T在两组中分布的Meta分析
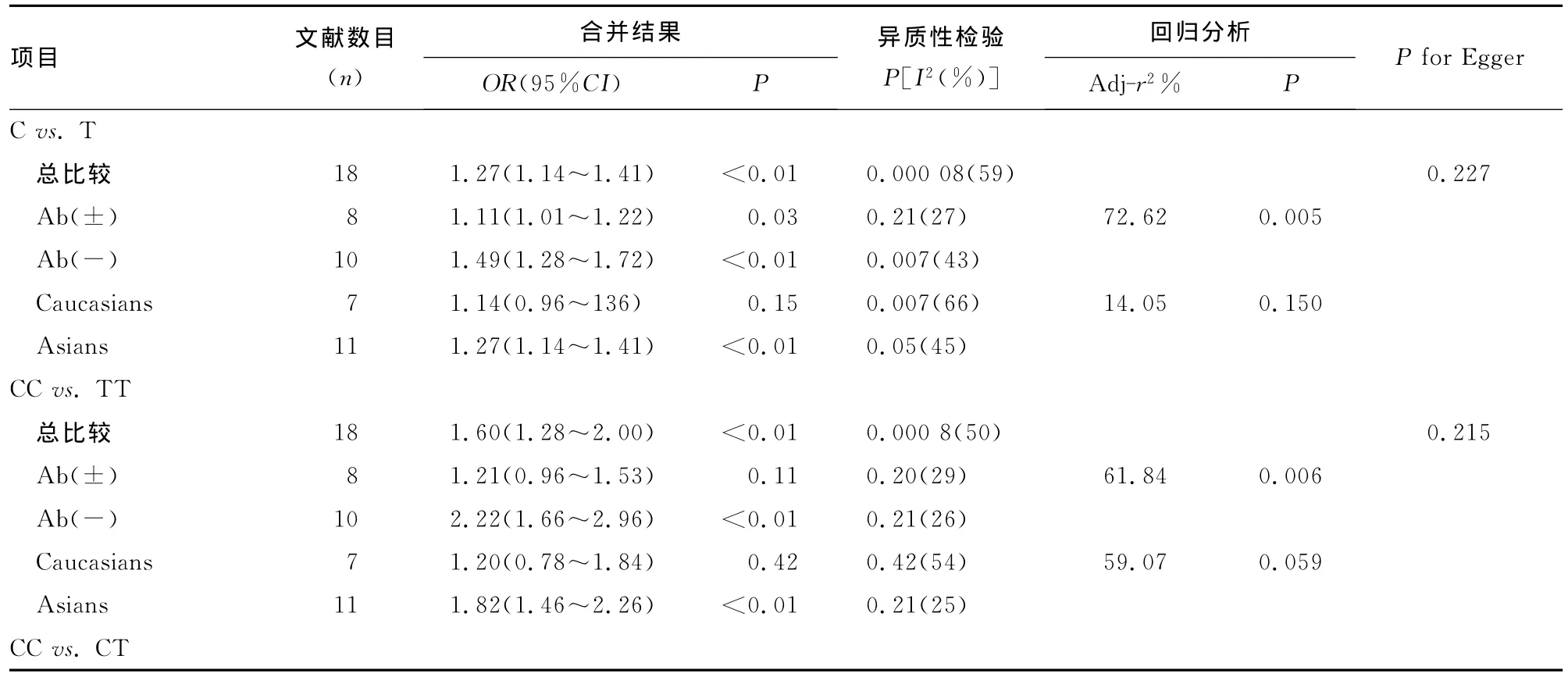
表2 CD40-1C/T基因多态性与Graves病关系的主要结果

续表2 CD40-1C/T基因多态性与Graves病关系的主要结果
2.2.2 CD40-1C/T多态性在Graves病眼病及家族史亚组中的分布 分别整合多篇文献分析CD40-1C/T多态性与Graves病眼病及家族史的关系,结果表明等位基因及基因型分布频率在伴Graves病眼病/不伴Graves病眼病、有Graves病家族史/无Graves病家族史这两个亚组中差异均无统计学意义(P>0.05),除Graves病眼病亚组中的CC+CTvs.TT对比中有中等异质性(I2=55%,P=0.05,经分析其异质性主要来源于个别大样本量的研究),余均研究之间较齐,合并的结果可靠。见表3。

表3 CD40-1C/T基因多态性与Graves病眼病及家族史关系的Meta分析
2.3 敏感性分析 用STATA12.0及Rveman5.2对有异质性的比较进行敏感性分析,通过观察单个研究数据对合并OR值的影响,结果表明其OR值没有大幅度的改变,合并的结果比较稳健。
2.4 发表偏倚 结合Egger回归法、漏斗图及非参数剪补法结果显示CTvs.TT有明显的发表偏倚(P=0.037),其余的比较均无明显发表偏倚(P>0.05),表明这些研究之间发表性偏倚较小,结果比较稳定。见表2。
3 讨 论
CD40/CD40L是B淋巴细胞免疫最重要的第二共刺激信号通路,它还在抗体的分泌、免疫球蛋白(Ig)的转换及调节CD4+T细胞应答等方面发挥关键作用[26]。研究表明CD40广泛表达于许多不同功能类型的细胞:如APCs细胞、甲状腺滤泡上皮细胞、纤维细胞等,而且Graves病患者的甲状腺组织中高表达是引起甲状腺器官特异性自身免疫的重要原因之一[27]。CD40基因的Kozak序列的转录起始密码子ATG是必不可少的翻译起点。
此次的Meta分析纳入符合条件的文献18篇(病例组5 198例,对照组4 417例),分析表明等位基因C/T及3种基因型模型比较显示它们在两组的分布差异均有统计学意义(P<0.05)。与T等位基因相比,C等位基因增加Graves病易感性风险,基因型CC和(或)基因CT个体增加Graves病发病风险。共性模型显示等位基因C呈递加性增加Graves病的发病风险(CC vs.TT:OR=1.60,CC vs.CT:OR=1.25,CTvs.TT:OR=1.16)表明Graves病发病易感性基因的外显率并不完全,且随风险等位基因的增加而增加。等位基因C可增加CD40mRNA的转录效率,从而使该分子异常表达在炎症、增生、细胞凋亡,甚至在基因调节过程中起重要作用[3-4]。CD40可能通过以下机制致甲状腺免疫疾病:(1)CD40高表达使B细胞更易于激活,甲状腺自身免疫相关抗体[如TSH受体抗体(TRAb)]分泌增加;(2)除了可通过调节下游常见的细胞因子及趋化因子,Graves病患者的纤维细胞高表达CD40致白细胞介素6(IL-6)亦升高,T细胞免疫异常激活而致甲状腺自身免疫,其机制涉及蛋白激酶 B(Akt)及核因子-κB(NF-κB)通路[28-29]。亚组分析及回归分析显示对照组甲状腺抗体(Ab±、Ab-)是研究之间的主要异质性来源,可见在选择正常对照组时有必要检测甲状腺抗体水平,以减少研究对象入选的误差。当以研究对象种群分层时,高加索人等位基因分布频率、显性模型及共性模型的CC vs.TT、CTvs.TT对比均差异无统计学意义。高加索人群人口最多且分布广泛,该人群的等位基因C/T突变频率可能受广泛的种群及环境因素筛选而差异大;另外在该人群的研究总样本量较少可能是CD40-1C/T多态性与高加索人Graves病发病的关系不甚明确的原因。敏感性分析表明最后结果比较稳健,无明显发表偏倚。CD40/CD40L是成纤维细胞活化的一个重要通路,Graves病眼病患者眼眶结缔组织高表达CD40mRNA及CD40分子,可能是Graves病眼病眼眶组织致敏、致炎及增生的分子基础[30]。然而分别整合各文献并未发现伴Graves病眼病与不伴眼病及伴Graves病家族史与不伴家族史亚组中CD40-1C/T多态性有分布频率的差异。本研究不能排除由于文献数少而统计假阴性的结果,另一方面可能Graves病眼病与Graves病的发病并不共享CD40-1C/T多态性。
本次的Meta分析尚有不足之处,一些灰色文献未被纳入、代表的人群不广泛、纳入文献偏少、文献的质量问题等限制了此次Meta分析的统计效力。本次Meta分析表明CD40-1C/T多态性与Graves病有关,与Graves病眼病及家族史无关联,但有待更多高质量且同质的研究分析验证。
[1] Brix TH,Kyvik KO,Christensen K,et al.Evidence for a major role of heredity in Graves′disease:apopulationbased study of two Danish twin cohorts[J].J Clin Endocrinol Metab,2001,86(2):930-934.
[2] Balazs C.The role of hereditary and environment factors in autoimmune thyroid disease[J].Orv Hetil,2012,153(26):1013-1022.
[3] Jacobson EM,Concepcion E,Oashi T,et al.A Graves′disease-associated kozak sequence single-nucleotide polymorphism enhance the efficiency of CD40gene translation:a case for translational pathophysiology[J].Endocrinology,2005,146(6):2684-2691.
[4] Hasham A,Tomer Y.Genetic and epigenetic mechanisms in thyroid autoimmunity[J].Immunol Res,2012,54(1/3):204-213.
[5] 陈晓铭,胡卓清,李潍,等.CD40-1C/T多态性(rs1883832)与粤西汉族人Graves病的关系[J].国际内分泌代谢杂志,2015,35(1):11-15.
[6] 王海宁,江鹤,刘威,等.在中国汉族人群中CD40 5′非翻译区的SNP与Graves′病相关[C].陕西:中华医学会第十二次全国内分泌学学术会议论文汇编,2013:119.
[7] Tomer Y,Ban Y,Concepcion E,et al.Common and unique susceptibility loci in Graves and Hashimoto diseases:results of whole-genome screening in a data set of 102multiplex families[J].Am J Hum Genet,2003,73(4):736-747.
[8] Li M,Sun H,Liu S,et al.CD40C/T-1polymorphism plays different roles in Graves′disease and Hashimoto′s thyroiditis:a Meta-analysis[J].Endocr J,2012,59(12):1041-1050.
[9] 苏咏明.CD40基因多态性与广东汉族人群Graves病临床相关关系分析[D].广东:广州医学院,2006.
[10]张怡,朱本章,孙燕.CD40基因多态性与自身免疫性甲状腺病的相关性[J].西安交通大学学报:医学版,2008,29(3):294-296,304.
[11]孟繁涛.CD40基因Kozak序列(C-T)单核苷酸多态性与Graves病相关性的研究[D].哈尔滨:哈尔滨医科大学遗传学,2007.
[12]孙玲玲,褚迅,黄薇,等.CD40基因多态性与Graves病的相关性研究[J].实用医学杂志,2007,23(5):655-657.
[13]Yang J,Qin Q,Yan N,et al.CD40C/T-1and CTLA-4 A/G(49)SNPs are associated with autoimmune thyroid diseases in the Chinese population[J].Endocrine,2012,41(1):111-115.
[14]Tomer Y,Concepcion E,Greenberg DA.A C/T singlenucleotide polymorphism in the region of the CD40gene is associated with Graves′disease[J].Thyroid,2002,12(12):1129-1135.
[15]Mukai T,Hiromatsu Y,Fukutani T,et al.A C/T polymorphism in the 5′untranslated region of the CD40gene is associated with later onset of Graves′disease in Japanese[J].Endocr J,2005,52(4):471-477.
[16]Makni T,Hadjkacem H,Rebai A,et al.Association and linkage studies of the 20q11.2region(GRD-2locus)with Graves′disease in the Tunisian population[J].Ann Hum Biol,2007,34(5):566-572.
[17]Kurylowicz A,Kula D,Ploski R,et al.Association of CD40gene polymor-phism(C-1T)with susceptibility and phenotype of Graves′disease[J].Thyroid,2005,15(10):1119-1124.
[18]Kim TY,Park YJ,Hwang JK,et al.A C/T polymorphism in the 5′-untranslated region of the CD40gene is associated with Graves′disease in Koreans[J].Thyroid,2003,13(10):919-925.
[19]Jurecka-Lubieniecka B,Ploski R,Kula D,et al.Association between age at diagnosis of Graves′disease and variants in genes involved in immune response[J].PLoS One,2013,8(3):e59349.
[20]Jacobson EM,Huber AK,Akeno N,et al.A CD40kozak sequence polymorphism and susceptibility to antibodymediated autoimmune conditions:the role of CD40tissuespecific expression[J].Genes Immun,2007,8(3):205-214.
[21]Inoue N,Watanabe M,Yamada H,et al.Associations between autoimmune thyroid disease prognosis and functional polymorphisms of susceptibility genes,CTLA4,PTPN22,CD40,FCRL3,and ZFAT,previously revealed in genome-wide association studies[J].J Clin Immunol,2012,32(6):1243-1252.
[22]Jy H,Tien KJ,Hsiao CT,et al.A C/T polymorphism in CD40gene is not associated with susceptibility and phenotype of Graves′disease in Taiwanese[J].Endocr J,2008,55(3):477-484.
[23]Houston FA,Wilson V,Jennings CE,et al.Role of the CD40locus in Graves′disease[J].Thyroid,2004,14(7):506-509.
[24]Heward JM,Simmonds MJ,Carr-Smith J,et al.A single nucleotide polymorphism in the CD40gene on chromosome 20q(GD-2)provides no evidence for susceptibility to Graves′disease in UK Caucasians[J].Clin Endocrinol(Oxf),2004,61(2):269-272.
[25]Ban Y,Tozaki T,Taniyama M,et al.Association of a C/T single-nucleotide polymorphism in the 5′untranslated region of the CD40gene with Graves′disease in Japanese[J].Thyroid,2006,16(5):443-446.
[26]龚非力.医学免疫学[M].3版.北京:科学出版社,2012:69-72.
[27]Smith TJ,Sciaky D,Phipps RP,et al.CD40expression in human thyroid tissue:evidence for involvement of multiple cell types in autoimmune andneoplastic diseases[J].Thyoid,1999,9(8):749-755.
[28]Huber AK,Finkelman FD,Li CW,et al.Genetically driven target tissue overexpression of CD40:a novel mechanism in autoimmune disease[J].J Immunol,2012,189(6):3043-3053.
[29]Gillespie EF,Raychaudhuri N,Papageorgiou KI,et al.Interleukin-6production in CD40-engaged fibrocytes in thyroid-associated ophthalmopathy:involvement of Akt and NF-κB[J].Invest Ophthalmol Vis Sci,2012,53(12):7746-7753.
[30]赵立全,程金伟,魏锐利.甲状腺相关眼病眼眶结缔组织中共刺激分子CD40/CD40L的表达[J].第二军医大学学报,2010,31(7):801-804.

