白头鹎对季节性驯化和温度适应的生理反应
夏素素,杨 芳,王润梅,郑蔚虹,2,赵志军,2,柳劲松,2,*
1 温州大学生命与环境科学学院, 温州 325035 2 温州大学应用生态研究所, 温州 325035
白头鹎对季节性驯化和温度适应的生理反应
夏素素1,杨 芳1,王润梅1,郑蔚虹1,2,赵志军1,2,柳劲松1,2,*
1 温州大学生命与环境科学学院, 温州 325035 2 温州大学应用生态研究所, 温州 325035
在自然环境中,有机体某一特性的可塑性变化在适应和功能方面是非常重要的。以成年白头鹎(Pycnonotussinensis)为研究对象,分别在野外驯化条件和实验室温度适应条件下测定静止代谢率(RMR)、蒸发失水率(EWL)和代谢活性器官的重量,同时测定肝脏及肌肉的线粒体呼吸和细胞色素C氧化酶活力(COX)。野外季节性驯化在冬季和夏季时测定;实验室温度适应分为2组,分别在10℃和30℃下适应4周后进行测定。结果显示,与夏季驯化和暖适应组相比,冬季驯化和冷适应组RMR和EWL较高、代谢活性器官较重,线粒体呼吸速率和COX活性显著增加;器官重量和细胞产热能力的适应性变化可能是导致了RMR适应性调节。结果表明,白头鹎可以表现出对季节性驯化和温度适应的生理反应,利用这种能力应付野外环境温度的波动。生理能量特性的可塑性是鸟类能量代谢的共同特征。
白头鹎;温度适应;季节性驯化;生理反应
鸟类生理适应性的研究已成为生态生理学和进化生理学的中心议题[1- 2]。鸟类在应对外界环境变化可通过改变其形态、生理、行为及生活史对策等引起短期补偿性的适应反应,而这种变化反应是表型可塑性的结果[3- 5]。表型可塑性反映了生物对不同环境的适应能力,是先前固有遗传特征对不同环境条件的适当表现,包括短期适应和季节性驯化[6- 7]。
鸟类的代谢率(MR)与其生活的外界环境密切相关,对其研究有助于了解动物在形态学、生理学、行为学和生活史对策上的进化[8- 9]。同时MR也反映出动物对环境的适应模式和生理能力,体现出生物多样性与环境之间相适应的关系[10- 11]。此外,研究表明蒸发失水(EWL)受外界环境的影响显著,同时水分丢失往往伴随着热量的散发,使得EWL在鸟类的热量平衡中起重要作用[12- 13]。
从生物进化的角度看,一个器官的功能结构应该和能量需求相匹配,即器官能随能量需求的变化而做出适应调节[14]。Swanson[1]研究认为动物为了应对多变的外界环境,可通过身体组分或特定组织的代谢调节使身体组分或器官大小(重量)及基础代谢产热发生变化。由于形态结构和功能能力的表现型变化可通过能量的获得和使用直接影响着适合度,所以器官的这种表型可塑性也是脊椎动物适应环境的普遍和典型的适应方式[15]。另外,鸟类提高基础产热的潜在机制之一是提高组织的细胞色素C氧化酶(COX)的活力和线粒体呼吸[16- 18]。
白头鹎(Pycnonotussinensis)属雀形目(Passeriformes)鹎科(Pycnonotidae),为留鸟。世界分布于欧亚大陆及非洲北部、中南半岛。在我国主要分布于东南沿海地区、太平洋诸岛屿,在浙江省是常见的雀形目鸟类之一[19]。白头鹎食性很杂,随着季节的变化而不同,春夏季以动物性食物为主,秋冬两季主要吃植物性食物。已发现白头鹎具有较高的体温、较低的基础代谢率(BMR)和较宽的热中性区[20],其代谢产热存在明显的昼夜节律和季节性变化[21- 22]。内部器官(如肝脏、心脏、肾脏和消化道)及肌肉重量都与BMR的大小呈正相关,肝脏和肌肉的线粒体呼吸、COX活力及甲状腺激素冬季明显高于夏季,显示出白头鹎在季节性驯化过程中从整体、器官到生理和生化的可塑性变化[23- 29]。
目前,国内外已有较多关于鸟类季节驯化的报道[17- 18,30]或温度适应的研究[27- 29,31- 32],但少有关于整合两者的研究[33]。为进一步了解鸟类季节性驯化与温度适应生理反应的异同,本研究以白头鹎为实验对象,测定了野外驯化条件和实验室温度适应条件下白头鹎的静止代谢率(RMR)、EWL和代谢活性器官的重量,同时测定肝脏及肌肉的线粒体呼吸和COX活力,试图从整体、器官、细胞及酶学水平系统的解释白头鹎季节性驯化到温度适应能力的改变及其生理适应对策。
1 材料和方法
1.1 研究地点
温州地区气候温暖,年平均降雨量可达1700mm,每季均有降雨,其中以春、冬两季降雨量较高。平均最高温度从7月的39℃到1月的8℃,平均最低温度从7月的28℃到1月的3℃,年平均温度18℃[18,22]。
1.2 季节性驯化实验
16只白头鹎于2011年夏季(6月下旬至7月,8只,3♀、5♂)和冬季(12月下旬至次年1月,8只,4♀、4♂)捕自浙江省温州地区,标记并单笼(60cm×60cm×30cm)饲养于温州大学动物实验房。在自然光照、室温的环境条件下自由饮水、取食(食物为江苏谢通生物工程有限公司生产的饲料:粗蛋白20%,粗脂肪6%,粗纤维4%,钙1%,赖氨酸0.5%,蛋氨酸+胱氨酸0.5%)。白头鹎在实验室适应1d后用于实验。
1.3 实验室温度适应实验
18只白头鹎于2011年8月捕自浙江省温州地区,单笼饲养于温州大学实验动物房,自然光照、室温下自由取食及饮水。适应1周后,随机分为低温组(10℃)与暖温组(30℃),每组9只,分别于温州大学人工气候室中驯化4周(其中光照时间:12L∶12D)。
1.4 静止代谢率(RMR)代谢测定
代谢率以每小时整体耗氧量(mL O2/h)表示。耗氧量采用开放式氧气分析仪测定(AEI technologies S- 3A/I,美国)。呼吸室体积为1.6 L,人工气候箱(BIC- 250,北京)控制呼吸室实验温度30℃(±0.5℃)。RMR的测定每天在18:00—24:00时间进行。动物实验前禁食3 h,放入呼吸室内适应1 h后开始测定耗氧量,共测定1 h,选择20个连续稳定的最低值计算RMR(大约7分钟)。每次实验前后称量鸟的体重(精确至0.1g),以泄殖腔温度代表体温,用数字式温度测量仪(北京师范大学司南仪器厂,TH- 212,精确至0.1℃)插入泄殖腔内约1.5cm处测定约30秒[27,34]。
1.5 蒸发失水(EWL)测定
在测定RMR的同时测定EWL,待RMR出现稳定值后,将预先称重(精确至0.1mg)并装有干燥硅胶的“U”型管接在呼吸室后,连续测定1 h,实验前后干燥剂重量差即为EWL。若鸟在测定期间有排泄现象,则数据作废[34]。
1.6 热传导的计算
根据牛顿冷却定律简化公式计算白头鹎的热传导值:
C=MR/(Tb-Ta)
式中,C为热传导(mL O2g-1h-1℃-1),MR为代谢率(mL O2g-1h-1),Tb为体温(℃),Ta为环境温度(℃)[35]。
1.7 器官重量的测定
RMR测定结束后,隔日处死实验动物,将心、肝、肌肉及小肠各部分小心分离并迅速取出,部分肝脏和肌肉用于测定线粒体呼吸及细胞色素C氧化酶活力。同时将小肠剔除肠系膜和脂肪组织,然后纵剖,用生理盐水洗净内容物,滤纸吸干,将各器官置于60℃烘箱内烘至恒重,用电子天平(瑞士梅特勒,0.1mg)称量记为干重[17]。
1.8 线粒体的制备
按照Sundin等[36]介绍的方法,将肝脏和肌肉置于0.25 mol/L蔗糖溶液中清洗(冰浴),然后将剪碎的组织放入玻璃-Teflon匀浆器内,加入一定体积的匀浆液匀浆(100 mmol/L KCl, 50 mmol/L Tris-HCl, 5 mmol/L MgSO4, 1 mmol/L EDTA, pH 7.2),于3000 r/min离心7 min,取上清液于10000 r/min离心(10 min两次),得到线粒体[16,18,26]。
1.9 线粒体呼吸及细胞色素C氧化酶(COX)的测定
肝脏和肌肉的线粒体状态4呼吸采用铂氧电极-溶氧仪(英国Hansatech, DW- 1)测定,反应温度为30℃,反应杯总体积为2 mL,加入1.98 mL基质液(225 mmol/L sucrose, 50 mmol/L Tris/HCl, 5 mmol/L MgCl2, 1 mmol/L EDTA, 5 mmol/L KH2PO4, pH 7.2)和0.02 mL线粒体提取液[37],以琥珀酸作底物。
1.10 数据
利用SPSS统计软件包进行相关数据统计分析。组间体重和体温比较采用单因素方差分析(one-way ANOVA),为了避免代谢率、EWL、热传导及器官重量指标受体重影响而导致结果分析出现误差,组间代谢率、EWL、热传导和器官重量的比较均采用协方差分析(ANCOVA)(体重为协变量),用此方法对各指标在季节驯化和温度适应条件下的回归曲线进行对比分析。本文同时对白头鹎雌雄个体在季节性驯化和温度适应的各项指标进行了相关统计分析。文中数据均以平均值±标准误(Mean±SE)表示,P<0.05即认为差异显著。
2 结果
白头鹎雌雄个体在季节性驯化和温度适应的体重和体温、代谢率、蒸发失水、器官重量及生理和生化等各项指标均未达到显著水平(P>0.05),因此合并一组。
2.1 体重和体温
白头鹎的体重随着季节性驯化和温度适应均出现显著性差异(F3,30=21.391,P<0.001)。白头鹎的体重冬季较高,夏季较低;而经过4周温度适应后,白头鹎暖适应组(30℃)的体重出现明显降低(表1)。而白头鹎的体温无论是季节性驯化还是温度适应组均未表现出明显变化(表1)。
2.2 代谢率(RMR)、热传导和蒸发失水(EWL)
当体重校正至28.6g,白头鹎的RMR(mL O2/h)明显受季节性驯化和温度适应的影响(F3,29=21.891,P<0.001)。冬季驯化和冷适应的鸟类具有较高的RMR,分别比夏季和暖适应的RMR高出62.1%和31.0%(表1)。同时白头鹎的代谢率受体重影响较大,较大的体重有相对较高的RMR(图1)。
回顾性分析2016年11月至2017年10月于我院治疗的122例NSTEMI患者的临床资料,依据患者入院时心电图检查结果,将伴有fQRS改变者归入fQRS组(61例),未伴有fQRS改变者归入非fQRS组(61例)。fQRS组:男36例、女25例;年龄42~77(61.05±4.53)岁;并发糖尿病者15例、合并血脂异常18例、合并高血压21例。非fQRS组:男34例、女27例;年龄41~77(61.10±4.51)岁;并发糖尿病者14例、合并血脂异常20例、合并高血压22例。两组基本资料相比,差异无统计学意义(P>0.05),具有可比性。
白头鹎的热传导(mL O2g-1h-1℃-1)受季节驯化和温度适应的影响显著(F3,29=19.066,P<0.001)。冬季驯化和冷适应白头鹎的热传导比夏季驯化和暖适应白头鹎的热传导分别高出63.6%和34.6%(表1)。
季节驯化和温度适应同时影响白头鹎的EWL(F3,29=8.381,P<0.001),冬季驯化和冷适应白头鹎的EWL分别比夏季驯化和暖适应白头鹎的EWL高出66.7%和47.6%(表1)。同时体重影响白头鹎的蒸发失水,较重的个体具有较大的蒸发失水量(r2=0.189,P<0.05)(图2)。
此外,白头鹎的RMR与EWL呈正相关,具有较高RMR的白头鹎趋向于具有较高的EWL(r2=0.367,P<0.001)(图3)。

图1 白头鹎在季节驯化与温度适应中RMR与体重(BM)的相关性Fig.1 Correlation between resting metabolic rate (RMR) and body mass (BM) in Chinese bulbuls

图2 季节驯化与温度适应中白头鹎EWL与体重(BM)的相关性Fig.2 Correlation between evaporative water loss (EWL) and body mass (BM) in Chinese bulbuls

图3 季节驯化与温度适应中白头鹎EWL与代谢率(RMR)的相关性Fig.3 Correlation between evaporative water loss (EWL) and resting metabolic rate (RMR) in Chinese bulbuls
2.3 内部器官
协方差分析表明,各器官重量均受季节驯化和/或温度适应的影响(肝脏:F3,29=5.893,P<0.01;心脏:F3,29=9.701,P<0.001;肾脏:F3,29=3.523,P<0.05;小肠:F3,29=4.045,P<0.05)。然而不同的器官重量受季节驯化与温度适应的影响不同。肝脏与小肠重量受温度适应的影响显著(P<0.05),并且冷适应组鸟类肝脏重量比暖适应组高出39.9%,冷适应组鸟类小肠重量比暖适应组高出33.6%(表1)。心脏和肾脏重量受季节驯化的影响显著(P<0.05),并且冬季白头鹎心脏的重量比夏季高出33.5%,肾脏重量比夏季高出35.6%(表1)。相关分析表明白头鹎的心脏、肾脏和小肠的重量与RMR具有明显的正相关(图4)。
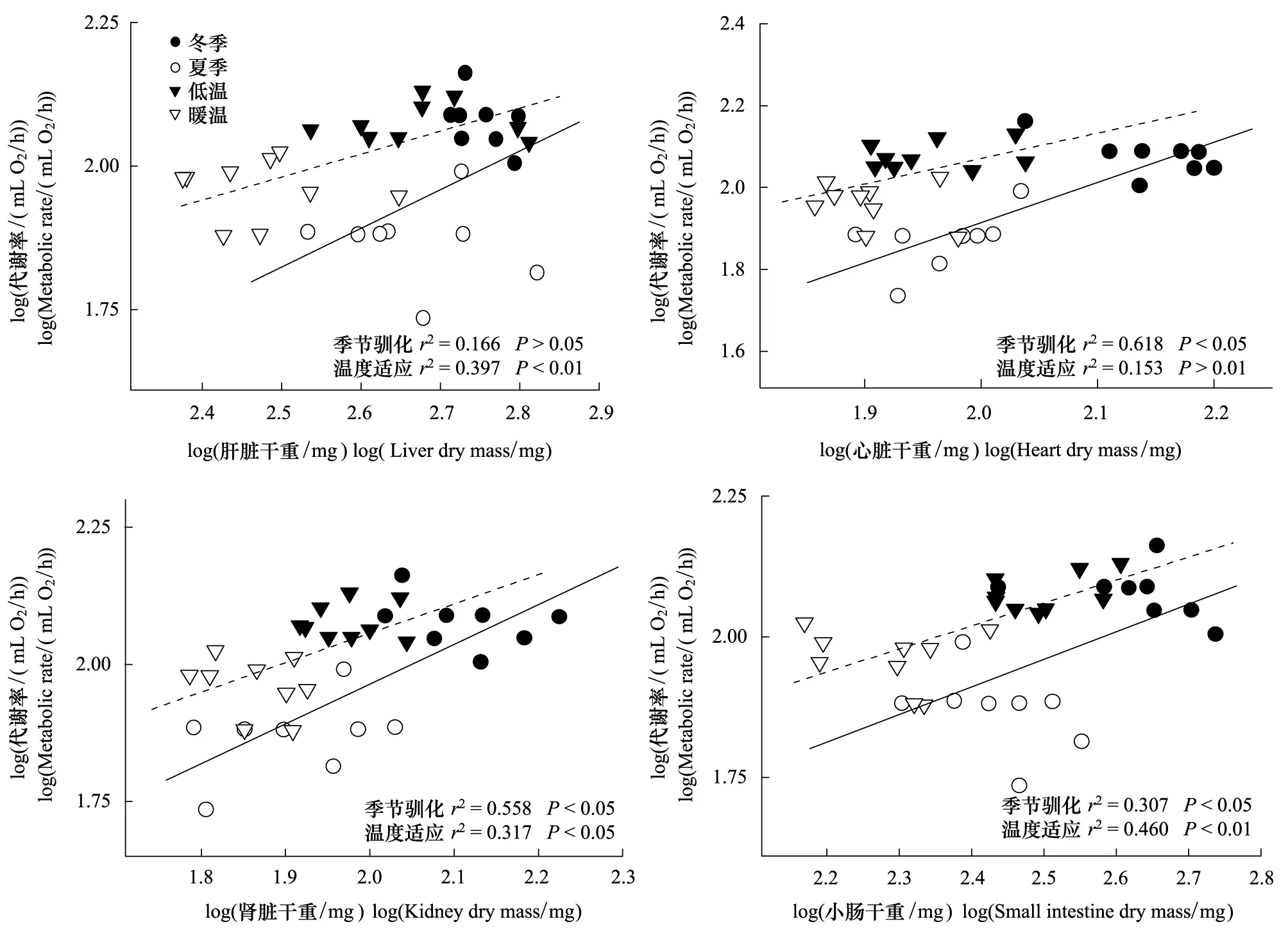
图4 季节驯化与温度适应中白头鹎RMR与器官干重的相关性Fig.4 Correlation between resting metabolic rate (RMR) and organs dry mass in Chinese bulbuls
2.4 肝脏和肌肉线粒体呼吸及细胞色素C氧化酶活力(COX)
方差分析表明肝脏和肌肉的线粒体呼吸及COX均受季节驯化和/或温度适应的影响(肝脏呼吸:F3,30=23.828,P<0.001;肌肉呼吸:F3,30=6.652,P<0.01;肝脏COX:F3,30=38.837,P<0.001;肌肉COX:F3,28=11.730,P<0.001)(表1)。季节性驯化对白头鹎肝脏的和肌肉的线粒体呼吸影响显著(P<0.05),冬季白头鹎肝脏和肌肉的线粒体呼吸分别比夏季高出105%和119%(表1)。白头鹎肝脏的COX受季节驯化影响显著(P<0.05),冬季白头鹎肝脏的COX与夏季相比增加了171%(表1)。白头鹎肌肉COX同时受季节驯化和温度适应的影响(P<0.05),冬季和冷适应白头鹎肌肉的COX与夏季和暖适应相比分别增加了183%和152%(表1)。相关分析表明白头鹎的肌肉线粒体呼吸、肝脏和肌肉的COX与RMR具有明显的正相关(图5)。
表1 白头鹎野外驯化(冬季和夏季)和实验室适应(低温和高温)的形态和生理参数
Table 1 Morphological and physiological parameters ofPycnonotussinensisfrom field (winter and summer) and laboratory experiments (acclimated at either 10 or 30℃)

参数Parameter野外Field冬季Winter夏季Summer实验室Laboratory冬季Winter夏季Summer样本数Samplesize8899体重Bodymasses/g33.2±0.7c27.2±0.7ab28.4±0.8b25.8±0.5a体温BodyTemperature/℃41.9±0.241.6±0.242.0±0.242.0±0.2静止代谢率Restingmetabolicrate/(mLO2/h)121.07±6.34c74.69±4.30a119.79±3.82c91.43±4.80b热传导Thermalconductance/(mLO2g-1h-1℃-1)0.36±0.02c0.22±0.02a0.35±0.01c0.26±0.02b蒸发失水Evaporativewaterloss/(gH2O/h)0.35±0.03b0.21±0.02a0.31±0.02b0.21±0.02a器官重量Organmass肝脏Liver/mg492.5±42.4b495.2±28.7b483.8±25.6b345.9±32.1a心脏Heart/mg129.1±5.9b96.7±4.0a91.7±3.6a87.8±4.5a肾脏Kidney/mg117.7±7.7b86.8±5.2a95.1±4.6a81.5±5.8a小肠Smallintestine/mg359.3±26.5b298.3±17.9b321.8±16.0b240.8±20.0a状态4呼吸State4respiration/(nmolO2min-1gtissue-1)肝脏Liver1852.09±203.56c904.24±125.67b734.04±50.23ab544.11±42.76a肌肉Muscle685.13±159.95b312.76±40.04a257.36±27.41a232.23±34.14a细胞色素C氧化酶活力Cytochromecoxidaseactivity/(nmolO2min-1gtissue-1)肝脏Liver2219.14±191.29b818.04±124.16a940.94±78.57a725.71±37.90a肌肉Muscle158.79±14.44b56.04±5.87a281.91±30.37c185.95±42.16b
表中数据为平均值±标准误;表中代谢率、蒸发失水、热传导及器官重量的调整平均值系在实测值的基础上通过协方差分析将体重校正至28.6g而得到; 在同一行中,不同上标字母表示差异显著
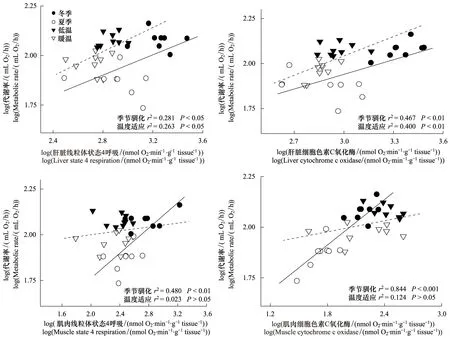
图5 季节驯化与温度适应中白头鹎RMR与线粒体状态4呼吸(SR)和细胞色素C氧化酶(COX)的相关性Fig.5 Correlation between state 4 respiration (SR) and cytochrome c oxidase (COX) with resting metabolic rate (RMR) in Chinese bulbuls
3 讨论
鸟类的能量代谢水平反映了动物对环境的适应模式,它与诸多环境因素有关[9- 10],其中温度对动物的体重、产热等有显著的影响[27- 29]。本研究表明,白头鹎对季节性驯化和温度适应表现出明显不同的生理反应,其冬季和冷适应的RMR、生理和生化等指标较夏季和暖适应明显增加,且季节驯化相关指标的变化程度高于温度适应。
3.1 体温(Tb)和体重的变化
关于鸟类能量学的研究中有大量关于鸟类体温的报道[38- 40]。本文所研究的白头鹎体温在季节性驯化和温度适应前后表现相同且基本保持稳定,表明白头鹎具有较强的体温调节能力。Schmidt-Nielsen[41]研究表明内温动物要保持高而恒定的体温,主要机制之一是改变产热和散热的比率。本文中白头鹎在冬季与冷环境下主要是通过增加代谢产热的能力抵御严寒[18,22,27];在夏季和暖温条件下主要是通过降低代谢产热水平增加体温与环境温度的差值,利于向外界散热,适应南方夏季炎热的环境[42]。
鸟类的体重受许多环境因素的影响,反映动物能量贮备和营养状态的综合指标[10]。本研究表明白头鹎的体重表现出明显的季节性变化,冬季体重比夏季高出22.06%。另外,随着驯化时间的延长,温度适应组体重的变化与季节驯化组的变化呈现相同趋势:冷适应组白头鹎体重不变,而暖适应组体重逐渐降低,并在4周后出现显著差异(冷适应组比暖适应组高出10.1%)。本文中白头鹎的体重在冬季和冷适应时增加,一方面可以解释为白头鹎在面对寒冷时,会通过增加隔热层提高对寒冷的耐受性,即在冬季通过增加羽毛的厚度和提高皮下脂肪的含量[41,43- 44];另一方面可以解释为动物能量储备和/或产热调节的改变[45]。
3.2 代谢率(RMR)、热传导(C)和蒸发失水(EWL)的变化
小型鸟类由于身体大小的限制,它们的毛皮隔热不能无限地增加,因此抵抗冬季寒冷的主要方式可能是增加产热[46- 47]。如小鹀(Emberizapusilla)和栗鹀(E.rutila)的RMR在环境温度低于25℃时随着温度的降低而升高[48]。这与本研究中白头鹎冬季驯化和冷适应的RMR明显高于夏季和暖适应一致。而冬季驯化和冷适应的RMR变化相同,主要是寒冷环境使得鸟类高能量消耗维持体温和面对高压力生存条件及炎热条件下鸟类受热胁迫和水资源限制所致[11,30,49]。因为动物代谢水平的高低能直接反映其对外界环境的耐受性,具有高代谢产热能力的种群对寒冷环境的适应力强,而对热环境适应能力较强的物种具有较低的代谢产热能力,所以本实验结果暗示了白头鹎冬季驯化和冷适应的RMR增加是其重要的适应性对策之一[46]。另外,本实验结果显示RMR受体重影响且两者呈正相关关系,验证了Zar[50]提出的异速增长理论[10]。
鸟类的热传导是体现能量消耗受环境温度程度的重要指标[35]。本研究结果显示白头鹎的热传导受季节驯化和温度适应的影响显著,冬季驯化和冷适应白头鹎的热传导比夏季驯化和暖适应白头鹎的热传导分别高出63.6%和34.6%,表明白头鹎在冬季驯化和冷适应时比夏季驯化和暖适应具有更高的体表非辐射热损失速率[51]。相似的结果也出现在小型哺乳动物中[52]。根据Weathers[53]指出的热传导会表现出与BMR呈正相关的结论,即BMR低的鸟类也有低的热传导,反之亦然。本研究中热传导的变化也表现出与BMR变化相一致的水平。
鸟类的EWL是水代谢中失水的主要途径,是粪便丢失水分量的5倍[54],因此被广泛用于测定不同环境条件鸟类种内和种间失水量的指标[2]。同时EWL也是研究鸟类代谢产热的一个重要指标[49,55]。本研究中季节驯化和温度适应均会影响白头鹎的EWL,其中冬季驯化和冷适应白头鹎的EWL分别比夏季驯化和暖适应白头鹎的EWL高出66.7%和47.6%,这一结果与林琳等人[29]的研究相似。目前,关于MR和EWL间的关系尚不明确,但猜测造成本研究结果的原因可能是因为较高的代谢率会使白头鹎通气量增加,引起呼吸失水(RWL)的增加,进而增加EWL[11]。此外,本实验结果也表明体重影响白头鹎的蒸发失水,较重的个体具有较大的蒸发失水量,而这一结论吻合了动物体重与EWL存在异速增长关系的理论[12,56]。
3.3 内部器官的变化
根据Daan等人[14]的“能量需求”假设认为,鸟类短期BMR的调整可以通过改变内部器官的大小来适应能量需求。据此,Starck和Rahmaan[3]提出基础代谢反映了那些产生高代谢率的组织或器官的维持消耗,理论上这些器官可能包括肝、心和肾等。而在实际中一些研究也表明用于基础代谢的大部分能量被内脏器官(特别是心脏、肝脏、肾脏和肠)消耗掉了[11,17- 18,57],这些器官具有很高的代谢活性,因此内脏器官应当是BMR的主要决定因素之一。本研究结果表明肝脏、心脏、肾脏和小肠各器官重量均受季节驯化和/或温度适应的影响,在冬季驯化和冷适应下,白头鹎代谢活性器官的重量较高,这一结果与张国凯等[23]、Zheng等[27]和林琳等[29]的报道相一致。另外,实验显示白头鹎的心脏、肾脏和小肠的重量与RMR具有明显的正相关,这一结果佐证了动物代谢率与心脏、肾脏等代谢活性器官有关的观点[58- 59]。从以上实验结果可以认为白头鹎体内存在代谢活性器官,这些器官组织具有高代谢活性的特点,因此其质量的增加很可能是引起RMR显著增加的原因之一。
3.4 细胞水平上产热能力的变化
细胞内线粒体呼吸是动物化学产热调节体温的热能的重要来源,而COX是线粒体内重要的呼吸酶之一,其酶活力的变化可以反映出组织内代谢产热的差异,且研究表明冷环境下某些物种肝的状态4呼吸或COX活力会升高[16,18,26- 27]。本文实验数据显示,肝脏线粒体呼吸及COX均受季节驯化和/或温度适应的影响,季节性驯化对白头鹎肝脏的线粒体呼吸影响显著:冬季白头鹎肝脏的线粒体呼吸与COX分别比夏季高出105%和171%,暖适应白头鹎肝脏的线粒体呼吸与COX分别比夏季高出35%和30%。这些数据表明白头鹎冬季肝脏的代谢产热明显高于夏季肝脏的代谢产热。相似的结果发现于树麻雀(Passermontanus)[16,60]、毛啄木鸟(Picoidespubescens)[43]等鸟类和树鼩(Tupaiabelangeri)和长爪沙鼠(Merionesunguiculatus)[61]等小型哺乳动物中。
已有研究表明骨骼肌产热能力增加的机制之一是由线粒体呼吸及酶活力的提高所决定的[16,18,62- 63]。本研究结果显示肌肉的线粒体呼吸及COX均受季节驯化和温度适应的影响:冬季和冷适应白头鹎肌肉的COX与夏季和暖适应相比分别增加了183%和152%;经季节性驯化的白头鹎其肌肉的线粒体呼吸比夏季高出119%,表明白头鹎冬季和冷适应的肌肉的代谢产热明显高于夏季和暖适应肌肉的代谢产热。这一结果与鸟类树麻雀(Passermontanus)[16]、家鸽(Columbalivia)[62]及哺乳类动物布氏田鼠(Microtusbrandti)[64]、人(Homosapiens)[62]等的肌肉产热特点相似。
3.5 白头鹎对季节驯化和温度适应的生理反应的不同点
本研究中在季节驯化和温度适应条件下,其冬季和冷适应组的白头鹎因居于寒冷环境其能量消耗水平、生理、生化等指标都产生适应性的增加。同时,用协方差分析法对季节驯化和温度适应下的回归直线对比分析发现季节驯化冬、夏季组白头鹎各指标的变化程度明显高于温度适应组:季节驯化组白头鹎的RMR,心脏、小肠和肾脏干重,肝脏和肌肉的线粒体呼吸以及肝脏COX活力的回归曲线的总体截距与温度适应组相比差异较显著(P<0.01),且季节驯化组高于温度适应组;季节驯化环境下白头鹎的肌肉线粒体呼吸速率与COX活力回归曲线的总体斜率明显高于温度适应组(P<0.05)。这些数据表明白头鹎对季节驯化和温度适应具有不同的表型可塑性,且在野外季节驯化条件下可塑性能力更强。此次试验我们将实验室温度控制在暖室30℃、冷室10℃的条件下,但野外条件下温州地区常有最高极端温度超过37℃、最低温度到达3℃的情况,白头鹎对季节驯化和温度适应表型可塑性能力的不同,可能是由于实验室温度对野外温度相对而言波动较小,这与Maldonado等人[33]在拉普拉塔研究红领带鹀(Zonotrichiacapensis)所得的结论一致。
总之,冬季和冷适应的白头鹎均有较高的RMR、EWL和较重的代谢活性器官,肝脏和肌肉具有相对较高的线粒体呼吸速率和COX活性,同时季节驯化的表型可塑性的能力强于实验室温度适应的表型可塑性能力。白头鹎在季节性驯化和温度适应过程中通过改变体重、器官重量、线粒体呼吸及COX等形态和生理生化指标来应对外界多变的环境,生理能量特性的可塑性是鸟类能量代谢的共同特征。
[1] Swanson D L. Seasonal metabolic variation in birds: functional and mechanistic correlates //Thompson C F. Current Ornithology Volume 17. New York: Springer, 2010: 75- 129.
[2] Williams J B, Muoz-Garcia A, Champagne A. Climate change and cutaneous water loss of birds. Journal of Experimental Biology, 2012, 215(7): 1053- 1060.
[3] Starck J M, Rahmaan G H A. Phenotypic flexibility of structure and function of the digestive system of Japanese quail. Journal of Experimental Biology, 2003, 206(11): 1887- 1897.
[4] McKechnie A E, Freckleton R P, Jetz W. Phenotypic plasticity in the scaling of avian basal metabolic rate. Proceedings of the Royal Society B, 2006, 273(1589): 931- 937.
[5] Clement M E, Muoz-Garcia A, Williams J B. Cutaneous water loss and covalently bound lipids of the stratum corneum in nestling house sparrows (PasserdomesticusL.) from desert and mesic habitats. Journal of Experimental Biology, 2012, 215(7): 1170- 1177.
[6] Piersma T, Drent J. Phenotypic flexibility and the evolution of organismal design. Trends in Ecology and Evolution, 2003, 18(5): 228- 233.
[7] McKechnie A E. Phenotypic flexibility in basal metabolic rate and the changing view of avian physiological diversity: a review. Journal of Comparative Physiology B, 2008, 178(3): 235- 247.
[8] Zheng W H, Li M, Liu J S, Shao S L, Xu X J. Seasonal variation of metabolic thermogenesis in Eurasian tree sparrows (Passermontanus) over a latitudinal gradient. Physiological and Biochemical Zoology, 2014, 87(5): 704- 718.
[9] Wiersma P, Muoz-Garcia A, Walker A., Williams J B. Tropical birds have a slow pace of life. Proceeding of National Academy of Science of the United State of America, 2007, 104 (22): 9340- 9345.
[10] McNab B K. Ecological factors affect the level and scaling of avian BMR. Comparative Biochemistry and Physiology Part A: Molecular and Integrative Physiology, 2009, 152(1): 22- 45.
[11] Jimenez A G, Cooper-Mullin C, Calhoon E A, Williams J B. Physiological underpinnings associated with differences in pace of life and metabolic rate in north temperate and neotropical birds. Journal of Comparative Physiology B, 2014, 184(5): 545- 561.
[12] Williams J B. A phylogenetic perspective of evaporative water loss in birds. The Auk, 1996, 113(2): 457- 472.
[13] Versteegh M A, Helm B, Dingemanse N J, Tieleman B I. Repeatability and individual correlates of basal metabolic rate and total evaporative water loss in birds: A case study in European stonechats. Comparative Biochemistry and Physiology Part A: Molecular and Integrative Physiology, 2008, 150(4):452- 457.
[14] Daan S, Masman D, Groenewold A. Avian basal metabolic rates: their association with body composition and energy expenditure in nature. The American Journal of Physiology, 1990, 259(2): R333-R340.
[15] Piersma T, Lindström Å. Rapid reversible changes in organ size as a component of adaptive behaviour. Trend in Ecology and Evolution, 1997, 12(4): 134- 138.
[16] Zheng W H, Li M, Liu J S, Shao S L. Seasonal acclimatization of metabolism in Eurasian tree sparrows (Passermontanus). Comparative Biochemistry and Physiology Part A: Molecular and Integrative Physiology, 2008, 151(4):519- 525.
[17] Zheng W H, Lin L, Liu J S, Xu X J, Li M. Geographic variation in basal thermogenesis in little buntings: Relationship to cellular thermogenesis and thyroid hormone concentrations. Comparative Biochemistry and Physiology Part A: Molecular and Integrative Physiology, 2013, 164(3): 483- 490.
[18] Zheng W H, Liu J S, Swanson D L. Seasonal phenotypic flexibility of body mass, organ masses, and tissue oxidative capacity and their relationship to Resting Metabolic Rate in Chinese bulbuls. Physiological and Biochemical Zoology, 2014, 87(3): 432- 444.
[19] Zheng G M, Zhang C Z. Birds in China. Beijing: China Forestry Publishing House, 2002: 167- 169.
[20] Zhang Y P, Liu J S, Hu X J, Yang Y, Chen L D. Metabolism and thermoregulation in two species of passerines from south-eastern China in summer. Acta Zoologica Sinica, 2006, 52(4): 641- 647.
[21] 周围, 王玉萍, 陈德汉, 柳劲松. 白头鹎体温、体重及能量代谢的昼夜节律. 生态学杂志, 2010, 29(12): 2395- 2400.
[22] Zheng W H, Liu J S, Jiang X H, Fang Y Y, Zhang G K. Seasonal variation on metabolism and thermoregulation in Chinese bulbul. Journal of Thermal Biology, 2008, 33(6): 315- 319.
[23] 张国凯, 方媛媛, 姜雪华, 柳劲松, 张永普. 白头鹎的代谢率与器官重量在季节驯化中的可塑性变化. 动物学杂志, 2008, 43(4): 13- 19.
[24] 彭丽洁, 唐小丽, 柳劲松, 孟海涛. 甲状腺激素对白头鹎基础产热的影响. 生态学报, 2010, 30(6): 1500- 1507.
[25] 倪小英, 林琳, 周菲菲, 王小华, 柳劲松. 光周期对白头鹎(Pycnonotussinensis)体重、器官重量和能量代谢的影响. 生态学报, 2011, 31(6): 1703- 1713.
[26] Jimenez A G, Williams J B. Cellular metabolic rates from primary dermal fibroblast cells isolated from birds of different body masses. Comparative Biochemistry and Physiology Part A: Molecular and Integrative Physiology, 2014, 176: 41- 48.
[27] Zheng W H, Lin L, Liu J S, Pan H, Cao M T, Hu Y L. Physiological and biochemical thermoregulatory responses of Chinese bulbulsPycnonotussinensisto warm temperature: Phenotypic flexibility in a small passerine. Journal of Thermal Biology, 2013, 38(5): 240- 246.
[28] Wu Y N, Lin L, Xiao Y C, Zhou L M, Wu M S, Zhang H Y, Liu J S. Effects of temperature acclimation on body mass and energy budget in the Chinese bulbulPycnonotussinensis. Zoological Research, 2014, 35(1): 33- 41.
[29] 林琳, 曹梦婷, 胡益林, 黄丽丽, 李洲, 柳劲松. 环境温度对白头鹎代谢产热和蒸发失水的影响. 生态学报, 2014, 34(3): 564- 571.
[30] Liknes E T, Swanson D L. Phenotypic flexibility in passerine birds: Seasonal variation of aerobic enzyme activities in skeletal muscle. Journal of Thermal Biology, 2011, 36(7): 430- 436.
[31] McKechnie A E, Chetty K, Lovegrove B G. Phenotypic flexibility in the basal metabolic rate of laughing doves: responses to short-term thermal acclimation. Journal of Experimental Biology, 2007, 210(1): 97- 106.
[32] Tieleman B I. Differences in the physiological responses to temperature among stonechats from three populations reared in a common environment. Comparative Biochemistry and Physiology Part A: Molecular and Integrative Physiology, 2007, 146(2): 194- 199.
[33] Maldonado K E, Cavieres G, Veloso C, Canals M, Sabat P. Physiological responses in rufous-collared sparrows to thermal acclimation and seasonal acclimatization. Journal of Comparative Physiology B, 2009, 179(3): 335- 343.
[34] Xia S S, Yu A W, Zhao L D, Zhang H Y, Zheng W H, Liu J S. Metabolic thermogenesis and evaporative water loss in the HwameiGarrulaxcanorus. Journal of Thermal Biology, 2013, 38(8): 576- 581.
[35] Aschoff J. Thermal conductance in mammals and birds: Its dependence on body size and circadian phase. Comparative Biochemistry and Physiology Part A: Molecular and Integrative Physiology, 1981, 69(4): 611- 619.
[36] Sundin U, Moore G, Nedergaard J, Cannon B. Thermogenin amount and activity in hamster brown fat mitochondria: Effect of cold acclimation. The American Journal of Physiology, 1987, 252(5): R822-R832.
[37] Estabrook R W. Mitochondrial respiratory control and the polarographic measurement of ADP: O ratios. Methods in Enzymology, 1967, 10: 41- 47.
[38] Prinzinger R, Preßmar A, Schleucher E. Body temperature in birds. Comparative Biochemistry and Physiology Part A: Molecular and Integrative Physiology, 1991, 99(4): 499- 506.
[39] McKechnie A E, Lovegrove B G. Avian facultative hypothermic responses: a review. The Condor, 2002, 104(4): 705- 724.
[40] Clarke A, Rothery P. Scaling of body temperature in mammals and birds. Functional Ecology, 2008, 22(1): 58- 67.
[41] Schmidt-Nielsen K. Animal Physiology: Adaptation and Environment. Cambridge: Cambridge University Press, 1997: 169- 214.
[42] Burton C T, Weathers W W. Energetics and thermoregulation of the gouldian finch (Erythruragouldiae). Emu, 2003, 103(1): 1- 10.
[43] Landys-Ciannelli M M, Piersma T, Jukema J. Strategic size changes of internal organs and muscle tissue in the bar-tailed godwit during fat storage on a spring stopover site. Functional Ecology, 2003, 17(2): 151- 159.
[44] Cooper S J. Daily and seasonal variation in body mass and visible fat in mountain chickadees and juniper titmice. The Wilson Journal of Ornithology, 2007, 119(4): 720- 724.
[45] Wu M S, Xiao Y C, Yang F, Zhou L M, Zheng W H, Liu J S. Seasonal variation in body mass and energy budget in Chinese Bulbuls (Pycnonotussinensis). Avian Research, 2014, 5: 4.
[46] Swanson D L. Cold hardiness and summit metabolism in North American kinglets during fall migration. Acta Zoologica Sinica, 2007, 53(4): 600- 606.
[47] Swanson D L, Liknes E T. A comparative analysis of thermogenic capacity and cold tolerance in small birds. The Journal of Experimental Biology, 2006, 209(3): 466- 474.
[48] 柳劲松, 张智研, 马红, 侯增山. 小鵐和栗鵐静止代谢率的特征. 动物学报, 2001, 47(3): 374- 350.
[49] Tieleman B I, Williams J B, Buschur M E. Physiological adjustments to arid and mesic environments in larks (Alaudidae). Physiological and Biochemical Zoology, 2002, 75(3): 305- 313.
[50] Zar J H. The use of the allometric model for avian standard metabolism-body weight relationships. Comparative Biochemistry and Physiology, 1969, 29(1): 227- 234.
[51] Schleucher E, Withers P C. Re-evaluation of the allometry of wet thermal conductance for birds. Comparative Biochemistry and Physiology Part A: Molecular and Integrative Physiology, 2001, 129(4): 821- 827.
[52] Zhao Z J, Cao J, Meng X L, Li Y B. Seasonal variations in metabolism and thermoregulation in the striped hamster (Cricetulusbarabensis). Journal of Thermal Biology, 2009, 35(1): 52- 57.
[53] Weathers W W. Energetics and thermoregulation by small passerines of the humid, lowland tropics. Auk, 1997, 114(3): 341- 353.
[56] Williams J B. Heat production and evaporative water loss of Dune Larks from the Namib desert. The Condor, 1999, 101(2): 432- 438.
[57] Piersma T, Bruinzeel L, Drent R, Kersten M, van der Meer J, Wiersma P. Variability in basal metabolic rate of a long-distance migrant shorebird (Red Knot,Calidriscanutus) reflects shifts in organ sizes. Physiological Zoology, 1996, 69(1): 191- 217.
[58] Klaassen M, Oltrogge M, Trost L. Basal metabolic rate, food intake, and body mass in cold- and warm-acclimated Garden Warblers. Comparative Biochemistry and Physiology Part A: Molecular and Integrative Physiology, 2004, 137(4): 639- 647.
[59] Liu J S, Li M. Phenotypic flexibility of metabolic rate and organ masses among tree sparrowsPassermontanusin seasonal acclimatization. Acta Zoologica Sinica, 2006, 52(3): 469- 477.
[60] 柳劲松, 李铭, 邵淑丽. 树麻雀肝脏和肌肉产热特征的季节性变化. 动物学报, 2008, 54(5): 777- 78.
[61] Li Q F, Sun R Y, Huang C X, Wang Z K, Liu X T, Hou J J, Liu J S, Cai L Q, Li N, Zhang S Z, Wang Y. Cold adaptive thermogenesis in small mammals from different geographical zones of China. Comparative Biochemistry and Physiology Part A: Molecular and Integrative Physiology, 2001, 129(4): 949- 961.
[62] Jimenez A G, Cooper-Mullin C, Anthony N B, Williams J B. Cellular metabolic rates in cultured primary dermal fibroblasts and myoblast cells from fast-growing and controlCoturnixquail. Comparative Biochemistry and Physiology Part A: Molecular and Integrative Physiology, 2014, 171: 23- 30.
[63] Swanson D L, Sabirzhanov B, VandeZande A, Clark T G. Seasonal variation of myostatin gene expression in pectoralis muscle of house sparrows (Passerdomesticus) is consistent with a role in regulating thermogenic capacity and cold tolerance. Physiological and Biochemical Zoology, 2009, 82(2): 121- 128.
[64] Liu J S, Yang M, Sun R Y, Wang D H. Adaptive thermogenesis in Brandt′s vole (Lasiopodomysbrandti) during cold and warm acclimation. Journal of Thermal Biology, 2009, 34(2): 60- 69.
Physiological responses in Chinese bulbuls to seasonal acclimatization and temperature acclimation
XIA Susu1, YANG Fang1, WANG Runmei1, ZHENG Weihong1,2, ZHAO Zhijun1,2, LIU Jinsong1,2,*
1SchoolofLifeandEnvironmentalSciences,WenzhouUniversity,Wenzhou325035,China2InstituteofAppliedEcology,WenzhouUniversity,Wenzhou325035,China
Measuring an organism′s response to a changing environment can yield an insight into the adaptive value of phenotypic adjustments. However, it is not clear how an organism translates seasonal acclimatization to temperature acclimation. In the present study, we measured resting metabolic rate (RMR), evaporative water loss (EWL) and internal organ masses in seasonal acclimatized adult Chinese bulbuls (Pycnonotussinensis) that were captured in winter and summer, and bulbuls that were acclimated to 10℃ (cold) and 30℃ (warm) in laboratory for four weeks. We also measured state 4 respiration and cytochrome c oxidase (COX) activity in liver and muscle of these birds. RMR was measured using an open-circuit respirometry system. State 4 respiration and COX activity in liver and muscle mitochondria were determined at 30℃ using a Clark electrode. Winter- and cold-acclimated birds showed significantly higher RMR, EWL and internal organ masses, as well as state 4 respiration and COX activity than their summer- and warm-acclimated counterparts. The adaptive adjustment of organ masses and cellular thermogenesis might partly contribute to the variability of RMR. The findings suggest that Chinese bulbuls exhibit adaptive adjustments in some physiological and biochemical traits in response to changes in seasonal environment and the changes in temperature only, which can be employed to cope with fluctuations in environmental conditions. These data test the hypothesis that physiological flexibility in energetic traits is a common feature of avian metabolism.
Chinese bulbuls (Pycnonotussinensis); temperature acclimation; seasonal acclimatization; physiological response
国家自然科学基金资助项目(31070366, 31470472);浙江省自然科学基金(LY13C030005);浙江省新苗人才计划项目部分资助(2014R424032)
2013- 07- 05;
日期:2014- 11- 15
10.5846/stxb201407051383
*通讯作者Corresponding author.E-mail: ljs@wzu.edu.cn
夏素素,杨芳,王润梅,郑蔚虹,赵志军,柳劲松.白头鹎对季节性驯化和温度适应的生理反应.生态学报,2015,35(7):2349- 2359.
Xia S S, Yang F, Wang R M, Zheng W H, Zhao Z J, Liu J S.Physiological responses in Chinese bulbuls to seasonal acclimatization and temperature acclimation.Acta Ecologica Sinica,2015,35(7):2349- 2359.

