白腐真菌对石油污染土壤的修复研究*
谭丽泉,余 梅,周 天,彭镇宇
(广东石油化工学院化学工程学院,广东茂名525000)
随着石油企业的飞速发展,石油类污染物对土壤的污染逐渐成为各个国家环境污染的一个重大的问题,大量石油污染物进入土壤,不但破坏土壤的质地和养分构成,而且还使其丧失可耕性与生物活性[1],加上土壤的自净能力有限,一旦受到破坏要让其自然恢复就变得极为艰难。因此,采取有效措施,治理土壤石油污染显得尤为迫切。
生物修复技术是土壤污染治理技术发展过程中的一个里程碑[2-6]。作为生物修复技术中的一员,用于污染物降解的白腐真菌,不仅具有广谱、高效、低耗、适用性强等特点,而且对营养要求低、耐受性高,还能对其它微生物产生较强的拮抗作用,有着其它生物系统,特别是细菌系统所不具备的优点,受到世界各国科学界及工业界的高度重视[7]。前人利用其对染料废水及多环芳烃等进行了处理,取得较好的效果[8-10]。本研究以白腐真菌作为降解菌,通过室内模拟实验利用响应面优化设计对白腐真菌降解石油的条件进行研究,以期找出白腐真菌降解土壤中石油的有利条件,为土壤石油污染微生物修复技术的应用提供依据。
1 实验材料
1.1 主要试剂及仪器
实验所用石油取自茂名石化公司炼油厂,为黑色黏稠液体,160℃下恒温蒸馏4h 后置于棕色试剂瓶中备用;NaH2PO4、硫胺素、石油醚(60~90℃)、正己烷、丙酮、藜芦醇、Tween-80、苯甲醇和MgSO4·7H2O等试剂均为分析纯,天津大茂化学试剂厂。
YXQ-LS-30S11 型立式压力蒸汽灭菌器、THZ-92B 型气浴恒温振荡器:上海博迅实业有限公司医疗设备厂;LRH-150B 型培养箱(广东省医疗器械厂);800 型离心机(上海精密科学仪器有限公司);TU-1810 紫外可见分光光度计(北京普析通用仪器有限责任公司);RE-52CS 旋转蒸发仪(上海亚荣生化仪器厂)。
1.2 菌种
实验所用白腐真菌(黄孢原毛平革菌(5.776))购自广州微生物菌种保藏中心。
1.3 培养基及菌悬液
PDA 固体养基:马铃200g·L-1,葡萄糖20g·L-1,KH2PO43g·L-1,MgSO4·7H2O1.5g·L-1,硫胺素8mg·L-1,琼脂20g·L-1,麦麸15g·L-1,pH 值为6,蒸馏水1L。
供降解用的菌悬液配制:将经扩大培养并产生孢子的菌种从4℃冷冻保存的冰箱中转入28℃培养箱中解冻复苏后,于超净工作台上用无菌水倒入平板中轻轻摇荡,使充分分散后转入灭菌的三角烧瓶中,制成乳白色的孢子悬浮液,4℃保存[11]。
1.4 污染土壤的制备
实验土壤取自广东石油化工学院校无石油污染的土壤,用锄头挖取土层10cm 以下的土壤,风干后用40 目筛子过筛,把大块的石头和其它杂质去除后放于阴凉处备用[12]。根据一定土壤含油率往已称重烧杯中加入适量土壤及石油,加入石油醚使其充分混合均匀后将石油醚挥发至恒重,算出土壤实际含油率。
2 实验方法与分析方法
2.1 实验方法[13]
2.1.1 单因素实验 以土壤含水率、摇床转速、土壤含油率、Tween80 及藜芦醇为影响因子进行单因素研究,将降解体系在5 个锥形瓶中称取含油率为8.0%的土壤6g,灭菌后加入2mL 菌悬液,加入适量的无菌水,在28℃、120r·min-1条件下恒温培养9d,考察各因素对土壤中石油降解的影响,每组做两个平行实验。
2.1.2 响应面法优化降解条件 根据单因素实验结果,采用3 因素3 水平响应面Box-Behnken 设计,优化土壤中石油降解条件,实验因素及水平编码如表1。
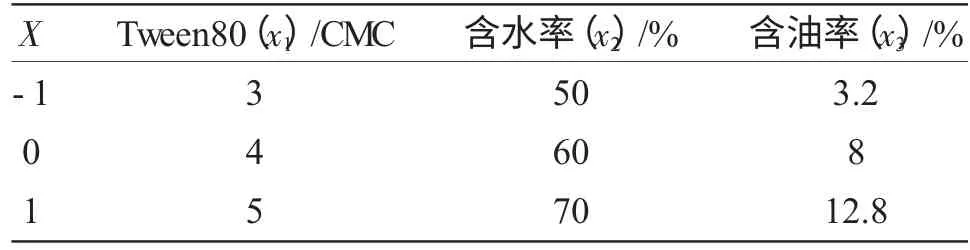
表1 因素及水平编码表Tab.1 Test factors coding table
2.1.3 验证实验 根据软件Design expert 7.0 分析得出的最佳水平组合进行验证实验,平行三次实验得出平均值。
2.2 分析方法
2.2.1 白腐真菌生物量的测定采用细胞干重法[14]。
2.2.2 石油降解率的测定降解后的污泥体系高压灭菌后,用200mL(1∶1)的正己烷/丙酮混合液索氏抽提48h 后旋转蒸发至剩余5mL 液体,转移到已称重锥形瓶,将锥形瓶置于水浴锅中以50℃把溶剂蒸干至恒重,锥形瓶增加的重量即为土壤中石油的重量。每组做一个无菌体系的空白实验,以消除石油挥发所带来的误差。
2.2.3 石油降解率的计算
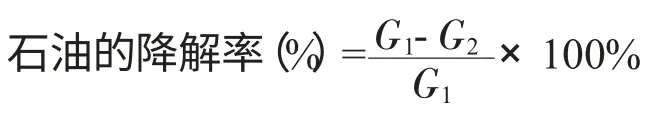
式中 G1:无菌体系石油含量;G2:有菌体系剩余石油含量。
3 结果与讨论
3.1 单因素实验结果
3.1.1 含水率对白腐真菌降解土壤中石油的影响5 个锥形瓶中称取含油率为8.0%的土壤6g,灭菌后加入2mL 菌悬液,加入适量的无菌水调节其含水率分别为40%、50%、60%、70%、80%,28℃、120r·min-1条件下恒温培养9d 后测其石油降解率。实验结果见图1。
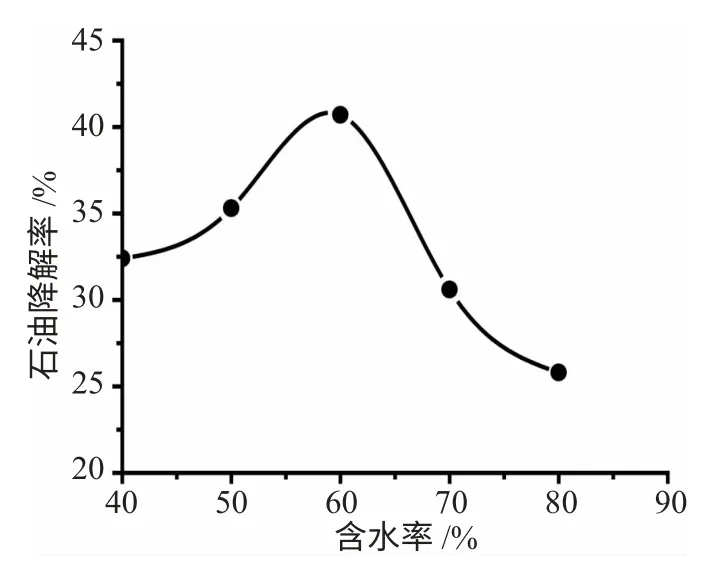
图1 含水率对土壤中石油降解的影响Fig.1 Effect of moisture content of petroleum in the soil degradation
由图1 可知,不同含水率对白腐真菌降解石油有很大的影响。石油降解率先随着土壤含水率的增加逐渐升高,含水率为40%时降解率只有32.4%;含水率为50%时降解率达到35.3%,而当含水率为60%时达到最大降解率40.7%,之后降解率随着土壤含水率的增加而下降。实验结果表明,土壤含水率在(40%~60%)的范围内对石油的降解效果较好。土壤含水量对土壤中石油的微生物降解有很大的影响[15,16],因为水会在土壤颗粒表面形成一层水膜,对石油与土壤颗粒间的联系、吸附产生了阻碍,并形成了油水界面;而土壤中的微生物大多存在于油水界面,因此土壤含水量增多会增加微生物与石油的接触,促进石油的降解;而土壤含水过低使微生物生长得不到充足的水分,细胞活性受到抑制,降解能力下降。但是土壤含水率过高又会造成土壤淹渍的现象,使土壤中的氧气含量减少,而白腐真菌用于降解有机物的木质素过氧化物酶和锰过氧化物酶必须首先与有氧条件下合成的H2O2反应才能实现有机物的降解,因此,对石油的降解产生影响。根据实验结果,选用土壤含水率为60%进行后续实验。
3.1.2 摇床转速对白腐真菌降解土壤中石油的影响 准确称取含油率为8.0%的土壤6g 至锥形瓶,灭菌后加入2mL 菌悬液,并加入适量的无菌水调节其含水率为60%,考察转速0、40、80、120、160、200r·min-1对石油降解的影响,实验结果见图2。
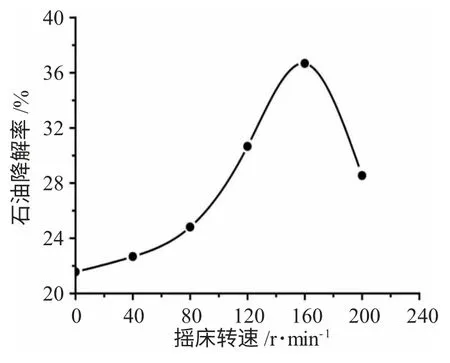
图2 摇床转速对白腐真菌降解土壤中石油的影响Fig.2 Effect of rotation speed of petroleum in the soil degradation
由图2 可知,白腐真菌降解石油的能力先是随着摇床转速的上升而逐渐升高,在转速为160r·min-1时达到最大石油降解率36.68%,之后转速增大降解率降低。这是由于振荡培养条件下加速了营养物和氧气在细胞间的传质效率;同时振荡速度越快,剪切力越强,形成的白腐真菌菌丝小球体积越小,增大了菌丝小球的表面积,和氧气充分接触,并获取更多的营养物,促进了菌的生长及产酶,有利于石油的降解。而过高的转速则会使菌体受到强的剪切力冲击而死亡[17]。
3.1.3 土壤含油率对白腐真菌降解土壤中石油的影响 准确称取含油率分别为1.6%、3.2%、8.0%、12.8%、20.0%的土壤6g 至5 个锥形瓶,灭菌后加入2 mL 菌悬液,调节体系含水率为60%,120r·min-1、28℃下恒温培养9d 后测其石油降解率,实验结果见图3。
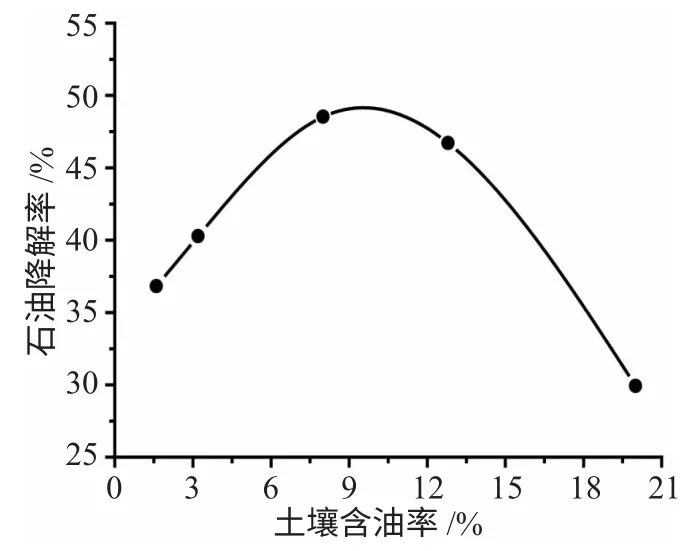
图3 土壤含油率对白腐真菌降解土壤中石油的影响Fig.3 Effect of the oil content of petroleum in the soil degradation
由图3 可知,石油降解率随土壤石油含量的增大而增高,当石油含量达到8.0%时降解率达到最大值48.53%,之后随着土壤石油含量的增多而下降,当土壤中的石油含量达到20.0%时降解率只有29.92%。石油浓度较低时可以作为碳源被白腐真菌利用,促进菌的生长,从而有利于石油的降解;而石油浓度过高会导致土壤中产生难分散的厚油层,使土壤中营养物和氧气缺乏,菌的活性及降解能力都受到影响[18]。
3.1.4 Tween80 对白腐真菌降解土壤中石油的影响
因为土壤对石油有吸附性,会影响微生物对土壤中石油的降解。石油的增溶洗脱是微生物修复石油污染土壤的前提,因此选用了非离子型表面活性剂Tween80 做研究。往降解体系中加入Tween80,使其在体系中的浓度分别为2CMC、3CMC、4CMC、5CMC、6CMC(Tween80 的临界胶束浓度CMC 值为14mg·L-1),加入2mL 菌悬液后置于摇床中恒温培养后测其石油降解率,实验结果见图4。
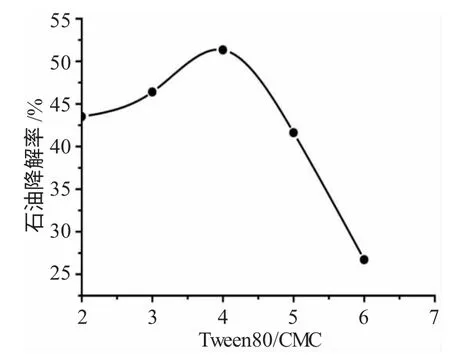
图4 Tween80 对白腐真菌降解土壤中石油的影响Fig.4 Effect of Tween80 of petroleum in the soil degradation
由图4 可知,Tween80 在较低浓度时(<4CMC)对石油降解的促进作用较明显,在4CMC 时降解率达到了最大值51.33%,之后的石油降解率开始下降,6CMC 时只有26.71%。Tween80 属于非离子型表面活性剂,不仅能增强土壤中石油的解吸作用,促进石油的降解,而且还充当了石油降解的共代谢底物,促进了白腐真菌的生长,从而提高了石油的降解率[19,20]。但是过高浓度(大于6CMC)的Tween80会对白腐真菌产生生物毒性,破坏其细胞膜的结构,甚至导致其死亡,从而影响石油的降解。
3.1.5 藜芦醇浓度对白腐真菌降解土壤中石油的影响 改变体系中藜芦醇浓度分别为0.10、0.15、0.20、0.25、0.30g·L-1,灭菌后加入2mL 菌悬液,调节体系含水率为60%,120r·min-1、28℃下恒温培养9d后测其石油降解率,实验结果见图5。
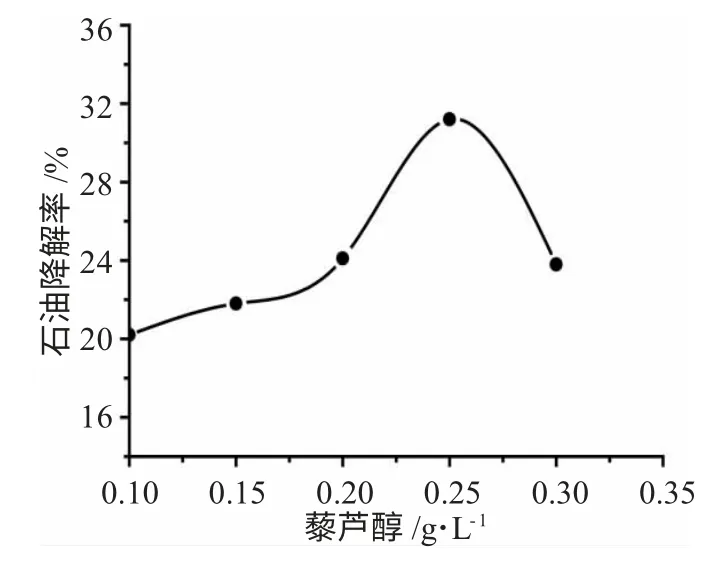
图5 藜芦醇浓度对白腐真菌降解土壤中石油的影响Fig.5 Effect of veratryl alcohol of petroleum in the soil degradation
由图5 可知,随藜芦醇浓度的升高,石油降解率逐渐增大,在浓度为0.25g·L-1时达到最大值31.2%,之后降解率下降。在白腐真菌对有机物降解的次级代谢过程中产生了藜芦醇(VA),而白腐真菌对石油的降解属于间接氧化过程,需要一些易被木质素过氧化物酶(LiP)直接氧化成自由基的化学物质的帮助,此时藜芦醇就充当了该氧化还原反应的电子调节者,诱导了酶的合成[21]。藜芦醇既可以成为LiP的降解底物,又可避免LiP 因培养过程中产生的过量H2O2而失活。因此,在白腐真菌的降解反应体系中加入适量的藜芦醇对石油的降解是有帮助的。
3.2 Box-Benhnken 实验结果分析
依照单因素实验的结果,以石油降解率(Y)为响应值,选取了实验中降解率较高的Tween80(x1)、含水率(x2)、含油率(x3)3 个因素作为研究对象,根据Box-Behnken 中心组合原理,设计3 因素3 水平响应面分析实验,每个因素分别取3 个水平,以(-1,0,1)编码进行3 因素3 水平的组合实验设计,实验设计见表1,实验结果见表2。
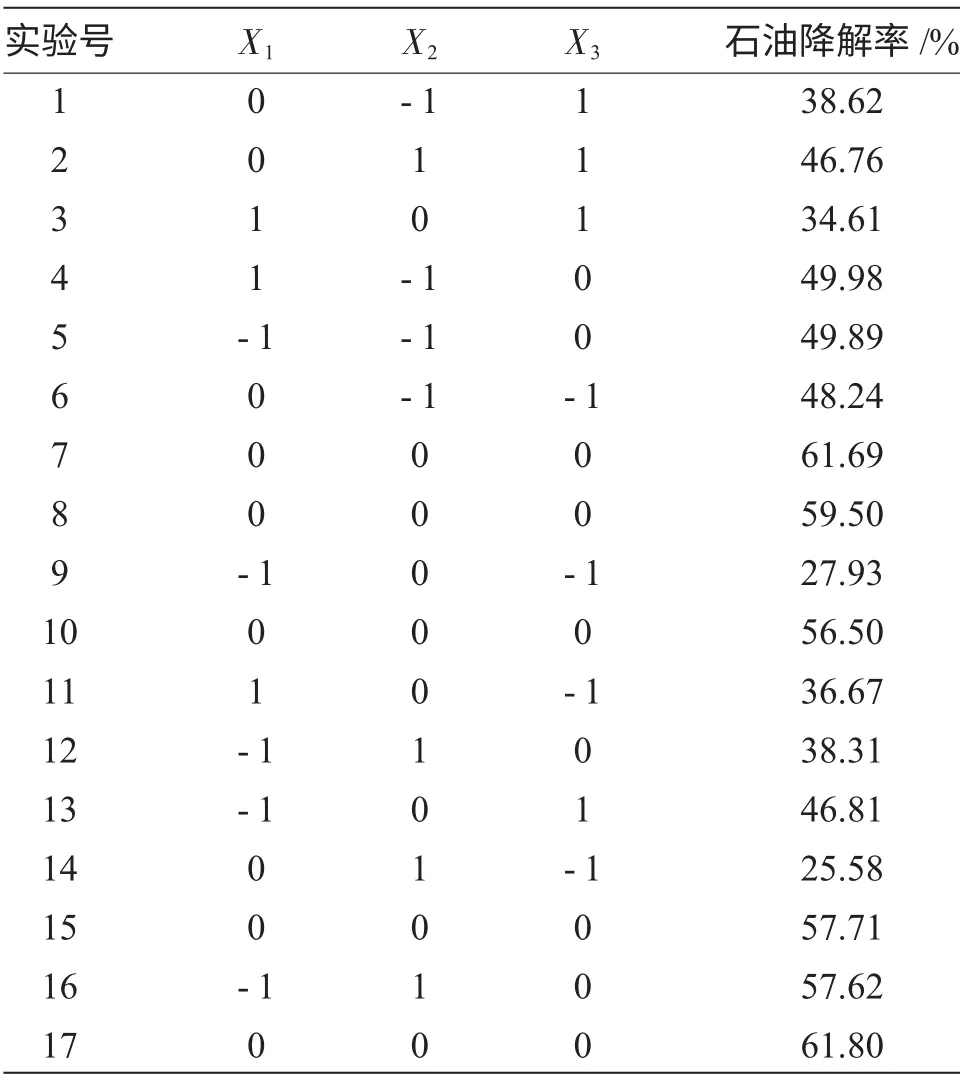
表2 响应面实验设计条件及结果Tab.2 Response surface experimental design and results
对表2 中响应值进行二元回归拟合,获得石油降解率对泥土体系的Tween80(x1)、含水率(x2)和含油率(x3)的多元二次回归方程:
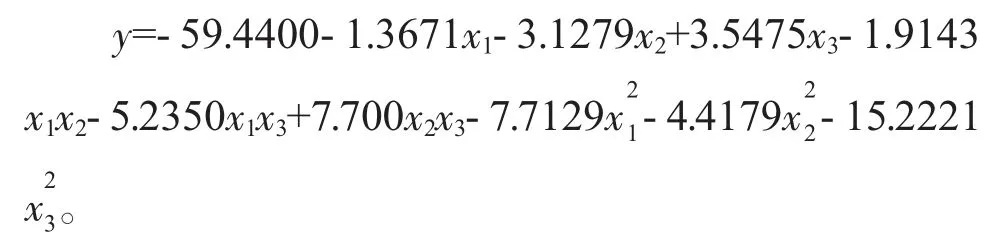
并且该模型的R2=0.89996,P=0.0000<0.05,说明模型与实际实验拟合度较好,自变量和响应值之间关系显著。
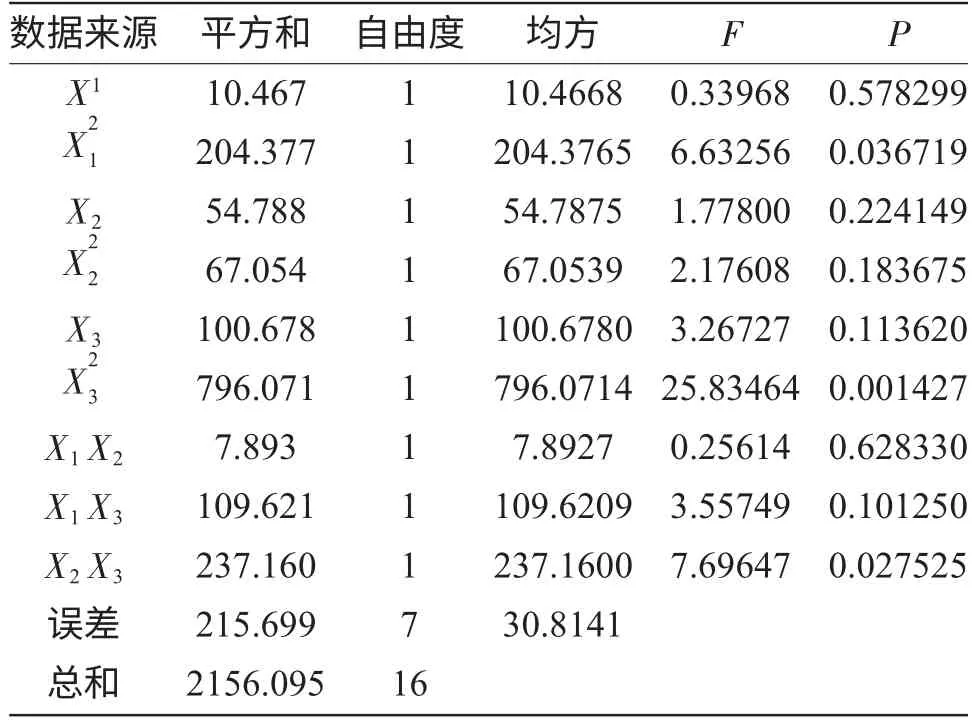
表3 响应面二次模型的方差分析Tab.3 Analysis of variance and regression for the quadratic model
由表3 的P 值和F 值可知,在选取的各因素的水平范围内,其对石油降解率的影响大小依次为:含油率>含水率>Tween80。其次,由表3 的P 值数据可知,在交互作用下,X2X3显著,而X1X2和X1X3交互作用不显著,即含水率和含油率的交互作用明显。根据回归方程做出响应面,考察拟合响应曲面的形状,分析含油率、含水率、ween80 对石油降解率的影响,结果见图6~8。
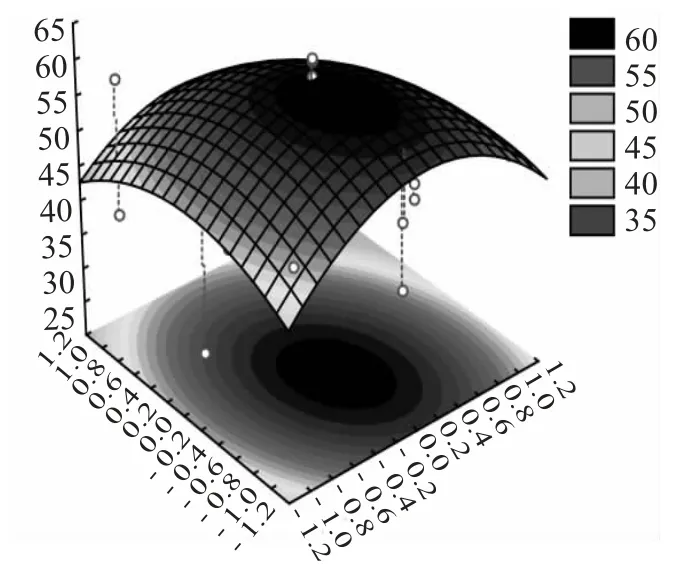
图6 含水率与Tween80 交互作用的响应面曲面图Fig.6 Response surface of interaction between moisture content and Tween80
由图6 知,随着含水率和Tween80 的增加石油降解率出现先升后降的变化趋势,但通过仔细观察可以发现,含水率的变化较Tween80 陡峭。
由图7 知,含油率的变化较为陡峭,而Tween80的变化则相对平滑。
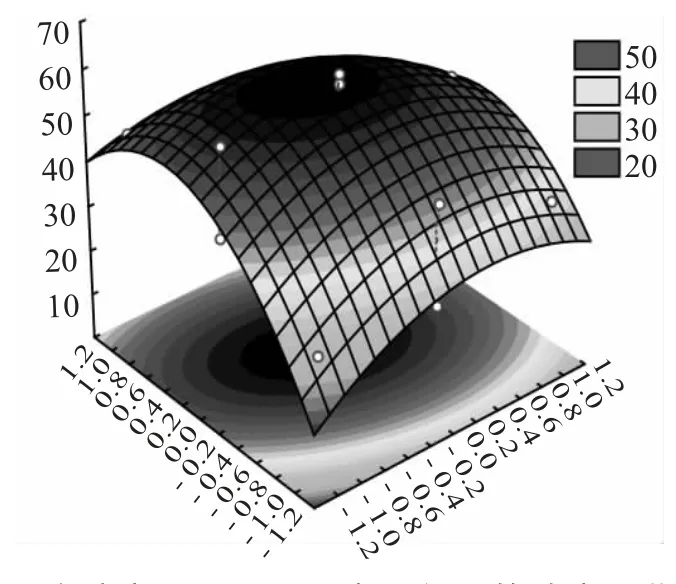
图7 含油率与Tween80 交互作用的响应面曲面图Fig.7 Response surface of interaction between oil content and Tween80
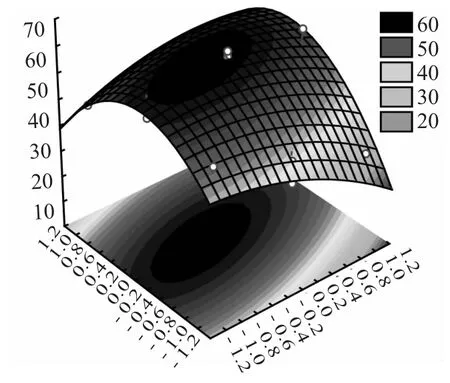
图8 含油率与含水率交互作用的响应面曲面图Fig.8 Response surface of interaction between oil content and moisture content
由图8 知,事实上含油率的变化较含水率陡峭,也就是说实际上含油率的影响比含水率大,这也就与表3 的分析相对应。
经过模型优化,得到预测模型为X1=-0.0714、X2=-0.2903、X3=0.05539 的点(即在Tween80 为2.93 cmc,土壤含水率为58.2%,土壤含油率为8.27%),并且该点具有石油降解的预测最大值60.04%。但考虑到实验的可行性将各因素的值调整为Tween80=2.93CMC、壤含水率=58%、土壤含油率=8.27%,在上述实验条件下验证该实验,做3 组平行实验,石油降解率分别为58.64%,59.54%,57.86%,平均值为58.68%,与预测值偏离较小。
4 结论
(1)单因素研究表明,土壤含水率为60%、摇床转速为160r·min-1、Tween80 浓度为4CMC、土壤含油率为8%、藜芦醇浓度为0.25g·L-1时白腐真菌对土壤中石油达到最大降解。
(2)响应面实验表明,Tween80、含水率、含油率3 个因素对石油降解率的影响大小依次为:含油率>含水率>Tween80,含水率和含油率的交互作用对土壤中石油的降解率影响较显著。响应面模型优化后得到的最佳降解条件为土壤含水率58.2%、土壤含油率8.27%、Tween80 2.93CMC,此时土壤中石油的预期降解率能达到60.93%;验证实验得到的降解率为58.68%,达到理论预测值的97.73%。
[1]杜显元.石油开采区土壤污染物源解析、毒性及快速检测法研究[D].北京:华北电力大学,2012.
[2]田苗. 石油降解菌的筛选及对石油污染土壤的修复实验[D].陕西:西北大学,2010.
[3]Sanjeet Misshra,Jeevan Jyot.In situ bioremendiation potential of an oily sludge-degrading bacterial consortium[J].Current Microbiology,2001,43(5):329-335.
[4]HUBALEK T,VOSAHLOVA S,MATEJU V,et al.Ecotoxicitymonitoring of hydrocarbon-contaminated soil during bioremediation:a case study[J].Arch Enciron Contam Toxicol,2007,52(1):1-7.
[5]DIPLOCK E E,MARDLIN D P,KILLHAM K S,et al.Predicting bioremediation of hydrocarbons:laboratory to field scale[J].Environ Pollut,2009,157(6):1831-1840.
[6]王聪颖,王芳,王涛,等.生物强化和生物刺激对土壤中PAHs降解的影响[J].中国环境科学,2010,30(1):121-127.
[7]李慧蓉.白腐真菌的研究进展[J].环境科学进展,1996,4(6):69-77.
[8]常天俊,潘文维,赵丽,等.白腐真菌对染料脱色的培养条件研究[J].环境工程学报,2007(2):54-58.
[9]Koschorreck K,Richter S M,Swierczek A,et al.Comparative characterization of four laccases from Trametes versicolor concerning phenolic C-C coupling and oxidation of PAHs[J].Archives of Biochemistry and Biophysics,2008,474(1):213-219.
[10]边名鸿,叶光斌,杨跃寰.白腐菌处理染料废水的研究进展[J].四川理工学院学报(自然科学版),2013,26(4):1-4.
[11]陈建海,李慧蓉. 黄孢原毛平革菌对多环芳烃菲的生物降解[J].江苏石油化工学院学报,2000,12(3):25-28.
[12]张红.黄孢原毛平革菌合成木素过氧化物酶酶活的提高及其在石油降解中的应用研究[D].乌鲁木齐:新疆农业大学,2006.
[13]任红梅,刘左军,袁慧君,等.低温纤维素降解菌的筛选及其产酶研究[J].食品工业科技,2013,5.
[14]李晔,陈新才,王焰新. 石油污染土壤生物修复的最佳生态条件研究[J].环境科学与技术,2004,27(4):17-19.
[15]顾传辉,陈桂珠.石油污染土壤生物降解生态条件研究[J].生态科学,2000,19(4):67-72.
[16]高大文,文湘华,钱易.白腐真菌培养条件对其分泌木质素降解酶的影响[J].中国环境科学,2005,25(5):572-575.
[17]杨国君.两株假单胞菌摄取与降解烷烃研究[D].无锡:江南大学,2004.
[18]陈静,王学军,胡俊栋,等.表面活性剂对白腐真菌降解多环芳烃的影响[J].环境科学,2006,72(1):154-159.
[19]张丽芳,肖红,魏德洲. 表面活性剂对土壤石油污染物微生物降解的影响[J].辽宁化工,2002,31(12):509-513
[20]谭丽泉,余梅,黄敏,等.黄孢原毛平革菌的生长及降解石油条件的优化[J].化工环保,2012,2(1):11-15.

