脓毒血症患者抗炎和促炎指标动态变化在临床病情评估中的意义*
苏明华,冯璇璘,邓 磊,李 依,李俊英,陈友岱
(四川省医学科学院/四川省人民医院EICU,成都610072)
近20余年来,重症医学的发展为人类抗击脓毒血症尤其是严重脓毒血症提供了有力的支持。2001年欧洲重症学会、美国重症学会和国际脓毒症论坛发起“拯救脓毒症战役”,2002年欧美国家多个组织共同发起并签署“巴塞罗那宣言”[1],医学界满怀信心,然而10余年后的今天,面临的仍然是脓毒血症居高不下的死亡率(30%~70%)[2-3]。炎症-抗炎症因子平衡学说认为:脓毒血症早期以致炎因子增加为主要免疫学特征,并由此产生不同程度的临床炎性反应[4],主要致炎因子包括:白细胞介素(IL)-1、肿瘤坏死因子-α(TNF-α)、IL-8、IL-12。伴随机体炎性反应的为抗炎性反应,抗炎因子如:IL-4、IL-10、IL-13及前列腺素E2,理论上能降低机体炎性反应,从而达到炎症程度的自我调节和控制。本研究动态监测本院EICU内收治的脓毒血症患者诊断明确后第1、3、5、7天血清样本中IL-1、TNF-α、IL-4、IL-10浓度,评估其在脓毒血症患者病情严重程度及预后评价中的临床意义。
1 资料与方法
1.1 一般资料 2010~2011年收住本院EICU的脓毒血症患者43例,其中男25例,女18例,平均年龄(53.5±17.9)岁;入住时合并器官功能不全的严重脓毒血症患者28例,器官功能正常脓毒血症患者15例;住院存活27例,死亡16例,根据预后分为存活组和死亡组。排除糖尿病、肿瘤、重度营养不良、免疫系统疾病、器官移植术后或使用免疫抑制剂者。排除诊断明确后1周内死亡患者。
1.2 脓毒血症纳入标准[5]血培养结果阳性或存在明确的感染部位[经血液、脑脊液、胸腔积液、腹腔积液、尿、痰培养阳性和(或)CT、胸片确定感染部位];同时合并全身炎性反应综合征(systemic inflammatory response syndrome,SIRS),诊断标准依据2001年国际脓毒症定义会议对SIRS定义修正后新的诊断标准[任何致病因素作用于机体所引起的全身炎性反应,并且具备以下2项或2项以上体征:体温大于38℃或小于36℃;心率大于每分钟90次;呼吸频率大于每分钟20次,或动脉血二氧化碳分压(PaCO2)<32mm Hg;外周血白细胞计数大于12×109/L或小于4×109/L,或未成熟粒细胞大于0.10]。严重脓毒血症即脓毒血症合并1个或1个以上器官功能不全或衰竭,并且排除慢性疾病导致的器官功能障碍。
表1 两组促炎、抗炎指标比较(±s)
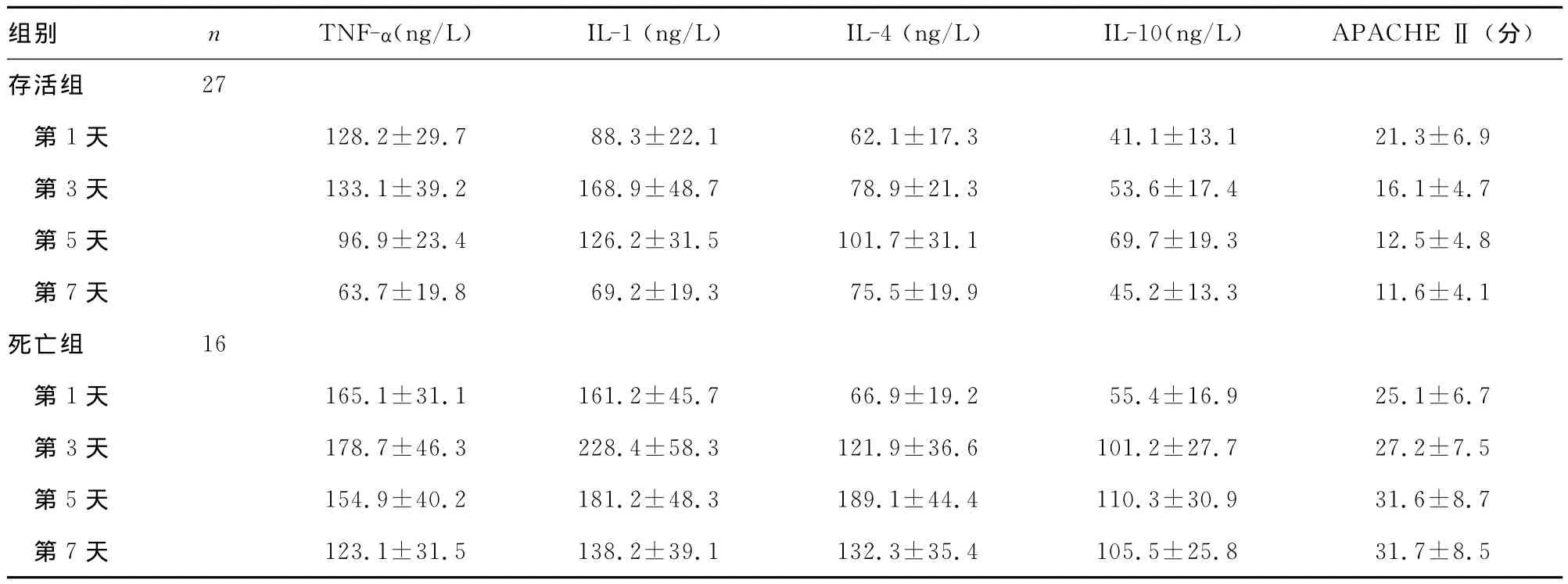
表1 两组促炎、抗炎指标比较(±s)
组别 n TNF-α(ng/L)IL-1(ng/L)IL-4(ng/L)IL-10(ng/L)APACHEⅡ(分)27第1天 128.2±29.7 88.3±22.1 62.1±17.3 41.1±13.1 21.3±6.9第3天 133.1±39.2 168.9±48.7 78.9±21.3 53.6±17.4 16.1±4.7第5天 96.9±23.4 126.2±31.5 101.7±31.1 69.7±19.3 12.5±4.8第7天 63.7±19.8 69.2±19.3 75.5±19.9 45.2±13.3 11.6±4.1死亡组 16第1天 165.1±31.1 161.2±45.7 66.9±19.2 55.4±16.9 25.1±6.7第3天 178.7±46.3 228.4±58.3 121.9±36.6 101.2±27.7 27.2±7.5第5天 154.9±40.2 181.2±48.3 189.1±44.4 110.3±30.9 31.6±8.7第7天 123.1±31.5 138.2±39.1 132.3±35.4 105.5±25.存活组8 31.7±8.5
1.3 检测指标 采集诊断明确后第1、3、5、7天清晨血清样本,常温静置30min后,离心机4 000r/min离心8~10min,取上层血清样本并在-20℃保存备用。动态监测降钙素原(procalcitonin,PCT)、血常规、血气分析、凝血常规、肝肾功能和生命体征,同时动态记录患者入住后急性生理和慢性健康状况评分(APACHEⅡ)。采用欣博盛生物科技有限公司提供ELISA试剂盒,双抗体夹心ELISA法测定TNF-α、IL-1、IL-4、IL-10血清浓度。
1.4 统计学处理 应用SPSS13.0统计软件进行处理,数据采用±s表示,组内比较使用单因素方差分析,组间比较采用q检验,P<0.05为差异有统计学意义。
2 结果
两组TNF-α、IL-1均呈早期上升,病程进展第3日达到峰值水平,之后第5、7日呈逐渐下降,在相同监测时间点死亡组指标均显著高于存活组(P<0.05)。两组IL-4均在第5天达到峰值水平后下降,在相同监测时间点死亡组指标均显著高于存活组(P<0.05)。存活组IL-10在第5天达到峰值水平后下降;死亡组IL-10水平呈现逐渐升高,并维持高位,第3、5、7天IL-10血清浓度差异无统计学意义(P>0.05)。存活组APACHEⅡ呈显著下降趋势,而死亡组则呈上升趋势并维持高评分值;两组第1天评分值比较,差异无统计学意义(P>0.05),但死亡组APACHEⅡ分值仍明显高于存活组。见表1。
3 讨论
脓毒血症是严重创伤、重度感染、大面积烧伤、休克等临床急危重患者的严重并发症,病情加重合并器官功能不全为严重脓毒血症或脓毒性休克,往往导致2个或2个以上器官功能障碍,临床定义为多器官功能障碍综合征(multiple organ dysfunction syndrome,MODS),是脓毒血症患者的主要死亡原因,也是重症医学工作中的重点和难点。
贯穿在SIRS-脓毒血症-严重脓毒血症-MODS病理生理过程中的主要临床特征为炎性反应。早在20世纪80年代脓毒血症的研究已表明这种机体的炎性反应不单一由细菌及其毒素所致,而由脂多糖等诱导而产生的多种炎症介质、促炎因子的瀑布样释放更为关键[6-8]。主要促炎因子包括:TNF-α、IFN、IL-1、IL-8、IL-12、PAF、ADP、LTB4、TXA2、PF3-4。TNF-α是感染及创伤后最早释放并且最关键的促炎因子,其具有显著的全身作用。TNF-α的核心作用是在炎性反应中激活细胞因子级联反应,诱发IL-1、IL-6、前列腺素等的分泌,由此激发炎症连锁反应[9]。而IL-1协同TNF-α启动脓毒血症的炎性反应,并在其发展过程中起放大作用,即所谓的免疫炎症瀑布反应。炎症时细胞因子还激活PMN和巨噬细胞中的iNOS释放NO,影响血流动力学,参与脓毒血症的发展过程。参与抗炎反应的介质主要包括:IL-4、IL-10、IL-13、IL-1rα、TGF-β等[10]。IL-4主要由肥大细胞或嗜碱性粒细胞系统成熟的Th2细胞分泌。IL-4驱动Th2细胞响应,介导肥大细胞的聚集和活化,通过刺激B细胞分化为IgE分泌细胞来刺激IgE抗体的产生。IL-4具有显著地抑制发炎性细胞因子表达和释放的作用。它能够屏蔽或者抑制单核细胞产生的细胞因子,包括:IL-1、TNF-α、IL-6、IL-8和巨噬细胞炎症蛋白(MIP)-1α;IL-10主要是由CD4+Th2、单核细胞、B-细胞合成的,IL-10抑制单核/巨噬细胞产生TNF-α、IL-1、IL-6、IL-8、IL-12、粒细胞集落刺激因子、MIP-1α和MIP-2α。IL-10抑制主要组织相容性抗原Ⅱ分子在细胞表面表达B7辅助分子,以及抑制LPS识别信号分子CD14。它还抑制嗜中性粒细胞核自然杀伤细胞产生细胞因子。IL-10抑制核因子κB(NF-κB)在LPS刺激以后的转移,促进促炎细胞因子前体的mRNA的降解。除此之外,IL-10还可以衰减TNF受体在细胞表面的表达,促进TNF受体的脱落[11]。
有学者的SIRS与代偿性抗炎反应综合征(CARS)平衡失控理论认为:感染与非感染因子作用局部细胞可产生促炎介质和抗炎介质,当这两种介质泛滥入血可导致SIRS与CARS,当SIRS为主即炎性反应在人体发挥主体作用时,出现休克、细胞凋亡、凝血功能紊乱和多器官功能障碍[12];当CARS占据主导时,免疫功能全面抑制,对感染易患性增加;而当CARS与SIRS并存时,如彼此间作用相互加强,则最终形成对机体损伤更强的免疫失衡现象,产生更强的损伤和更严重的免疫抑制,即混合性拮抗反应综合征(MARS)[13]。
本研究发现,促炎介质TNF-α、IL-1在脓毒血症早期迅速升高并达到峰值,并且死亡组高于存活组,提示TNF-α、IL-1升高程度与患者病情严重度有关;临床综合监测生命体征、血气分析、器官功能等指标计算APACHEⅡ评分值,死亡组在疾病病程中呈现上升趋势,而存活组则逐渐下降。抗炎介质IL-4、IL-10上升并达峰时间较促炎介质迟滞,可能是炎症介质升高后机体产生继发反应,二者存在前因后果关系,与文献[14-15]研究发现一致。另外,本研究发现死亡组IL-10在第3、5、7天3个监测时点均维持较高水平,且相互比较无显著差异,提示无明显血清浓度升降趋势,考虑与患者病情严重程度有关,持续较强的炎症反应导致机体过度的抗炎反应,即产生MARS,导致更强的损伤和更严重的免疫抑制,机体处于“免疫麻痹”状态,并由此导致患者死亡,作者认为这是死亡组与存活组患者有明显异常之处。
炎症-抗炎平衡在临床工作中难以量化,理论上二者接近平衡状态能对机体产生较小的损伤,并取得理想的临床治疗效果,但实际上机体内细胞因子众多,生物学特性复杂,很难从单个或者数个介质水平监测而全面评价患者炎症-免疫功能状态,轻易使用免疫增强或免疫抑制剂均可能导致严重临床后果。
TNF-α、IL-1、IL-4、IL-10等炎症、抗炎指标血清水平对病情严重程度有提示意义,对预后评判也有较好的临床价值。本研究监测临床病例数量有限,且多为来源于院外的急危重症患者,尚需在监测数量、时间点、病员来源范围做进一步改良和优化。
[1] Dellinger RP.The surviving sepsis campaign:2013and beyond[J].Chin Med J(Engl),2013,126(10):1803-1805.
[2] 曹书华.脓毒症与多脏器功能失常综合征[J].中华急诊医学杂志,2010,19(7):781-782.
[3] Engel C,Brunkhorst FM,Bone HG,et al.Epidemiology of sepsis in Germany:results from a national prospective multicenter study[J].Intensive Care Med,2007,33(4):606-618.
[4] Napolitano LM.Immune stimulation in sepsis:to be or not to be[J].Chest,2005,127(6):1882-1885.
[5] 俞森洋.SIRS、sepsis、严重sepsis和MODS的诊断标准[J].临床肺科杂志,2009,14(1):1-2.
[6] Cavaillon JM,Adib-Conquy M,Fitting C,et al.Cytokine cascade in sepsis[J].Scand J Infect Dis,2003,35(9):535-544.
[7] Sin DD,Man SFP.Why are patients with chronic obstructive pulmonary disease at increased risk of cardiovascular diseases?The potential role of systemic inflammation in chronic obstructive pulmonary disease[J].Circulation,2003,107(11):1514-1519.
[8] Gan WQ,Man SFP,Senthilselvan A,et al.Association between chronic obstructive pulmonary disease and systemic inflammation:a systematic review and a meta analysis[J].Thorax,2004,59(7):574-580.
[9] Johnson BL 3rd,Goetzman HS,Prakash PS,et al.Association between tumor necrosis factor-alpha promoter-308 A/G polymorphism and susceptibility to sepsis and sepsis mortality:a systematic review and meta-analysis[J].Crit Care Med,2010,38(1):276-282.
[10] Calvano SE,Xiao WZ,Richanls DR,et al.A networkbased analysis of systemic inflanrmtion in humans[J].Nature,2005,437(7061):1032-1037.
[11] Herzum I,Renz H.Inflammatory markers in SIRS,sepsis and septic shock[J].Curr Med Chem,2008,15(6):581-587.
[12] 龙鼎,喻莉,武晓灵.系统性炎症反应综合征患者血浆D-二聚体与细胞因子动态变化的研究[J].重庆医学,2012,41(8):738-740.
[13] Novotny AR,Reim D,Assfalg V,et al.Mixed antagonist response and sepsis severity-dependent dysbalance of proand anti-inflammatory responses at the onset of postoperative sepsis[J].Immunobiology,2012,217(6):616-621.
[14] Saban MR,Hellmich H,Nguyen N,et al.Time course of LPS-induced gene expression in a mouse model of genitourinary inflammation[J].Physiol Genomios,2001,5(3):147-160.
[15] 宋振举,郦珊珊,童朝阳,等.脓毒症患者血清促炎和抗炎细胞因子的变化[J].中华急诊医学杂志,2008,17(11):1191-1194.

