续骨冲和膏的质量标准研究
吴凤荣,曾聪彦,胡玉良,卢建业(.广州中医药大学附属中山中医院,广东中山 5840;.广东药学院中药学院,广东中山 58400)
续骨冲和膏由大黄、赤芍、当归、续断、黄柏、独活等20味中药制备而成,是广州中医药大学附属中山中医院的常用经验方,具有活血通络、消肿止痛、疗伤续骨的功效,主要用于治疗跌打瘀伤。由于该制剂尚未建立完善的质量标准,为了控制其产品质量,保证其安全性和有效性,本研究采用薄层色谱(TLC)法对该制剂中的大黄、黄柏、赤芍、当归、骨碎补、独活、荆芥、木香等多味药进行了定性鉴别,并采用高效液相色谱(HPLC)法对制剂中的君药大黄所含的大黄素和大黄酚进行了含量测定。
1 材料
1.1 仪器
1100型HPLC仪(美国安捷伦公司);KQ3200E型医用超声波清洗器(昆山市超声仪器有限公司);BS224S型电子天平(德国赛多利斯公司);电热恒温水浴锅(上海衡平仪器仪表厂);TC-15型套式恒温器(浙江新华医疗器械厂)。
1.2 药品与试剂
续骨冲和膏(批号:20131109、20131202、20140108)由广东省中山市中医院制剂室提供;大黄素(批号:110756-200110)、大黄酚(批号:110796-201118)、芍药苷(批号:110736-201136)对照品及黄柏(批号:121510-201105)、大黄(批号:121249-201003)、赤芍(批号:121093-200402)、当归(批号:120927-201315)、骨碎补(批号:121169-200503)、独活(批号:120940-201111)、木香(批号:120921-201008)、荆芥(批号:120911-201110)对照药材均购自中国食品药品检定研究院;硅胶G(青岛海洋化工有限公司分厂,批号:20120208);其余试剂均为市售分析纯。
2 方法与结果
2.1 TLC鉴别
2.1.1 大黄[1]取本品1.5 g,用玻璃棒分散,加甲醇20 ml,浸泡1 h,滤过,取滤液5 ml,蒸干,残渣加水10 ml使溶解,加盐酸1 ml,水浴加热回流30 min,立即冷却,用乙醚分2次振摇提取,每次20 ml,合并乙醚液,蒸干,残渣加三氯甲烷1 ml使溶解,作为供试品溶液。取大黄对照药材0.1 g,加甲醇20 ml,按供试品溶液的制备方法制成对照药材溶液。取缺大黄的其余药味适量,按处方工艺制成缺大黄的阴性对照品,取约1.5 g,按上述供试品溶液的制备方法制成缺大黄的阴性对照溶液。照TLC法[2010年版《中国药典》(一部)附录ⅥB]试验,吸取上述3种溶液各5 μl分别点于同一硅胶G薄层板上,以石油醚(30~60 ℃)-甲酸乙酯-甲酸(15∶5∶1,V/V/V)的上层溶液为展开剂,展开,取出,晾干,分别置于日光和紫外光灯(365 nm)下检视。结果,供试品色谱中,在与对照药材色谱相应的位置上,显相同的橙黄色荧光斑点;置氨蒸气中熏后,斑点变为红色。大黄的TLC图见图1。
2.1.2 黄柏[2-3]取本品3 g,用玻璃棒分散,加1%醋酸甲醇溶液20 ml,超声(功率:150 W,频率:40 kHz)处理20 min,滤过,滤液浓缩至1 ml,作为供试品溶液。取黄柏对照药材0.1 g,加1%醋酸甲醇20 ml,按供试品溶液的制备方法制成对照药材溶液。取缺黄柏的其余药味制成的阴性对照品3 g,按上述供试品溶液的制备方法制成缺黄柏的阴性对照溶液。照TLC法[2010年版《中国药典》(一部)附录ⅥB]试验,吸取供试品溶液、阴性对照溶液各5 μl及对照药材溶液1 μl分别点于同一硅胶G薄层板上,以乙酸乙酯-丁酮-甲酸-水(10∶6∶1∶1,V/V/V/V)为展开剂,展开,取出,晾干,分别置日光和紫外光灯(365 nm)下检视。结果,供试品色谱中,在与对照药材色谱相应的位置上,显相同颜色的黄色斑点和荧光斑点。黄柏的TLC图见图2。

图1 大黄的TLC图A.熏氨蒸气前;B.熏氨蒸气后;C.紫外光灯下;1~3.供试品;4.大黄对照药材;5缺大黄的阴性样品Fig 1 TLC of Rhei RadixA.before fumed with ammonia vapor;B.after fumed with ammonia vapor;C.under UV lamp;1-3.test samples;4.Rhei Radix reference substance;5.negative control without Rhei Radix
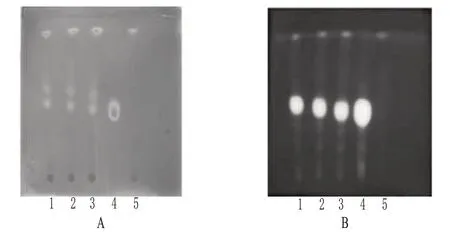
图2 黄柏的TLC图A.日光下;B.紫外光灯下;1~3.供试品;4.黄柏对照药材;5.缺黄柏的阴性样品Fig 2 TLC ofP.chineseA.under sunlight;B.under UV lamp;1-3.test samples;4.Phellodendri Chinensis reference substance;5.negative control withoutP.chinese
2.1.3 赤芍[4]取本品22 g,用玻璃棒分散,加乙醇50 ml,振摇5 min,滤过,滤液蒸干,残渣加乙醇2 ml使溶解,作为供试品溶液。取赤芍对照药材0.5 g,加乙醇10 ml,按上述供试品溶液的制备方法制成对照药材溶液。取缺赤芍的其余药味制成的阴性对照品22 g,按上述供试品溶液的制备方法制成缺赤芍的阴性对照溶液。照TLC法[2010年版《中国药典》(一部)附录ⅥB]试验,吸取上述3种溶液各5 μl分别点于同一硅胶G薄层板上,以三氯甲烷-乙酸乙酯-甲醇-甲酸(40∶5∶10∶0.2,V/V/V/V)为展开剂,展开,取出,晾干,喷以5%香草醛硫酸溶液,加热至斑点显色清晰。结果,供试品色谱中,在与对照药材色谱相应的位置上,显相同的蓝紫色荧光斑点。赤芍的TLC图见图3。
2.1.4 当归[5]取本品22 g,加乙醚50 ml,超声(功率:150 W,频率:40 kHz)处理10 min,滤液蒸干,残渣加乙醇1 ml使溶解,作为供试品溶液。取当归对照药材0.5 g,加乙醚20 ml,按上述供试品溶液的制备方法制成对照药材溶液。取缺当归的其余药味制成的阴性对照品22 g,按上述供试品溶液的制备方法制成缺当归的阴性对照溶液。照TLC法[2010年版《中国药典》(一部)附录ⅥB]试验,吸取上述3种溶液各10 μl分别点于同一硅胶G薄层板上,以正己烷-乙酸乙酯(4∶1,V/V)为展开剂,展开,取出,晾干,置紫外光灯(365 nm)下检视。结果,供试品色谱中,在与对照药材色谱相应的位置上,显相同颜色的荧光斑点。当归的TLC图见图4。
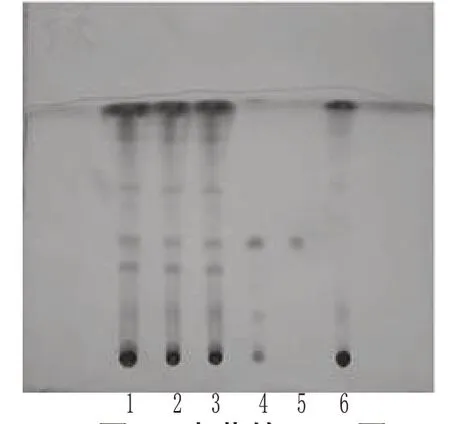
图3 赤芍的TLC图1~3.供试品;4.赤芍对照药材;5.芍药苷对照品;6.缺赤芍的阴性样品Fig 3 TLC of Paeoniae Radix Rubra1-3.test samples;4.Paeoniae Radix Rubra reference substance;5.peoniflorin control;6.negative control without Paeoniae Radix Rubra

图4 当归的TLC图1~3.供试品;4.当归对照药材;5.缺当归的阴性对照品Fig 4 TLC ofA.sinensis1-3.test samples;4.Angelicae Sinensis Radix reference substance;5.negative control withoutA.sinensis
2.1.5 木香[6]取本品20 g,加甲醇40 ml,用玻璃棒分散,超声(功率:150 W,频率:40 kHz)处理30 min,滤过,取滤液浓缩至2 ml,作为供试品溶液。取木香对照药材0.5 g,加甲醇10 ml,按供试品溶液的制备方法制成对照药材溶液。取缺木香的其余药味制成的阴性对照品0.5 g,按上述供试品溶液的制备方法制成缺木香的阴性对照溶液。照TLC法[2010年版《中国药典》(一部)附录ⅥB]试验,吸取上述3种溶液各5 μl分别点于同一硅胶G薄层板上,以三氯甲烷-环己烷-甲醇(5∶3∶0.1,V/V/V)为展开剂,展开,取出,晾干,喷以1%香草醛硫酸溶液,加热至斑点显色清晰。结果,供试品色谱中,在与对照药材色谱相应的位置上显相同颜色的荧光斑点。木香的TLC图见图5。
2.2 大黄素和大黄酚的含量测定[7-8]
2.2.1 色谱条件与系统适用性试验 色谱柱:Boston Green ODS C18(250 mm × 4.6 mm,5 μm);流动相:甲醇-0.1%磷酸溶液(85∶15,V/V);柱温:25 ℃;检测波长:254 nm。理论板数按大黄素、大黄酚峰计应不低于3 000。
2.2.2 供试品溶液的制备[1]精密称取本品约3 g,置于100 ml锥形瓶中,精密加入甲醇25 ml,称定质量,加热回流提取30 min,放冷,再次精密称定,加甲醇补足减失的质量,摇匀,滤过。精密量取续滤液10 ml,置圆底烧瓶中,挥干溶剂,加水15 ml使溶解,再加盐酸1 ml,超声(功率:150 W,频率:40 kHz)处理5 min,加热回流提取30 min,立即冷却,置于分液漏斗中。用少量乙醚洗涤容器,洗涤液并入分液漏斗中,用乙醚分3次振摇提取,每次15 ml,合并乙醚液,蒸干。残渣加甲醇使溶解,转移至25 ml量瓶中,加甲醇定容,摇匀,经0.45 μm微孔滤膜滤过,取续滤液,即得。
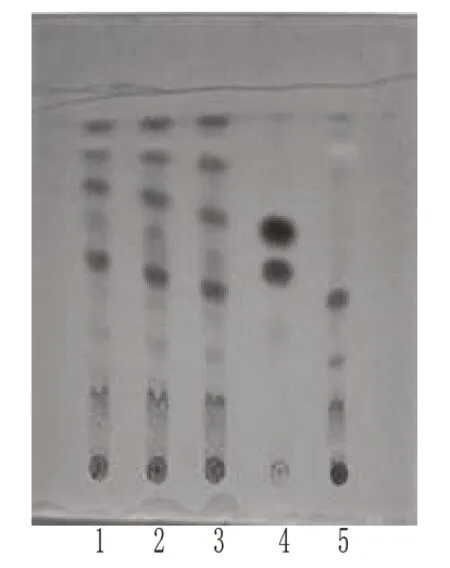
图5 木香的TLC图1~3.供试品;4.木香对照药材;5.缺木香的阴性对照品Fig 5 TLC ofA.lappa1-3.test samples;4.Aucklandiae Radix reference substance;5.negative control withoutA.lappa
2.2.3 混合对照品溶液的制备 精密称取大黄素、大黄酚对照品各适量,加甲醇制成每1 ml含48.25 μg大黄素和109 μg大黄酚的混合对照品溶液。
2.2.4 阴性样品溶液的制备 按处方比例称取药材,按续骨冲和膏的处方工艺制成缺大黄的阴性样品,再按“2.2.2”项下方法制成缺大黄的阴性样品溶液。
2.2.5 专属性试验 分别精密吸取混合对照品溶液、供试品溶液及阴性样品溶液各20 μl,按“2.2.1”项下色谱条件进样测定。结果,供试品色谱中,在与对照品色谱相应保留时间处,有相同的色谱峰;阴性对照无干扰。色谱见图6。
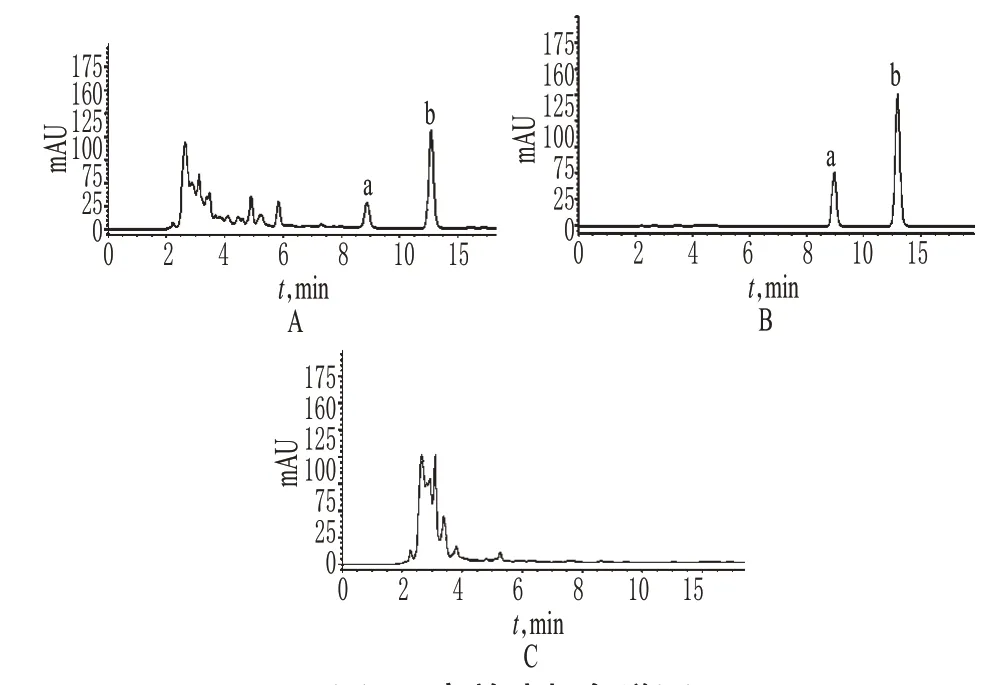
图6 高效液相色谱图A.供试品;B.混合对照品;C.阴性对照;a.大黄素;b.大黄酚Fig 6 HPLC chromatogramsA.test sample;B.mixed control;C.negative control;a.emodin;b.chrysophanol
2.2.6 线性关系考察 精密量取“2.2.3”项下的混合对照品溶液0.5、1、2、4、8 ml,分别用甲醇稀释,得到系列浓度的混合对照品溶液。分别精密吸取系列对照品溶液各20 μl,按“2.2.1”项下色谱条件进样测定,记录峰面积。以质量浓度(x,μg)为横坐标、峰面积(y)为纵坐标,绘制标准曲线,得大黄素的回归方程为y=72.876x-30.738(r=0.999 9),大黄酚的回归方程为y=62.82x-57.904(r=0.999 9)。结果表明,大黄素和大黄酚的质量浓度分别在2.41~38.6、5.45~87.2 μg/ml范围内与各自峰面积呈良好线性关系。
2.2.7 精密度试验 精密称取续骨冲和膏(批号:201301202)样品适量,按“2.2.2”项下方法制备供试品溶液,再按“2.2.1”项下色谱条件连续进样5次,记录峰面积。结果,大黄素和大黄酚峰面积的RSD分别为1.3%、1.2%(n=5),表明仪器精密度良好。
2.2.8 稳定性试验 精密吸取同一批供试品溶液各适量,分别于配制0、2、4、6、8 h时按“2.2.1”项下色谱条件进样测定,记录峰面积。结果,大黄素和大黄酚峰面积的RSD分别为1.08%、1.53%(n=5),表明供试品溶液在8 h内稳定性良好。
2.2.9 重复性试验 称取同一批次的续骨冲和膏(批号:201301202)共6份,按“2.2.2”项下方法制备供试品溶液,再按“2.2.1”项下色谱条件进样测定,记录峰面积,计算样品含量。结果,大黄素和大黄酚的平均含量分别为0.15、0.33 mg/g,其峰面积的RSD分别为1.2%、1.1%(n=6),表明该方法重复性良好。
2.2.10 加样回收率试验 精密称取同一批次(批号:201301202)已知含量的续骨冲和膏1 g(约含大黄素0.15 mg、大黄酚0.33 mg),共6份,分别置于磨口锥形瓶中,精密加入混合对照品溶液适量,按“2.2.2”项下方法制备供试品溶液,再按“2.2.1”项下色谱条件进样测定,记录峰面积,并计算加样回收率,结果见表1。
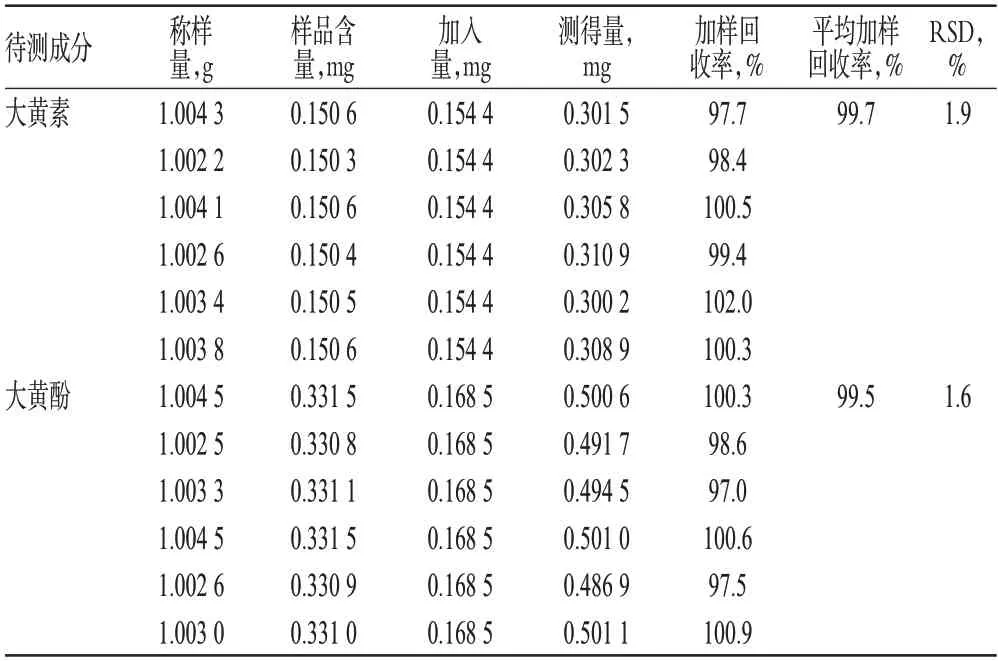
表1 加样回收率试验结果(n=6)Tab 1 Results of recovery tests(n=6)
2.2.11 样品含量测定 精密称取3批样品各适量,分别按“2.2.2”项下方法制备供试品溶液,再按“2.2.1”项下色谱条件进样测定,记录峰面积,并计算样品含量,结果见表2。
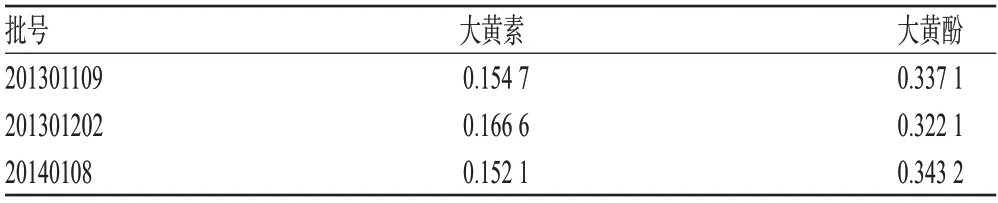
表2 样品含量测定结果(mg/g,n=3)Tab 2 Results of content determination(mg/g,n=3)
3 讨论
本制剂中各药味的TLC鉴别试验基本参照2010年版《中国药典》(一部)中有关药味的鉴别方法。其中,大黄、赤芍、当归的TLC鉴别试验方法分别与2010年版《中国药典》方法基本一致。黄柏原采用2010年版《中国药典》中的鉴别条件,以三氯甲烷-甲醇-水(30∶15∶4,V/V/V)的下层溶液为展开剂[2],结果斑点不清晰;后尝试采用文献方法[3]的乙酸乙酯-丁酮-甲酸-水(10∶6∶1∶1,V/V/V/V)为展开剂,结果斑点清晰,分离度好。木香原采用2010年版《中国药典》中的鉴别条件,以环己烷-甲酸乙酯-甲酸(15∶5∶1,V/V/V)的上层溶液为展开剂[2],结果展开效果也很差,后参考文献方法[4]改成三氯甲烷-环己烷-甲醇为展开剂,且经不断调整各试剂比例,直至调整到5∶3∶0.1(V/V/V)时,其展开效果好。由于本制剂是由20味中药组成的复方制剂,成分较为复杂,TLC鉴别过程中对提取方法及展开剂的选择有较高要求,在对处方中骨碎补、续断、防风、红花、蒲黄、独活等其余药味的TLC鉴别研究中,存在图谱斑点不清晰、拖尾、阴性干扰大等缺陷,需进一步研究,暂不列入标准中。
采用HPLC法测定大黄素和大黄酚含量时,供试品溶液的制备方法则参照了有关文献方法,简化了2010年版《中国药典》中大黄含量测定项[2]中配制8%盐酸溶液的步骤,缩短了回流提取时间。参照2010年版《中国药典》(一部)中大黄含量测定项下的色谱条件,以甲醇-0.1%磷酸溶液(75∶25、80∶20、85∶15,V/V)多种比例试验选择流动相,当比例为85∶15时,大黄素和大黄酚的色谱峰分离度适合、基线平直、峰形对称、其余成分无干扰。
综上所述,本研究所建立的方法方便快捷,重现性、专属性好,结果稳定可靠,可作为续骨冲和膏的质量控制方法。
[1]刘起华,张萱,文谨.高效液相色谱法测定四黄膏中大黄素、大黄酚的含量[J].中国现代应用药学杂志,2007,24(1):6.
[2]国家药典委员会.中华人民共和国药典:一部[S].2010年版.北京:中国医药科技出版社,2010:286、58、22.
[3]王丽军,刘丽萍.黄柏止痒洗剂中黄柏、苦参的薄层色谱鉴别[J].陕西中医,2011,32(10):1 407.
[4]李伯群,彭腾,余蕾,等.祛毒胶囊质量标准研究[J].中国药房,2007,18(12):925.
[5]黄艳萍,黄勇红.当归调经片的薄层鉴别和阿魏酸的测定[J].中国实验方剂学杂志,2010,16(6):119.
[6]齐双山,王青虎,包巴特尔,等.蒙成药中木香的薄层色谱鉴别研究[J].时珍国医国药,2001,12(5):430.
[7]赵嘉将,刘静,龚元香,等.沉香化气片的薄层色谱鉴别[J].中国药业,2008,17(20):39.
[8]曹文静,郭姗姗,笔雪梅.HPLC测定结核丸中大黄的5种有效成分含量[J].黑龙江医药,2014,27(4):733.

