不同林龄白桦天然次生林土壤碳通量和有机碳储量
韩营营, 黄 唯, 孙 涛, 陆 彬, 毛子军
东北林业大学, 森林植物生态学教育部重点实验室, 哈尔滨 150040
不同林龄白桦天然次生林土壤碳通量和有机碳储量
韩营营, 黄唯, 孙涛, 陆彬, 毛子军*
东北林业大学, 森林植物生态学教育部重点实验室, 哈尔滨150040
白桦天然次生林是中国东北地区地带性顶极植被类型——阔叶红松林遭到严重干扰破坏后恢复形成的主要天然次生林类型,测定了生长季内不同林龄白桦天然次生林(20、36、82a)的土壤呼吸速率及土壤碳含量。结果表明:土壤呼吸速率的季节变化呈单峰曲线,主要受土壤温度的驱动,土壤10cm处温度可以解释不同林龄白桦林之间土壤呼吸速率86%—92%的变异,土壤呼吸与土壤含水量关系不显著(P>0.05)。随着林龄的增加,生长季内土壤表面CO2通量呈增加的趋势,依次分别为740(20a)、768(36a)和809(82a)gC m- 2a-1。土壤呼吸的温度敏感性指数Q10亦随林龄的增加呈上升的趋势,依次分别为2.64、2.91和3.35。平均土壤有机碳含量(0—50cm土壤层)和碳密度均随林龄的增加而增加,随土壤深度的增加而减少;其中,随着林龄的增加土壤有机碳含量依次分别为 43.75、47.72和55.96 g/kg,有机碳密度为14.7、18.1和18.7 kg/m2。不同林龄间土壤表面CO2年通量与土壤有机碳密度之间存在显著的正相关关系(P<0.01),但其相关程度因土层而异,其中与0—10cm土层的有机碳密度相关最为密切(R2=0.908)。
林龄; 白桦天然次生林; 土壤表面CO2通量; 土壤有机碳
土壤是全球陆地生态系统中最大的碳库,土壤呼吸作为森林生态系统土壤碳库向大气中释放CO2的一个重要过程,是陆地生态系统的第二大碳通量[1]。因而,即便是土壤碳贮存或土壤呼吸发生微小的变化,对大气中的CO2浓度、全球碳循环和碳平衡也会产生显著影响。不仅气候变化和生态系统中植被类型的不同会引起土壤呼吸过程的变化,林龄也是影响森林生态系统碳库动态的一个极为重要的影响因素[2]。随着林龄的变化,森林生态系统的群落结构、物种组成以及物种丰富度都会产生巨大的变化,生物量的积累以及碳分配也会发生变化,进而影响森林生态系统土壤碳库变化和碳吸存潜力[3- 4]。
白桦天然次生林是中国东北地区地带性顶极植被类型—阔叶红松林遭到严重干扰破坏后恢复形成的主要天然次生林类型,广泛分布于全区各地,在森林生态系统碳平衡中占有重要地位[5- 6]。因此,研究白桦次生林土壤呼吸和地下碳贮量随林龄的变化规律及其控制机理,对于准确评估本区森林生态系统的碳收支及大尺度的碳循环模型构建具有非常重要的意义。而目前有关白桦次生林的相关研究多集中为土壤特性[7]、生物量与碳储量[8]及叶面积指数[9]等,直接针对森林动态发育过程中不同林龄白桦天然次生林的土壤碳通量和碳贮量的研究尚未见报道。本研究选择小兴安岭腹地伊春林区3个年龄阶段的白桦天然次生林(年龄序列分别为20,36,82a)为研究对象,旨在揭示不同林龄白桦天然次生林(1)土壤呼吸速率的季节动态变化及其主要环境驱动因子;(2)土壤有机碳含量和碳密度的变化;(3)土壤碳通量的变化及主要影响因素。
1 研究方法
1.1研究地概况
本研究地位于小兴安岭地区南坡北段,丰林国家级自然保护区和五营林业局境内(129°11′—129°18′E,48°07′—48°09′N)。该地区气候属于大陆性季风气候,地带性土壤为暗棕色森林土,平均海拔为338 m。年平均气温为-0.5℃,1月份气温最低,平均为-22.7℃,7月份温度最高,平均为20.4℃,年日照时数为2190h;年降水量625—750 mm,雨量集中于7、8月份,年蒸发量为930 mm,随季节变化,干湿交替比较明显;早霜始于9月中旬,植物生长的无霜期为100—110 d[10]。
该地区白桦群落是原地带性植被——阔叶红松林屡遭人为干扰后经过次生演替而形成的天然次生林。研究样地的主林层均为白桦,其老龄林内已有明显的由红松、云冷杉等组成的演替层。本研究分别选择林分年龄分别为20,36,82a的白桦天然次生林生态系统为研究对象,在每个年龄的群落中随机设置了30m×30m的固定样地进行土壤呼吸速率和碳贮量的测定。2008年采用常规方法进行标准地调查,试验样地概况见表1。

表1 样地的立地状况和植被组成Table 1 Site characteristics and vegetation composition of the sampled plots
1: 白桦Betulaplatyphylla,2: 红松Pinuskoraiensis,3: 暴马丁香Syringaamurensis,4: 兴安落叶松Larixgmelini,5: 鱼鳞云杉Piceajezoensis,6: 刺五加Acanthopanaxsenticosus,7: 山杨Populusdavidiana,8: 紫椴Tiliaamurensis,9: 刺枚蔷薇Rosadahurica,10: 臭冷杉Abiesnephrolepis,11: 东北山梅花Philadelphusschrenkii,12: 瘤枝卫矛Euonymuspauciflorus,13: 糠椴Tiliamandshurica,14: 青楷槭Acertegmentosum,15: 榛子Corylusheterophylla,16: 大青杨Populusussuriensis,17: 稠李Prunuspadus
1.2土壤呼吸速率及相关环境因子的测定
2008年4月下旬在每个样地内随机布设6个内径为10.2cm,高度为6cm的PVC土壤环。将PVC环的底端削尖,压入土壤中,并确定其整个测定期间位置的恒定[11]。在2008年生长季5—10月份期间,采用LI- 6400- 09土壤呼吸室连接到LI- 6400便携式光合分析系统(LI-COR Inc. USA)测定土壤呼吸速率,根据天气的实时状况,约每两个星期测定1次,共测定10次。每次测定的24h前重新检查土壤环的安放是否正常。由于LI- 6400分析仪在低温下难以运行,所以未能测定非生长季内土壤呼吸速率。所有测定基本涵盖了本地区除冬季以外的土壤温度和含水量的季节变化范围。
在进行土壤呼吸速率测定的同时,将土壤热电偶探针(LI- 6400- 09TC)插入土壤环附近的一个点,测定土壤表面10cm处的土壤温度;同时用TDR300(Spectrum Technologies,USA)探针测定0—10cm深度土壤平均体积含水量;土壤温度的动态监测数据由研究样地临近的五营林业气象实验站提供。
1.3土壤有机碳含量和碳密度的测定
2009年8月份,在3个不同林龄白桦天然次生林样地内,随机挖取6个土壤剖面,确定土壤剖面发生层次后,分别在剖面深度0—10 cm,10—20 cm,20—30 cm和30—50 cm处分层取样。用土壤环刀(100 cm3)在每一土层取土样测定土壤容重,每层取3个重复;同时每层另取约500g土壤样品装入土壤袋并带回实验室,用于土壤有机碳(SOC)的测定。仔细剔除环刀内土壤样品中的植物根系和石砾,在105℃烘干24h后,称重并计算土壤容重。样品袋内的土样自然风干后,取部分土样过100目筛,采用重铬酸钾外加热法测定土壤有机碳含量。
土壤有机碳密度是指单位面积一定深度的土层中土壤有机碳的贮量。由于它以土体体积为基础作统计计算,不受面积和土层深度的影响,因此土壤碳密度已成为评价和衡量土壤中有机碳贮量的一个极其重要的指标。某一土层i的有机碳密度(SOCi,kg/m2)的计算公式为:
如果某一土壤剖面由n层组成,那么该土壤剖面的总有机碳密度(SOCt,kg/m2)为:
式中,Ci为土壤有机碳含量(g/kg),Di为土壤容重(g/cm3),Ei为土层厚度(cm),Gi为直径大于2 mm的石砾所占的体积百分比(%)。
1.4数据分析
土壤呼吸速率与土壤温度间的关系采用指数模型模拟[12]:
Rs=R0eβT
(1)
温度敏感性指数Q10模型[13- 14]:
Q10= e10β
(2)
式中,Rs为平均土壤呼吸速率(μmol m-2s-1);T为平均土壤温度(℃);R0为0℃的呼吸速率(μmol m-2s-1);β为温度反应系数。T所能解释的呼吸速率变化用该回归模型的决定系数R2的百分数表示。
生长季期间的土壤表面CO2通量是基于实测的土壤呼吸数据建立的指数函数模型与连续动态监测的土壤温度数据相结合,通过以天为步长累加而得。分别将土壤不同深度的温度与土壤呼吸速率进行相关性拟合,总体来看,土壤呼吸速率与10cm土深处的温度相关性更为紧密(表3),因此选用T10为变量进行土壤表面CO2年通量的估测。
通过3块样地的土壤温度实际观测值和临近气象站同步的观测值进行比较分析,发现二者存在极显著的线性相关关系(P<0.01),表达式如下:
T20= 0.455T0+ 2. 785R2= 0. 975
(3)
T36= 0.584T0+ 4. 683R2= 0. 952
(4)
T82= 0.502T0+ 4. 201R2= 0. 964
(5)
式中,T0代表临近气象站同步观测的土壤10cm深处的温度(℃),T20、T36、T82分别是林龄20、36、82a的白桦天然次生林10cm处土壤温度(℃)。以此依据气象站土壤温度资料可以模拟计算出3个白桦林的同步土壤温度,再利用公式(1)和(2)通过以天为步长累加计算,得出生长季5—10月份的土壤表面CO2通量。
利用单因素方差分析法(one-way ANOVA)比较不同林龄白桦次生林土壤呼吸速率、土壤温度、土壤湿度、土壤有机碳含量、土壤容重、土壤总有机碳碳密度及土壤表面CO2通量差异;采用简单线性回归建立土壤呼吸速率与土壤温度、土壤湿度的关系。统计显著水平若不做说明,均设定为α=0.05。所有数据的图表均由Origin8.0和Microsoft Excel2003分别处理完成,统计分析由SPSS11.5统计分析软件处理完成。
2 结果与分析
2.1不同林龄白桦天然次生林土壤呼吸速率的季节变化特征
生长季内不同林龄白桦林的土壤呼吸基本呈现一致的单峰曲线格局,这与土壤温度的季节变化趋势基本一致(图1)。在生长季初期(5月初)3个白桦林之间的土壤呼吸速率差异较小,变化范围为1.95—2.37μmol m-2s-1。随着土壤温度的升高,土壤呼吸速率随之增加,不同林龄间土壤呼吸速率的差异也逐渐增加,并在7月末和8 月初到达峰值,变化范围为4.72 —6.65μmol m-2s-1,随后土壤呼吸速率逐渐下降。在生长季末期(10月末)不同林龄土壤呼吸速率之间的差异再次变小,变化范围仅为1.43—1.85μmol m-2s-1。
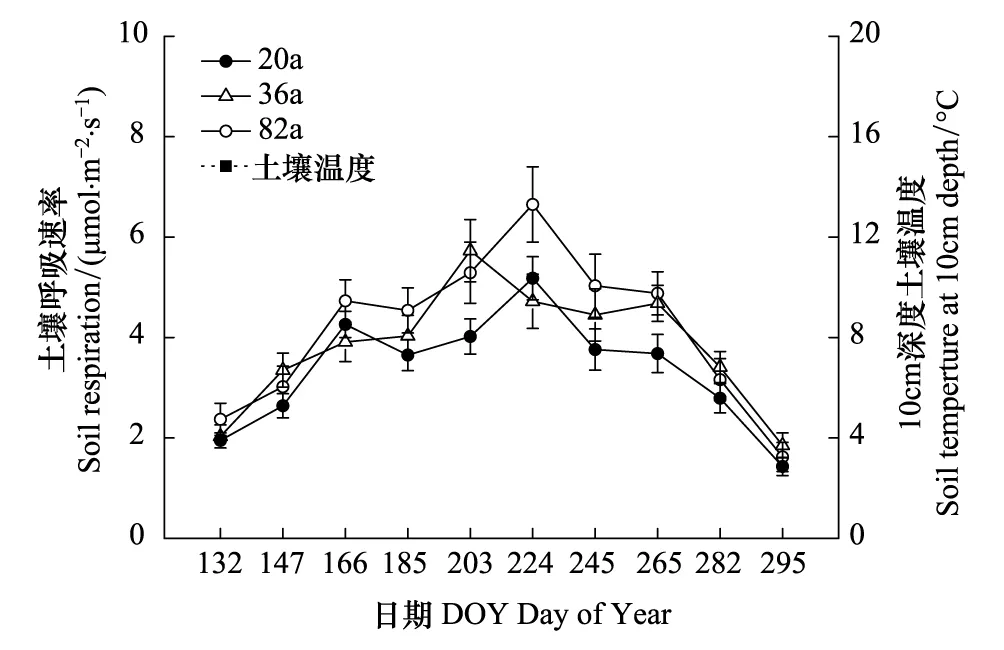
图1 不同林龄白桦天然次生林的土壤呼吸和土壤10cm处土壤温度的季节变化特征Fig.1 Seasonal dynamics of soil respiration rate and soil temperature at the soil depth of 10 cm in the different age stands of Betula platyphyll
表2不同林龄白桦天然次生林的土壤呼吸速率、土壤温度和湿度平均值多重比较
Table 2Duncan′s multiple-range test for the means of soil respiration, soil temperature and moisture in the different age stands ofBetulaplatyphylla
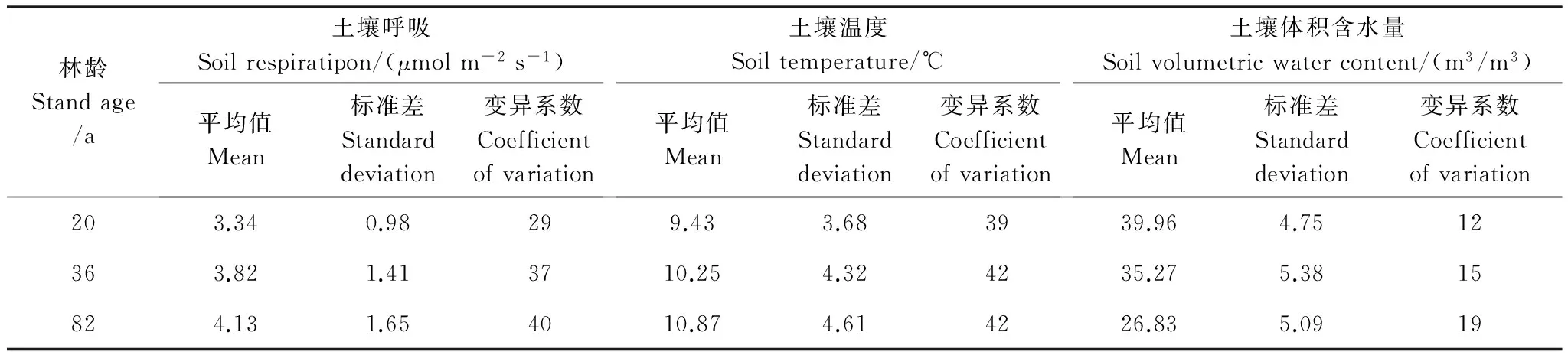
林龄Standage/a土壤呼吸Soilrespiratipon/(μmolm-2s-1)平均值Mean标准差Standarddeviation变异系数Coefficientofvariation土壤温度Soiltemperature/℃平均值Mean标准差Standarddeviation变异系数Coefficientofvariation土壤体积含水量Soilvolumetricwatercontent/(m3/m3)平均值Mean标准差Standarddeviation变异系数Coefficientofvariation203.340.98299.433.683939.964.7512363.821.413710.254.324235.275.3815824.131.654010.874.614226.835.0919
2.2不同林龄白桦天然次生林土壤呼吸速率与环境因子的关系
2.2.1土壤呼吸速率与土壤温度的关系
3个白桦林之间土壤10cm处的平均温度差异不显著(P>0.05)。由生长季内土壤呼吸作用观测结果分析可知,3个白桦林土壤呼吸速率随土壤温度升高均呈指数增加(图2),且二者之间指数关系极显著(P<0.001)。利用土壤温度可以解释不同林龄白桦林土壤呼吸速率86%—92%的变异(图2)。

图2 不同林龄白桦天然次生林的土壤呼吸速率和10cm深处的土壤温度、土壤体积含水率的关系Fig.2 The relationships between soil respiration rate and soil temperature, soil volumetric water content at 10cmdepth in the different age stands of Betula platyphylla
由土壤呼吸与林内土壤各层次温度之间的指数关系回归分析可知(表3),3个林龄样地的土壤呼吸速率与其土壤 2、5、10和15cm处的温度都极显著相关(P<0.001)。生长季内20、36、82a白桦天然次生林样地2、5、10和15cm处的土壤温度变化分别解释了其土壤呼吸速率67.5%—74.3%,78.8%—83.5%,82.8%—92.1%,76.8%—80.4%的变异,表明土壤温度是控制该地区白桦天然次生林土壤呼吸变化的主要环境因子之一。
为了探讨温度对土壤呼吸及其敏感性(Q10)的影响,本文通过公式(2)来计算Q10值,结果表明(图2),随着林龄的增加,Q10值呈递增的趋势,林龄20、36、82a白桦天然次生林10cm处的Q10值依次为 2.64、2.91和3.35。

表3 不同林龄白桦天然次生林内不同深度的土壤温度与土壤呼吸速率的关系Table 3 Correlation coefficients of soil respiration with soil temperature at different depths in the different age stands of Betula platyphylla
2.2.2土壤呼吸速率与土壤湿度的关系
不同林龄白桦林的0—10cm深度土壤平均体积含水量差异显著(P<0.05)(表2),且3个林龄白桦林土壤含水量的季节动态没有明显的规律性(图2),与林地的土壤呼吸速率变化规律不一致。相关分析表明,对整个生长季而言,土壤含水量对土壤呼吸作用的影响并不显著(P>0.05),但在36a白桦林内当土壤体积含水量达到35%—40%时,土壤呼吸速率略呈下降的趋势,说明土壤含水率过高可能会对土壤呼吸产生抑制作用;而在82a白桦林内当土壤体积含水率变化范围在30%—54%之间时,土壤呼吸速率则表现出随土壤水分含量升高而增加的趋势(图2)。
2.3不同林龄白桦天然次生林土壤有机碳含量和土壤容重的变化
不同林龄白桦林的SOC总含量和各土层的SOC含量平均值之间均存在显著差异(P<0.01)(表4)。随着林龄的增加,SOC总含量亦随之增加,20、36、82a林分的变化范围分别为13.11—79.41 g/kg,19.94—97.84 g/kg,21.17—106.53 g/kg(表4)。就各土层的平均SOC含量来说,0—10 cm,10—20 cm,20—30 cm和30—50 cm 4个层次的最大值分别出现在82a(106.53g/kg),82a(62.29g/kg),36a(49.89g/kg),82a(21.17g/kg)白桦林中。
在测定的0—50cm深度范围内,土壤容重随土壤深度的增加而增大,其总体平均值变化范围为0.68—1.43 g/cm3。而SOC含量则随土壤深度的增加而减小,其中各层变化幅度最大的是82a白桦林,最小的是20a白桦林。
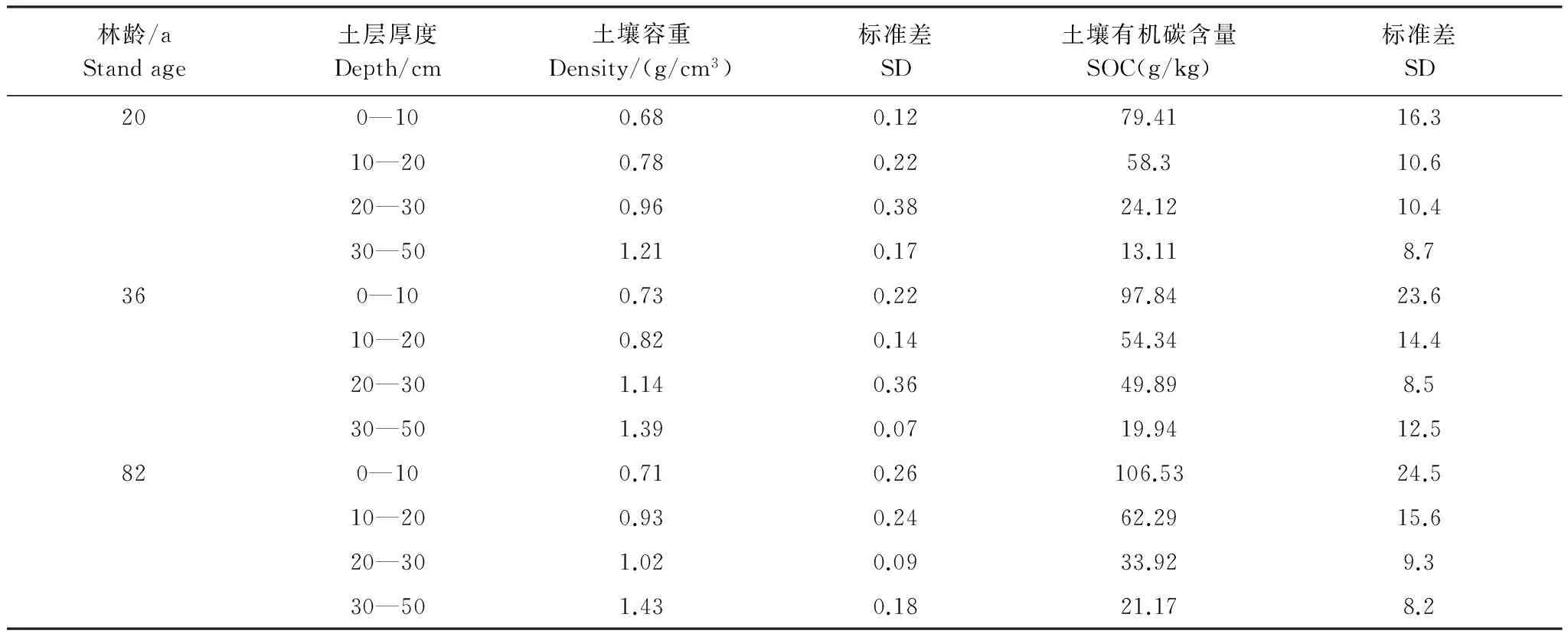
表4 不同林龄白桦天然次生林的土壤容重和有机碳含量Table 4 Comparison of soil bulk density and soil organic carbon (SOC) content in the different age stands of Betula platyphylla
2.4不同林龄白桦天然次生林土壤有机碳密度的变化
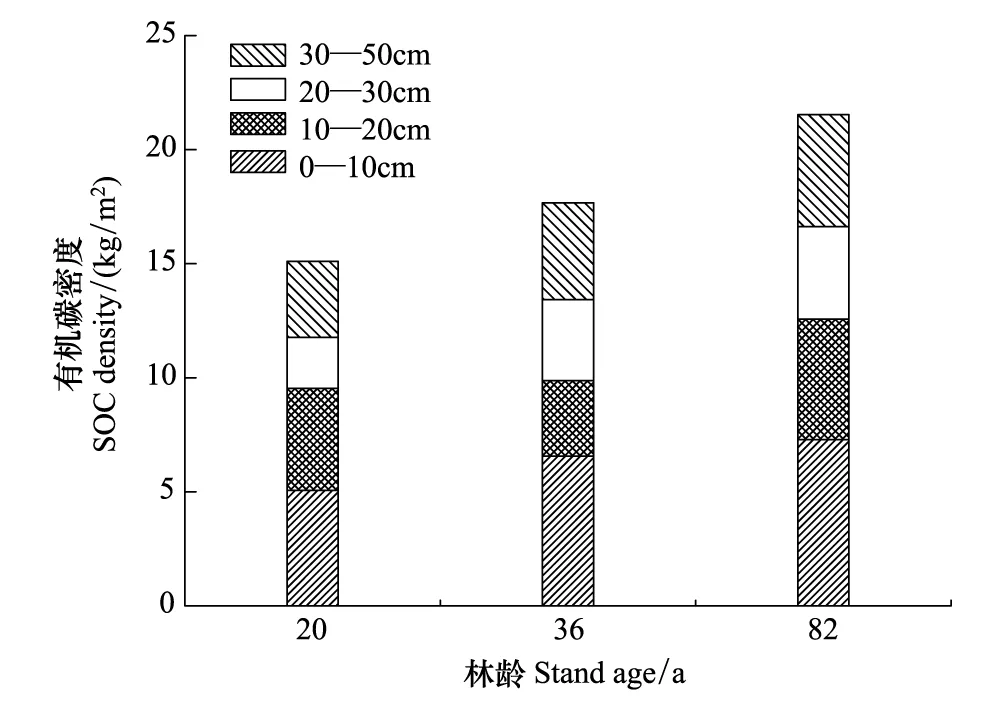
图3 不同林龄白桦天然次生林的土壤有机碳密度比较Fig.3 Comparison of the soil organic carbon density in the different age stands of Betula platyphylla
不同林龄白桦林的SOC总密度差异显著(P<0.05)(图3)。随着林龄的增加,SOC总密度亦递增,20、36、82a林分的SOC总密度含量分别为15.1kg/m2,17.67 kg/m2和21.53 kg/m2(图3)。不同林龄之间0—10cm土层的SOC密度存在显著差异(P<0.01),波动范围为5.06—7.29 kg/m2,而10—20 cm和20—30 cm土层的SOC密度差异不显著(P>0.05),波动范围分别为3.31—5.28 kg/m2和2.24—4.05 kg/m2;30—50cm土层的SOC密度存在显著差异(P<0.01),波动范围为3.33—4.91 kg/m2(图3)。
2.5不同林龄白桦天然次生林生长季内土壤表面CO2通量和有机碳密度之间的关系
用以10cm深处的土壤温度(℃)为自变量建立起来的土壤呼吸速率统计模型来估测整个生长季内土壤表面CO2通量,20、36、82a林分的土壤表面CO2年通量分别为740、768和809gC m-2a-1。相关分析表明,不同林龄土壤表面CO2年通量和0—20cm土层的SOC密度之间均存在显著的正相关关系(P<0.01),但其相关程度因土层而异,其中与0—10cm土层的SOC密度相关最为密切(R2=0.908)。
3 讨论
3.1不同林龄白桦天然次生林土壤呼吸速率的季节变化及其主要环境驱动因子
本研究中3个林龄白桦天然次生林的土壤呼吸呈现一致的单峰曲线格局,具有明显的季节特征,即在生长季旺盛的夏季呼吸速率最高,而在生长季初期和末期呼吸速率最低,与土壤温度变化趋势一致。这表明土壤温度是影响小兴安岭不同林龄白桦天然次生林土壤呼吸速率的关键因子,本研究中二者之间极显著的指数关系(P<0.001)(图2)也证明了此点。这与其它温带森林的研究结果相一致[2,15- 17]。Vose等人认为,土壤温度主要是通过影响土壤微生物活性和植物呼吸酶的活性,进而影响土壤呼吸速率[18]。黄看看等人也发现,土壤温度在0—35℃之间时,土壤微生物的活性以及植物根系呼吸酶的活性会随着土壤温度的升高而加强[19],此时土壤呼吸速率会随着温度的增高而增强。
Q10通常是被用来表示土壤呼吸对温度变化敏感程度的一个重要指标[20]。这一指标也反映了温度升高后,土壤呼吸作用的相应规律,对于了解未来气候变化条件下森林生态系统中土壤呼吸速率的变化规律具有重要的参考意义。本研究中3个林龄白桦天然次生林的平均Q10值大于全球范围各种生态系统土壤呼吸Q10值的中位值2.4[21],且其值随着林龄的增加而增加(图2),这与其它研究结果相一致[15,22],也证明了该地区是对气候变化敏感的区域。
此外,土壤水分状况也是影响森林生态系统土壤呼吸速率的又一个重要环境因子[23- 24],但是由于在野外条件下土壤温度和湿度的相互交叉和互逆,所以难以独立区分及其效应。当土壤水分含量充足而不成为限制因子时,土壤呼吸与土壤温度呈正相关;而在水分成为限制因子的干旱或半干旱地区,土壤呼吸往往受到土壤温湿度的共同影响[25]。本研究结果表明,尽管从统计学意义上来说,土壤体积含水率对土壤呼吸速率的影响并不显著,但也发现在36a白桦林中,当土壤含水率过高时,土壤呼吸速率有降低的趋势,表明土壤过高的含水量可能抑制土壤微生物呼吸和根系呼吸,从而使土壤呼吸速率降低,但限于观测样本的次数较少,其阈值确定需要进一步的研究。
3.2不同林龄白桦次生林土壤表面CO2年通量及其影响因子
本研究中白桦天然次生林土壤表面CO2年通量波动在740—809gC m-2a-1之间,处于大多数温带阔叶森林的研究结果范围之内,其变化范围为122—1754gC m-2a-1[21,26]。本文的研究结果表明,白桦天然次生林的土壤表面CO2年通量随林龄的增加而增加,这与其他研究结果相一致。Irvine和Law[27]以及闫俊华[28]等人的研究表明土壤表面CO2年通量与林地凋落物产量之间呈现显著的正相关关系,随着林龄的增加,林地上凋落物产量亦增加,因此较高的生产力和丰富的易分解碎屑,刺激了土壤微生物活性,并为异养呼吸提供了大量的底物,进而间接地增大了土壤表面CO2年通量。
此外,在温度和土壤水分相对稳定的情况下, 土壤的物理和化学性质是影响土壤表面CO2年通量的重要因素[29- 31]。本研究中土壤表面CO2年通量与土壤0—10cm和10—20cm土层的SOC密度之间存在显著的正相关关系,这与耿远波等[32]对内蒙古草原和杨金艳[11]对温带森林的研究结论相似。究其原因可能是:(1)该层土壤位于土壤表层,具有较高的土壤温度,尤其是0—10cm层,有利于土壤生物和微生物的代谢活动,而土壤微生物是土壤异养呼吸的主要组分之一[15,20,25]。(2)该层土壤有较高的土壤有机碳含量,土壤活性碳含量所占比例较大,有利于土壤有机碳的分解[20,33- 34],有机碳的分解也是土壤向大气释放CO2的主要形式之一。(3)该层土壤中分布有大量的根系,尤其是生理活动相对较为活跃的细根,而细根呼吸是土壤自养呼吸的组分之一[20,35]。
3.3不同林龄白桦天然次生林土壤有机碳含量和密度的变化
小兴安岭不同林龄白桦天然次生林的SOC总含量波动在43.74—55.98 g/kg。在同一生态系统中,SOC含量随土壤深度的增加而减小(表4)。这与以前的研究结果相符合[36]。Jobbagy G等人[37]研究指出,植物根系的分布直接影响SOC的垂直分布,这主要是因为根系的周转为土壤提供了丰富的碳源。另一方面,大量的地表凋落物也是SOC重要的碳源物质,因此凋落物分解速率的差异也是造成同一生态系统各土层SOC含量不同的另一可能原因[38]。
随着森林演替的进行,白桦天然次生林的SOC总含量和密度均随林龄的增加呈递增的趋势。此研究结果与杨丽韫等[39]对长白山不同演替阶段的地下碳储量的研究结果一致。这可能是因为随着次生林的生长,凋落物的种类和数量逐渐增加[40],改变了土壤微生物群落结构[41],从而加快了凋落物分解速率[42],增加了土壤可利用的碳源,造成土壤有机碳的积累[43]。
然而,纵观目前的土壤有机碳密度研究结果,其变异非常大,存在极大的不确定性。除了受研究方法的不统一,如土壤分类、剖面分析、土壤参数估计、土壤厚度及土壤容重数据的估算方法的限制外,还受到植被类型、土地利用、农田管理及林龄的影响,这些因素势必影响到土壤碳的动态变化[31,39]。因此确定统一、规范的测定方法也是今后土壤碳研究中的重要课题之一。
4 结论
生长季内不同林龄白桦天然次生林的土壤呼吸呈现一致的单峰曲线格局, 样地平均土壤呼吸速率随着林龄的增加呈上升趋势,依次为3.34、3.82、4.13μmol m-2s-1;土壤温度是控制该地区白桦天然次生林土壤呼吸变化的主要环境因子之一,二者之间指数关系极显著(P<0.001),利用土壤温度可以解释不同林龄白桦林土壤呼吸速率86%—92%的变异,其中10cm处土壤温度的变化能够最好地解释生长季内土壤呼吸的变化;土壤含水量对土壤呼吸作用的影响并不显著(P>0.05)。
随着林龄的增加,SOC总含量随之增加,SOC总密度亦递增,20、36、82a林分的SOC总密度大小分别为15.1、17.67 kg/m2和21.53 kg/m2;土壤表面CO2年通量随林龄的增加而增加,20、36、82a林分别为740、768和809gC m-2a-1;不同林龄土壤表面CO2年通量和0—20cm土层的SOC密度之间存在显著的正相关关系(P<0.01),其中与0—10cm土层的SOC密度相关最为密切(R2=0.908)。
致谢:本研究得到黑龙江省丰林国家级自然保护区科学技术室的宋国华主任和王全波副主任的大力支持,特此致谢。
[1]Raich J W, Potter C S. Global patterns of carbon dioxide emissions from soils. Global Biochemical Cycles, 1995, 9(1): 23- 36.
[2]Tang J W, Bolstad P V, Martin J G. Soil carbon fluxes and stocks in a Great Lakes forest chronosequence. Global Change Biology, 2009, 15(1): 145- 155.
[3]FeldPauseh T R, Rondon M A, Femandes E C M,Riha S J, Wandelli E. Carbon and nutrient accumulation in secondary forests regenerating on pasturesin central Amazonia.Ecological Applications, 2004, 14(S4): 164- 176.
[4]De Kovel C G F, Van Mierlo A E M, Wilms Y J O, Berendes F. Carbon and nitrogen in soil and vegetation at sites differing in successional age. Plant Ecology, 2000, 149(1): 43- 50.
[5]陈大珂, 周晓峰, 丁宝永, 祝宁, 王义弘, 赵惠勋, 鞠永贵, 金永岩. 黑龙江省天然次生林研究(I)——栽针保阔的经营途径. 东北林学院学报, 1984, 12(4): 1- 12.
[6]于振良, 赵士洞, 王庆礼, 翟永华. 长白山阔叶红松林带内杨桦林动态模拟. 应用生态学报, 1997, 8(5): 455- 458.
[7]李文影, 满秀玲, 张阳武. 不同林龄白桦次生林土壤特性及其水源涵养功能. 中国水土保持科学, 2009, 7(5): 63- 69.
[8]宋熙龙, 毕君, 刘峰, 王超. 木兰林管局白桦次生林生物量与碳储量研究. 北京林业大学学报, 2010, 32(6): 33- 36.
[9]刘志理, 金光泽. 小兴安岭白桦次生林叶面积指数的估测. 生态学报, 2013, 33(8): 2505- 2513.
[10]孙冰, 杨国亭, 李弘, 马瑞萍. 白桦种群的年龄结构及其群落演替. 东北林业大学学报, 1994, 22(3): 43- 48.
[11]杨金艳, 王传宽. 土壤水热条件对东北森林土壤表面CO2通量的影响. 植物生态学报, 2006, 30(2): 286- 294.
[12]Luo Y Q, Wan S Q, Hui D F, WallaceL L. Acclimatization of soil respiration to warming in a tall grass prairie. Nature, 2001, 413(6856): 622- 625.
[13]Richard D B, Knute J N, Richard D B, Jerry M M, Jason B G. Contributions of aboveground litter, belowground litter, and root respiration to total soil respiration in a temperate mixed hardwood forest. Canadian Journal of Forest Research, 1993, 23(7): 1402- 1407.
[14]Rey A, Pegoraro E, Tedeschi V, De Parri I, Jarvis P G, Valentini R. Annual variation in soil respiration and its components in a coppice oak forest in central Italy. Global Change Biology, 2002, 8(9): 851- 866.
[15]Luan J W, Liu S R, Wang J X, Zhu X L, Shi Z M. Rhizospheric and heterotrophic respiration of a warm-temperate oak chronosequence in China. Soil Biology and Biochemistry, 2011, 43(3): 501- 512.
[16]Russell C A, Voroney R P. Carbon dioxide efflux from the floor of a boreal aspen forest. I. Relationship to environmental variables and estimates of Crespired. Canadian Journal of Soil Science, 1998, 78(2): 301- 310.
[17]Savin M C, Gorres J H, Neher D A, Amador J A. Biogeophysical factors influencing soil respiration and mineral nitrogen content in an old field soil. Soil Biology and Biochemistry, 2001, 33(4): 429- 438.
[18]Vose J M, Ryan M G. Seasonal respiration of foliage, fine roots, and woody tissues in relation to growth, tissue N, and photosynthesis. Global Change Biology, 2002, 8(2): 182- 193.
[19]黄看看, 李吉跃, 张学利, 张金娥. 土壤呼吸影响因素研究进展. 内蒙古林业调查设计, 2008,31(2): 98- 100.
[20]Xu M, Qi Y. Soil-surface CO2efflux and its spatial and temporal variations in a young ponderosa pine plantation in northern California.Global Change Biology, 2001, 7(6): 667- 677.
[21]Raich J W, Schlesinger W H. The global carbon dioxide flux in soil respiration and its relationship to vegetation and climate.TellusB, 1992, 44(2):81- 90.
[22]吴鹏, 崔迎春, 杨婷, 丁访军, 陈骏,朱军. 茂兰喀斯特森林主要演替群落土壤呼吸研究. 南京林业大学学报: 自然科学版, 2013, 37(4): 57- 62.
[23]Davidson E A, Belk E, Boone R D. Soil water content and temperature as independent or confounded factors controlling soil respiration in a temperate mixed hardwood forest. Global Change Biology, 1998, 4(2): 217- 227.
[24]Wang C K, Yang J Y, Zhang Q Z. Soil respiration in six temperate forests in China. Global Change Biology, 2006, 12(11): 2103- 2114.
[25]刘绍辉, 方精云. 土壤呼吸的影响因素及全球尺度下温度的影响. 生态学报, 1997, 17(5): 469- 476.
[26]Bond-Lamberty B, Wang C K, Gower S T. A global relationship between the heterotrophic and autotrophic components of soil respiration? Global Change Biology, 2004, 10(10): 1756- 1766.
[27]Irvine J, Law B E. Contrasting soil respiration in young and old-growth ponderosa pine forests. Global Change Biology, 2002, 8(12): 1183- 1194.
[28]Yan J H, Wang Y P, Zhou G Y, Zhang D Q. Estimates of soil respiration and net primary production of three forests at different succession stages in South China.Global Change Biology, 2006, 12(5): 810-821.
[29]Boudot J P, Hadj B A, Choné T. Carbon mineralization in Andosols and aluminium-rich highland soils. Soil Biology and Biochemistry, 1986, 18(4): 457- 461.
[30]Fang C, Moncrieff J B. A Model for soil CO2production and transport: Model development. Agricultural and Forest Meteorology, 1999, 95(4): 225- 236.
[31]Priess J A, de Koning G H J, Veldkamp A. Assessment of interactions between land use change and carbon and nutrient fluxes in Ecuador. Agriculture Ecosystems and Environment, 2001, 85(1): 269- 279.
[32]GengY B, Zhang S, DongY S, Meng W Q, Qi Y C, Chen Z Z, Wang Y F.The content of soil organic carbon and total nitrogen and correlactivity between their content and fluxes of CO2, N2O and CH4in Xilin River Basin Steppe.Acta Geographica Sinica, 2001, 56(1): 44- 53.
[33]李凌浩, 韩兴国, 王其兵, 陈全胜, 张焱, 杨晶, 白文明, 宋世环, 邢雪荣, 张淑敏. 锡林河流域一个放牧草原群落中根系呼吸占土壤总呼吸比例的初步估计. 植物生态学报, 2002, 26(1): 29- 32.
[34]Xu A, Zhou Y, Ruan HH, Luo Y Q, Wang J S. Temperature sensitivity increases with soil organic carbon recalcitrance along an elevational gradient in the Wuyi Mountains, China. Soil Biology and Biochemistry, 2010, 42(10): 1811- 1815.
[35]Burke M K,Raynal D J. Fine root growth phenology, production, and turnover in northern hardwood forest ecosystems. Plant and Soil, 1994, 162(1): 135- 146.
[36]Sun W X, Shi X Z, Yu D S, Wang K, Wang H J. Estimation of soil organic carbon density and storage of northeast China.Acta Pedologica Sinica, 2004, 41(2): 298- 301.
[37]Jobbagy E G, Jackson R B. The vertical distribution of soil organic carbon and it′s relation to climate and vegetation. Ecological Applications, 2002, 10(2): 423- 436.
[38]Lavado R S, Sierra J O, Hashimoto P N. Impact of grazing on soil nutrients in a Pampean grassland.Journal of Range Management, 1996, 49(5): 452- 457.
[39]杨丽韫, 罗天祥, 吴松涛. 长白山原始阔叶红松林不同演替阶段地下生物量与碳、氮贮量的比较. 应用生态学报, 2005, 16(7): 1195- 1199.
[40]张庆费, 宋永昌, 吴化前, 由文辉. 浙江天童常绿阔叶林演替过程凋落物数量及分解动态. 植物生态学报, 1999, 23(3):250- 255.
[41]王清奎. 碳输入方式对森林土壤碳库和碳循环的影响研究进展. 应用生态学报, 2011, 22(4):1075- 1081.
[42]侯玲玲, 孙涛, 毛子军, 吕海亮, 赵娟, 宋元. 小兴安岭不同林龄天然次生白桦林凋落物分解及养分变化. 植物研究, 2012, 32(4): 492- 496.
[43]黄靖宇,宋长春, 张金波, 郭跃东, 廖玉静. 凋落物输入对三江平原弃耕农田土壤基础呼吸和活性碳组分的影响. 生态学报, 2008, 28(7): 3417- 3424.
Soil organic carbon stocks and fluxes in different age stands of secondaryBetulaplatyphyllain Xiaoxing′an Mountain,China
HAN Yingying, HUANG Wei, SUN Tao, LU Bin, MAO Zijun*
KeyLaboratoryofForestPlantEcologyofMinistryofEducation,NortheastForestryUniversity,Harbin150040,China
Soil respiration, known as the second largest componentof carbon dioxide flux between terrestrial ecosystems and the atmosphere,is sensitive to climate, vegetation type as well as forest age. In order to simulate the long-term forest carbon dynamics and its impact on climate system, we need to understand the successional status of carbon dynamics more than learn the responses of forest ecosystems to the changing climate. However,in spite of its significant role in determining the distribution of carbon pools and fluxes in different forest ecosystems, the effect of age on forest carbon fluxes great is uncertain. Soil temperature and soil water content are recognized as the main factors controlling the temporal variation of soil respiration. In this paper, soil carbon dynamic was measured in different age stands of SecondaryBetulaplatyphylla(20a, 36a, 82a) in Xiaoxing′an Mountain, China. Soil respiration measurements were conducted using a LI- 6400- 09 soil CO2flux system from May to October in 2008. Besides, We measured soil organic carbon content (g/kg) and bulk density (g/cm3) at four layers across the chronosequence in August 2009. Our specific objectives were to: (1) compare the cumulative soil respiration during the growing season for the different age stands of SecondaryBetulaplatyphylla, (2) quantify soil organic carbon (SOC) contents and SOC density and (3) establish quantitative relationships between soil carbon fluxes and SOC density for the three forest ecosystems. Our results showed that the seasonality of soil respiration was driven mainly by soil temperature with the peak appeared in August,and was roughly consistent with that of soil temperature. Soil temperature at 10 cm could explain 86% —92% of the variation of soil respiration for the 3 different age stands of SecondaryBetulaplatyphylla. And the soil volumetric water content was not significantly correlated with soil respiration rate and it was not a key factor to soil respiration. We fitted site-based models and used continuous measurements of soil temperature to estimate cumulative soil respiration for the growing season of 2008 (days 132—295). Cumulative soil respiration in the growing season was estimated to be 740、768 and 809 C m- 2a-1in the 20a, 36a and 82aBetulaplatyphylla, respectively. Both, cumulative soil respiration andQ10increased during stand establishment.Q10was estimated to be 2.64, 2.91and 3.35 in the 20a, 36a and 82aBetulaplatyphylla, respectively. Both, total soil organic carbon (SOC) contents and SOC density at 0—50 cm increased during stand establishment, but decreased with soil depth. SOC was estimated to be 43.75, 47.72 and 55.96 g/kg for the three forest ecosystems. Meanwhile, the figures were 14.7, 18.1 and 18.7 kg/m2for SOC density in the 20a, 36a and 82aBetulaplatyphylla, respectively. Soil surface carbon flux was positively correlated to SOC content (P<0.01), and the significance level of the correlation depended on soil depth, and the soil carbon flux was more positively correlated to SOC concentration at the depth of 0—10 cm(R2=0.908) .
stand age; secondaryBetulaplatyphylla; soil carbon flux; soil organic carbon stock
国家自然科学基金项目(31270494, 31070350); 国家“973”重点基础研究项目发展计划项目(2010CB951301)
2014- 03- 11;
日期:2014- 10- 23
10.5846/stxb201403110418
*通讯作者Corresponding author.E-mail: zijunm@nefu.edu.cn
韩营营, 黄唯, 孙涛, 陆彬, 毛子军.不同林龄白桦天然次生林土壤碳通量和有机碳储量.生态学报,2015,35(5):1460- 1469.
Han Y Y, Huang W, Sun T, Lu B, Mao Z J.Soil organic carbon stocks and fluxes in different age stands of secondaryBetulaplatyphyllain Xiaoxing′an Mountain,China.Acta Ecologica Sinica,2015,35(5):1460- 1469.

