尾鳍缺失和恢复生长对不同生境的两种鲤科鱼类快速启动游泳能力的影响
闫东娟, 曹振东, 付世建
重庆师范大学, 进化生理与行为学实验室, 动物生物学重庆市重点实验室, 重庆 401331
尾鳍缺失和恢复生长对不同生境的两种鲤科鱼类快速启动游泳能力的影响
闫东娟, 曹振东, 付世建*
重庆师范大学, 进化生理与行为学实验室, 动物生物学重庆市重点实验室, 重庆 401331
为了考查尾鳍切除及其恢复生长对偏好静水环境的鲫鱼(Carassiusauratus)与偏好激流环境的宽鳍鱲(Zaccoplatypus)两种鲤科鱼类快速启动游泳能力的影响,将鲫鱼幼鱼((6.34 ± 0.02) cm)和宽鳍鱲幼鱼((6.26 ± 0.12) cm)各16尾,其中8尾在(25.0 ± 0.5) ℃的条件下分别进行尾鳍切除、20 d恢复生长、再次切除处理,另外8尾作为对照组;测量计算两种实验鱼的相关形态参数并采用电刺激方式,通过高速摄像机获取实验鱼的影像资料,分析计算后获得快速启动相关参数。结果显示:鲫鱼的细度比(FR)显著小于宽鳍鱲(P< 0.01),尾鳍指数(FI)却显著大于宽鳍鱲(P<0.01),两种实验鱼的快速启动最大线速度(Vmax)、移动距离(d)、相对旋转半径(RTr)和弯曲指数(BC)均无显著差异;尾鳍切除后,两种实验鱼快速启动的Vmax、d和RTr与正常组相比均呈现显著下降(P<0.01),其中鲫鱼Vmax下降39%而宽鳍鱲下降24%;经过20 d的恢复生长,两种实验鱼的尾鳍面积均恢复至切除前的60%,而快速启动的Vmax、d、RTr和BC却与正常组(同样经过20 d生长)无显著差异;尾鳍再次切除后与正常组相比,鲫鱼和宽鳍鱲Vmax的下降幅度(17%和9%)与首次切除后的(39%和24%)相比均呈现降低的趋势,其中鲫鱼的下降幅度更大;尾鳍再次切除后与正常组相比,宽鳍鱲的BC显著增大(P= 0.046)。结果表明:(1)鲫鱼尾鳍对快速启动能力的作用大于宽鳍鱲;(2)而偏好急流环境的宽鳍鱲经过恢复生长表现出更加明显的功能补偿现象。
尾鳍切除; 再生; 鲤科鱼类; 快速启动游泳能力; 生境
鱼类为满足不同生境的运动需求,经过长期适应性进化会出现体型特化的现象[1-2]。自然界水体的水流速度存在较大的差异,水流速度在鱼类表型进化过程中常常起着关键作用,偏好激流环境的鱼类具有较强的持续游泳能力,体型通常更趋向流线型[3-4];而在缓流或静水水体中生存的鱼类,运动更加灵活,具有较大的体高[1-2,5]。快速启动是鱼类面临捕食或逃逸时所采用的一种迅速而短暂的加速运动方式,尽管这种运动方式持续时间很短,移动距离也有限,然而对鱼类在各种环境下的生存和生长却至关重要[6]。根据快速启动过程中首次肌肉收缩结束时鱼体姿态的不同,可将其划分为“C”型和“S”型启动[6],多数鱼类通常表现为“C”型启动方式[7]。
不同种类鱼的尾鳍大小和形状不尽相同。尾鳍作为鱼类运动系统的重要器官在游泳过程中具有推进及导向等重要作用[8],其大小和形状在很大程度上影响鱼类的游泳能力[9],较大的尾鳍面积和较低尾鳍纵横比有助于鱼类的快速启动游泳能力[1,10]。由于种内的争斗[11]、种间捕食[12]以及病原体感染[13]等均会导致尾鳍的部分缺失,进而导致鱼类运动能力的下降[12,14]。不同鱼类尾鳍缺失后的运动能力下降的程度存在明显差异[15-16]。为了揭示生活在不同水流环境中两种鲤科鱼的尾鳍对运动能力的影响,本研究选用生活在宽阔水体中的鲫鱼与偏好急流环境的宽鳍鱲为实验对象,考查其尾鳍形态的差异及尾鳍切除对快速启动游泳能力的影响。
鱼类尾鳍缺失后会在一段时间内通过组织增生使缺失部分能够在一定程度上得以恢复[17-18]。鱼类尾鳍恢复生长及其对运动能力影响的相关资料鲜有报道。为了比较两种实验鱼的尾鳍恢复能力,考查恢复生长的尾鳍对快速启动运动能力的影响;本研究将实验鱼恢复生长一段时间后,测量恢复生长的尾鳍面积并再次评估恢复生长的尾鳍对两种实验鱼快速启动运动能力的影响。
本实验选取鲤科鱼类宽鳍鱲和鲫鱼为研究对象,通过尾鳍切除、20 d恢复生长、再次切除处理;测量并计算两种实验鱼的相关形态参数;并采用电刺激方式,通过高速摄像机获取实验鱼的影像资料,分析计算后获得快速启动相关参数,以揭示不同水流生境的两种鱼类尾鳍在快速启动过程中的作用,考查恢复生长情况及相关功能的变化。
1 材料和方法
1.1 实验鱼的来源及驯化
宽鳍鱲捕捉于野外,鲫鱼购于重庆市北碚区歇马镇养殖场。将两种鱼放入实验室自净化循环控温水槽(1.2 m × 0.55 m × 0.55 m,实际水量250 L)驯养2周,期间以曝气后的自来水作为实验用水,日换水量约为总水体的10%,驯化温度为(25 ± 0.5)℃,光照周期为14 L: 10 D,溶氧水平 ≥ 7 mgO2/L,每天用商业颗粒饵料饱足投喂实验鱼1次。驯养结束后,分别挑选身体健康、体重和体长接近的两种鲤科鱼各16尾作为实验鱼,实验鱼体重和体长情况如表1。
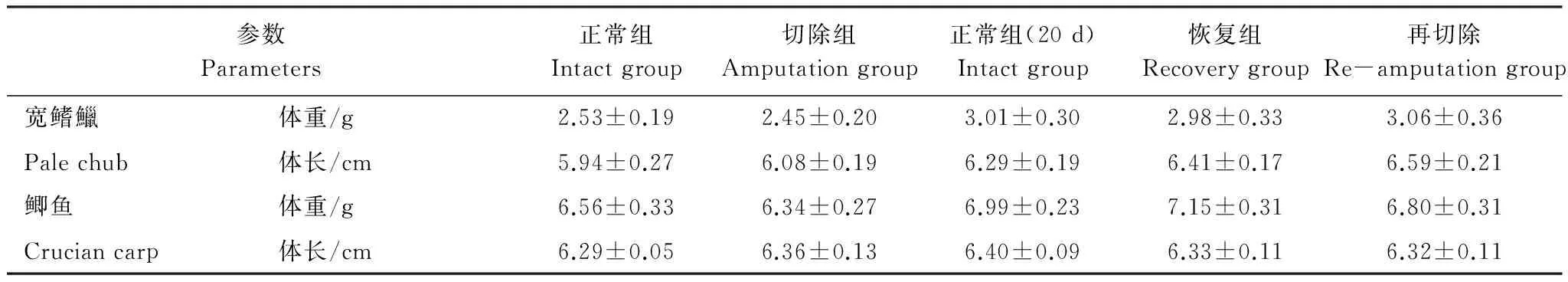
表1 两种实验鱼不同实验组的体重和体长(平均值±标准误, n=8)Table 1 Body mass and body length of different groups of pale chub and crucian carp
1.2 实验方案
随机选取两种实验鱼各16尾,其中8尾分别进行尾鳍切除、20 d恢复生长、再次切除处理,另外8尾作为对照组,对照组的左侧位照片获取形态参数;首次切除处理后的两种实验鱼分别放回水体恢复2 d[19],拍摄整个快速启动过程并计算两种实验鱼快速启动指标;随后进行20 d的恢复生长,20 d后分别测量并计算两种实验鱼尾鳍形态参数及快速启动指标;最后将恢复尾鳍再次切除,并测量快速启动相关指标。实验鱼进行尾鳍切除操作时均采用氨基甲酸乙酯(MS-222,50 mg/L)进行麻醉处理。
1.3 形态参数测量与计算
采用软件(tpsDig2)分析两种实验鱼的左侧位照片,获取两种实验鱼的基础形态指标。通过公式计算两种实验鱼的相关形态参数。
鱼体细度比(FR):
FR=L/H
(1)
式中,L表示鱼体体长,H表示鱼体体高。
尾鳍纵横比(AR):
AR=h2/S尾
(2)
式中,h表示尾鳍高度,S尾表示尾鳍面积。
尾鳍指数(FI):
FI=S尾/L2
(3)
式中,S尾表示尾鳍面积,L表示鱼体体长。
尾鳍相对面积S相对尾:
S相对尾=S尾/(S尾+S侧)
(4)
1.4 快速启动相关参数测量与计算
采用已报道方法[20-21]对两种实验鱼快速启动运动过程进行测定,采用软件(tpsDig2)分析图片并获取实验鱼的质心坐标。用Excel(2003)处理采集的坐标数据,求得两种实验鱼快速启动的最大线速度(Vmax)、移动距离(d)和质心旋转半径(Tr)。Tr的计算公式为[22]:
Tr=D/2cos[(π-θ)/2]
(5)
式中,D为相邻图片质心的移动距离;θ为相邻两个质心坐标的向量夹角。由于质心旋转半径随鱼体体长成比例增加[6],因此采用旋转半径与体长的比值来求得鱼体的相对旋转半径(RTr)。弯曲指数(BC)为实验鱼在快速启动第一阶段末的最大弯曲度,用来反映鱼类提供给快速启动第二阶段推力的大小[23],它的计算公式为[24]:
BC= 1 -CL/L
(6)
式中,BC表示快速启动第一阶段末鱼体弯曲系数;CL表示快速启动第一阶段末鱼体吻段到尾端的长;L表示鱼体体长。
1.5 数据处理
实验数据采用Excel(2003)进行常规计算,采用SPSS(17.0)软件将每种实验鱼各处理组的快速启动参数和两种实验鱼的形态参数进行t-检验,单因素、双因素方差分析;统计数值以平均值±标准误(Mean ± SE)表示,显著性水平规定为P<0.05。
2 结果
2.1 不同水流生境中的两种实验鱼相关形态参数及恢复生长后的变化
宽鳍鱲的FR显著高于鲫鱼(P<0.001)(表2,图1),鲫鱼的尾鳍面积和FI均显著大于宽鳍鱲(P<0.01)。经过20 d的恢复生长两种鱼的AR和FI均显著低于切除前(P<0.001),其中宽鳍鱲和鲫鱼尾鳍面积分别恢复至原面积的62.60%和64.66%。
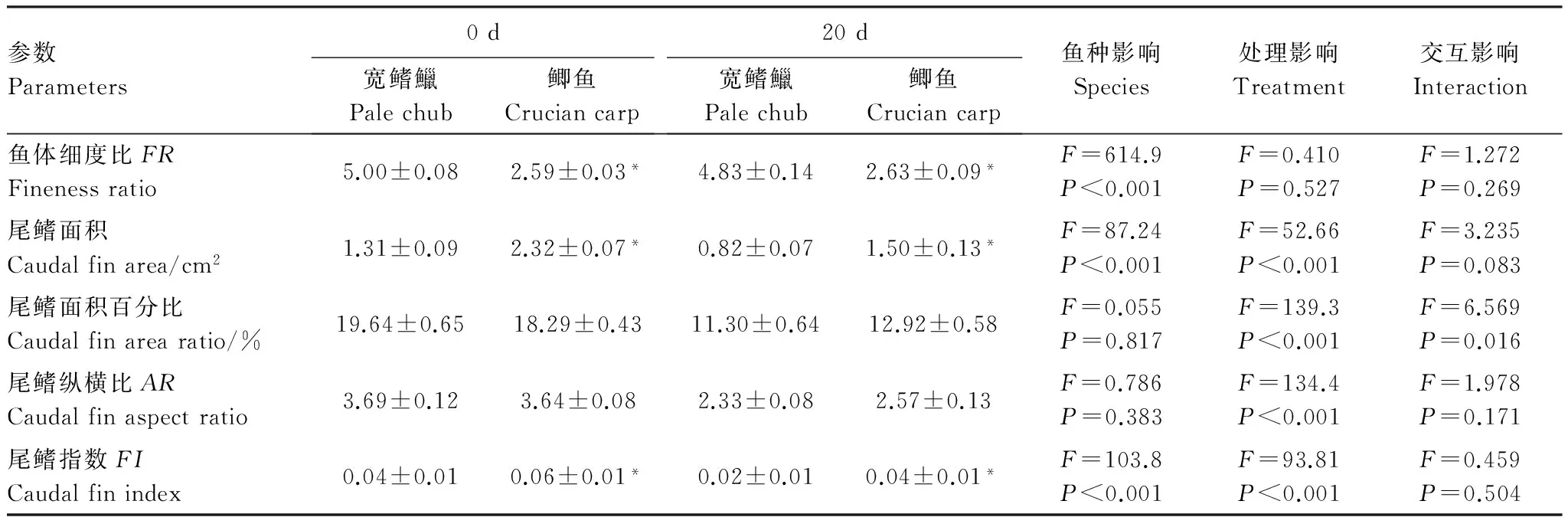
表2 鱼种和尾鳍处理对两种实验鱼形态参数的影响(平均值±标准误,n=8)Table 2 The effects of fish species and treatment on the morphological parameters of pale chub and crucian carp
*同一行数值间差异显著(P< 0.05)

图1 宽鳍鱲和鲫鱼尾鳍完整、尾鳍切除及20 d尾鳍恢复照片Fig.1 The photos of caudal-fin-intact, caudal-fin-lost and 20d-regenerated pale chub and crucian carp
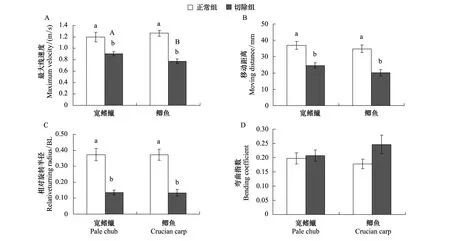
图2 尾鳍切除对两种实验鱼快速启动最大线速度(Vmax)、移动距离(d)、相对旋转半径(TRr)和弯曲指数(BC)的影响(平均值 ± 标准误, n=8)Fig.2 The effect of caudal fin loss on maximum linear velocity (Vmax), moving distance (d), relative turning radius (TRr) and bending coefficient (BC) of fast-start process in pale chub and crucian carp
2.2 尾鳍切除对两种实验鱼快速启动运动参数的影响
两种实验鱼快速启动Vmax、d、RTr和BC均无显著差异(图2)。尾鳍切除后,两种实验鱼快速启动的Vmax、d和RTr均显著下降(P< 0.01),其中宽鳍鱲Vmax、d和TRr的下降幅度分别为24%、33%和62%,鲫鱼的下降幅度分别为39%、42%和65%;尾鳍切除后两种实验鱼的BC与正常组相比均无显著差异(图2)。
2.3 尾鳍恢复生长及其对两种实验鱼快速启动运动参数的影响
经过20 d的恢复生长,宽鳍鱲和鲫鱼的快速启动Vmax、d、RTr和BC与经过20 d生长的正常组相比均无显著差异(图3)。宽鳍鱲恢复组的Vmax和d基本恢复完全,RTr恢复至正常组的89%,鲫鱼恢复组的Vmax、d和RTr分别恢复至正常组的97%、85%和98%。
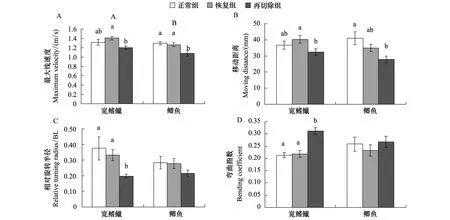
图3 20 d的恢复生长和尾鳍再次切除对两种实验鱼快速启动最大线速度(Vmax)、移动距离(d)、相对旋转半径(TRr) 和弯曲指数(BC)的影响(平均值 ± 标准误,宽鳍鱲正常组n=7,其余均n=8)Fig.3 The 20 d-recovery and caudal fin re-amputation on maximum linear velocity (Vmax), moving distance (d), relative turning radius (TRr) and bending coefficient (BC) in pale chub and crucian carp
2.4 尾鳍再次切除对两种实验鱼快速启动运动参数的影响
尾鳍再次切除后,宽鳍鱲快速启动Vmax、d和RTr与恢复组相比均显著下降(图3)(P<0.05),而BC却显著上升(P= 0.042),鲫鱼仅Vmax呈现显著下降(图3),宽鳍鱲和鲫鱼Vmax的下降幅度分别为14.72%和14.62%;与经过20 d生长的正常组相比,鲫鱼快速启动Vmax和d呈现显著下降(P<0.05),宽鳍鱲和鲫鱼Vmax的下降幅度分别9%和17%,宽鳍鱲的BC显著增加(P= 0.046),而鲫鱼的BC有所增加,但不显著(图3)。
3 讨论
3.1 尾鳍对快速启动游泳能力的影响
一般认为尾鳍面积的缺失使鱼体向前的加速能力降低[9,12]。尾鳍部分切除或全部切除会导致鳊鱼(Parabramispekinensis)、金鱼(Carassiusauratus)、鲤鱼(Cyprinuscarpio)和中华倒刺鲃(Spinibarbussinensis)有氧持续游泳能力下降[16,25];雄性食蚊鱼(Gambusiaholbrooki)在天敌追捕下的无氧爆发游泳速度也会随着尾鳍面积的减小而显著降低[12]。有关尾鳍对快速启动游泳能力的研究鲜有报道,仅在虹鳟(Salmogardneri)的研究发现奇鳍被不同程度切除后,实验鱼的快速启动能力显著下降且与切除面积呈正相关[26]。本研究的两种实验鱼尾鳍切除后快速启动能力均显著下降(图2),可见尾鳍在两种实验鱼的快速启动能力方面起到重要作用。由于水流环境的不同使本研究的两种实验鱼体型产生很大差异,它们的尾鳍相对面积却十分接近。然而在尾鳍缺失后,鲫鱼的Vmax下降幅度为39%而宽鳍鱲仅下降24%,表明鲫鱼的尾鳍在快速启动游泳中起的作用更大。鲫鱼尾鳍在快速启动运动中的作用较大可能与其生存的水环境及由此适应性进化所形成的扁平的体型有关。
鱼类逃逸反应的成功不仅与最大线速度有关,还与鱼类快速启动过程的灵活性有关。RTr是评价鱼类快速启动灵活性的重要指标[27],半径越小则鱼类逃逸的灵活性越高。本研究发现,尾鳍切除后两种实验鱼快速启动的RTr显著下降(图2),出现灵活性明显增加的现象。表明这两种实验鱼尾鳍缺失后,最大速度的下降导致逃逸策略向灵活性增加的方向改变。
3.2 恢复生长对快速启动游泳能力的影响
鳍缺失后鱼类通过组织的增生进行恢复生长[18],以尽快消除产生的不利影响。剽鲈(Etheostomaedwini)右胸鳍或尾鳍半叶进行切除后,两个月后缺失部分可完全恢复生长至初始大小[17]。尽管尾鳍对两种鱼快速启动能力影响不同,本研究的两种实验鱼尾鳍恢复生长速度却没有显著差异(经过20 d的恢复生长尾鳍面积恢复至切除前的62%—64%)。尽管本研究的两种实验鱼尾鳍面积没有完全恢复,但它们的快速启动运动能力却得到了全面恢复(图3)。另外,尾鳍再次切除后与经过20 d生长的正常组相比,宽鳍鱲和鲫鱼的快速启动的Vmax下降幅度(9%和17%)均小于初次尾鳍切除后(24%和39%),由此推论除恢复尾鳍面积作用以外,两种实验鱼还可能存在其他方面的功能补偿,如尾鳍纵横比的显著降低(表2),生理生化功能的显著增强(肌纤维变粗),运动姿态的更加协调等。更为有趣的是,尽管本研究宽鳍鱲和鲫鱼尾鳍(60%)和快速启动能力(100%)的恢复速度相似,然而鲫鱼尾鳍再次切除后快速启动Vmax下降幅度(17%)大于宽鳍鱲(9%),表明宽鳍鱲其他方面的功能补偿作用更大。尾鳍切除后在快速启动能力的行为补偿方面弯曲指数是一个常常被关注的指标,通常认为弯曲指数的增加有助于提高动物的快速启动能力[23-24]。蜥蜴(Euryceabislineata)成体通过增加弯曲指数来补偿因变态导致推力的降低[24];鳊鱼、鲤鱼和中华倒刺鲃在尾鳍半切除和全切除后,通过增大摆幅(弯曲指数增加)来弥补尾鳍切除造成的不利影响[16,25]。本研究显示,尾鳍再次切除后宽鳍鱲的弯曲指数与经过20 d生长的正常组相比呈显著上升(P= 0.046),而鲫鱼的却无显著变化(图3),表明宽鳍鱲尾鳍恢复生长后存在着明显的行为补偿现象。
尾鳍作为主要运动器官对鱼类的运动能力具有重要作用。生活开阔水体中的鲫鱼体型更趋侧扁,尾鳍对快速启动游泳能力的作用更大;而生活在激流环境中的宽鳍鱲体型则更趋细长的流线型,尾鳍恢复生长后的快速启动能力表现出更明显的补偿现象,其中行为补偿可能具有较大的权重。
[1] Langerhans R B, Layman C A, Shokrollahi A M, DeWitt T J. Predator-driven phenotypic diversification inGambusiaaffinis. Evolution, 2004, 58(10): 2305-2318.
[2] Fu S J, Cao Z D, Yan G J, Fu C, Pang X. Integrating environmental variation, predation pressure, phenotypic plasticity and locomotor performance. Oecologia, 2013, 173(2): 343-54.
[3] Langerhans R B, Chapman L J, DeWitt T J. Complex phenotype-environment associations revealed in an East African cyprinid. Journal of Evolutionary Biology, 2007, 20(3): 1171-1181.
[4] Yan G J, He X K, Cao Z D, Fu S J. An interspecific comparison between morphology and swimming performance in Cyprinids. Journal of Evolutionary Biology, 2013, 26(8): 1806-1815.
[5] Haas T C, Blum M J, Heins D C. Morphological responses of a stream fish to water impoundment. Biology Letters, 2010, 6(6): 803-806.
[6] Domenici P, Blake R W. The kinematics and performance of fish fast-start swimming. The Journal of Experimental Biology, 1997, 200(8): 1165-1178.
[7] Domenici P, Batty R S. Escape manoeuvres of schoolingClupeaharengus. Journal of Fish Biology, 1994, 45(SA): 97-110.
[8] Handegard N O, Pedersen G, Brix O. Estimating tail-beat frequency using split-beam echosounders. ICES Journal of Marine Science, 2009, 66(6): 1252-1258.
[9] Plaut I. Critical swimming speed: its ecological relevance. Comparative Biochemistry and Physiology Part A: Molecular and Integrative Physiology, 2001, 131(1): 41-50.
[10] Domenici P, Turesson H, Brodersen J, Brönmark C. Predator-induced morphology enhances escape locomotion in crucian carp. Proceedings of the Royal Society B: Biological Sciences, 2008, 275(1631): 195-201.
[11] Winemiller K O. Caudal eyespots as deterrents against fin predation in the Neoptropical Cichlid cichlidAstronotusocellatus. Copeia, 1990, (3): 665-673.
[12] Sinclair E L E, Ward A J W, Seebacher F. Aggression-induced fin damage modulates trade-offs in burst and endurance swimming performance of mosquitofish. Journal of Zoology, 2011, 283(4): 243-248.
[13] Ziskowski J, Mercaldo-Allen R, Pereira J J, Kuropat C, Goldberg R. The effects of fin rot disease and sampling method on blood chemistry and hematocrit measurements of winter flounder,Pseudopleuronectesamericanusfrom New Haven Harbor (1987—1990). Marine Pollution Bulletin, 2008, 56(4): 740-750.
[14] Ward D L. Effects of marking techniques and handling on swimming ability of Bonytail Chub. Journal of the Arizona-Nevada Academy of Science, 2003, 36(1): 34-36.
[15] Kasapi M, Domenici P, Blake R W, Harper D G. The kinematics and performance of the escape response in the knife fish (Xenomystusnigri). Canadian Journal of Zoology, 1993, 71(1): 189-195.
[16] Fu C, Cao Z D, Fu S J. The effects of caudal fin loss and regeneration on the swimming performance of three cyprinid fish species with different swimming capacities. The Journal of Experimental Biology, 2013, 216(16): 3164-3174.
[17] Champagne C E, Austin J D, Jelks H L, Jordan F. Effects of fin clipping on survival and position-holding behavior of brown darters (Etheostomaedwini). Copeia, 2008, (4): 916-919.
[18] Böckelmann P K, Ochandio B S, Bechara I J. Histological study of the dynamics in epidermis regeneration of the carp tail fin (Cyprinuscarpio, Linnaeus, 1758). Brazilian Journal of Biology, 2010, 70(1): 217-223.
[19] Fu C, Cao Z D, Fu S J. The effects of caudal fin amputation on metabolic interaction between digestion and locomotion in juveniles of three cyprinid fish species with different metabolic modes. Comparative Biochemistry and Physiology Part A: Molecular and Integrative Physiology, 2013, 164(3): 456-465.
[20] 王芳, 曹振东, 付世建, 陈波见. 中华倒刺鲃幼鱼的快速启动与逃逸行为. 生态学杂志, 2010, 29(11): 2181-2186.
[21] Yan G J, He X K, Cao Z D, Fu S J. The trade-off between steady and unsteady swimming performance in six cyprinids at two temperatures. Journal of Thermal Biology, 2012, 37(6): 424-431.
[22] Domenici P, Blake R W. The kinematics and performance of the escape response in the angelfish (Pterophyllumeimekei). The Journal of Experimental Biology, 1991, 156: 187-205.
[23] Webb P W. Fast-start performance and body form in seven species of teleost fish. The Journal of Experimental Biology, 1978, 74: 211-226.
[24] Azizi E, Landberg T. Effects of metamorphosis on the aquatic escape response of the two-lined salamander (Euryceabislineata). The Journal of Experimental Biology, 2002, 205(6): 841-849.
[25] 杨晗, 曹振东, 付世建. 尾鳍切除对鳊鱼幼鱼游泳能力、能量效率与行为的影响. 水生生物学报, 2013, 37(1): 157-163.
[26] Webb P W. Effects of median-fin amputation on fast-start performance of rainbow trout (Salmogairdneri). The Journal of Experimental Biology, 1977, 68: 123-135.
[27] Domenici P. Escape responses in fish: Kinematics, performance and behavior//Domenici P, Kapoor B G, eds. Fish Locomotion: An Eco-ethological Perspective. Enfield: Science Publishers, 2010: 123-170.
The effects of caudal fin loss and regeneration on fast-start performance in juveniles of two cyprinid fish species
YAN Dongjuan, CAO Zhendong, FU Shijian*
LaboratoryofEvolutionaryPhysiologyandBehaviour,ChongqingKeyLaboratoryofAnimalBiology,ChongqingNormalUniversity,Chongqing401331,China
Swimming performance is an important capacity for fish species because it is closely related to the ability to gain food, to predator avoidance and to other daily activities. As an important locomotive organ for most fish species, the caudal fin plays a crucial role in propelling and guiding fish during swimming and thus the shape, size and stiffness of the caudal fin are all expected to strongly affect swimming performance. In nature, the caudal fins of fish species are frequently lost to some extent by aggressive behaviour, predation and diseases. To investigate the effects of caudal fin loss and regeneration on fast-start performance of crucian carp (Carassiusauratus, inhabiting in still water) and pale chub (Zaccoplatypus, inhabiting in rip current), 16 juveniles of both crucian carp (body length, (6.27 ± 0.04) cm) and pale chub (body length, (6.14 ± 0.12) cm) were allocated to two groups, respectively. One group (8 fish for each treatment) for the treatment of caudal-fin-amputation-regeneration (20 days) and re-amputation, the other group (8 fish for each treatment) for control. The movement of each fish was recorded by a high-speed camera after an electric stimulation for the analysis of fast-start parameter. Furthermore, the morphological parameters such as body length (L), body height (H), fitness ratio (FR), caudal fin aspect ratio (AR), relative caudal fin area ratio and caudal fin index (FI) in the two cyprinid fish species were measured. The experimental water temperature was maintained at (25.0 ± 0.5)℃. The results showed that the crucian carp showed a significant lowerFRand higherFIthan pale chub (P< 0.01), but the maximum linear velocity (Vmax), escape distance (d), relative turning radius (TRr) and bending coefficient (BC) showed no significant difference between the two cyprinid fish species. TheVmax,dandTRrduring fast-start process of both fish species decreased significantly after caudal fin loss (P< 0.01), with theVmaxof crucian carp decreased by 39% while that of pale chub decreased by 24% after caudal fin loss. After 20 days′ recovery, the areas of caudal fin of both fish species recovered about 60% those of the caudal-fin-intact fish. However, theVmax,d,RTrandBCof both caudal-fin-regenerated crucian carp and pale chub showed no significant difference compared with those of the control groups, respectively. Compared to the caudal-fin-intact fish, the decrease ofVmaxof crucian carp and pale chub after the second amputation (17% and 9%) was smaller than the first amputation (39% and 24%). The decrease ratio between the first and the second caudal fin amputation in crucian carp was larger than that of pale chub. However, the bending coefficient (BC) of pale chub increased significantly after the second caudal fin amputation compared with those of fin-intact group (P= 0.046). The results indicated that (1) the caudal fin of crucian carp played a more important role than that of pale chub during fast-start movement; and (2) the pale chub which prefer to rip current habitat showed more significant functional compensation after 20 days′ recovery.
caudal-fin-amputation; regeneration; cyprinids; fast-start swimming performance; habitat
国家自然科学基金项目(31172096); 重庆市自然科学基金重点项目(cstc2013jjB20003); 重庆市教委科研项目(KJ130624)
2013-05-17;
日期:2014-04-25
10.5846/stxb201305171097
*通讯作者Corresponding author.E-mail: shijianfu9@hotmail.com
闫东娟,曹振东,付世建.尾鳍缺失和恢复生长对不同生境的两种鲤科鱼类快速启动游泳能力的影响.生态学报,2015,35(6):1947-1954.
Yan D J, Cao Z D, Fu S J.The effects of caudal fin loss and regeneration on fast-start performance in juveniles of two cyprinid fish species.Acta Ecologica Sinica,2015,35(6):1947-1954.

