玉米初生根向水性诱导优化试验研究
胡田田, 牛晓丽, 漆栋良, Wu Yajun
1 西北农林科技大学 旱区农业水土工程教育部重点实验室, 杨凌 712100 2 Department of Biology and Microbiology, South Dakota State University, Brookings SD 57007, USA
玉米初生根向水性诱导优化试验研究
胡田田1, 牛晓丽1, 漆栋良1, Wu Yajun2,*
1 西北农林科技大学 旱区农业水土工程教育部重点实验室, 杨凌 712100 2 Department of Biology and Microbiology, South Dakota State University, Brookings SD 57007, USA
为了研究湿度梯度对根系向水性反应的影响,采用Takahashi and Scott 于1993年创建的方法,设置以下3个试验:1)向水性诱导物不同倾斜角试验;2)根系距向水性诱导物不同距离试验;3)根尖距底部饱和K2CO3溶液不同距离试验。同时,还研究了根长和根系延伸速率对根系向水性弯曲的影响。结果表明,用饱和K2CO3溶液控制湿度时根系的向水性弯曲度明显大于纯水。随着诱导物倾斜角的增大,向水性弯曲增强。与距诱导物3 mm和6 mm相比,根系直接接触诱导物时表现出最大的向水性反应。与根尖距底部盐溶液6 cm相比,相距4 cm时向水性弯曲度增大,这些与根尖周围的湿度梯度增大有关。当根长为1.0、1.5、2.0、2.5、3.0 cm时,短根比长根表现出更大的向水性反应,这可能与其较慢的延伸速率为根系对湿度梯度的反应提供了更充足的时间有关。为了验证这个假说,用相同长度的根系、通过控制不同温度进行试验,结果表明根系的向水性弯曲随温度升高而降低。可见,玉米初生根的向水性反应受环境和根系发育阶段两方面影响。当根系相距诱导物较近、根系周围的湿度梯度较大时,根系向水性反应更强。而且,具有较小延伸速率根系的向水性反应更大。考虑到干旱条件下根系伸长慢、且土壤中湿度梯度大,因而可以认为干旱条件下根系的向水性生长在玉米吸收水分中有重要作用。同时,对根系向水性诱导方法的优化有助于其生理机制的进一步研究。
玉米; 根系; 向水性; 试验条件; 根长; 延伸速率
根系具有向水性的观点在约1700年由J.L. Dodart首次提出[1],1811年Knight和Esq对其进行了论述[2],Sachs于1872年通过试验验证了根系向水性的存在[3]。此后,向水性的研究基本处于停滞阶段,直到1985年豌豆向地性突变种发现[4]之后,向水性的研究再次受到重视。目前,国外、尤其是日本,在植物根系向水性的研究方面,最为深入和广泛。已对根系向水性的感知与信号传递、基因表达与激素调控等方面开展了一些研究[5-9],并和根系生长模拟结合了起来[10]。然而,国内根系向水性的研究起步晚,也尚未受到充分的重视。仅严晓丹[11]曾对国外根系向水性方面的研究进行过综述,也有研究对根系向水性生长进行了模拟[12-13]。关于根系向水性、以及根系向水性与植物抗旱性关系的研究,有利于开发丰富的植物资源和抗旱新品种的培育,有利于挖掘植物自身抗旱性、提高水分利用效率。
一直以来,对根系向水性的研究存在难度,是由于在地球上难以克服根系的向重力性,并且很难控制和模拟能够诱导向水性的湿度梯度。要进行根系向水性的研究,首要任务就是要有一套能够诱导出根系向水性的试验方法。尽管前人在根系向水性诱导方面做过一些探索,建立了相应的根系向水性诱导方法[14],但他们的研究同时表明,根系向水性诱导所要求的湿度梯度与植物种类和品种等有关[15]。为此,在借鉴国际上研究成果的基础上,本研究对玉米幼苗根系的向水性诱导进行了一些摸索,优化了FR697玉米根系向水性诱导的方法,并研究了向水性诱导物倾斜角、根尖距盐溶液距离、根系距向水性诱导物距离、根系长度及温度等因素对根系向水性反应的影响,可为其他植物种类和品种的向水性研究提供借鉴,为推动植物根系的向水性研究奠定基础。
1 试验材料与方法
1.1 试验材料
供试玉米品种为FR697。玉米种子整齐摆放于用水饱和的发芽纸上,用保鲜膜密封,上面扎一些小孔用于通气,在25 ℃的培养箱中萌发一定时间后(萌发时间依据所需根长而变,1—1.5 cm约66 h、2—3 cm约74 h),挑选长度一致的根系用于向水性诱导试验。
1.2 试验装置
向水性诱导装置是在Takahashi和Scott[16]的基础上做了一些改进,具体见图1和图2。一端具有一定倾斜角的海绵或泡沫塑料板(长13 cm、宽10 cm、厚3 cm),外覆6层纱布,吸水饱和后作为向水性诱导物(hydrostimulant)。每一块向水性诱导物上,用细铁丝或回形针固定5—7个已发芽的玉米种子(具有一定长度的、笔直的种子根),使玉米的根尖伸出向水性诱导物边缘1 mm。将装有发芽种子的向水性诱导物垂直固定于泡沫塑料箱(30 cm× 24 cm× 26 cm)内,箱子底部放置饱和盐溶液,盖上盖子。试验装置见照片(图2)。箱子内部的湿度及湿度梯度由向水性诱导物及饱和盐溶液维持稳定[15]。整个装置放置在一定温度条件下维持一定时间后进行根系的向水性弯曲度测量。
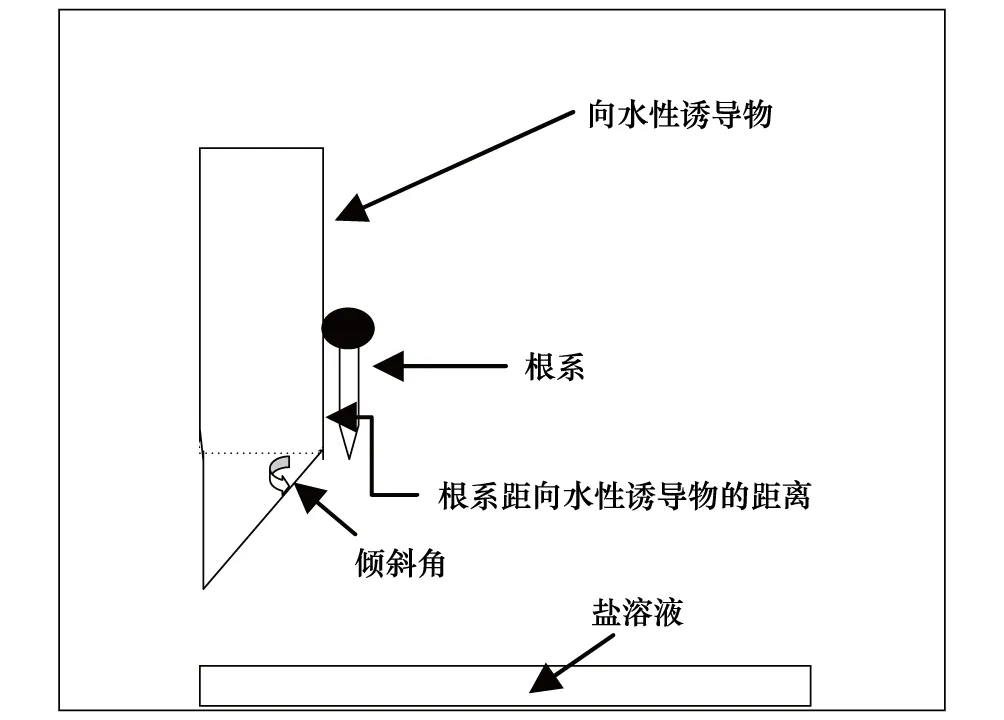
图1 根系向水性诱导装置示意图Fig.1 Diagram of the setup for root hydrotropism induction

图2 试验装置照片Fig.2 A picture for a real experimental setup
1.3 试验方案及实施
1.3.1 根系向水性弯曲度的影响因素研究
设置不同的试验,分别针对向水性诱导物的倾斜角(试验一)、根尖距底部盐溶液的距离(试验二)、饱和K2CO3溶液与纯水控制空气湿度的异同(试验三)、根长(试验四)、温度(试验五)及根系距向水性诱导物距离(试验六)对根系向水性反应的影响进行研究。各试验涉及这些因素中的一个或两个,重复3—4次,每次测量玉米幼苗10—12个。
试验一,研究向水性诱导物倾斜角对根系向水性弯曲度的影响。为通过向水性诱导物倾斜角的改变来改变根尖周围的湿度梯度,试验设40°、50°、60° 3个倾斜角,采用饱和K2CO3作为诱导湿度梯度的盐溶液,使根尖距底部盐溶液的距离为6 cm,选取具有笔直的(1.0±0.2) cm根长的发芽种子,将根系紧贴向水性诱导物表面,在25 ℃条件下培养10 h后测定根系的向水性弯曲度。
试验二,研究根尖距底部盐溶液距离对根系向水性弯曲度的影响。设4 cm和6 cm两个距离,采用倾斜角为60°的向水性诱导物,其余非试验因素与上述试验一相同。
试验三,用饱和K2CO3溶液与纯水控制室内空气湿度的比较试验。以纯水和饱和K2CO3溶液分别控制室内空气湿度,采用倾斜角为60°的向水性诱导物,所选根长为1.0、1.5、2.0、2.5、3.0 cm,将不同长度根系的根尖沿向水性诱导物下端的上边缘排成一行,保持与底部盐溶液距离均为4 cm。其余非试验因素与上述试验一相同。
试验四,研究供试根长对根系向水性弯曲度的影响。选取具有直的长度为1.0、1.5、2.0 cm和2.5 cm初生根的发芽种子,使根尖距盐溶液的距离均为4 cm(同试验三),采用倾斜角为60°的向水性诱导物,以饱和K2CO3为诱导湿度梯度的盐溶液,其余非试验因素与上述试验一相同。
试验五,研究温度对根系向水性弯曲度的影响。将长度为(1.8±0.2) cm的初生根在25、20、15 ℃ 3个温度下培养,依据供试玉米根系在25、20、15 ℃下的平均生长速率依次是1.28、0.81、0.50 mm/h(测定方法见1.3.3),分别控制10,14 h和23 h的处理时间,以获得向水性测量时基本相同的根系生长长度。其余非试验因素与上述试验四相同。
试验六,研究温度和根系距向水性诱导物距离对根系向水性弯曲度的综合影响。通过在根系与向水性诱导物之间铺垫不同厚度的塑料板(外覆两层纱布),控制0、3、6 mm 3个根系距向水性诱导物距离,选取长度为(1.8±0.2) cm的初生根在25 ℃和15 ℃两个温度下培养。其余非试验因素与上述试验四相同。
1.3.2 根系延伸生长速率研究
玉米种子用吸水饱和的发芽纸固定在发芽盘中,放置于25 ℃的恒温箱中,待种子萌发后,每天固定在8:00、14:00、20:00,用不同颜色的记号笔对各条根系的生长位置进行标记,根据两个时间点之间根系生长的长度及所需时间,计算根系的延伸生长速率。重复3次,每次测量萌发种子10—12个。
1.3.3 温度对根系生长的影响研究
与1.3.2所不同的是,培养温度为25、20、15 ℃ 3个,分别测定10,14 h和23 h内根系的延伸生长长度,计算根系的平均生长速率。
1.4 根系向水性弯曲度的测量

图3 供向水性弯曲度测量的照片Fig.3 Measurement of root hydrotropic curvature
向水性诱导试验结束后,仔细观察根系生长的弯曲情况。照相时,在旁边放一直尺,将各条根系的最初弯曲部位排在同一高度,按照弯曲方向放置根系,之后,进行照相。将照片放大后,在根系最初发生弯曲的部位,画两条尽量逼近其弯曲度的直线,即一条沿垂直方向,另一条沿根系最初发生向水性弯曲的方向(图3),用量角器测量根系的向水性弯曲度(如图3中从左向右第四条根的弯曲度为27°),并统计其弯曲百分数(即发生弯曲根条数占总试验根条数的百分数)。
1.5 数据处理
用SPSS统计分析软件对试验数据进行方差分析与多重比较。方差分析用one-way ANOVA,多重比较用Duncan 法进行。
2 结果与分析
2.1 向水性诱导物倾斜角对根系向水性反应的影响
表1表明,向水性诱导物倾斜角分别为40、50°和60°时,玉米根系均有向水性反应,且所有供试根系均百分之一百地发生向水性弯曲。3个倾斜角所不同的是,随着倾斜角度数的增大,根系的向水性弯曲度增加。表明在40°—60°范围内,增大向水性诱导物的倾斜角,可以增强根系的向水性反应。这与向水性诱导物倾斜角增大时根尖与诱导物的距离更近、根系周围湿度梯度更大[15-16]有关。
2.2 溶液距根尖距离对根系向水性反应的影响
在维持根系距向水性诱导物距离不变的条件下,为改变根尖周围的湿度梯度,改变了根尖距底部饱和盐溶液的距离。从表2可以看出,根尖距饱和盐溶液的距离为4、6 cm时,供试玉米根系均百分之一百地发生向水性弯曲;但二者有所不同,根尖距饱和盐溶液的距离为4 cm时的向水性弯曲度显著大于距离为6 cm,增加幅度为26%,随着根尖距饱和盐溶液距离的增大,根系向水性反应有减弱现象。
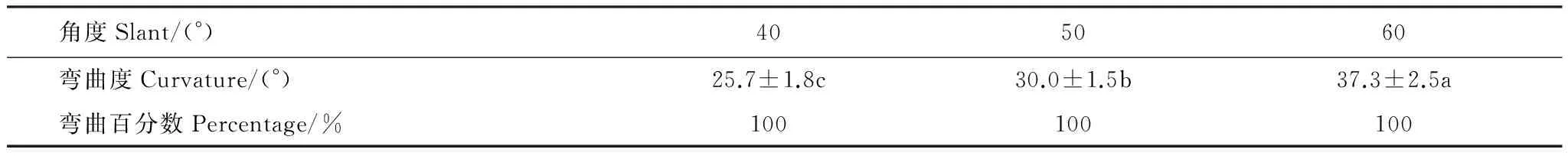
表1 向水性诱导物倾斜角对根系向水性弯曲度的影响(平均值±标准误)Table 1 Effect of the slanted angles of the hydydrostimulant on root curvature (means ±SE)
数据后的a、b、c表示同一行间存在显著差异(P< 0.05)
表2 溶液距根尖距离不同时根系的向水性弯曲度(平均值±标准误) Table 2 The root curvature under different distances between salt solution and root tip (means ±SE)

距离Distance/cm46弯曲度Curvature/(°)41.6±3.2a33.0±2.8b弯曲百分数Percentage/%100100
数据后的a、b、c表示同一行间存在显著差异 (P<0.05)
2.3 饱和K2CO3溶液与纯水诱导根系向水性反应的比较
为了比较纯水与饱和K2CO3溶液控制室内湿度时根系向水性反应的不同,也用纯水进行了试验。表3表明,除饱和碳酸钾溶液外,用纯水控制室内空气湿度时,同样可以诱导玉米根系发生向水性弯曲。但二者有所不同,1.0、1.5、2.0、2.5 cm和3.0 cm各根长下,以饱和K2CO3溶液维持湿度梯度时,根系的向水性弯曲度较纯水依次增大31.3%,31.5%,29.0%,33.6%,24.9%,而且,根系弯曲的百分数也以饱和K2CO3溶液明显大于纯水处理。可见,用于维持湿度梯度的盐溶液发生变化时,不仅影响根系的向水性弯曲度,而且对其弯曲的概率也有影响。
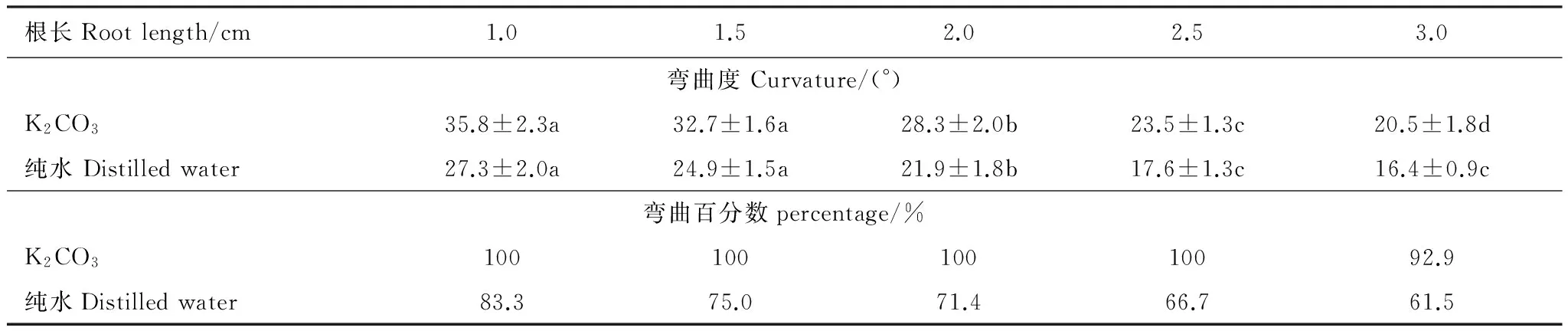
表3 盐溶液和纯水条件下不同根长时玉米根系的向水性弯曲(平均值±标准误)Table 3 Curvature for roots in different length under K2CO3 solution or water (means ±SE)
数据后的a、b、c表示同一行间存在显著差异 (P< 0.05)
2.4 根系向水性反应对根系长度的响应
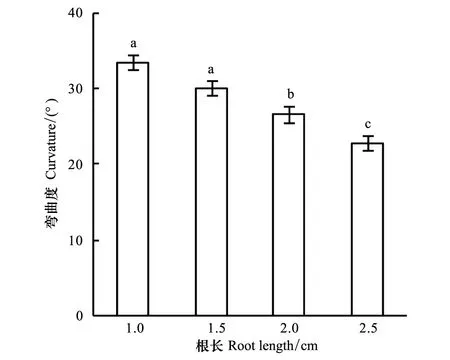
图4 不同根长下玉米根系的向水性反应(平均值±标准误)Fig.4 Curvature for roots in different length (means ±SE)
为研究供试根长对根系向水性反应的影响,将不同长度根系的根尖沿向水性诱导物下端的上边缘排成一行,保持与底部盐溶液距离相同。试验结果表明,根系的长度对根系的向水性弯曲有显著影响(图4)。除根长1.5 cm与1.0 cm间差异未达5%显著水平外,其他供试根长两两之间均存在显著差异;与根长2.5 cm相比,1.0、1.5、2.0 cm根长时的向水性弯曲分别增加46.1%,31.3%,16.2%。从表3也可以看出,不论装置底部用饱和K2CO3溶液还是纯水控制空气湿度,不同长度根系之间的向水性弯曲度均表现出显著差异,而且,根系的向水性弯曲度均随根长的增大而减小。
2.5 温度对根系向水性反应的影响
供试玉米根系延伸生长速率随根系长度变化的结果表明,根系的延伸生长速率随根系长度的变化呈对数曲线,在一定范围内随根长的增大而增大,尤其是根长在5 cm以内时,延伸生长速率随根系长度的增幅很大(图5)。由此可以推测,上述短根比长根表现出更大向水性反应的原因可能在于其较小的延伸速率。为了验证这个假说,用相同长度的根系、通过控制不同温度进行试验。结果表明,根系直接固定在向水性诱导物表面(即距向水性诱导物距离为0 mm)时,3个不同温度条件下根系的向水性弯曲度存在明显差异(图6)。随着温度降低,根系的向水性弯曲度显著增大,20 ℃和15 ℃较25 ℃的增幅分别是7.3%和28.9%。可见,降低温度有利于根系向水性的诱导。表4进一步表明,不论根系距向水性诱导物的距离是0、3 mm还是6 mm,降低温度均使根系的向水性弯曲度明显增大。
2.6 温度和根系距向水性诱导物距离的耦合效应
从表4还可以看出,根系向水性弯曲度不仅随温度降低而增大,也随根系距向水性诱导物的距离发生变化。15 ℃和25 ℃两个温度均表现为,随着距离的减小,根系向水性弯曲度明显增大。在15 ℃和25 ℃条件下,0、3 mm两个距离较6 mm的增幅分别为66.7%,36.9%和73.4%、52.7%,而且以25 ℃下的增幅更大。说明温度和根系距向水性诱导物距离均会对根系的向水性反应产生影响,而且温度较高时,减小根系距向水性诱导物距离的效果更明显。
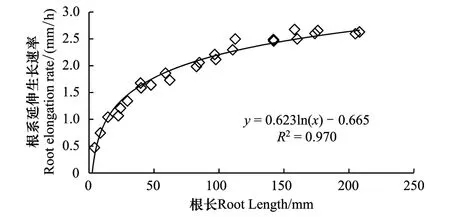
图5 根系延伸生长速率随根系长度的变化Fig.5 Change of root elongation rate with the length
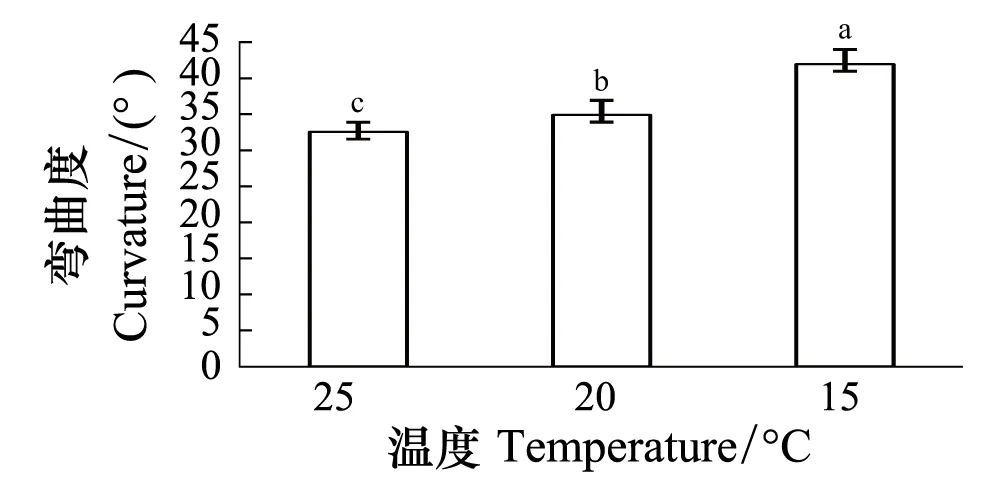
图6 温度对根系向水性弯曲度的影响 (平均值±标准误)Fig.6 Effect of temperature on root curvature (means ±SE)不同小写字母a、b、c表示差异显著(P< 0.05)

表4 温度和根系距向水性诱导物距离对向水性弯曲度的综合影响(°)(平均值±标准误)Table 4 Effect of temperature and the distance from root tip to the hydrostimulant on root curvature (means±SE)
数据后的a、b、c表示同一行间存在显著差异
3 讨论
根系发生向水性弯曲要求一定的湿度梯度。当根尖周围存在一定的湿度梯度时,根系低水势一侧细胞壁延伸性能增强、水分传导加快,导致高水势一侧较低水势一侧根系生长受到更大的抑制,从而使根系向着湿度大的一侧发生弯曲[14,17-19]。本研究表明,玉米根系的向水性弯曲度与根尖距装置中盐溶液的距离、根系距向水性诱导物的距离、向水性诱导物的倾斜角均有密切关系。这可能与这些因素均影响着根尖部位的湿度梯度有关。已有研究表明,在装有向水性诱导物和饱和盐溶液的密闭容器中,其空气湿度由饱和盐溶液和向水性诱导物决定,而根尖周围的湿度梯度还取决于向水性诱导物距饱和盐溶液的距离以及与根系的距离有关,距离增大,湿度梯度减小[15-17]。Oyanagi等研究表明,由这种向水性诱导物与饱和盐组成的密闭容器中,根尖部位的湿度梯度因所用饱和盐的种类变化0.03—1.84% RH/mm之间[20];湿度梯度为0.67% RH/mm时根系表现出向水性反应,且向水性反应随湿度梯度的增大而增强[15,20]。根系发生向水性弯曲所要求的湿度梯度因植物种类而发生变化,向地性敏感的种类或品种所要求的湿度梯度要大[14-15]。这方面尚需进一步试验研究。
本研究发现,玉米根系的向水性弯曲随根系长度的增大而减小,也随温度升高而降低,这可能与温度和根系长度均影响根系的延伸生长速率、从而影响根尖对湿度梯度的反应时间有关。玉米初生根的延伸速率在一定根长范围内随根长的增加而增大[21](图5)。在2.5一节中,我们用相同长度的根系、通过控制不同温度以获得不同的延伸速率进行试验,结果表明升高温度可加快根系的生长速率、但降低根系的向水性反应(图6、表4)。前人研究表明,根系向水性的最初弯曲发生在距根尖1.8—2.5 mm处,即生长最快之处[22]。尽管根冠部位对湿度梯度的感知时间不到2 min,但根系的向水性弯曲发生在暴露于一定湿度梯度下3—4 h之后,比根系的向地性反应明显慢[14,18,22]。因而可以认为,根系的向水性弯曲受根系延伸生长速率的影响,根系延伸越快,根系对湿度梯度的反应时间越短,向地性的干扰相对越强,向水性反应越小;反之,根系延伸生长较慢时,可为根尖对湿度梯度的反应提供充足时间,从而增强其向水性反应。其内在生理学机制还需进一步深入研究。
综上所述,玉米初生根的向水性反应受环境和根系发育阶段两方面影响。当根尖距向水性诱导物距离较近、根系周围的湿度梯度较大时,玉米根系的向水性反应更强烈。而且,具有较小延伸速率的根系,其向水性反应更大。这从根系向水性反应对温度和根系距向水性诱导物距离的耦合响应(表4)可得到进一步证明。考虑到干旱条件下根系伸长慢、且此时土壤中湿度梯度大,因而可以认为干旱条件下根系的向水性生长在玉米吸收水分中有重要作用,值得进一步重视。本研究同时对根系向水性诱导方法进行了优化,有助于根系向水性生理机制的进一步研究。
4 结论
通过六个不同的试验,综合分析得出以下主要结论:
(1)饱和K2CO3溶液和纯水均可以诱导玉米根系发生向水性弯曲,且前者明显优于后者;与6 cm相比,根尖距盐溶液的距离为4 cm时根系的向水性弯曲度增大;随着向水性诱导物倾斜角从40°、50°增大到60°,根系的向水性弯曲呈增强趋势;根系距向水性诱导物距离为0、3、6 mm时,根系向水性弯曲度减小。说明根系向水性反应的弯曲程度与向水性诱导物倾斜角、根尖距盐溶液的距离、根系距向水性诱导物的距离等决定根尖周围湿度梯度的因素都有密切关系,根系周围的湿度梯度较大时,根系的向水性反应更强烈。
(2) 温度为15、20 ℃和25 ℃时,根系向水性弯曲度随温度升高而降低;根长为1.0、1.5、2.0、2.5、3.0 cm时,根系向水性弯曲度随根系长度的增大而减小。表明根系向水性反应的弯曲程度也随温度、根长等影响根系延伸生长速率的因素而变,降低温度或减小供试根长可使根系延伸速率减小,为根系对周围湿度梯度的反应提供充足时间,从而使其向水性反应更强。
[1] Hart J W. Plant Tropism: and Other Growth Movement. London: Unwin Hyman, 1990.
[2] Knight T A, Esq F R S. On the causes which influence the direction of the growth of roots.Philosophical Transactions of the Royal Society of London, 1811, 2: 209-219.
[3] Sachs J V. Ablenkung der Wurzel von ihrer normalen Wachstumsrichtung durch feuchte Korper. Arbeit botanisches Institut, Wurzburg, 1872, 1: 209-222.
[4] Jaffe M J, Takahashi H, Biro R L. A pea mutant for the study of hydrotropism in roots. Science, 1985, 230(4724): 445-447.
[5] Takano M, Fujii N, NIshltani K, Hirasawa T, Takahashi H. Expression of endo-xyloglucan transferase (EXGT) gene during the hydrotropic response of pea (PisumsativumL) root. Plant Cell Physiol, 1997, 38(supplement): 110-110.
[6] Kobayashi A, Kakimoto Y, Fujii N, Takahashi H. Physiological and genetic characterization of hydrotropic mutants ofArabidopsisthaliana. Uchū Seibutsu Kagaku, 2003, 17(3): 243-244.
[7] Takahashi H, Miyazawa Y, Fujii N. Hormonal interactions during root tropic growth: hydrotropism versus gravitropism. Plant Molecular Biology, 2009, 69(4): 489-502.
[8] Cassab G I, Eapen D, Campos M E. Root hydrotropism: An update. American Journal of Botany, 2013, 100 (1): 14-24.
[9] Moriwaki T, Miyazawa Y, Kobayashi A, Takahashi H. Molecular mechanisms of hydrotropism in seedling roots ofArabidopsisThaliana(Brassicaceae). 2013, American Journal of Botany, 2013, 100(1) 25-34.
[10] Tsutsumi D, Kosugi K, Mizuyama T. Effect of hydrotropism on root system development in soybean (Glycinemax): growth experiments and a model simulation. Journal of Plant Growth Regulation, 2003, 21(4): 441-458.
[11] 严晓丹. 向水性研究进展. 现代农业科学, 2008, 15(3): 1-2, 5-5.
[12] 金明现, 王天铎. 玉米根系生长及向水性的模拟. 植物学报, 1996, 38(5): 384-390.
[13] 张吴平, 刘建宁, 李保国. 结构与功能反馈机制下根系生长向性模拟. 农业工程学报, 2009, 25(Suppl 2): 110-117.
[14] Takahashi H. Hydrotropism: The current state of our knowledge. Journal of Plant Research, 1997, 110 (1098): 163-169.
[15] Takahashi H, Scott T K. Intensity of hydrostimulation for the induction of root hydrotropism and its sensing by the root cap. Plant, Cell and Environment, 1993, 16(1): 99-103.
[16] Takahashi H, Scott T K. Hydrotropism and its interaction with gravitropism in maize roots. Plant Physiology, 1991, 96(2): 558-564.
[17] Hirasawa T, Takahashi H, Suge H, Ishihara K. Water potential, turgor and cell wall properties in elongating tissues of the hydrotropically bending roots of pea (PisumsativumL). Plant, Cell and Environment, 1997, 20(3): 381-386.
[18] Takahashi H, Suge H. Root hydrotropism of an agravitropic pea mutant,ageotropum. Physiologia Plantarum, 1991, 82(1): 24-31.
[19] Miyamoto N, Ookawa T, Takahashi H, Hirasawa T. Water uptake and hydraulic properties of elongating cells in hydrotropically bending roots ofPisumsativumL. Plant Cell Physiology, 2002, 43(4): 393-401.
[20] Oyanagi A, Takahashi H, Suge H. Interactions between hydrotropism and gravitropism in the primary seminal roots ofTriticumaestivumL. Annals of Botany, 1995, 75(3): 229-235.
[21] Wu Y, Sharp R E, Durachko D M, Cosgrove D J. Growth maintenance of the maize primary root at low water potentials involves increases in cell wall extension properties, expansin activity and wall susceptibility to expansins. Plant Physiology, 1996, 111(3): 765-772.
[22] Takano M, Takahashi H, Hirasawa T, Suge H. Hydrotropism in roots: sensing of a gradient in water potential by the root cap. Planta, 1995, 197(2): 410-413.
Optimizing hydrotropic response in the maize primary roots
HU Tiantian1, NIU Xiaoli1, QI Dongliang1, WU Yajun2,*
1KeyLaboratoryofAgriculturalSoilandWaterEngineeringinAridandSemiaridAreas,MinistryofEducation,NorthwestA&FUniversity,Yangling712100,China2DepartmentofBiologyandMicrobiology,SouthDakotaStateUniversity,Brookings,SD57007,USA
Roots can sense and then grow toward a water source. This extraordinary capability of roots — hydrotropism---has not been well studied. The objective of this study was to examine the environmental and physiological factors that might affect hydrotropic response in the maize primary roots. A system that was first established by Takahashi and Scott in 1993 was adopted in this study. Maize seedlings with uniform root length were fixed on a vertically placed wet pad with a slanted angle at the bottom. The root tips were aligned with the upper edge of the slanted pad bottom. The pad with seedlings was then vertically placed in a small chamber. The humidity of the chamber was controlled by placing a reservoir of either saturated K2CO3solution or pure water at the bottom of the chamber. The root continued to elongate downward in the darkened, closed chamber. Due to the higher humidity of the air near the slanted bottom of the wet pad (compared to the relatively dry air on the other side of the root), the root curved and grew toward the wet pad and grew away from the drier air. The curvature away from the vertical (gravity) axis was measured to quantify the strength of the hydrotropic response. To test the effect of the humidity gradient on the hydrotropic response, three experiments were conducted: 1) roots were grown on the wet pads with different slanted angels; 2) the roots were placed a few mm away from the wet pad; and 3) the roots were positioned at different distances from the saturated K2CO3solution. The effect of root length and of the elongation rate on hydrotropic curvature was also tested. Because the results showed that hydrotropic curvature was greater, when the saturated K2CO3solution was used to control the chamber humidity compared to pure water, all the other experiments in this study were conducted by using the saturated K2CO3solution. When pads with different slanted degrees were compared (40°, 50°, or 60°), the root curvature was greater as the slanted angle increased (Note: The greater the slanted angle is, the closer the root tip is to the hydrostimulant — the wet pad.) Also, the roots showed the best hydrotropic curvature when the roots directly touched the hydrostimulant compared to when the roots were placed 3 mm or 6 mm away from the hydrostimulant. Finally, root curvature was greater when the distance between the root tip and the salt solution was 4 cm compared to 6 cm. When roots of different lengths (1.0, 1.5, 2.0, 2.5, or 3.0 cm) were compared, the shorter roots showed much better hydrotropic response than the longer roots did. Since maize primary roots elongate faster as the roots get longer during germination (before reaching a relatively steady rate), it is possible that a better hydrotropic response in the shorter roots might be explained by a slower elongation, providing more time for the roots to respond to the humidity gradient. To test this hypothesis, roots of the same length, but with different elongation rates, were tested for their hydrotropic response. The root elongation rate was controlled by varying growth temperatures, and the time was adjusted to allow the roots at different temperatures to reach the same final length before root curvature was determined. The results showed that root curvature decreased as the growth temperature increased. In summary, this study demonstrated that hydrotropic response in the maize primary roots is affected by environmental factors as well as the developmental stages of the roots. Maize roots showed a stronger hydrotropic response when the roots are closer to the hydrostimulant and when the humidity gradient around the roots becomes steeper. Moreover, roots with slower elongation showed greater hydrotropic response. Since roots elongate slower under drought, and the humidity gradient is steeper in dry soil, it can be hypothesized that hydrotropism may play an important role in water acquisition in maize plants under drought. The findings from this study also allow us to optimize an experimental system that can be used to study the mechanisms of hydrotropism in the future.
maize;roots; hydrotropism; experimental conditions; root length; elongation rate
国家自然科学基金(51079124); 中央高校基本科研业务费专项资金(QN2011067); 留学人员科技活动项目择优资助经费
2013-05-14;
日期:2014-04-25
10.5846/stxb201305291225
*通讯作者Corresponding author.E-mail: yajun.wu@sdstate.edu
胡田田, 牛晓丽, 漆栋良, Wu Yajun.玉米初生根向水性诱导优化试验研究.生态学报,2015,35(6):1829-1836.
Hu T T, Niu X L, Qi D L, Wu Y J.Optimizing hydrotropic response in the maize primary roots.Acta Ecologica Sinica,2015,35(6):1829-1836.

