近岸海域自动监测浮标在赤潮预警中的应用及其缺陷
李天深,蓝文陆,卢印思,谢鑫(广西壮族自治区海洋环境监测中心站,广西北海536000)
近岸海域自动监测浮标在赤潮预警中的应用及其缺陷
李天深,蓝文陆,卢印思,谢鑫
(广西壮族自治区海洋环境监测中心站,广西北海536000)
摘要:利用位于广西北部湾的自动监测站,研究2012年2月薄壁几内亚藻以及2014年2月球形棕囊藻的赤潮自动监测数据变化的差异。结果表明,薄壁几内亚藻赤潮期间pH、溶解氧以及叶绿素出现同步的变化趋势,溶解氧以及叶绿素显著升高;球形棕囊藻的赤潮期间,pH、溶解氧以及叶绿素未发生明显变化,与棕囊藻自身生理生态习性有关。自动监测浮标在硅藻等高含叶绿素种类的赤潮中能够起到较好的监控和预警作用,但在微微型、混合营养及异养赤潮种类的赤潮预警应用方面仍有待进一步验证及研究。
关键词:自动监测;赤潮;预警
1 引言
随着环境监测技术和管理需求的不断发展,近岸海域自动监测浮标由于可以在恶劣环境下实现无人值守的全天候、全天时长期连续定点观测,已经成为常规的海洋现场监测手段[1],代表近岸海域重点和敏感区域环境监测的一个发展趋势。自动监测浮标可提供实时、连续监测数据,是赤潮监测预警中较好的有效监测手段。目前,通过对自动监测浮标数据的变化趋势分析,国内外学者实现对赤潮的跟踪监测及预报(见表1),但主要是对于已发生的赤潮自动监测数据进行分析,现场应用还是较少,仍缺乏足够的实际应用以验证准确性和不足之处。本研究应用北部湾的自动监测浮标,分析其对同一海域、同一段时期的薄壁几内亚藻(Guinardia flaccida)和球形棕囊藻(Phaeocystis globosa)赤潮过程的自动监测与预警作用,探讨自动监测浮标在不同赤潮种赤潮预警的应用及其缺陷,为自动监测浮标赤潮预警预报提供更科学有效的参考。
2 材料与方法
2.1主要仪器设备
自动监测浮标(GX09号)位于广西廉州湾(见图1),由密封仓系统、监测系统、航标系统、数据采集系统、通信系统、固定锚链系统、太阳能供电系统和室内监控接收系统组成,具有自动采样、分析、记录、数据储存和无线传输等功能,可在室内随时接收监测站位的水质变化,系统内置备用电源,可确保监测的连续进行。其中,监测系统主机为多参数水质测定仪(YSI6600型,美国YSI公司生产)。
2.2监测方法
自动监测站主要监测表层(1.5 m)水质状况,包括:水温、盐度、电导、pH值、DO、DO%、浊度、叶绿素、蓝绿藻。测定一次的时间间隔为30 min,数据通过移动卫星通信GPRS传输到监控中心。监测分析方法均采用相关的国家标准方法。监测期间定期(<15天/次)对仪器进行维护、校准及比对,以保证仪器的运行性能维持在最佳工作状态,确保监测数据的可靠性。
浮游植物调查和分析方法:利用小体积采水器分别采集表层海水0.5 L,立即用鲁哥氏液固定,使其最终浓度为15‰。带回实验室后,摇匀水样,取出0.1 ml样品,利用浮游植物分析框在Olympus IX51倒置式显微镜下观察、计数和鉴定种类。为了使误差减少到10%,每次计数的浮游植物细胞数均达到400个以上。

表1 自动监测浮标对赤潮的跟踪监测及预警预报
图1 廉州湾GX09号自动监测站位置
2.3数据分析
根据现场调查,主要对2012年2月14日—3月8日以及2014年2月4日—3月8日的自动监测数据进行分析,期间包括赤潮发生前期、中期及消亡期。数据处理采用excel及origin软件完成。
3 结果与分析
3.1赤潮调查过程与现场描述
2012年2月21—24日,廉州湾的GX09号自动监测站的叶绿素、溶解氧及pH值数据均出现异常情况,存在同步升降的现象,且叶绿素值显著升高,怀疑有赤潮的爆发。2月23—24日,到现场进行调查时发现海水颜色呈棕褐色,与正常近岸海水水色存在明显差异,表层水体中薄壁几内亚藻密度达到16.5×104—29.7×104个/L,达到几内亚藻赤潮的标准限值(10×104个/L),认定为存在薄壁几内亚藻赤潮爆发。经与叶绿素自动监测结果进行对应比较,薄壁几内亚藻达到赤潮密度时,叶绿素自动监测结果为35.9—45.2µg/L。从叶绿素自动监测结果分析,薄壁几内亚藻赤潮应从2月21日开始,2月26日消亡。现场调查显示赤潮主要发生在GX09附近海域(见图2a)。
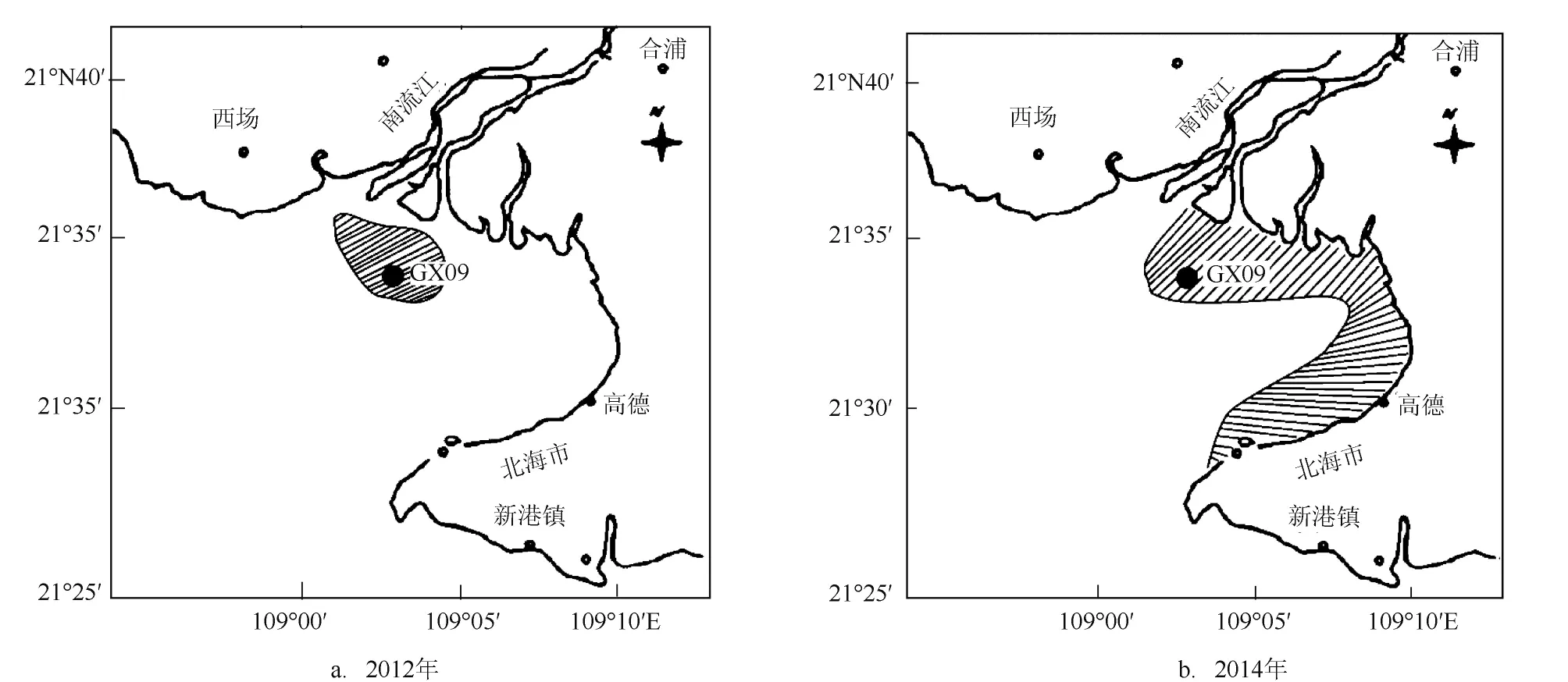
图2 廉州湾赤潮发生区域
2014年2月26—28日,在对廉州湾调查时发现GX09自动监测站附近海域出现大面积的棕色球状悬浮藻体,且近岸有大量的藻体聚集,水体呈深棕色,在自动监测站附近及廉州湾近岸海域采集浮游植物样品,经镜检发现,水体中棕色球形藻体为球形棕囊藻,藻团密度达10个/L,达到2007年汕头湾爆发球形棕囊藻赤潮的细胞密度[8]。经对周边渔民进行咨询,出现这种现象已经有将近一周。因此,此次球形棕囊藻赤潮时间大概在2月20—3月10日左右,主要分布在近岸海域(见图2b)。
3.2自动监测站数据变化
3.2.12012年赤潮前后环境因子变化
2012年廉州湾赤潮前后(2月14日—3月8日)水温、盐度、pH、溶解氧以及叶绿素的变化情况见图3。2012年2月廉州湾水温变化范围为10.8—17.46℃,水温变化比较显著(图3a)。从12日开始,廉州湾水温出现一个的升高趋势,至16日出现一个峰值(15.77℃),此后受冷空气影响,2月19日水温下降到10.8℃。随着天气回暖,2月20日水温又出现爬升态势,至24日,水温升高到17.46℃,升温幅度比第一次更大。2月25日之后水温又开始显著回落,2月28日下降至11.15℃。
2012年2月廉州湾盐度变化范围为19.82—31.01,每天的变化幅度较大,主要受到南流江入海径流的影响,具有典型河口海湾特征。在赤潮发生期间,盐度均在正常的波动范围之内(图3b)。
溶解氧的变化与水温出现同步的变化趋势,溶解氧随着水温下降而降低,随着水温升高而升高(图3d)。2012年2月溶解氧浓度变化范围为8.53—14.02 mg/L,溶解氧百分比含量变化范围为94.1%—171.3%,在水温升高期间溶解氧明显过饱和,溶解氧最高值出现在2月24日,与水温出现最高值的日期一致。
在2012年2月份pH值变化范围为7.81—8.55。pH值在2月12—2月23日之间均保持相对稳定,在2月24日出现一个显著升高的过程,从8.09升高到8.55,pH值最高值出现时间与溶解氧以及水温一致,此后pH值维持在相对较高的水平(图3c)。
在第一个升温过程即2月12—16日,叶绿素监测值变化范围为1.5—31.2µg/L,出现明显的昼夜变化规律,从上午开始升高,至下午15点左右出现一天最高值,此后回落,到夜间出现最低值。期间在2 月16日叶绿素监测最高值达到31.2µg/L,超过赤潮发生的叶绿素阈值。在2月17—19日的降温过程,叶绿素并没有出现下降趋势,而在2月20日开始的第二个升温过程,叶绿素出现显著升高的趋势,叶绿素变化范围为8—61.1µg/L,且全天绝大部分的监测值均大于10µg/L的赤潮阈值[9],在25日出现最高值,此后开始随着水温的下降迅速回落(图3e)。

图3 廉州湾环境因子的变化(2012年2月14日—3月8日)
3.2.22014年赤潮前后环境因子变化
2014年廉州湾赤潮前后(2月4日—3月8日)水温、盐度、pH、溶解氧以及叶绿素的变化情况见图4。2014年2月廉州湾水温变化范围为8.8—21.5℃,水温变化幅度较2012年2月份大。2月初,水温维持在20℃左右,2月8日水温开始下降,至2 月13日达到最低值(8.8℃),此后水温出现一个的升高趋势,19—20日略有下降之后,又开始显著升高,至2月28日达到20.9℃,接近月初水温值(见图4a)。
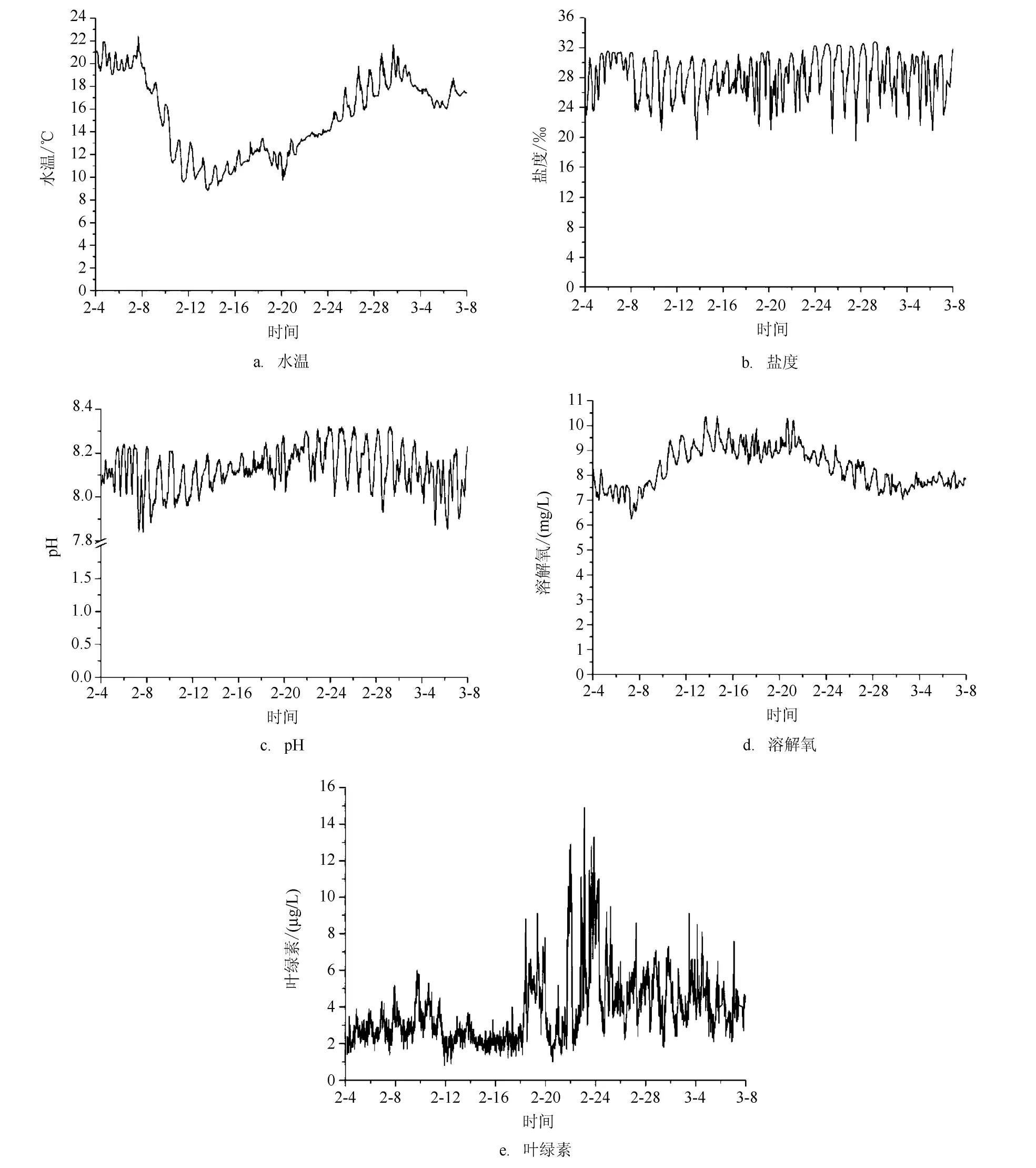
图4 廉州湾环境因子的变化(2014年2月4日—3月8日)
2014年2月廉州湾盐度变化范围为19.66—31.31,每天的变化幅度较大,主要受到南流江入海径流的影响,具有典型河口海湾特征。在赤潮发生期间,盐度均在正常的波动范围之内(见图4b)。
与2012年不同,溶解氧与水温变化趋势相反,从2月8—13日,溶解氧随着水温下降而升高,溶解氧浓度从7.06 mg/L升高到10.35 mg/L,溶解氧百分比从94.1%升高到102.9%,溶解氧没有出现明显的过饱和现象。2月14—18日,水温升高,溶解氧略有下降,21—28日溶解氧又随着水温升高而降低(见图4d)。2014年2月份,pH值变化范围为7.85—8.31,保持在相对平稳(见图4c)。
2014年2月份,叶绿素变化范围为0.9—14.5µg/L。其中在2月14—18日的水温升高过程中,叶绿素在18日之前保持在较低水平,变化范围为1.5—3.2µg/L,到18日出现一个显著的升高,最高值达到8.8µg/L。此后,在2月21—28日水温升高过程,维持在相对较高的水平,但仅有个别监测数值大于10µg/L的赤潮阈值。与2012年的数据相比,叶绿素没有出现逐步升高的趋势,且在棕囊藻赤潮过程中,自动监测的叶绿素值并没有显著升高(见图4e)。
4 讨论
4.12012年与2014年赤潮过程环境因子变化的差异
从水温、溶解氧、pH以及叶绿素这几个因子的变化情况分析,2012年与2014年2次赤潮发生过程中环境因子变化存在着较大的差异,主要表现在以下2点。一是溶解氧的变化,2012年溶解氧变化与水温变化基本一致,而2014年溶解氧变化则与水温变化相反。近岸海域水温是控制水体中溶解氧含量的主要因素,水温升高,水体中的溶解氧浓度应有所降低,但2012年,溶解氧随水温的升高而升高,与水温升高造成浮游植物(薄壁几内亚藻)大量增殖,叶绿素显著升高,光合作用强烈有关。而2014年在水温升高时,溶解氧浓度随之下降,此时尽管处于球形棕囊藻赤潮,但叶绿素含量并没有显著升高,仍维持在相对较低水平,浮游植物光合作用释氧作用不强,此时水温可能是控制水体溶解氧含量的主要因素。二是叶绿素变化不同,2012年薄壁几内亚藻赤潮期间,自动监测站的叶绿素含量出现显著升高,在2月23—25日,叶绿素浓度维持在较高水平,变化范围为17.9—61.1µg/L,全天均超过10µg/L的叶绿素赤潮阈值。而2014年,在棕囊藻赤潮期间,叶绿素的自动监测值却较低,日平均值最高值仅为7.5µg/L,且仅有少个别时段出现大于10µg/L的叶绿素赤潮阈值。
4.2自动监测浮标在硅藻赤潮预警中的应用
在本次研究中,自动监测站在硅藻赤潮中的预警作用表现较好,这和庄宏儒等的报道相一致[4-5]。硅藻是海洋浮游植物的重要组成类群,是生物多样性最为丰富的光合作用类群,其光合作用的色素主要是叶绿素a、C1、C2和β-胡萝卜素,岩藻黄素、硅藻黄素等[10]。硅藻较低的表面积体积比决定其生长需要较高的营养盐条件[11],因而在高营养盐环境中硅藻易成为浮游植物群落的优势类群。在外部条件合适下,硅藻赤潮藻通过其更高的生长率,在短时间大量增殖,从而形成赤潮。硅藻大量增殖过程中,水体叶绿素含量显著升高,而且由于其强烈的光合作用,水体中二氧化碳浓度降低,释放大量的氧气,造成溶解氧及pH值显著升高。典型硅藻如中肋骨条藻、角毛藻、几内亚藻等发生赤潮时,其叶绿素a监测值均较高,甚至达到95.6µg/L,同时溶解氧及pH值也会显著升高(见表2)。通过对叶绿素、溶解氧、pH值三者的协同变化情况分析可对硅藻赤潮的发生进行预警预报。
从2012年的薄壁几内亚藻赤潮的自动监测结果分析,在赤潮发生前(2月17—19日),水体中叶绿素开始出现升高,最高值达到30µg/L,且溶解氧、pH以及叶绿素存在同步涨落的现象,表明赤潮开始爆发。而在2月21—25日,叶绿素、溶解氧显著升高,溶解氧明显过饱和,且叶绿素监测值在一天中均维持在较高水平,表明水体中硅藻密度较高,处于赤潮发展及维持期间。2月26—28日,受冷空气影响,叶绿素及溶解氧自动监测值开始显著下降,表明赤潮开始消亡。自动监测浮标完整的监控到薄壁几内亚藻赤潮的发生过程,为其赤潮预警提供良好的数据资料和依据。目前,国内学者利用自动监测数据,建立基于叶绿素等参数的数理统计预报和经验预报模式,实现对中肋骨条藻、旋链角毛藻、圆海链藻、丹麦细柱藻等典型硅藻赤潮的在线监控及预警[4-5,7]。可见根据光合自养的生理生态特征,自动监测站可应用于高叶绿素含量的硅藻赤潮的预警预报。
4.3自动监测浮标赤潮预警的缺陷性
与硅藻赤潮相比,棕囊藻赤潮发生时其叶绿素a及溶解氧监测值明显偏低(见表2)。Hai研究发现球形棕囊藻赤潮时,叶绿素a与溶解氧变化不一致,叶绿素监测值出现相对较高的水平(37.8µg/L),但溶解氧浓度却很低(5.7—6.4 mg/L)[12]。同样从我们自动监测数据分析,与2012年的硅藻赤潮相比,2014年球形棕囊藻赤潮发生期间,叶绿素、溶解氧以及pH并没有发生明显的增高趋势,叶绿素总体与正常值相近,仅有个别时段出现大于10µg/L,溶解氧也未出现明显的过饱和,从自动监测数据并不能很明显的发现该次赤潮的发生。
球形棕囊藻赤潮期间pH、溶解氧和叶绿素的自动监测结果未有明显增高的现象可能与其复杂的生理生态史有关。球形棕囊藻存在2种截然不同的生活形态——游离单细胞形态和囊体形态,并且能够在2种形态间自由交替[13]。尽管游离鞭毛细胞和囊体细胞共生,棕囊藻藻华时一般以囊体细胞和囊体为主要形式[14],且囊体大都分布在水体上层[15]。我们现场观测也发现,球形棕囊藻主要呈条状态的漂浮在海水表层,而自动监测仪器则放置在水下约1.5 m左右,监测水层与藻体水层分布的不一致可能是造成不能准确并实时监控到赤潮的原因之一。另外,由于球形棕囊藻的细胞呈球形或近球形,单细胞的直径为3—9µm,在各个方向均能产生强度一致的散射光[16],一定程度上降低球形棕囊藻的叶绿素自动监测结果。而且,球形棕囊藻囊体内的细胞有10%—35%甚至达到40%的生物量被消耗于囊体的建设上[17-18],因此囊体内细胞本身的生物量减少,即使囊体数量很多,但是对叶绿素a的贡献相对较低[19],这也是球形棕囊藻赤潮时叶绿素含量较低的另一个可能原因。在2014年球形棕囊藻赤潮时溶解氧含量也未发生显著的变化,可能与囊体的形成限制氧气的扩散有关[20],球形棕囊藻细胞光合作用产生的氧气被囊体包裹,增大了囊体的体积并且降低密度,进而控制囊体的浮力[21]。有研究还表明在营养盐限制的情况下,球形棕囊藻可能具有吞噬营养的能力[22],因此在球形棕囊藻赤潮期间,叶绿素以及溶解氧可能不会发生显著的变化,自动监测系统可能将难以对球形棕囊藻赤潮进行有效地监控和预警。

表2 典型硅藻及棕囊藻赤潮期间pH、DO及叶绿素a的监测值
近年来,随着监测技术的不断进步,在我国渤海海域连续发现由微微型藻海金藻(Pelagophyte) Aureococcus anophagefferens引起的“褐潮”[33-34]。该微微型藻赤潮发生时,溶解氧以及pH也没有明显上升,可能与其属混合营养类型,异养模式是其主要营养方式有关[34]。此外,某些异养的原生动物也能引发赤潮[35]。因此,根据之前的研究以及本次研究结果,自动监测浮标很可能在硅藻等高含叶绿素种类的赤潮中能够起到较好的自动监测和预警作用,但在微微型、混合营养及异养赤潮种类的赤潮预警方面仍有待在现场应用中进一步的补充和研究。
参考文献:
[1]蔡树群,张文静,王盛安.海洋环境观测技术研究进展[J].热带海洋学报, 2007, 26(3): 76-81.
[2] Lee J H W, Hodgkiss I J, Wong K T M, et al. Real time observations of coastal algal blooms by an early warning system [J]. Estuarine, Coastal and Shelf Science, 2005, 65(1-2): 172-190.
[3] Kim G, Lee Y W, Joung D J, et al. Real-time monitoring of nutrient concentrations and red-tide outbreaks in the southern sea of Korea [J]. Geophysical Research Letters, 2006, 33(13): L13607, doi: 10.1029/2005GL025431.
[4]庄宏儒.水质自动监测系统在厦门同安湾赤潮短期预报中的应用[J].海洋环境科学, 2006, 25(2): 58-61.
[5]李天深,李远强,赖春苗,等.廉洲湾赤潮自动监测结果与分析[J].中国环境监测, 2011, 27(4): 32-35.
[6]陈国斌.厦门同安湾海域血红哈卡藻赤潮前的自动监测研究[J].海洋环境科学, 2012, 31(3): 391-394.
[7]吴玉芳.赤潮高发期间厦门海域叶绿素值预报方程建立及应用于灾害性赤潮预报模式的研究[J].海洋预报, 2012, 29(2): 39-44.
[8]赵雪,杨凡,郭娜,等. 2007年2月汕头赤潮事件水文气象及海水理化因子影响分析[J].海洋预报, 2009, 26(1): 43-51.
[9]张水浸,杨清良,邱辉煌,等.赤潮及其防治对策[M].北京:海洋出版社, 1994.
[10] Jeffrey S W, Vesk M. Introduction to marine phytoplankton and their pigment signatures. In: Jeffrey S W, Mantoura R F C, Wright S W eds. Phytoplankton pigments in oceanography: guidelines to modern methods[M]. Paris: UNESCO, 2005: 37-84.
[11] Chisholm S W. Phytoplankton size. In: Falkowski P G, Woodhead A D eds. Primary productivity and biogeochemical cycles in the sea[M]. New-York: Plenum, 1992: 213-237.
[12] Hai D N, Lam N N, Dippner J W. Development of Phaeocystis globosa blooms in the upwelling waters of the South Central coast of Viet Nam[J]. Journal of Marine Systems, 2010, 83(3-4): 253-261.
[13] Rousseau V, Vaulot D, Casotti R, et al. The life cycle of Phaeocystis (Prymnesiophyceae): evidence and hypotheses[J]. Journal of Marine Systems, 1994, 5(1): 23-39.
[14] Rousseau V, Chrétiennot-Dinet M J, Jacobsen A, et al. The life cycle of Phaeocystis: state of knowledge and presumptive role in ecology[J]. Biogeochemistry, 2007, 83(1-3): 29-47.
[15] Lancelot C, Keller M D, Rousseau V, et al. Autoecology of the Marine Haptophyte Phaeocystis sp. In: Anderson D M, Cemballa A D, Hallegreff G M eds. Physiological Ecology of Harmful Algal Blooms[M]. New York: Springer, 1998: 209-224.
[16]尹平河,王梅,赵玲等.球形棕囊藻的荧光光谱特征及定量测定[J].分析测试学报, 2006, 25(2): 56-59.
[17] van Rijssel M, Hamm C E, Gieskes W W C. Phaeocystis globosa (Prymnesiophyceae) colonies: hollow structures built with small amounts of polysaccharides[J]. European Journal of Phycology, 1997, 32(2): 185-192.
[18] Janse I, van Rijssel M, Gottschal J C, et al. Carbohydrates in the North Sea during spring blooms of Phaeocystis: a specific fingerprint[J].Aquatic Microbial Ecology, 1996, 10(1): 97-103.
[19]王艳,王小冬,李韶山.充气和搅动对球形棕囊藻生长及囊体形成的影响[J].生态学报, 2010, 30(12): 3368-3374.
[20] Ploug H, Stolte W, Jørgensen B B. Diffusive boundary layers of the colony-forming plankton alga Phaeocystis sp. -implications for nutrient uptake and cellular growth[J]. Limnology and Oceanography, 1999, 44(8): 1959-1967.
[21] Peperzak L, Colijn F, Koeman R, et al. Phytoplankton sinking rates in the Rhine region of freshwater influence[J]. Journal of Plankton Research, 2003, 25(4): 365-383.
[22] Verity P G, Medlin L K. Observations on colony formation by the cosmopolitan phytoplankton genus Phaeocystis [J]. Journal of Marine Systems, 2003, 43(3-4): 153-164.
[23]赵卫红,崔鑫,王江涛,等.赤潮水体中胶体物质对赤潮异弯藻(Heterosigma akashiwo)和中肋骨条藻(Skeletonema costatum)生长的影响[J].生态学报, 2009, 29(2): 573-580.
[24]俞秀霞.厦门同安湾海域一次三相型赤潮及其成因分析[J].福建水产, 2012, 34(3): 203-206.
[25]洪君超,黄秀清,蒋晓山.长江口赤潮多发区的一次中肋骨条藻赤潮现象观察[J].海洋环境科学, 1992, 11(3): 75-79.
[26]霍文毅,俞志明,邹景忠,等.胶州湾中肋骨条藻赤潮与环境因子的关系[J].海洋与湖沼, 2001, 32(3): 311-318.
[27]费岳军,蒋红.舟山朱家尖海域角毛藻赤潮与环境因子关系的研究[J].海洋环境科学, 2008, 27(1): 38-41.
[28]陈菊芳,徐宁,江天久,等.中国赤潮新记录种--球形棕囊藻(Phaeocystis globosa)[J].暨南大学学报(自然科学版), 1999, 20 (3): 124-129.
[29]徐宁,齐雨藻,陈菊芳,等.球形棕囊藻(Phaeocystis globosa Scherffel)赤潮成因分析[J].环境科学学报, 2003, 23(1): 113-118.
[30]Grattepanche J D, Breton E, Brylinski J M, et al. Succession of primary producers and micrograzers in a coastal ecosystem dominated by Phaeocystis globosa blooms[J]. Journal of Plankton Research, 2011, 33(1): 37-50.
[31]Lamy D, Obernosterer I, Laghdass M, et al. Temporal changes of major bacterial groups and bacterial heterotrophic activity duringa Phaeocystis globosa bloom in the eastern English Channel[J]. Aquatic Microbial Ecology, 2009, 58(1): 95-107.
[32] Saiz E, Calbet A, Isari S, et al. Zooplankton distribution and feeding in the Arctic Ocean during a Phaeocystis pouchetii bloom [J]. Deep Sea Research Part I: Oceanographic Research Papers, 2013, 72: 17-33.
[33]孔凡洲,于仁成,张清春,等.对桑沟湾海域一次藻华事件原因种的初步分析[J].海洋环境科学, 2012, 31(6): 824-829.
[34]刘爱英,宋秀凯,秦华伟,等. 2011年烟台四十里湾微微型金藻褐潮分析[J].海洋湖沼通报, 2013, (3): 73-79.
[35]王璐,韩笑天,张洪亮,等.红色中缢虫的生物学特征及其爆发赤潮成因分析[J].海洋科学, 2008, 32(2): 80-84.
Application of automatic monitoring buoy in early warning for algal blooms in offshore area
LI Tian-shen, LAN Wen-lu, LU Yin-si, XIE Xin
(Marine Environmental Monitoring Center of Guangxi, Beihai 536000 China)
Abstract:Differences in changes of automatic monitoring data of Guinardia flaccida bloom in February 2012 and Phaeocystis globosa bloom in February 2014 were studied using automatic monitoring buoy data in the Beibu Gulf in Guangxi. The contents of DO、pH and chlorophyll appeared synchronous changing trend, while DO and chlorophyll increased significantly in Guinardia flaccida bloom. However, during Phaeocystis globosa bloom, DO、pH and chlorophyll did not change significantly, which related to the physiological and ecological habit of Phaeocystis globosa. Automatic monitoring buoy could play a good role in monitoring and early warning for red tide of high chlorophyll-containing of phytoplankton, such as diatom. However, using automatic monitoring buoy in early warning for bloom of pico-phytoplankton, mixed and heterotrophic nutrition species, remains to be further studied.
Key words:automatic monitoring;algal blooms;early warning
作者简介:李天深(1981-),男,工程师,硕士,主要从事近岸海域自动及生态监测方面研究。E-mail:litianshen@126.com
基金项目:国家环境保护公益性行业科研专项(201309008);广西自然科学基金(2013GXNSFBA019224;2013GXNSFAA019281);广西科学研究与技术开发计划(桂科攻14124004- 3-13;桂科合14125008-2-8)
收稿日期:2014-5-23
DOI:10.11737/j.issn.1003-0239.2015.01.011
中图分类号:X55
文献标识码:A
文章编号:1003-0239(2015)01-0070-09

