溶剂沉降法纯化猪软骨中硫酸软骨素
高 蕊,王 鑫,宋志鹏,苏 杨,于 淼,杨志伟,林 平
(哈尔滨商业大学 食品工程学院 省高校食品科学与工程重点实验室,哈尔滨 150076)
溶剂沉降法纯化猪软骨中硫酸软骨素
高 蕊,王 鑫,宋志鹏,苏 杨,于 淼,杨志伟,林 平
(哈尔滨商业大学 食品工程学院 省高校食品科学与工程重点实验室,哈尔滨 150076)
采用猪软骨为原料,以硫酸软骨素得率为指标,对有机溶剂纯化硫酸软骨素的方法进行研究.以乙醇为溶剂,选择硫酸软骨素提取液和乙醇体积比,乙醇体积分数,氯化钠质量浓度,pH值,醇沉次数为影响因素纯化硫酸软骨素,采用正交实验确定最佳纯化工艺条件.实验结果表明,硫酸软骨素最佳纯化条件为:提取液和乙醇体积比为1∶25,乙醇体积分数为80%,NaCl质量浓度为30 g/L,pH值为6.4,醇沉次数为3次,硫酸软骨素得率为56.76%.
硫酸软骨素;乙醇沉降法;纯化;软骨
硫酸软骨素(chondroitin sulfate, CS),别名牛磺软骨素和康得宁等,是共价连接在蛋白质上形成蛋白聚糖的一种广泛存在于动物结缔组织中的酸性粘多糖[1-2],其糖链由交替的D-葡萄糖醛酸以β-1,3糖苷键与N-乙酰半乳糖胺(又称N-乙酰-D-氨基半乳糖)链接形成二糖,而二糖单位之间则是通过一个似糖链街区连接到核心蛋白的丝氨酸残基上,以β-1,4糖苷键连接而成[3-4].干燥软骨中含有约20%~40%的CS,且因提取于不同年龄、种类、部位以及疾病等的动物软骨而有不同的种类和含量[5].CS 是一种白色或略带黄色的粉末状物质,无臭、无味,因有羧基、羟基、硫酸基等极性基团存在其分子结构中而拥有比较强的吸湿性、易溶于水,且水溶液具有黏稠性,加热不凝结,温度超过60 ℃则会发生降解;CS不溶于甲醇、乙醇、丙酮、乙醚和冰醋酸等有机溶剂,系一种生化产品,迄今为止尚无法人工合成[6].但目前尚存在纯化工艺复杂、费时、成本高、产品质量不稳定、得率低等问题[7-8].因此,优化硫酸软骨素纯化工艺提高产品得率和纯度,提高畜禽产业的附加值,迫在眉睫.
1 材料与方法
1.1 实验材料
猪月牙骨,市售;硫酸软骨素粗提物,实验室自制
1.2 主要试剂与仪器
咔唑(上海源叶生物科技有限公司)无水乙醇(哈尔滨市宏利达盛有限公司);氢氧化钠(沈阳盛金隆有限公司);盐酸(北京俱时化工);氯化钠(山东恒天化工);浓硫酸(哈尔滨市化工试剂厂);FZ102机型微型植物粉碎机(天津市泰斯特仪器有限公司);TU-1900 型双光束紫外分光光度计(普析通用仪器有限责任公司);TDL80-2B型低速台式离心机(上海安亭科学仪器厂);恒温水浴振荡器(上海一恒科学仪器有限公司);DK-98-1型电子恒温水浴箱(天津市泰斯特仪器有限公司);ALC-1100.2型电子分析天平(北京赛多利斯仪器系统有限公司);便携式pHS-3C型数字精密pH计(中国上海仪器厂).
1.3 实验方法
1.3.1猪软骨中CS提取
称取一定质量的猪软骨,平均等份置于250 mL烧杯中,按照猪软骨和2.5%NaOH溶液1∶6比例添加,计算溶液浓度,用NaCl溶液调至浓度达2.5 mol/L,并使溶液pH值达到12~13,在水浴温度为35 ℃中振荡24 h保留上清液备用.调节上清液pH值为7~8,迅速升温至80~90 ℃,保持20 min后冷却过滤,得到盐解液.调节盐解液pH值为2~3,搅拌10 min后静置.调节过滤后上清液pH值至6.5,加去离子水使溶液的NaCl浓度达到1 mol/L.上述备用溶液加入无水乙醇(95%),使乙醇的体积分数达到50%~60%,采用无水乙醇洗涤沉淀3~4次,真空干燥后即得CS粗品[9].
1.3.2最大吸收波长的确定
配制质量浓度为0.125 g/ L 的CS标准品溶液,取1mL于冰水浴中冷却后加入6.00 mL浓硫酸,振荡均匀后于100 ℃中加热20 min,迅速冷却后加入0.20 mL质量浓度为1.00 g/L 的咔唑溶液,,摇匀后置于100 ℃中加热15 min,显色,迅速冷却至室温[10].采用无醛乙醇作为空白溶液,双光束紫外分光光度计在波长于400~600 nm范围内进行扫描,确定CS最大吸收波长.
1.3.3硫酸软骨素纯化的单因素试验
1)提取液和乙醇体积比的选择
取5个烧杯,分别吸取硫酸软骨素粗提物溶液(0.3 g硫酸软骨素粗提物和1 mL蒸馏水),分别加入30 g/L的NaCl,调节pH值至6.4,加入体积分别为5、10、15、20、25 mL的75%的乙醇,静置1 h后,500 r/min离心5 min,弃去上清液后沉淀用少量无水乙醇洗涤脱水,于 60 ℃真空干燥箱中干燥,计算CS得率,确定提取液和乙醇的最佳体积比.
2)纯化溶剂乙醇体积分数的选择
取5个烧杯,分别吸取硫酸软骨素粗提物溶液(0.3 g硫酸软骨素粗提物和1 mL蒸馏水),分别加入30 g/L的NaCl,调节 pH值至6.4,加入20 mL体积分数分别为 60、65、70、75、80%的乙醇,静置1 h后,500 r/min离心5 min,弃去上清液后沉淀用少量无水乙醇洗涤脱水,于 60 ℃真空干燥箱中干燥,计算CS得率,确定纯化CS的最佳乙醇体积分数.
3、)纯化溶剂NaCl质量浓度的选择
取5个烧杯,分别吸取硫酸软骨素粗提物溶液(0.3 g硫酸软骨素粗提物和1 mL蒸馏水),分别加入10、20、30、40、50 g/L的NaCl,调节 pH值至6.4,分别加入20 mL 体积分数为75%的乙醇,静置1 h后,500 r/min离心5 min,弃去上清液后沉淀用少量无水乙醇洗涤脱水,于 60 ℃真空干燥箱中干燥,计算CS得率,确定纯化CS的最佳NaCl质量浓度.
4)pH值的选择
取5个烧杯,分别吸取硫酸软骨素粗提物溶液(0.3g硫酸软骨素粗提物和1mL蒸馏水),分别加入30 g/L的NaCl,调节pH值分别为6.1、6.2、6.3、6.4、6.5,分别加入20 mL 体积分数为75%的乙醇溶液,静置1 h后,500 r/min离心5 min,弃去上清液后沉淀用少量无水乙醇洗涤脱水,于 60 ℃真空干燥箱中干燥,计算CS得率,确定纯化CS最佳pH值.
5)醇沉次数的选择
取5个烧杯,分别吸取硫酸软骨素粗提物溶液(0.3 g硫酸软骨素粗提物和1 mL蒸馏水),分别加入30 g/L的NaCl,调节pH至6.4,分别加入75%的乙醇20 mL,分别醇沉1、2、3、4、5次,静置1 h后,500 r/min离心5 min,弃去上清液后沉淀用少量无水乙醇洗涤脱水,于60 ℃真空干燥箱中干燥,计算CS得率,确定纯化最佳醇沉次数.
1.3.4正交试验法优化CS纯化的工艺条件
根据单因素实验的结果,选择影响纯化效果的四个主要因素:提取液与乙醇体积比(A)、乙醇体积分数(B)、NaCl质量浓度(C),醇沉次数(D)采用正交设计表L9(34)安排实验.见表1.

表1 CS纯化因素与水平表
1.3.5验证实验
将CS粗提取物按有机溶剂法纯化后的最佳条件进行三次平行试验,沉淀物干燥后称量,计算出硫酸软骨素得率.
1.3.6CS的定性实验
将CS提取物采用硫酸-咔唑法显色后,在400~600 nm范围内扫描,比较猪软骨中CS提取物与CS标准品图谱的出峰位置及峰形,对所提物质进行定性实验.
2 结果与讨论
2.1 最大吸收波长确定结果与分析
由图1可以看出,CS标准品溶液在526 nm有最大吸收峰,因此选择526 nm为CS最大吸收波长.
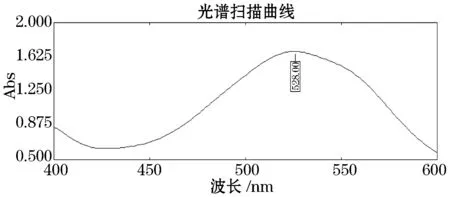
图1 CS标准品扫描图谱
2.2 溶剂沉降法纯化CS的单因素试验结果与分析
选取影响有机溶剂法纯化CS的主要因素:提取液和乙醇体积比,乙醇体积分数,氯化钠质量浓度,pH值及醇沉次数分别进行单因素实验,以CS得率为指标,确定影响有机溶剂法纯化CS的主要因素,为正交实验提供依据.
2.2.1提取液和乙醇体积比对纯化效果的影响
如图2所示,当粗提取液与乙醇体积比从1∶5至1∶20时,CS得率明显增加;当提取液与乙醇体积比为1∶20时,CS得率最高;当提取液与乙醇体积比大于1∶20时,CS得率呈下降趋势.因此体积比的最佳比例为1∶20.
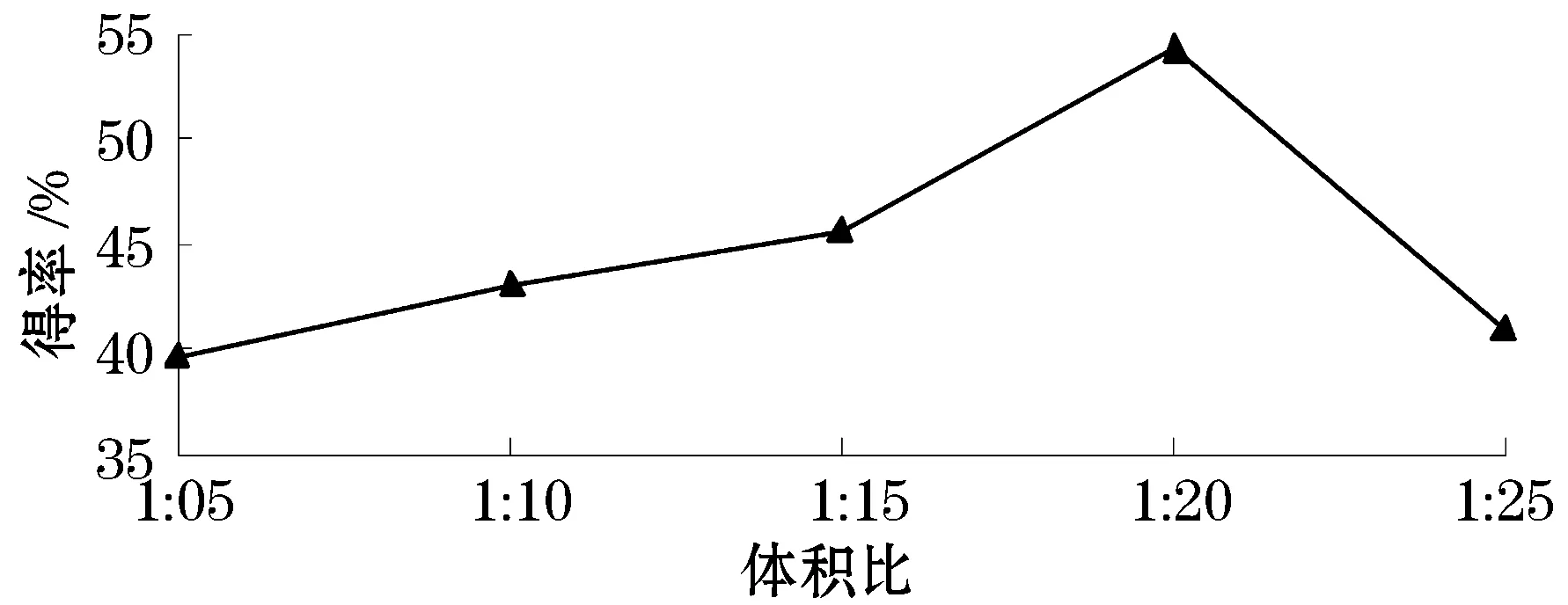
图2 体积比对纯化效果的影响
2.2.2乙醇体积分数对纯化效果的影响
如图3所示,乙醇体积分数在60%~70%时,CS得率有所增加;乙醇体积分数在70%~75%时,CS得率趋于平稳;乙醇体积分数为75%时,CS得率最高;当乙醇体积分数大于75%时,由于乙醇体积分数升高导致CS得率下降.乙醇沉淀CS的原理在于加入乙醇后的CS水溶液介电常数降低,破坏了CS分子表面溶剂化水膜,导致带电基团之间的作用力增加,分子间相互聚集,使CS沉淀.随溶剂体积分数的增加,沉淀物中CS质量和纯度也随之增大,当乙醇体积分数继续增大时,物质本身其他杂质成分(如蛋白等)也随之沉淀.因此乙醇的最佳体积分数为75%.

图3 乙醇体积分数对纯化效果的影响
2.2.3氯化钠质量浓度对纯化效果的影响
如图4所示,NaCl质量浓度在10~30 g/L时,CS得率明显上升;当NaCl质量浓度在30 g/L时,CS得率取得最大值;当NaCl质量浓度大于30 g/L时,CS得率明显下降.由于CS与水溶液之间具有强烈的吸附作用,为使CS沉淀,必须破坏水溶液在胶体微粒之间形成的高分子水化层.NaCl对纯化效果的影响包括NaCl 与CS争夺水分子和NaCl 使水分子极化而定向排列两方面.减弱CS与水溶液的结合力使其失去水化层,导致溶解度降低;另一方面定向排列导致水的活度降低而减弱其与CS的水合作用.但避免溶液中其他杂质的溶出,选择NaCl的最佳质量浓度为30 g/L.

图4 氯化钠质量浓度对纯化效果的影响
2.2.4pH值对纯化效果的影响
如图5所示,当pH值从6.1~6.3时,CS得率明显上升;当pH值在6.3~6.4时,CS得率趋于平稳;当pH值6.4时,CS得率最高;当pH值大于6.4时,CS得率呈下降趋势.CS属于两性化合物,pH值的变化会影响在醇沉体系中的溶解度,净电荷数少时,分子间吸引力增加,相互凝聚而产生沉淀也随之增加.因此最佳pH值为6.4.

图5 pH值对纯化效果的影响
2.2.5醇沉次数对纯化效果的影响
如表2所示,醇沉次数小于4次时,纯化物中CS含量随醇沉次数增多而增加;当醇沉次数为4次时,CS得率为最大;当醇沉次数大于4次时,CS得率下降.CS含量随醇沉次数增加而增加,由于猪软骨中粗提物中蛋白质、氨基酸等杂质会随着醇沉次数的增多而逐渐减少,猪软骨CS纯化物中的葡萄糖醛酸含量随之增加,但CS的得率降低.因此选择最佳醇沉次数为4次.

表2 猪软骨CS醇沉次数对纯化效果的影响
2.3 正交试验法优化硫酸软骨素纯化的工艺条件结果与分析
通过正交试验确定最佳的纯化工艺,为了使实验数据更加准确,每组实验均做3次的平行实验,考察指标为CS得率,其实验结果见表3.

表3 溶剂沉降法纯化CS正交试验结果表
由表4的极差分析可知,各因素对CS 得率影响的大小顺序为A > C > D > B,即CS提取液与乙醇体积>NaCl质量浓度>醇沉次数>乙醇体积分数.最佳的因素水平组合为A3B2C3D1.即体积比1∶25,乙醇体积分数75%,NaCl质量浓度40 g/L,醇沉次数3次.

表4 正交试验方差分析表
2.4 验证实验结果与分析
由表5所示,经3次平行实验,计算CS得率为53.03%.但是正交设计试验中第9组的CS得率为56.76%,大于正交试验法优化的CS得率53.03%,因此对验证实验结果进行显著性分析.经t检验显著性分析后得知,第9组实验和正交试验法优化后的实验得率之间显著性(P<0.05),选择第9组,即纯化的最佳条件为提取液与乙醇体积比为1∶25,乙醇体积分数为80%,氯化钠质量浓度为30 g/L,醇沉次数为3次,硫酸软骨素得率为56.76%.

表5 验证实验结果分析表
2.5 定性试验结果与分析
由图6可见,CS准品在最大吸收波长526 nm处有较稳定的吸收峰,以此确定猪软骨中CS的最大吸收波长为526 nm.从猪软骨中提取的CS纯化后的样品与CS标品的出峰位置及峰形一致,因此确定纯化物为硫酸软骨素.
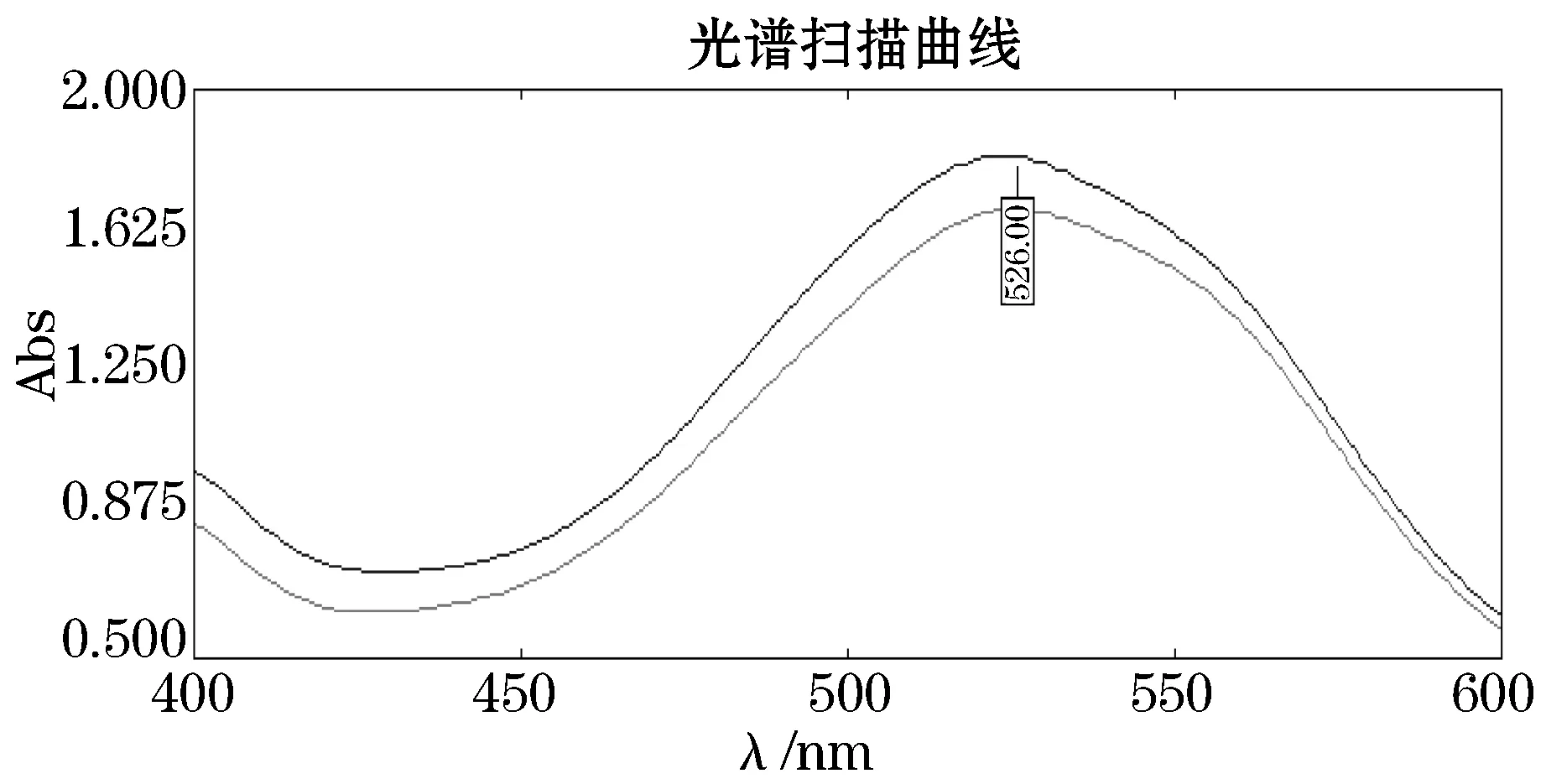
图6 硫酸软骨素标品与样品紫外扫描图谱
3 结 语
采用市售猪软骨为原料,以CS纯化后得率为指标,对溶剂沉降法进行研究,以乙醇为主要溶剂,选择硫酸软骨素粗提取物溶液体积和乙醇体积比,
醇沉体系的乙醇体积分数,NaCl质量浓度,pH值,重复沉淀次数为影响因素纯化硫酸软骨素,得出以下结论:硫酸软骨素的最佳纯化工艺条件为:硫酸软骨素粗提取物溶液体积和乙醇体积比为1∶25,醇沉体系的乙醇体积分数为80%,NaCl质量浓度为30 g/L,重复沉淀3次,通过紫外光谱分析,证明猪软骨CS纯化后的物质与CS标准品峰形位置一致,证明从猪软骨中纯化后的物质是CS,纯化得率为56.76%.
[1] 陈红丽,杨永锋,于建军.胃蛋白酶提取硫酸软骨素的研究[J].应用化工, 2009, 38(12): 1766-1768.
[2] 卢京光, 姬胜利, 张尊建. 硫酸软骨素及其衍生物的研究进展[J]. 中国海洋药物杂志, 2006, 25(1): 59-63.
[3] SIMANEK V, KREN V, ULRICHOVA J,etal. The efficacy of glucosamine and chondroitin sulfate in the treatment of osteoarthritis:Are these saccharides drugs or nutraceuticals [J]. Biomed Pap Med Fac Univ Palacky Olomouc Czech Repub, 2005, 149(1): 51-56.
[4] 徐传屯, 关瑞章, 郑 江. 硫酸软骨素测定方法的研究进展[J]. 集美大学学报:自然科学版, 2008, 13(1): 52-56.
[5] 卢京光, 姬胜利, 张尊建. 硫酸软骨素及其衍生物的研究进展[J].中国海洋药物杂志, 2006, 25(1): 59-63.
[6] 李瑞国. 硫酸软骨素不同生产工艺的考察[J]. 中国医药杂志, 2003, 34(5): 221-222.
[7] 谢果凰. 鲨鱼硫酸软骨素的分离提纯及其抗氧化功能的研究[D].宁波: 宁波大学, 2010. 1-54.
[8] 苏现波, 刘安军. 羊软骨粘多糖的提取与分离[J]. 食品工业科技, 2004, 25(3): 98-100.
[9] 郑志新, 孙丰梅, 石光雨. 硫酸软骨素的提取工艺研究[J]. 河北北方学院学报:自然科学版, 2008, 24(3): 37-40.
[10] 陆 钊, 杨亚楠. 咔唑分光光度法测定猪硫酸软骨素含量[J]. 安徽农业科学, 2008, 36(33): 14368-14371.
Purification of chondroitin sulfate by solvent sedimentation from pig cartilage
GAO Rui, WANG Xin, SONG Zhi-peng, SU Yang, YU Miao, YANG Zhi-wei, LIN Ping
(Key Laboratory of Food Science and Engineering, School of Food Engineering, Harbin University of Commerce, Harbin 150076, China)
Chondroitin sulfate from pig cartilage were extracted and purified with the method of solvent sedimentation by the orthogonal experiment. Five independent variables (the volume ratio of the crude chondroitin sulfate and ethanol, the ethanol concentration, the sodium chloride concentration, pH and the number of times of ethanol sedimentary) were explored. The result showed that the optimum purification conditions were as follows: the volume ratio of the crude chondroitin sulfate and ethanol, the ethanol concentration, the sodium chloride concentration, pH and the number of times of ethanol sedimentary were 1∶25, 80%, 30 g/L, 6.4 and 3, respectively. The yield of Chondroitin sulfate was up to 56.76%.
chondroitin sulfate; ethanol sedimentation; purification; cartilage
2014-09-02.
大学生创新创业训练计划项目(201410240103)
高 蕊(1993-),女,研究方向:食品营养与安全.
王 鑫(1984-),女,博士,讲师,研究方向:食品营养与安全,农产品加工及贮藏.
S2
A
1672-0946(2015)05-0593-05

