新城疫病毒F基因的克隆表达及重组蛋白的反应原性分析
曲光刚,李佃场,李茂峰,金婷婷,武曰星,王长江,刘博,高三阳
(1.山东省滨州畜牧兽医研究院博士后科研工作站,山东滨州 256600;2.吉林大学博士后流动站,长春130062;3.山东省滨州畜禽蜂胶疫苗研究开发推广中心,山东滨州 256600;4. 山东省青岛市即墨市畜牧兽医局,山东青岛266200;5.山东绿都生物科技有限公司,山东滨州 256600)
新城疫病毒F基因的克隆表达及重组蛋白的反应原性分析
曲光刚1,2,3,李佃场4,李茂峰5,金婷婷5,武曰星5,王长江5,刘博5,高三阳1*
(1.山东省滨州畜牧兽医研究院博士后科研工作站,山东滨州 256600;2.吉林大学博士后流动站,长春130062;3.山东省滨州畜禽蜂胶疫苗研究开发推广中心,山东滨州 256600;4. 山东省青岛市即墨市畜牧兽医局,山东青岛266200;5.山东绿都生物科技有限公司,山东滨州 256600)
为分析新城疫病毒(NDV)融合蛋白(F)及其突变体(Fm)基因的反应原性,以携带有NDV-F和NDV-Fm基因的质粒为模板设计引物,PCR扩增产物经双酶切后分别连入原核表达载体pET-SUMO、pET-28a,构建重组质粒pET-SUMO-F、pET-28a-Fm,将重组质粒转化入宿主菌Rosetta 2感受态细胞,在IPTG诱导下表达。SDS-PAGE和Western blotting结果显示,NDV-F和NDV-Fm在原核系统中表达后分别获得了相对分子量为64.7 kD和48.7 kD的重组蛋白;重组蛋白能被抗NDV鸡阳性血清识别。试验表明,NDV-F和NDV-Fm可以在原核系统中表达,且具有良好的反应原性。
新城疫病毒;F蛋白;原核表达;反应原性
新城疫(Newcastle disease, ND)被我国列为1类疫病,它是由新城疫病毒(Newcastle disease virus,NDV)引起的一种急性、烈性传染性疫病,给全球养禽业带来巨大的经济损失[1]。NDV囊膜上的融合蛋白(Fusion protein, F)在介导病毒与细胞融合、穿入细胞和产生溶血方面发挥重要作用,同时它也能诱导机体产生中和性抗体,因此,F蛋白已成为人们研制亚单位疫苗、重组疫苗等新型疫苗的首选抗原[2-4]。裂解位点是F蛋白的重要区域,它位于F蛋白前体第112~117位氨基酸残基处,F蛋白活性的发挥需要裂解位点处的断裂,它是决定毒力强弱的关键部位[5]。
近年来,针对F蛋白的研究日益频繁,在原核表达方面,多数研究者倾向于利用基因工程手段来实现F基因部分功能片段的表达或基因片段的串联表达[2, 6-7]。而NDV F 基因全序列表达则少见报端。本研究通过原核系统表达含NDV融合蛋白F基因及其裂解位点缺失突变体(Fm)基因,通过SDS-PAGE和Western blotting分析F和Fm基因的表达产物,为进一步研究F蛋白的功能和NDV 基因工程疫苗、亚单位疫苗奠定基础。
1 材料与方法
1.1 材料 原核表达载体pET-28a、pET-SUMO及含NDV 分离株株F及Fm基因的重组的质粒,由山东省滨州畜牧兽医研究院实验室构建保存;E.coliRosetta 2感受态细胞,由山东省滨州畜牧兽医研究院实验室自制;DNA Marker、SDS-PAGE蛋白Marker、限制性内切酶、T4 连接酶、PrimeSTAR Max DNA Polymerase,均购自大连宝生物工程有限公司;卡那霉素、IPTG购自SIGMA公司;胶回收试剂盒和质粒提取试剂盒,均购自OMEGA公司。抗鸡新城疫阳性血清,由山东绿都生物科技有限公司生产保存;酶标兔抗鸡IgG二抗,购自上海合星生物科技有限公司;增强型HRP-DAB底物显色试剂盒,购自天根生化科技(北京)有限公司。
1.2 方法
1.2.1 引物的设计与合成 根据已克隆F及Fm基因序列和原核表达质粒上的多克隆位点设计1对引物,上游引物:5’-CGGGATCCATGCTAGAGGGCACGCCACT-3’,下游引物:5’-CCCAAGCTTTTAAGCAGATGTGCAGGCTTGTCTC-3’,下划线部分为BamHⅠ和HindⅢ酶切位点。预期扩增产物分别为1407 bp(F)、1383 bp(Fm)。引物由上海生工生物工程技术服务有限公司合成。
1.2.2 目的基因的扩增 以携带NDV-F和NDV-Fm的质粒为模板,加入适量的PrimeSTAR Max Premix (2×),上下游引物,最后以无菌去离子水定容至50 μL混匀,置于PCR扩增仪上进行扩增。PCR循环参数为98 ℃ 30 s,55 ℃ 30 s,72 ℃ 30 s,35个循环。PCR产物经1%琼脂糖凝胶电泳鉴定,并通过胶回收试剂盒进行纯化回收。
1.2.3 NDV-F和NDV-Fm重组载体的构建 将纯化的PCR产物、质粒pET-SUMO和pET-28a经BamHⅠ和HindⅢ双酶切,凝胶回收试剂盒进行纯化回收。经酶切后的目的基因与载体按照10∶1摩尔比混合于10 μL反应体系中,在T4连接酶的作用下16 ℃链接2 h,将连接产物转化入E.coliDH5α感受态细胞,用含卡那霉素的LB平板筛选阳性克隆,对阳性克隆进行菌液PCR鉴定,并提取质粒送上海生工生物工程技术服务公司测序。
1.2.4 序列同源性分析 利用基因分析软件 DNAStar 7. 1 对测定的序列与 I~IX 基因型NDV 各代表株相应基因核苷酸序列进行同源性分析。1.2.5 目的蛋白的诱导表达 将鉴定为阳性的重组质粒转化入E.coliRosetta 2,挑取单菌落置于含卡那霉素(50 μg/mL)的LB固体培养基,37 ℃过夜培养,按照1%接种于的LB培养基中,37 ℃培养至吸光度(A600值)至0.5左右,取出1 mL,其余加入IPTG至终浓度为0.1 mmol/L,28 ℃诱导表达6 h,12000 r/min离心1 min收集菌体,重悬于200 μL PBS(pH7.4)中,对pET-28a-Fm重组菌和未诱导的重组菌,取50 μL重悬后的菌体,加入等体积2倍的SDS上样缓冲液,混匀,水浴煮沸10 min;对pET-SUMO-F重组菌进行冰浴超声裂解(功率200 W,持续1 s,间隔2 s,共10次),12000 r/min离心10 min,将上述样品进行SDS-PAGE,考马斯亮蓝R-250染色,分析重组蛋白的表达和可溶性。
1.2.6 蛋白质印记(Western blotting)分析 将表达的重组蛋白进行SDS-PAGE电泳,蛋白条带采用电转移法转移至醋酸纤维素膜上,经 3% 的脱脂奶粉封闭后,在鸡抗NDV抗体(1∶500)中室温下孵育1 h,然后用含有0.05% Tween 20 的PBS洗膜5次,每次5 min。将醋酸纤维素膜在1∶10000的兔抗鸡IgG-HRP 二抗中室温条件下孵育1 h,然后用含有0.05% Tween 20 的PBS洗膜5次,每次5 min。参照增强型HRP-DAB底物显色试剂盒说明书操作进行显色并用成像仪拍照。
2 结果
2.1 原核表达载体的构建 采用设计合成的引物,对含有目的基因的质粒进行PCR扩增,获得与目的片段
大小一致的条带;同时对目的产物进行纯化、酶切,分别连接到pET-28a、pET-SUMO,并转化E.coliDH5α感受态细胞,经菌液PCR鉴定为阳性,测序结果也表明序列完全一致,说明重组质粒构建成功,并将其命名为pET-SUMO-F和pET-28a-Fm(图1)。
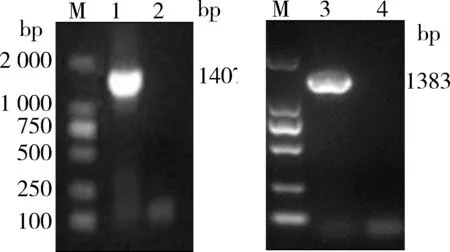
M.DNA标志物;1.F的PCR产物;2.阴性对照;3.Fm的PCR产物;4.阴性对照
2.2 系统进化树分析 根据与NDV各基因型F基因对应核苷酸序列对分离毒株进行基因分型,并绘制遗传进化树。图2结果显示,本实验用序列(NDV-F Isolation)与基因VII型代表株TW-2000和CH-A7-96处于进化树同一分支,同属于基因VII型。

图2 根据F基因核苷酸序列构建的NDV分离株和参考株系统进化树
2.3 表达产物 SDS-PAGE电泳分析将阳性质粒分别转化至E.coliRosetta 2,对其表达产物进行SDS-PAGE电泳分析,pET-SUMO-F重组菌在沉淀中出现于预期大小64.7 kD相一致的条带,而其对应的上清和未经诱导的重组菌则无此条带;pET-28a-Fm重组菌中显示48.7 kD的条带,与预期大小相符,而未经诱导的重组菌没有明显的条带出现,说明两个重组蛋白成功获得表达,且主要以包涵体形式表达(图3)。

M.蛋白标志物;1.pET-28a-F/R2超声裂解后上清;2.pET-28a-F/R2超声裂解后沉淀;3. pET-28a-F未诱导;4. pET-SUMO-Fm未诱导;5.pET-SUMO-Fm诱导
2.4 NDV F和NDV Fm重组蛋白的Western blotting分析 对原核表达产物的Western blotting分析显示,NDV F和NDV Fm重组蛋白能被抗NDV阳性二抗和兔抗鸡二抗识别,在64.7 kD和48.7 kD处可见特异性条带,而未诱导菌无此条带(图4),表明所表达的蛋白具有较好的反应原性。

1.pET-SUMO-F的表达产物;2. pET-28a-Fm的表达产物3.阴性对照;4.蛋白Marker
3 讨论
最近研究表明当前流行的NDV的基因型与广泛使用的疫苗株不同[8-9]。目前正在使用的疫苗不能应对当下流行基因型病毒引起的感染、排毒和疾病。感染和排毒使病毒在环境中反复传播,并且提供了一个可供病毒种群变异并适应免疫压力的环境[10]。因此,研究新城疫致病机理显得更为重要。
NDV表面的F蛋白介导两个感染或未感染的细胞质膜之间、或病毒与宿主细胞膜之间的膜融合,参与病毒的穿透,细胞融合和溶血等作用,是决定NDV毒性的主要因素。本研究通过Overlap技术将野生型NDV的裂解位点GGRRQKRF缺失,获得1383 bp的突变F基因(Fm),并在E.coliRosetta 2原核系统中成功高效表达了NDV F基因及其突变体Fm基因,诱导温度为28 ℃,IPTG终浓度为0.1 mmol/L,诱导6 h。Western blotting结果证明,该重组F蛋白和Fm蛋白均能够与NDV多抗血清特异性结合,具有很好的反应原性。
综上所述,本研究成功建立了新城疫病毒F基因和其突变体Fm基因的原核表达体系,并用Western blotting证明具有较高的免疫活性,这些都为进一步研究鸡新城疫F蛋白分子免疫学功能极其应用提供了实验材料,同时也为了进一步制备NDV单克隆抗体、研究其生物学功能和NDV工程疫苗的研发奠定了基础。
[1] Alexander D J. Newcastle disease and other avian paramyxo-viruses[J]. Rev Sci Tech, 2000,19(2): 443-462.
[2] 孟凡涛, 陈芳芳, 余为一. 鸡新城疫病毒F基因片段的原核表达及其抗F蛋白单克隆抗体的制备[J]. 安徽农业科学, 2012,(26): 12915-12916.
[3] Samal S, Khattar S K, Paldurai A,etal. Mutations in the cytoplasmic domain of the Newcastle disease virus fusion protein confer hyperfusogenic phenotypes modulating viral replication and pathogenicity[J]. J Virol, 2013,87(18): 10083-10093.
[4] Yan Y, Samal S K. Role of intergenic sequences in Newcastle disease virus RNA transcription and pathogenesis[J]. J Virol, 2008,82(3): 1323-1331.
[5] 李景芬, 刘莉. 新城疫病毒F蛋白的研究进展[J]. 安徽农业科学, 2010,(5): 2386-2388.
[6] 贺泂杰, 时永杰. 鸽源新城疫病毒F基因的克隆与原核表达[J]. 中国兽医科学, 2014,(7): 742-746.
[7] 程宝艳, 彭明义, 余为一, 等. 新城疫病毒F蛋白抗原表位串联基因的构建及其原核表达[J]. 中国兽医学报, 2010,(6): 734-737.
[8] Cho S H, Kwon H J, Kim T E,etal. Characterization of a recombinant Newcastle disease virus vaccine strain[J]. Clin Vaccine Immunol, 2008,15(10): 1572-1579.
[9] Miller P J, Decanini E L, Afonso C L. Newcastle disease: evolution of genotypes and the related diagnostic challenges[J]. Infect Genet Evol, 2010,10(1): 26-35.
[10]Perozo F, Marcano R, Afonso C L. Biological and phylogenetic characterization of a genotype VII Newcastle disease virus from Venezuela: efficacy of field vaccination[J]. J Clin Microbiol, 2012,50(4): 1204-1208.
(编辑:李文平)
Cloning, Expression and Western blotting Analysis of Newcastle Disease Virus F Gene
QU Guang-gang1,2,3,LI Dian-chang4, LI Mao-feng5,JIN Ting-ting5,WU Yue-xing5, WANG Chang-jiang5,LIU Bo5,GAO San-yang1*
(1.PostdoctoralProgramme,ShandongBinzhouAnimalScience&VeterinaryMedicineAcademy,Binzhou,Shandong256600,China; 2.PostdoctoralProgramme,JilinUniversity,Changchun130062,China; 3.ShandongBinzhouResearch,DevelopmentandPromotionCenterforLivestockandPoultryPropolisVaccine,Binzhou,Shandong256600,China; 4.AnimalHusbandryandVeterinaryBureauofJimo,Qingdao,Shandong266200,China; 5.ShandongLvduBiotechnologyCo.,Ltd.,Binzhou,Shandong256600,China)
To clone and express the fusion protein and its mutants of Newcastle disease virus (NDV),and analyze the immunogenicity, primers were designed with plasmid carrying the gene of fusion protein and its mutants of NDV as template, and DNA fragments were amplified from recombinant plasmids carrying the target gene. After treatment with double restriction enzyme,the product of PCR was inserted into pET-SUMO and pET-28a respectively, getting two recombinant plasmids named pET-SUMO-F and pET-28a-Fm.Recombinant plasmids were transformed intoE.coliRosetta 2 then induced by IPTG. The products of recombinant plasmids were verified by SDS-PAGE, which showed that two recombinant plasmids expressed recombinant proteins whose relative molecular weight of recombinant proteins was 64.7 kD and 48.7 kD respectively. Western blotting results revealed that both of the recombinant proteins can be recognized by chicken positive serum.It can be concluded that NDV-F and NDV-Fm can be expressed in prokaryotic expression system, and the recombinant proteins have good reactogenicity.
Newcastle disease virus; fusion protein; prokaryotic expression; reactogenicity
山东省自然科学基金资助项目(ZR2013CQ004,ZR2011CM004)
曲光刚,博士,从事病原源性免疫调节因子免疫调节功能的研究。
高三阳。E-mail:gaosanyang87@163.com
2015-06-01
A
1002-1280 (2015) 09-0007-04
S858.31

