硫醚环化B螺旋肽通过抑制内质网应激减轻HK-2细胞的氧化应激损伤
李龙 郑龙 胡超 林淼 龙亚秋 戎瑞明
(1.复旦大学附属中山医院泌尿外科,上海 200032;2.中国科学院上海药物研究所,上海 201203)
·论著·
硫醚环化B螺旋肽通过抑制内质网应激减轻HK-2细胞的氧化应激损伤
李龙1△郑龙1△胡超1林淼1龙亚秋2戎瑞明1
(1.复旦大学附属中山医院泌尿外科,上海200032;2.中国科学院上海药物研究所,上海201203)
摘要目的:通过体外实验探讨硫醚环化B螺旋肽(thioether-cyclized helix B peptide, CHBP)对肾小管上皮细胞的保护作用及机制。方法: 体外培养人近端肾小管上皮细胞(human renal proximal tubular cell line, HK-2) 并分为Control组、H2O2组和CHBP组。H2O2组和CHBP组均通过500 μmol/L H2O2刺激4 h建立氧化应激损伤模型。CHBP组在建立氧化应激损伤模型1 h前加入20 nmol/L的CHBP。500 μmol/L H2O2刺激4 h后,检测细胞的活性、凋亡情况以及氧化应激损伤程度。采用Western blotting和PCR技术检测连接免疫球蛋白(binding immunoglobulin protein, BiP)、C/EBP同源蛋白(C/EBP homologous protein, CHOP)以及下游NFE2相关因子2(NF-E2-related factor 2, Nrf2)信号通路中的分子表达水平,判断内质网应激水平。结果:CHBP预处理可以减轻氧化应激导致的细胞毒性损伤;CCK-8试剂盒和原位末端标记法(TUNEL)检测发现,CHBP预处理后细胞活性增加,凋亡减少,氧化应激和内质网应激水平下降。CHBP组Nrf2和血红素氧合酶1(heme oxygenase-1, HO-1)水平较H2O2组显著升高。结论:CHBP预处理可以减轻HK-2细胞的氧化应激损伤,这一保护作用可能是通过抑制内质网应激和激活下游Nrf2信号通路实现的。
关键词硫醚环化B螺旋肽;肾脏;肾小管上皮细胞;ER应激
△李龙和郑龙对本文有同等贡献,为共同第一作者。
在许多疾病的发展和治疗过程中都可能出现肾脏缺血再灌注损伤(ischemia reperfusion injury, IRI)[1]。发生肾脏IRI时,肾小管上皮细胞(tubular epithelial cells, TECs)损伤的潜在机制包括免疫损伤、线粒体失功、内质网(endoplasmic reticulum, ER)应激以及半胱天冬酶caspase级联反应[2]。预防TECs凋亡对于治疗肾脏IRI尤为重要。
线性B螺旋表面肽HBSP(helix B surface peptide, HBSP)来源于促红细胞生成素(erythropoietin, EPO)中非促红细胞生成作用的B组螺旋表面疏水段,已证实它在多个器官的IRI中有保护作用[3-4]。研究表明,HBSP在治疗IRI时比EPO更具优势,因前者不作用于促红细胞生成受体,故不会使红细胞生成过多而导致血液黏滞。然而,HBSP的半衰期仅为2 min,限制了其临床应用[3]。我们在前期研究[5]中通过对HBSP进行环化处理而合成了硫醚环化B螺旋肽(thioether-cyclized helix B peptide, CHBP)。CHBP的稳定性高于HBSP,且在肾脏发生IRI时可以保护肾功能,减轻组织炎性反应和细胞凋亡。本研究旨在探讨CHBP在体外的有效性及发挥保护作用的机制。
ER应激在肾脏IRI进程和TECs凋亡中发挥重要作用[6]。在IRI过程中,氧化应激干扰氧化还原反应平衡,导致ER腔中错误折叠和展开的蛋白积累,从而引起ER应激[7]。异源性蛋白,比如使分子伴侣解离的连接免疫球蛋白(binding immunoglobulin protein, BiP)的相互作用可以启动ER应激。ER应激中的特异反应称为未折叠蛋白反应(unfolded protein response, URP)。温和或一过性的ER应激引起适应性的URP而重建ER平衡[8]。NF-E2相关因子2(NF-E2-related factor 2, Nrf2)是一种关键的转录调节抗氧化蛋白,其调控的下游抗氧化酶包括血红素氧合酶1(heme oxygenase-1, HO-1)。Nrf2信号通路在适应性URP反应中被激活,保护TECs免受氧化应激损伤[9]。然而,IRI通常引起强烈的ER应激,从而导致另外一种URP阶段即凋亡相。在这一阶段,C/EBP同源蛋白(C/EBP homologous protein, CHOP)聚集、肌醇酶1(inositol-requiring enzyme 1, IRE1)磷酸化、c-Jun氨基末端激酶(c-Jun N-terminal kinase, JNK)激活被认为是重要的启动因素。通常认为,BiP和CHOP是ER应激的标志[2]。
基于ER应激在肾脏IRI中的关键作用,我们假设CHBP可以通过抑制ER应激来保护人肾小管上皮细胞株 HK-2免受氧化应激损伤,并通过实验来验证这一假设。
1资料与方法
1.1材料与试剂人肾小管上皮细胞株HK-2由复旦大学放射医学研究所赠送;DMEM/F12培养基和胎牛血清(fetal bovine serum, FBS)购置美国Gibco公司;CHBP由中国科学院上海药物研究所提供[5];CCK-8检测试剂盒、GSH/GSSG检测试剂盒、ROS检测试剂盒、核蛋白和胞浆蛋白提取试剂盒及一步法原位末端标记法(TUNEL)凋亡检测试剂盒购自上海碧云天生物技术有限公司。BiP、CHOP、HO-1的一抗和内参抗体购自德国CST公司, Nrf2和Lamin B的一抗购自美国Santa Cruz公司。本实验中引物序列见表1。

表1 PCR引物序列
1.2细胞培养和氧化应激模型的建立HK-2细胞用含10% FBS的DMEM/F12培养基在 37℃、CO2体积分数为5% 的培养箱中培养,常规换液、传代,用处于对数生长期的细胞进行实验。将HK-2细胞接种于六孔板中。待细胞贴壁且细胞融合度为80%时,应用含500 μmol/L H2O2的无血清培养基培养4 h,建立氧化应激模型。Control组不作任何处理,H2O2组仅接受氧化应激刺激,CHBP组在H2O2处理前1 h加入20 nmol/L CHBP。
1.3细胞活性检测通过检测CCK-8判断HK-2细胞的增殖活性。将处于对数生长期的HK-2细胞以3×103个/孔的密度接种于96孔板,每孔100 μL,37℃、CO2体积分数为5% 的 培养箱中培养24 h后,建立氧化应激模型。同时设置正常对照组和空白对照组(仅含培养液)。每组设6复孔,并重复3次实验。氧化应激模型建立后4 h加入10 μL CCK-8试剂,置于37℃、CO2体积分数为5% 的培养箱中培养2 h,在450 nm处测OD值。
1.4TUNEL检测应用一步法TUNEL凋亡检测试剂盒检测HK-2细胞的凋亡情况。将处于对数生长期的HK-2细胞接种于24 mm玻片中,置于六孔板中在培养箱内培养24 h后,建立氧化应激模型。然后,用4%多聚甲醛固定细胞30 min,磷酸盐缓冲液(PBS)洗涤后,加入含0.1% Triton X-100的PBS冰浴孵育2 min。根据说明书配置TUNEL检测液,加到每个玻片上,37℃避光孵育60 min。用PBS洗涤,DAPI染色10 min后在荧光显微镜下观察。
1.5实时定量PCR反应采用Trizol法提取各组细胞的RNA,应用美国Thermo Fisher公司生产的逆转录试剂盒将3~5 μg总RNA在20 μL反应体系中逆转录为cDNA;应用上海碧云天生物技术有限公司的Q-PCR SYBR Green Permix Ex TaqTM 试剂盒进行实时定量PCR检测。
1.6Western blotting检测成功建立氧化应激模型后,用PBS冲洗HK-2细胞2次后收集细胞,应用上海碧云天生物技术有限公司的蛋白抽提试剂盒分别提取各组细胞的核内蛋白和核外蛋白。Western blotting的实验步骤参照文献[10], 采用Image-Pro plus 6.0软件分析caspase-3、BiP、CHOP和HO-1蛋白的表达情况。
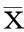
2结果
2.1氧化应激时,CHBP预处理可以提高HK-2细胞的活性,减少氧化应激损伤单独应用CHBP对HK-2细胞的活性没有影响,但CHBP预处理可以减轻H2O2刺激对HK-2细胞的损伤作用,最佳保护作用浓度为20 μmol/L(图1A),最佳给药时间为刺激前1 h(图1B)。与H2O2组相比,CHBP组的ROS水平明显降低,GSH/GSSH明显升高,表明CHBP可显著较低氧化应激水平(图1C、图1D)。
图1A:与H2O2组相比,20 μmol/L CHBP预处理可显著降低H2O2对HK-2细胞的损伤,差异有统计学意义,P<0.001;图1B:不同时间点用20 μmol/L CHBP处理HK-2细胞,以H2O2刺激前1 h给予CHBP的效果最佳,P<0.001;图1C、1D:与H2O2组相比,CHBP预处理可显著降低氧化应激水平,差异有统计学意义,P<0.001
图1氧化应激反应中,CHBP预处理对HK-2细胞活性及氧化应激水平的影响
2.2CHBP预处理可减少氧化应激损伤导致的凋亡H2O2刺激可以启动凋亡途径,而caspase-3在凋亡进程中起关键作用。本实验中,caspase-3活性检测和Western blotting结果显示,H2O2刺激后, caspase-3活性显著升高,分裂的caspase-3表达明显增强;而CHBP组较H2O2组caspase-3活性和分裂的caspase-3表达明显下降。TUNEL检测显示,H2O2刺激后细胞凋亡数量明显增多,而CHBP组凋亡较H2O2组明显减轻。见图2。
2.3CHBP预处理可降低氧化应激导致的ER应激Western blotting和PCR结果显示, H2O2刺激后细胞中BiP和CHOP表达升高,而CHBP预处理可以显著降低氧化应激引起的上述蛋白的表达(图3)。

图2A:H2O2刺激HK-2细胞引起的氧化应激反应中,caspase-3活性显著升高,CHBP预处理可显著降低caspase-3活性,差异具有统计学意义,P<0.01;图2B:TUNEL检测显示H2O2刺激后细胞凋亡数量明显增多,而CHBP组细胞凋亡明显减轻;图2C、2D:CHBP预处理显著抑制氧化应激引起的分裂的caspase-3表达的升高,差异具有统计学意义,P<0.01
图2氧化应激反应中,CHBP预处理对HK-2细胞凋亡的影响

图3A和3B:RT-PCR和Western blotting检测表明,H2O2刺激后HK-2细胞中BiP和CHOP表达升高,而CHBP预处理可以显著降低氧化应激引起的上述蛋白的表达,差异具有统计学意义,P<0.01
图3氧化应激反应中,CHBP预处理对HK-2细胞内质网信号通路的影响
2.4CHBP预处理激活下游Nrf2信号通路Nrf2和HO-1是适应性URP反应的重要效应分子。本研究显示,H2O2刺激可以上调Nrf2和HO-1蛋白的表达,而CHBP预处理可以促进Nrf2和HO-1表达进一步升高,表明CHBP可以进一步激活适应性URP反应。见图4。
3讨论
HBSP由M. Brines教授于2010年首次合成,包含EPO 的B组螺旋表面的11个疏水氨基酸(QEQLERALNSS)[3]。在中风模型和肾脏IRI模型中已证实HBSP具有强大的组织保护作用。然而,由于线肽半衰期较短,HBSP需要反复给药才能达到组织保护作用[10]。比如,在啮齿类动物外周神经损伤模型中, HBSP需要以23.5 nmol/kg的剂量每2 d给药1次,连续5 d,随后每周1次,才可减轻炎性反应和长期的触摸痛[11]。我们通过硫醚环化作用将线肽HBSP首尾连接而得到CHSP,大大增加了多肽的稳定性。前期研究[5]表明,CHBP同样具有组织保护作用,且较HBSP稳定性更好。
TECs与肾脏IRI密切相关。在肾移植中,IRI可导致TECs凋亡,进一步引起肾功能损伤,导致移植肾功能延迟恢复,从而影响临床获益[12]。本课题组的前期研究[5]表明,环肽CHBP可以有效保护小鼠肾功能,减轻肾脏IRI。为了研究体外CHBP的保护作用,本研究中我们用H2O2刺激HK-2细胞以模拟体内肾脏IRI,研究CHBP对ER应激的影响。CCK-8检测结果显示,20 nmol/L CHBP即对HK-2细胞表现出较强的保护作用,后续实验也沿用这一工作浓度(图1)。本实验通过检测ROS水平和GSH/GSSG比值研究CHBP对细胞的保护作用。细胞抗氧化能力主要取决于谷胱甘肽的氧化还原状态。在正常培养的细胞中,丢失的谷胱甘肽占胞内总谷胱甘肽的98%以上,通常用丢失的谷胱甘肽GSH和被氧化的谷胱甘肽GSSH的比值(GSH/GSSG)反应细胞的氧化还原状态,GSH/GSSG较低表示细胞氧化应激损伤较重[13]。本研究发现,CHBP预处理可以明显减轻氧化应激(图1)。

图4 氧化应激反应中,CHBP预处理对HK-2细胞Nrf2信号通路的影响
TUNEL染色显示,与H2O2组相比,CHBP组中凋亡的TECs细胞数量明显减少。半胱天冬酶caspase家族在凋亡的起始和效应阶段发挥重要作用,该通路下游的 caspase-3尤为重要,一旦被上游信号激活,直接介导细胞凋亡[14]。前期对小鼠肾脏IRI模型的研究[5]表明,CHBP治疗可以显著降低caspase-3的表达。本研究发现,在HK-2细胞中,CHBP预处理可以抑制H2O2引起的caspase-3的活化(图3A)。分裂的caspase-3是细胞凋亡的另一个典型标志,通过Western blotting检测发现,CHBP预处理可减少H2O2引起的分裂的caspase-3的表达(图3B)。
内质网是真核生物中非常重要的细胞器。在肾脏IRI中,ER应激被认为是引起TECs凋亡的重要原因。温和的内质网应激与适应性URP相关,内质网可达到再平衡[14]。但是,IRI诱导强烈的ER应激,可使URP进入凋亡相并最终导致细胞凋亡,CHOP、IRE1和JNK均参与凋亡反应。作为重要的分子伴侣,BiP参与多肽折叠,并指导初期糖蛋白的结构性成熟[15]。因此,我们通过检测CHOP和BiP表达水平来评价ER应激程度。结果表明,CHBP预处理可以降低H2O2引起的ER应激水平。根据以上结果我们推出,CHBP可以降低ER应激,使内质网应激从凋亡相向适应性反应转变。
在URP适应性反应中, Nrf2分子介导抗氧化反应[16]。ER应激可活化PERK和IRE1α-JNK-Nrf2轴,这两者均可活化Nrf2信号通路。作为重要的抗氧化调节基因,Nrf2与肾脏IRI密切相关。既往研究[17]表明,Nrf2敲除小鼠对IRI更加敏感。为了评估CHBP在URP中的作用,本实验检测了HK-2细胞中Nrf2的表达水平。结果显示,CHBP预处理可显著提高核内与核外Nrf2表达水平,表明CHBP预处理可以促进URP从凋亡相向适应性反应转变。
综上所述,对HK-2细胞进行CHBP预处理可以抑制ER应激,抑制凋亡,增强Nrf2信号通路,从而促进UPR反应从凋亡相向适应相转变,减轻氧化应激损伤。
参考文献
[1]Snoeijs MG, Vink H, Voesten N, et al. Acute ischemic injury to the renal microvasculature in human kidney transplantation[J]. Am J Physiol Renal Physiol, 2010, 299(5): F1134-1140.
[2]Dong B, Zhou H, Han C, et al. Ischemia/reperfusion-induced CHOP expression promotes apoptosis and impairs renal function recovery: the role of acidosis and GPR4[J]. PLoS One, 2014, 9(10): e110944.
[3]Brines M, Patel NS, Villa P, et al. Nonerythropoietic, tissue-protective peptides derived from the tertiary structure of erythropoietin[J]. Proc Natl Acad Sci U S A, 2008, 105(31): 10925-10930.
[4]Ueba H, Brines M, Yamin M, et al. Cardioprotection by a nonerythropoietic, tissue-protective peptide mimicking the 3D structure of erythropoietin[J]. Proc Natl Acad Sci U S A, 2010, 107(32): 14357-14362.
[5]Yang C, Xu Z, Zhao Z, et al. A novel proteolysis-resistant cyclic helix B peptide ameliorates kidney ischemia reperfusion injury[J]. Biochim Biophys Acta, 2014, 1842(11): 2306-2317.
[6]Yang JR, Yao FH, Zhang JG, et al. Ischemia-reperfusion induces renal tubule pyroptosis via the CHOP-caspase-11 pathway[J]. Am J Physiol Renal Physiol, 2014, 306(1): F75-84.
[7]Liu J, Ren F, Cheng Q, et al. Endoplasmic reticulum stress modulates liver inflammatory immune response in the pathogenesis of liver ischemia and reperfusion injury[J]. Transplantation, 2012, 94(3): 211-217.
[8]Pierre N, Barbe C, Gilson H, et al. Activation of ER stress by hydrogen peroxide in C2C12 myotubes[J]. Biochem Biophys Res Commun, 2014, 450(1): 459-463.
[9]Digaleh H, Kiaei M, and Khodagholi F, Nrf2 and Nrf1 signaling and ER stress crosstalk: implication for proteasomal degradation and autophagy[J]. Cell Mol Life Sci, 2013, 70(24): 4681-4694.
[10]McVicar CM, Hamilton R, Colhoun LM, et al. Intervention with an erythropoietin-derived peptide protects against neuroglial and vascular degeneration during diabetic retinopathy[J]. Diabetes, 2011, 60(11): 2995-3005.
[11]Swartjes M, Morariu A, Niesters M, et al. ARA290, a peptide derived from the tertiary structure of erythropoietin, produces long-term relief of neuropathic pain: an experimental study in rats and beta-common receptor knockout mice[J]. Anesthesiology, 2011, 115(5): 1084-1092.
[12]Gobe G, Willgoss D, Hogg N, et al. Cell survival or death in renal tubular epithelium after ischemia-reperfusion injury[J]. Kidney Int, 1999, 56(4): 1299-1304.
[13]Manikonda PK, Rajendra P, Devendranath D, et al. Extremely low frequency magnetic fields induce oxidative stress in rat brain[J]. Gen Physiol Biophys, 2014, 33(1): 81-90.
[14]Seo HS, Ku JM, Choi HS, et al. Induction of caspase-dependent apoptosis by apigenin by inhibiting STAT3 signaling in HER2-overexpressing MDA-MB-453 breast cancer cells[J]. Anticancer Res, 2014, 34(6): 2869-2882.
[15]Shimazawa M, Tanaka H, Ito Y, et al. An inducer of VGF protects cells against ER stress-induced cell death and prolongs survival in the mutant SOD1 animal models of familial ALS[J]. PLoS One, 2010, 5(12): e15307.
[16]Gonzalez-Guerrero C, Ocana-Salceda C, Berzal S, et al. Calcineurin inhibitors recruit protein kinases JAK2 and JNK, TLR signaling and the UPR to activate NF-kappaB-mediated inflammatory responses in kidney tubular cells[J]. Toxicol Appl Pharmacol, 2013, 272(3): 825-841.
[17]Ke B, Shen XD, Zhang Y, et al. KEAP1-NRF2 complex in ischemia-induced hepatocellular damage of mouse liver transplants[J]. J Hepatol, 2013, 59(6): 1200-1207.
Thioether-Cyclized Helix B Peptide Alleviate Oxidative Stress Damage of HK-2 Cells by Inhibiting Endoplasmic Reticulum Stress
LILong1△ZHENGlong1△HUChao1LINMiao1LONGYaqiu2RONGRuiming1
1.DepartmentofUrology,ZhongshanHospital,FudanUniversity,Shanghai200032,China; 2.ShanghaiInstituteofMateriaMedica,ChineseAcademyofSciences,Shanghai201203,China
AbstractObjective:To explore the protective effect of thioether-cyclized helix B peptide (CHBP) on renal tubular epithelial cells and its mechanism by experiment in vitro. Methods:Human renal proximal tubular epithelial cell line HK-2 cells were cultured in vitro and divided into control group, H2O2group and CHBP group. Oxidative stress damage models were established by stimulation with 500 μmol/L H2O2for 4 h. In CHBP group, 20 nmol/L CHBP was added to the culture medium 1 h prior to the establishment of oxidative stress model. After 4 h stimulation with 500 μmol/L H2O2, cell viability, situation of apoptosis, and severity of oxidative stress damage were measured. The expressions of Binding immunoglobulin protein(BiP), C/EBP homologous protein(CHOP), and the molecular in downstream NF-E2-related factor 2 (Nrf2) signaling pathway were detected by Western blotting and real-time PCR analysis, so as to evaluate the level of endoplasmic reticulum(ER) stress. Results: Oxidative stress induced cytotoxic injury could be alleviated by CHBP pretreatment. Kit-8(CCK-8) assay and TUNEL showed that, after CHBP pretreatment, cell viability increased, while cell apoptosis, oxidative stress and ER stress decreased. The levels of Nrf2 and heme oxygenase-1(HO-1) were significantly higher in CHBP group than those in H2O2group. Conclusions: CHBP pretreatment could alleviate oxidative stress damage of HK-2 cells, and the protective effect may be achieved by inhibiting ER stress and activating downstream Nrf2 signaling pathway.
Key WordsThioether-cyclized helix B peptide;Kidney;Renal tubular epithelial cell;Endoplasmic reticulum stress
通讯作者戎瑞明,E-mail:rong.ruiming@zs-hospital.sh.cn
基金项目:上海市卫生和计划生育委员会基金项目(编号:2014JQ008A);复旦大学附属中山医院青年基金(编号:2014ZSQN47)
中图分类号R 69
文献标识码A

