葡萄糖酸依诺沙星注射液无菌检查方法的建立及验证
刘 栋,汤长明(解放军第153中心医院药械科,郑州 450042)
依诺沙星为第三代喹诺酮类药物,在临床上广泛用于敏感菌所致的咽喉、支气管、肺、尿路、前列腺等部位感染[1]。由于葡萄糖酸依诺沙星注射液抑菌活性较强,去除其抑菌活性成为无菌检查的关键步骤。笔者严格按照2010年版《中国药典》(二部)附录ⅪH“无菌检查法”中的原则性要求进行试验[2],采用增加冲洗液量和在培养基中加入能与喹诺酮类药物发生络合反应的中和剂(Mg2+或Mn2+)的方法去除供试品的抑菌活性[2-11],并分别进行了验证,从而建立一种适用于葡萄糖酸依诺沙星注射液的无菌检查方法。
1 材料
1.1 仪器
HTY-2000A型智能集菌仪,配有全封闭集菌培养器(孔径为0.22 μm)(杭州泰林生物技术设备有限公司);隔水式恒温培养箱、百级净化工作台、高压蒸汽灭菌器等。
1.2 药品
葡萄糖酸依诺沙星注射液(某院自制制剂,批号:1312171、1312172、1312173,规格:100 ml∶0.2 g)。
1.3 培养基及试剂
硫乙醇酸盐流体培养基(批号:20131102)、改良马丁培养基(批号:20130808)、营养肉汤培养基(批号:20130105)、营养琼脂培养基(批号:20130428)、改良马丁琼脂培养基(批号:20130612)、蛋白胨(批号:20130108)均由北京奥博星生物技术有限责任公司生产;氯化镁(天津市瑞金特化学品有限公司,批号:20121016)、硫酸锰(天津市化学试剂三厂,批号:20090208)均为分析纯。
含Mg2+培养基:细菌、真菌培养基配制过程中加入氯化镁,使其终浓度为0.2 mol/L。含Mn2+培养基:细菌、真菌培养基配制过程中加入0.2 mol/L的硫酸锰溶液,加入量为5%。
所有培养基、冲洗液(0.1%蛋白胨水溶液)均按照2010年版《中国药典》(二部)附录ⅪH“无菌检查法”项下要求配制及灭菌,培养基的无菌性和灵敏度检查也均符合要求。
1.4 菌种
金黄色葡萄球菌[CMCC(B)26003]、大肠埃希菌[CMCC(B)44102]、枯草芽孢杆菌[CMCC(B)63501]、生孢梭菌[CMCC(B)64941]、白色念珠菌[CMCC(F)98001]、黑曲霉[CMCC(F)98003]均由中国食品药品检定研究院提供。
2 方法与结果
在建立样品的无菌检查方法前,先进行方法学验证。考虑到样品的抑菌活性,本试验通过增加冲洗液量的方法学验证Ⅰ和加入中和剂的方法学验证Ⅱ,来考察样品的抑菌活性能否得到有效去除。试验过程及结果如下:
2.1 菌液制备
按照2010年版《中国药典》(二部)附录ⅪH“无菌检查法”项下要求配制对照菌液,菌液浓度为每1 ml含菌数10~100 CFU,同时做平板计数,计数结果见表1。

表1 6种对照菌液菌落计数结果(CFU/ml)Tab 1 Results of 6 kinds of positive control bacteria colonies(CFU/ml)
由表1可知,所制得的各种对照菌菌悬液均符合药典要求,可以用于无菌验证及检查。
2.2 方法学验证Ⅰ
试验组:取样品9瓶,全量通过一次性全封闭三联集菌培养器,随后用0.1%蛋白胨水溶液冲洗,每次每筒过滤冲洗液100 ml,冲洗6次;在最后一次的冲洗液中分别加入金黄色葡萄球菌、大肠埃希菌和枯草芽孢杆菌菌悬液(菌落数为10~100 CFU),再向3个筒内各加入硫乙醇酸盐流体培养基100 ml。另取样品9瓶,同法操作,在最后一次的冲洗液中分别加入生孢梭菌、白色念珠菌和黑曲霉菌悬液(菌落数为10~100 CFU),然后向加入生孢梭菌菌悬液的筒内加入硫乙醇酸盐流体培养基,向加入白色念珠菌和黑曲霉菌悬液的筒内加入改良马丁培养基,加入量都是100 ml。
阳性对照组:取一次性全封闭三联集菌培养器,不加样品,其余操作按照试验组方法,最后得到6筒培养基作为阳性对照。
阴性对照组:取一次性全封闭三联集菌培养器,过滤0.1%蛋白胨水溶液,每次每筒过滤冲洗液100 ml,冲洗6次,然后分别加入硫乙醇酸盐流体培养基和改良马丁培养基各100 ml,作为阴性对照。
以上所得培养基均置于规定温度下培养3~5 d,逐日观察,记录各培养基上菌落生长情况,结果见表2(表中“+”表示有菌落生长,“-”表示无菌落生长下表同)。
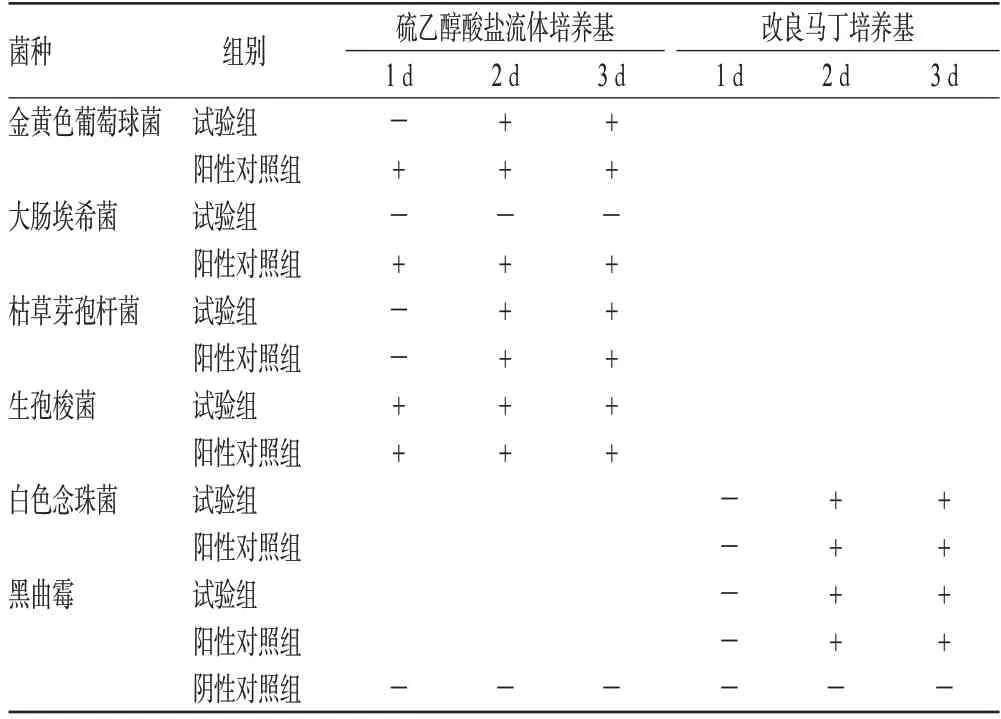
表2 方法学验证Ⅰ结果Tab 2 Results of methodology validationⅠ
由表2可知,当冲洗液为600 ml/膜时,阳性对照组各对照菌生长良好,阴性对照组均未有菌落生长,而试验组中大肠埃希菌未能正常生长,表明样品的抑菌作用仍未完全去除,需要进一步采取措施去除其抑菌活性。而若继续增加冲洗量,每张滤膜的液体过滤量会超过1 000 ml,需要进一步验证冲洗量对滤膜质量的影响;同时,冲洗量过大势必损伤滤膜上的微生物。因此,需要探索一种针对该样品的更为有效、快捷、方便的去除抑菌活性的方法。
由表2可知,在同等条件下,大肠埃希菌对样品的抑菌活性最为敏感,因此可将大肠埃希菌确定为葡萄糖酸依诺沙星注射液的敏感菌株,在无菌检查时作为阳性对照菌。
2.3 方法学验证Ⅱ
试验组:取样品9瓶,全量通过一次性全封闭三联集菌培养器,随后用0.1%蛋白胨水溶液冲洗,每筒过滤冲洗液100 ml,冲洗3次;在最后一次的冲洗液中分别加入金黄色葡萄球菌、大肠埃希菌和枯草芽孢杆菌菌悬液(菌落数为10~100 CFU),再向3个筒内各加入含Mg2+(或Mn2+)的硫乙醇酸盐流体培养基100 ml。另取样品9瓶,同法操作,在最后一次冲洗液中分别加入生孢梭菌、白色念珠菌和黑曲霉菌悬液(菌落数为10~100 CFU),然后向加入生孢梭菌菌悬液的筒内加入含Mg2+(或Mn2+)硫乙醇酸盐流体培养基,向加入白色念珠菌和黑曲霉菌悬液的筒内加入含Mg2+(或Mn2+)的改良马丁培养基,加入量都是100 ml。
阳性对照组:取一次性全封闭三联集菌培养器,不加样品,其余操作按照试验组方法,6个筒内最后加入的培养基也是含Mg2+(或Mn2+)的培养基,作为阳性对照。
阴性对照组:取一次性全封闭三联集菌培养器,过滤0.1%蛋白胨水溶液,每次每筒过滤冲洗液100 ml,冲洗3次,然后分别加入含Mg2+(或Mn2+)硫乙醇酸盐流体培养基和含Mg2+(或Mn2+)改良马丁培养基各100 ml,作为阴性对照。
以上所得培养基均置于规定温度下培养3~5 d,逐日观察,记录各培养基上菌落的生长情况,结果见表3。
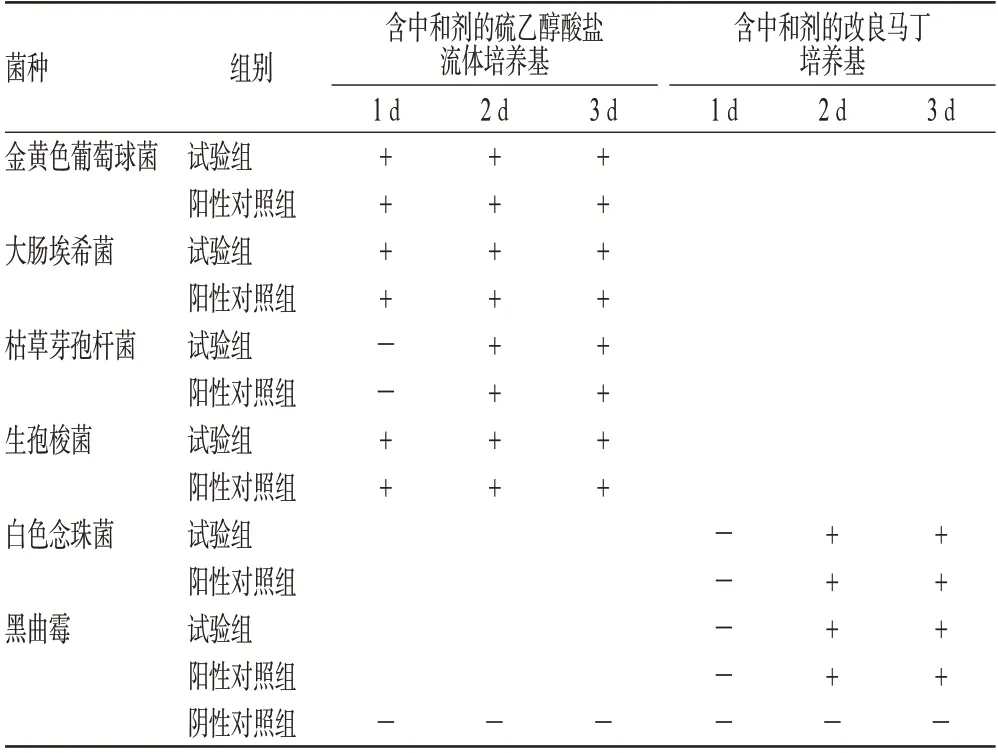
表3 方法学验证Ⅱ结果Tab 3 Results of methodology validationⅡ
由表3可知,当在培养基中加入中和剂(Mg2+或Mn2+)时,试验组及阳性对照组的细菌均能生长正常,说明该方法有效地去除了样品的抑菌作用。与方法Ⅰ相比,方法Ⅱ减少了无菌检查的冲洗量,缩短了无菌检查时间,降低了检查过程中的污染几率;另外,当样品的检验量增加时,在培养基中加入中和剂更具优越性。因此,方法Ⅱ适用于葡萄糖酸依诺沙星注射液的无菌检查。
2.4 样品的无菌检查
取本品9瓶,全量通过一次性全封闭三联集菌培养器,用0.1%蛋白胨水溶液冲洗,每筒冲洗3次,每次100 ml;冲洗完毕,2筒加入含Mg2+硫乙醇酸盐流体培养基各100 ml(其中1筒加入大肠埃希菌作为阳性对照),1筒加入含Mg2+改良马丁培养基100 ml。另取一套全封闭过滤器,过滤0.1%蛋白胨水溶液3次,每次每筒100 ml,然后分别加入含Mg2+硫乙醇酸盐流体培养基和含Mg2+改良马丁培养基各100 ml,作为阴性对照。将各培养基均置于规定温度培养14 d,逐日观察。3批样品无菌检查结果均显示供试品组和阴性对照组澄清,阳性对照菌则生长良好,表明供试品无菌检查符合规定。
3 讨论
培养基中中和剂的浓度是通过预试验确定的。其中,Mg2+的浓度为0.2 mol/L时,既不影响试验菌的生长,又能在使用较少冲洗液的情况下去除样品抑菌活性;而Mn2+的加入量除了考虑以上两个方面,还顾及到Mn2+在培养基中的溶解度。
在方法学验证Ⅱ的预试验过程中发现,硫酸锰在培养基中的溶解性很差,特别是在改良马丁培养基中用量稍大即出现浑浊;另外,金黄色葡萄球菌在含Mn2+硫乙醇酸盐流体培养基中的菌落形态也不及其在含Mg2+培养基中便于观察。综合考虑,笔者认为葡萄糖酸依诺沙星注射液的无菌检查使用含Mg2+的培养基更为合理。
方法学验证Ⅱ参考了解翠珠等[12]关于注射用葡萄糖酸依诺沙星的无菌检查方法,笔者在预试验过程中也曾将中和剂加入冲洗液中,但发现效果不是很理想,原因可能同冲洗液过滤速度相对较快、与滤器中的样品残留相互作用时间短暂有关;而只将中和剂加入培养基中,因其中和作用时间较长,已经可以达到很好的效果,因此简化了操作步骤,只将中和剂加入培养基中。
很多研究者都采用在培养基中加入Mg2+来去除门冬氨酸洛美沙星[5]、盐酸莫西沙星[10]、盐酸左氧氟沙星[11]等喹诺酮类药物在无菌检查中的抑菌活性,但将Mg2+作为中和剂消除葡萄糖酸依诺沙星注射液的抑菌活性还未见报道。考虑到不同喹诺酮类药物的抑菌活性有很大差异,且滤器的滤膜对不同喹诺酮类药物的吸附作用也有差异,故笔者对Mg2+去除葡萄糖酸依诺沙星注射液的抑菌活性进行了研究。
方法学验证Ⅰ结果显示,在不使用中和剂的情况下,试验组中的黑曲霉和白色念珠菌均能在改良马丁培养基里正常生长,表明样品对真菌抑菌活性较弱或者在该检验条件下已经能消除样品的抑菌活性,因此在改良马丁培养基中也可以不添加中和剂。
4 结论
本试验所建立的葡萄糖酸依诺沙星注射液的无菌检查方法为:以大肠埃希菌为阳性对照菌、采用0.1%蛋白胨水溶液冲洗3次(每次100 ml),经薄膜过滤后加入含Mg2+培养基。本方法简便、冲洗量相对较少,是葡萄糖酸依诺沙量注射液一种较为理想的无菌检查方法。
[1]陈新谦,金有豫,汤光.新编药物学[M].17版.北京:人民卫生出版社,2010:97-98.
[2]国家药典委员会,中华人民共和国药典:二部[S].2010年版.北京:中国医药科技出版社,2010:附录ⅪH.
[3]尤启东.药物化学[M].北京:化学工业出版社,2005:418.
[4]梁月秋,刘涛,朱斌,等.应用于喹诺酮类药物无菌检查金属离子的初步筛选[J].药物分析杂志,2009,29(2):334.
[5]裴小龙,黎隽,杨晓莉,等.喹诺酮类药物无菌检查中Mg2+的应用研究[J].中国药业,2011,20(1):28.
[6]朱斌,刘涛,蒋受军,等.Mg2+在药物无菌检查中的应用[J].中国现代应用药学,2010,27(11):1 031.
[7]张光华,余立,刘文杰.硫酸锰在几种喹诺酮类药物无菌检查中的应用[J].中国药品标准,2008,9(1):35.
[8]陈莹,邢轶华,卓明,等.加替沙星滴眼液无菌检查方法的建立[J].天津药学,2009,21(4):7.
[9]王沁馨.甲磺酸培氟沙星注射液无菌检查的方法学验证[J].中国药师,2010,13(9):1 361.
[10]江志杰,高春.无菌检查中消除喹诺酮类药物抗菌活性的方法研究[J].中国药业,2013,22(15):52.
[11]裴小龙,黎隽,杨晓莉,等.盐酸左氧氟沙星氯化钠注射液无菌检查法Mg2+加入方法验证[J].西北药学杂志,2010,25(6):446.
[12]解翠珠,赵军.注射用葡萄糖酸依诺沙星无菌检查方法的验证[J].中国药业,2008,17(12):40.

