生物膜“细菌-藻类”协同系统改良淡水池塘养殖水质与沉积物的效果研究*
江兴龙 邓来富
(1. 集美大学水产学院 厦门 361021; 2. 鳗鲡现代产业技术教育部工程研究中心 厦门 361021)
近 20年来, 我国淡水水产品产量一直位居世界第一, 我国淡水养殖产量约占全世界养殖产量的68%。其中, 池塘养殖是最主要方式, 淡水池塘养殖遍布全国, 草鱼是最重要的淡水养殖经济鱼类(刘兴国, 2011; 李振龙, 2014)。2013年鱼类淡水养殖产量占淡水总养殖产量的88.26%, 达2334.11万t, 其中草鱼占 20.49%, 草鱼的养殖产量占比第一(农业部渔业局, 2013)。近些年来农村的水产养殖业获得迅猛发展,已经成为推动农村经济发展的支柱产业(王武, 2009),逐渐成为促进农村经济发展的主要增长点(刘海波,2012)。然而由于追求高产量, 养殖密度大于水体的养殖容量, 大量残饵、肥料及生物代谢物的累积, 导致水体自净能力下降, 加剧了水体富养化, 养殖自身污染日趋严重(安鑫龙等, 2006; 王建平等, 2008)。近些年来淡水鱼类各类病害呈现多发态势, 新问题和新特征不断出现, 病害成为导致养殖生产经济损失的主要因素。据调查, 水质不好、溶氧不够和温度变化大、鱼苗质量差是造成养殖户病害损失的主要原因(陈洁等, 2014)。不良苗种可能导致养殖过程中出现一些问题, 加大了渔药等投入品的使用, 间接引发养殖生态系统失衡, 加剧养殖自身污染(吴伟等, 2014)。江兴龙等创建的精养殖水体和池塘生物膜低碳养殖技术, 应用于土池养殖日本鳗鲡(Anguilla japonica)和凡纳滨对虾(Litopenaeus vannamei), 大幅度降低了养殖自身污染及面源污染, 实现饲料蛋白二次利用, 获得显著的节水减排、节能低碳与增产增收效果(江兴龙等, 2010; 江兴龙, 2012; 江兴龙等, 2013)。本研究通过开展池塘生物膜低碳养殖技术在土池淡水草鱼苗种培育中的应用, 探讨生物膜“细菌-藻类”协同系统改良池塘养殖水质与沉积物的效果、对苗种培育效果的影响及其相关机理, 为该技术在草鱼苗种培育生产中的推广应用奠定基础。
1 材料与方法
1.1 材料
水产养殖专用生物膜净水栅(作者为发明人, 专利号 ZL201120032516.6), 基体材料为聚酰胺, 生物膜净水栅每组的长度 20m, 高度 0.7m。试验起始时,草鱼(Ctenopharyngodon idellus)鱼苗的投放入池规格约尾重(40±0.6)g。
1.2 方法
1.2.1 试验时间、地点及池塘条件 试验起始时间为2013年6月28日, 从完成池塘鱼苗的投放及生物膜净水栅的设置起, 至2013年11月17日完成草鱼大规格苗种的起捕, 试验养殖周期共计142天。在福建省龙岩市连城县松洋村渔业专业合作社示范基地内, 选择池塘条件相近的草鱼苗种培育土池共 8口,每口池塘面积约 2133—3670m2, 均配有二台功率为1.5kW的增氧机, 水源属溪河水。
1.2.2 实验分组和生物膜净水栅设置 把 8口土池随机分为2组, 4口没有设置生物膜净水栅的为对照组池塘, 4口有设置生物膜净水栅的为处理组池塘。生物膜净水栅的设置: 按每公顷池塘水面设置 45组生物膜净水栅, 组间距约 2m, 垂直悬挂在水面下约30cm处, 其两端可用木桩固定系紧。
1.2.3 养殖管理 草鱼鱼苗在下池时均每尾注射草鱼“三病”疫苗, 按每公顷池塘3万尾的密度投放。养殖期间的投饲管理参考草鱼池塘精养殖日常管理进行, 投饲草鱼浮性颗粒配合饲料, 饲料含粗蛋白(质量分数)≥28.0, 日投饲 2次, 日投饲率为鱼体重的2.5%—4.0%左右, 每3天适度补充投饲青草料, 处理组每公顷池塘每3天投加蔗糖45kg, 用池水溶解后泼洒于生物膜净水栅设置水域; 试验期间, 池塘为添补因蒸发损失的水及视水质情况每10天少量补水及换排水。认真记录每口池塘的投苗量、鱼苗规格、补水及换水量、使用药物、投饲量等。生产周期结束时,起捕鱼并随机抽样和称重, 记录每口池塘的鱼总重量、鱼体规格, 测算每口池塘草鱼的平均尾重、产量、成活率及饲料系数。
1.2.4 样品采集与检测 在鱼苗投放后及池塘安装生物膜净水栅前, 对各池塘使用有机玻璃采水器采集表层水(水下 50cm)水样一次(作为本底水样), 用柱状采泥器采集各池塘底泥表层 5 厘米的泥样一次(本底沉积物样)。生物膜净水栅设置完毕后, 各池塘于第4天、第15天及此后每20天开展生物膜的采样检测。用无菌剪子与镊子随机采集水下约50cm的填料丝约20g, 放进无菌培养皿中, 10g用于对生物膜的细菌总数、异养菌总数、弧菌、硝化细菌数及亚硝化细菌数等的检测, 带回实验室后, 将填料生物膜上的附着水珠用滤纸吸去, 首次称重后再移入装有100mL灭菌水的试剂瓶中, 瓶口盖紧后超声 30min,再全部取出填料用滤纸吸水后再称重, 计算两次重量之差可获得生物膜重量, 然后再把该试剂瓶内获得的生物膜水样, 搅拌均匀, 可开展生物膜的细菌总数、弧菌、异养菌总数、亚硝化细菌数及硝化细菌数及藻类等的抽样检测; 10g用于测量填料上的生物膜形成情况, 使用游标卡尺测生物膜厚度; 试验期间每隔20d, 现场检测每口池塘水质水温、溶氧(DO)和pH,在上午9点使用溶氧仪和pH计检测, 并采集表层水水样用于检测氨氮(TAN)、硝酸盐氮(NO3-N)、亚硝酸盐氮(NO2-N)、溶解性正磷酸盐(SRP)、化学需氧量(CODMn)、总碱度(Alk)、总氮(TN)、总磷(TP)、硫化物(Sulfide)、细菌总数、异养菌总数、弧菌数、藻类等水质指标。藻类水样用卢戈氏液进行现场固定(终浓度为2%)。试验开始后3个月及草鱼起捕前1天, 采集各池塘底泥表层 5 厘米的泥样一次, 现场检测氧化还原电位, 其余泥样送回实验室开展硫化物和有机碳的检测。
1.2.5 生物膜、水质和沉积物等因子的检测方法生物膜和池塘水质的细菌总数采用平板计数法(中华人民共和国国家质量监督检验检疫总局等2007a)、弧菌用平板计数法(国家标准GB17378.7-2007)、亚硝化细菌和硝化细菌均用液体选择培养基培养法(陈捷音,2007)、异养菌总数采用异养菌平板菌落计数法(戴吉胜等, 2007); 池塘水质溶解氧的检测用膜电极法、pH检测用玻璃电极法、氨氮检测用纳氏试剂光度法、亚硝酸盐氮检测用分光光度法、硝酸盐氮检测用紫外分光光度法、溶解性正磷酸盐检测用钼锑抗分光光度法、CODMn检测用高锰酸钾法、总碱度用酸碱指示剂滴定法、总氮用碱性过硫酸钾消解紫外分光光度法、总磷用钼酸铵分光光度法、硫化物用亚甲基蓝分光光度法,藻类用镜检细胞计数法(国家环境保护总局等, 2002);沉积物氧化还原电位的测定用电位计法、硫化物用亚甲蓝分光光度法、有机碳用重铬酸钾氧化-还原容量法(中华人民共和国国家质量监督检验检疫总局等2007b)。
1.2.6 数据处理和分析
多样性分析采用 Shannon-Wiener多样性指数H′公式:
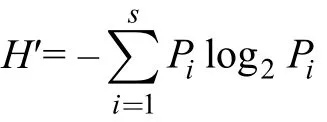
均匀度指数公式: J = H′/ log2S
式中, Pi= ni/N, ni为物种i的个体数, N为群落样本个体总数, Pi为第i种个体数占总个体数的比, S为样品中的种类数(国家标准GBl7378.7, 2007)。
使用SAS 9.1的统计分析软件(SAS Institute Inc.,Cary, NC, USA), 分析处理组与对照组的试验数据,并进行 t-test检验, 以 P<0.01为极显著差异, 以P<0.05为显著差异。

表2 对照组和处理组池塘水质本底因子浓度Tab.2 Background concentration of water quality parameters in control and treatment ponds
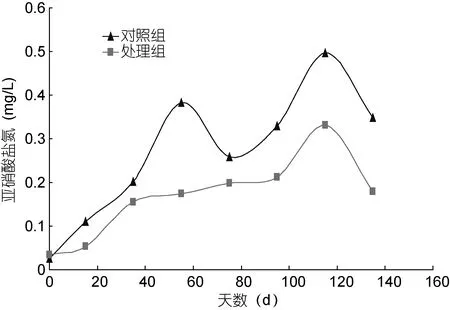
图1 试验期间对照组和处理组间的亚硝酸盐氮浓度Fig.1 The concentration of nitrite nitrogen among the control and treatment during experiment
2 结果
2.1 生物膜的形成
生物膜净水栅设置悬挂于池塘水体后的第 4天,目视检查可见其填料丝上已大量形成淡黄色的生物膜, 据生物膜的平均厚度及净水栅的比表面积等, 测算出平均每公顷池塘水面所形成的生物膜面积约为6—11万m2, 达池塘水面积的6—11倍; 经解剖镜和显微镜镜检, 生物膜的微生物群落主要由细菌、藻类、真菌和原生动物组成。检测结果, 生物膜上总细菌数平均为 4.9×106CFU/g, 异养菌总数平均为1.0×106CFU/g, 硝化细菌数平均为 0.9×105个/g, 亚硝化细菌数平均为4.5×105个/g。
2.2 节水减排与节能
试验期间, 处理组池塘的平均日换水率是 1.5%,对照组池塘的平均日换水率是 4.3%, 处理组池塘比对照组池塘节水减排 65.1%, 具极显著差异(P<0.01)(表 1)。和对照组的传统养殖模式比较, 平均每公顷池塘养鱼, 每月可节水减排养殖污水 1.26万 m3。应用水泵抽水, 平均每 1m3水耗电约 0.075度, 平均每公顷池塘养鱼每月可节电约945度。

表1 试验期间对照组与处理组池塘的换水量Tab.1 The quantity of water exchange in the control and treatment ponds during experiment
2.3 水质主要因子浓度
试验开始时, 池塘本底的水质主要因子浓度, 在处理组与对照组间均没有显著差异(P>0.05) (表2)。
由表3及图1、图2可知, 试验期间处理组的pH、总氮和亚硝酸盐氮分别极显著低于对照组 3.7%、31.3%和38.7%(P<0.01), 处理组的氨氮、总磷、活性磷和硫化物显著低于对照组25.6%、41.6%、37.8%和27.9%(P<0.05), 对照组与处理组之间的水温、溶解氧、硝酸盐氮、COD和总碱度无显著差异(P>0.05)。此外, 处理组池塘无机氮与无机磷的比值 2.09, 而对照组的1.78, 显著提高了17%(P<0.05)。
由表3可知, 处理组的弧菌数和藻类密度极显著低于对照组 63.1%和 51.3%(P<0.01), 硅藻相对密度极显著高于对照组 93.7%(P<0.01); 处理组的细菌总数和异养菌数显著高于对照组 50.8%和 33.6%(P<0.05), 蓝藻相对密度显著低于对照组 16.6%(P<0.05); 处理组的藻类生物均匀度指数显著高于对照组8.9%(P<0.05); 处理组和对照组之间的藻类生物多样性指数无显著性差异(P>0.05)。池塘水体藻类群落结构中的优势种组成有明显差异, 处理组池塘水体的第1至第3优势种分别为: 绿藻门栅藻Scenedesmus、十字藻Crucigenia及硅藻门菱形藻Nitzschia; 而对照组池塘水体的第1至第3优势种分别为: 绿藻门栅藻Scenedesmus、蓝藻门蓝纤维藻Dactylococcopsis、绿藻门十字藻Crucigenia。可见处理组池塘的藻相好于对照组池塘。

表3 试验期间对照组和处理组池塘水质因子浓度Tab.3 Concentrations of water quality parameters in the control and the treatment ponds during experiment

图2 试验期间对照组和处理组间的硫化物浓度Fig.2 Sulfide concentration among the control and treatment during experiment
2.4 生物膜上生物因子动态
由表4可知, 试验期间, 处理组池塘中设置的生物膜净水栅上所形成生物膜的平均细菌总数和异养菌数分别为1.30×109CFU/g和7.17×108CFU/g, 平均亚硝化细菌数 1.56×107个/g, 平均硝化细菌数1.18×106个/g, 弧菌数为 0。
2.5 沉积物理化因子
试验开始时, 池塘本底的沉积物因子浓度, 在处理组与对照组间均没有显著差异(P>0.05) (表5)。
由表6可知, 试验期间处理组池塘沉积物的氧化还原电位显著高于对照组 30.5%(P<0.05), 硫化物浓度显著低于对照组 47.0%(P<0.05), 处理组的有机碳浓度低于对照组40.0%(ɑ= 0.1, P<0.1), 未达到显著差异(ɑ= 0.05, P>0.05)。

表4 试验期间生物膜上的生物学因子数据Tab.4 The biological indicators data of biofilm during experiment

表5 对照组和处理组池塘的沉积物本底因子浓度Tab.5 Background values of sediment parameters in control and treatment ponds

表6 试验期间对照组和处理组池塘的沉积物因子浓度Tab.6 Background values of sediment parameters in control and treatment ponds during experiment
2.6 养殖结果
由表7可知, 处理组起捕规格、成活率、产量和生长速度分别显著高于对照组 24.6%、4.3%、29.8%和 28.6%(P<0.05), 饲料系数极显著低于对照组15.6%(P<0.01)。每公顷养殖水面购置生物膜净水栅的投入成本约22500元, 无需日常运行维护, 可以持续使用约 3年, 平均每公顷水面每年的折旧费用约为7500元; 处理组和对照组相比, 平均每公顷池塘净增产草鱼大规格鱼种 2385kg, 每公顷池塘养鱼增加收入3.8万元, 扣除饲料成本1.13万元以及生物膜净水栅的年折旧成本 0.75万元, 处理组比较对照组池塘培育草鱼大规格鱼种, 平均每公顷可增加净利润约1.92万元; 此外, 处理组出产的草鱼大规格鱼种明显比对照组规格更整齐, 健壮, 质量更优。

表7 对照组和处理组的养殖结果Tab.7 The yields in the control and treatment group duringexperiment
3 讨论
3.1 节水减排与节能效果
我国现有的池塘养殖模式, 池塘养殖废水基本未经处理直接排放, 对水资源产生了一定的压力(罗国芝等, 2010)。养殖期间一些养殖池塘由于天气变化引起倒藻、疾病暴发及水体出现发黑发臭等问题, 有些养殖户常常直接将这些养殖污水排入附近的河道中, 污染了周边的饮用水、灌溉水等的水源; 同时,邻近的养殖户由于养殖需要又抽提被污染河道的水,从而导致二次污染, 结果发生相互污染, 造成养殖户经济损失, 制约了水产养殖业的可持续发展(郭印等,2014)。据报道, 农村水环境的污染状况已非常严重,尤其有机污染严重超标, 基本上随经济发展水平提升河流水质污染程度也加重, 其中养殖业的污染呈现加剧趋势(杨林章等, 2004; 刘永权, 2008)。在许多内陆传统池塘养殖产区, 养殖用水难以满足生产需求, 池塘养殖甚至到了无水可换、仅依靠降水维持。水域环境恶化已成为危及池塘健康养殖的重要因素(李振龙, 2014)。本试验处理组比对照组显著节水减排约 65%, 减少水泵抽水平均每公顷池塘每月可节电约945度, 对于解决当前淡水池塘草鱼苗种培育节水减排与节能问题, 具有重要意义。
3.2 生物膜“细菌-藻类”协同系统水质改良效果及机理
试验期间, 处理组虽然比对照组池塘少换水65%, 在一定程度上影响了对处理组改良水质效果的评价, 但处理组池塘水质仍然显著优于对照组, 说明生物膜具有显著降解池塘养殖污染物的作用。生物膜的微生物群落组成主要有细菌、藻类、真菌及原生动物等。养殖环境中的细菌具有极大的物种多样性和代谢途径多样性, 细菌需要吸收氮、磷元素而生长, 也是高效的有机物分解者(肖国华, 2006), 生物膜上大量生长的亚硝化细菌和硝化细菌, 对养殖水体中的氨氮及亚硝酸盐氮具有良好的降解效果(江兴龙等,2010)。处理组池塘水质的细菌总数显著高于对照组50.8%; 处理组平均每公顷池塘所形成的生物膜面积约 6—11万 m2, 池塘生物膜上的平均细菌总数1.30×109CFU/g, 平均亚硝化细菌数 1.56×107个/g,平均硝化细菌数1.18×106个/g。因此处理组池塘水质的氨氮、亚硝酸盐氮、总氮、活性磷、总磷均显著低于对照组。徐乐中等(2008)认为生物絮凝、微生物细菌等对藻类的分解, 微生物大量繁殖, 分解的化感物质均可以抑制藻类的大量生长, 并进一步抑制水华的发生。江兴龙等(2013)认为池塘水体的细菌和藻类在竞争同化水体营养盐和生态位中, 细菌竞争力较强而导致藻类密度下降。由于处理组池塘的细菌总数显著高于对照组, 导致了处理组的藻类密度极显著低于对照组51.3%。池塘水中氮磷比值的提高, 有助于绿藻对蓝藻比例的提高, 并且蓝藻在种间竞争上的优势有可能被削弱; 营养盐浓度高时, 特别是相对于磷的氮被限制时, 蓝藻往往占优势(Hansell et al,1980; Boyd et al, 1998)。试验期间处理组池塘的氮磷比值高于对照组池塘, 总体的营养盐浓度显著低于对照组池塘, 从而使蓝藻的相对密度显著下降, 改善了藻类群落结构, 处理组池塘水体以绿藻和硅藻为优势种, 而对照池塘则以绿藻和蓝藻为优势种。绿藻类和硅藻类具有吸收有害物质, 保持水质的“活、爽”功能(彭聪聪等, 2011), 浮游植物多样性指数(H′)和均匀度(J)可以反映植物群落结构的多样性, 也是水环境质量的重要指标, 处理组的藻类均匀度指数显著高于对照组, 表明藻相优于对照池塘, 水质更好。
在光照正常情况下, 藻类密度低的池塘pH值将下降(江兴龙等, 2013)。池塘养殖中, 反硝化作用过程发生在当氧化的氮化合物扩散到厌氧的泥层中或在富营养水体的均温层中, 大量的无机氮在底泥进行着反硝化作用(Bouldin et al, 1974)。反硝化作用属碱性反应, 每消耗1mol硝酸盐产生1mol碱度(Boyd et al, 1998), 反硝化作用的发生导致pH升高。而硝化作用的发生及有机物降解都使pH下降, 它们综合作用的结果影响水体的pH值。试验期间处理组的pH值低于对照组0.033个单位, 认为是处理组比对照组池塘藻类密度低、有机物的降解量较大、硝化作用较强、反硝化作用较强等综合作用的结果。池塘中细菌及藻类等对部份硝酸盐的吸收同化及反硝化作用的进行,降低了硝酸盐浓度, 导致处理组和对照组间的硝酸盐氮浓度无显著差异。
池塘硫化物的来源之一为通过硫酸盐异化还原过程而产生, 另一个则是由于生物代谢产物、残饵等有机物质中的含硫氨基酸被微生物分解利用而形成,另外, 底质中的硫化物还可通过释放、水体对流等方式再进入水体(Boyd, 1996; 彭斌, 2008)。池塘水体中的硫在有氧环境下可被氧化成硫酸盐, 而在厌氧环境中被还原成硫化物(Boyd, 1996)。生物絮团为由细菌群落、浮游动植物、有机碎屑及一些聚合物质相互絮凝而形成的细菌团粒(Schryver et al, 2008)。应用池塘生物膜低碳养殖技术, 池塘水体中的有机碎屑、悬浮有机质、颗粒有机物等和生物膜上细菌、藻类及原生动物等可共同形成生物絮团(江兴龙, 2012; 江兴龙等, 2013)。Moss等(1995)报道, 养殖生物可以食用生物絮团。在产生了生物絮团的池塘中, 池塘水体中还形成有大量的颗粒有机碳(POM), 它由 46%的活体(藻类、细菌及原生动物)和 54%的有机碎屑所构成,养殖动物可摄食大于 5 μm的 POM (Hopkins et al,1995)。养殖期间形成的有机碎屑、残饵及排泄物等都可通过细菌粘附聚集形成生物絮团的一部分, 从而进入食物链(李卓佳等, 2008)。处理组池塘形成的大量生物膜生物絮团作为草鱼鱼苗的饵料而为草鱼所摄食, 从而降低了池塘水体及沉降于底泥表层沉积物中的有机物质, 减少了有机质中被微生物分解利用而产生硫化物。因此处理组池塘水质的硫化物浓度显著低于对照组27.9%。
3.3 沉积物改良效果及机理
由于处理组池塘形成生物膜生物絮团, 生物絮团为草鱼所摄食, 大幅度减少了池塘水中有机碎屑、悬浮有机物质、颗粒有机物等沉降于底泥表层, 也减少了死亡的细菌、藻类及原生动物等的生物体有机质沉降, 因此处理组沉积物有机碳浓度低于对照组。池塘中有机物在底泥沉积物中的累积会导致氧化还原电位的降低(Boyd, 1996), 处理组沉积物有机碳浓度降低导致其氧化还原电位显著高于对照组。底质硫化物与水体 COD呈显著线性相关, 有机质增加底质硫化物浓度也较高(甘居利等, 2003), 有机质的降解消耗了溶解氧, 使水-沉积物界面成为还原状态, 从而提高了硫酸盐还原菌的还原作用, 促进了硫化物的生成, 另一方面, 底质中的硫化物含量通常和氧化还原电位呈密切的负相关(彭斌, 2008), 养殖环境中底质硫化物含量的高低是衡量底质环境优劣的 1个重要指标(彭斌, 2008)。处理组沉积物有机碳浓度降低导致硫化物生成减少, 因此与对照组相比, 处理组的硫化物浓度显著降低, 也表明处理组池塘底质环境优于对照组。此外, 处理组池塘沉积物硫化物浓度的降低也有利于池塘水体中硫化物浓度的降低。
3.4 养殖效果
水体中的分子氨对水产动物产生毒害, 在水体中其质量浓度达到一定值时就会对养殖动物的生长发育产生负面影响, 直至死亡(李烁寒等, 2009)。亚硝酸盐对鱼类的毒性作用主要是鱼血液中的亚铁血红蛋白被氧化成了高铁血红蛋白, 抑制了血液载氧能力, 严重时使鱼类缺氧从而窒息死亡(王鸿泰等,1989)。水体硫化物中的硫化氢分子对养殖鱼虾具有毒性, 硫化氢分子在硫化物中的比例随水体 pH值及水温的上升而下降(Boyd, 1996)。硫化氢在低浓度时就具有毒性, 不同种类对硫化氢毒性的耐受力不同,水体硫化氢浓度达 0.011mg/L时, 就使蓝鳃鱼(Lepomis macrochirus)成鱼的生长缓慢(Smith et al,1976), 在pH值为7的水体中, 硫化氢对斑点叉尾鱼苗的半致死浓度为 1.0mg/L (3h LC50)(Bonn et al,1967)。硫化氢通过抑制氧分子对细胞色素a3的氧化,阻碍机体电子传输系统及停止氧化呼吸作用(Schwedler et al, 1985), 硫化氢可与养殖动物血液中的血红蛋白相结合形成硫血红蛋白, 降低机体中血液的携氧能力, 并对养殖动物的鳃组织有很强的刺激与腐蚀作用(彭斌, 2008)。处理组水中硫化物、氨氮及亚硝酸盐氮等毒性物质的浓度均显著低于对照组, 减少了对草鱼鱼苗的毒性应激及对生长的负面影响。处理组池塘由于形成了生物膜生物絮团, 而生物絮团可作为草鱼的饵料被摄食, 从而实现了二次利用饲料蛋白, 饲料转化率获得提高。池塘精养殖系统属于封闭的人工养殖生态系统, 养殖动物设在生物链顶端, 人为引入人工饵料, 削弱了其它因子, 导致系统中物质和能量的循环不能畅通, 生态系统失衡, 减弱了对外来干扰的自我调节, 养殖生态系统的稳定性被破坏,容易使养殖动物发病(晏小霞等, 2004)。对60 口优质鱼类养殖池塘中的水质理化和生物因子共 31 项进行调查和监测, 发现鱼类患病的池塘, 其亚硝酸盐氮的含量高于未患病的池塘(魏泰莉等, 1999), 亚硝酸盐对草鱼种有很高的毒性, 容易诱发草鱼出血病, 测定 46个草鱼池中的亚硝酸盐氮, 患出血病池中的亚硝酸盐氮含量均高于未发病池(王鸿泰等, 1989)。水产病原菌基本属于条件致病菌, 池塘水环境的改善可以降低发病率, 有利于提高养殖成活率。处理组池塘通过设置生物膜净水栅, 形成大量生物膜, 构建和发挥“细菌-藻类”协同改良水质的功用, 显著增强了池塘生态系统里初级生产者及分解者的功能, 促进了系统中物质和能量循环利用, 减少了水体中污染物的积累, 导致池塘水质、藻相和沉积物质量总体均优于对照池塘。另一方面, 生物膜净水栅的设置在池塘中为草鱼形成了隐匿的栖息区域, 有助于减少草鱼应激和游动, 体能消耗降低, 有利于鱼体增重生长。因此, 处理组的草鱼起捕规格、成活率、生长速度、饲料转化率、产量和养殖效益等均获得显著提高。池塘生物膜低碳养殖技术应用于草鱼苗种培育具有节水减排、增产增收、提高苗种质量等优点, 具有广阔的应用前景。
王 武, 2009. 我国水产养殖业的现状与发展趋势. 渔业致富指南, (7): 12—17
王建平, 陈吉刚, 斯烈钢等, 2008. 水产养殖自身污染及其防治的探讨. 浙江海洋学院学报: 自然科学版, 27(2):192—196
王鸿泰, 胡德高, 1989. 池塘中亚硝酸盐对草鱼种的毒害及防治. 水产学报, 13(3): 207—214
晏小霞, 唐文浩, 2004. 养殖水环境生物修复研究进展. 热带农业科学, 24(2): 69—72
中华人民共和国国家质量监督检验检疫总局, 中国国家标准化管理委员会, 2007a. 中华人民共和国国家标准. 海洋监测规范第 7部分: 近海污染生态调查和生物监测, GB 17378. 7-2007. 北京: 中国标准出版社, 1—94
中华人民共和国国家质量监督检验检疫总局, 中国国家标准化管理委员会, 2007b. 中华人民共和国国家标准. 海洋监测规范第5部分: 沉积物分析, GB 17378. 5-2007. 北京:中国标准出版社, 1—94
甘居利, 林 钦, 黄洪辉等, 2003. 大鹏澳网箱养殖区底质硫化物分布、变化和污染分析. 水产学报, 27(6): 570—574
安鑫龙, 周启星, 2006. 水产养殖自身污染及其生物修复技术.环境污染治理技术与设备, 7(9): 1—6
江兴龙, 关瑞章, 2010. 日本鳗鲡(Anguilla japonica)精养殖水体生物膜原位修复低碳养殖技术的研究. 海洋与湖沼,41(5): 769—775
江兴龙, 2012. 日本鳗鲡(Anguilla japonica)土池生物膜原位修复低碳养殖技术的研究. 海洋与湖沼, 43(6): 1134—1140
江兴龙, 邓来富, 2013. 凡纳滨对虾(Litopenaeus vannamei)池塘生物膜低碳养殖技术研究. 海洋与湖沼, 44(6):1536—1543
刘兴国, 2011. 池塘养殖污染与生态工程化调控技术研究. 南京: 南京农业大学博士学位论文, 1—173
刘永权, 2008. 惠州市农村环境污染现状调查. 环境, (S1):54—55
刘海波, 2012. 关于农村水产养殖中存在问题的思考. 才智,(28): 273
农业部渔业局, 2013. 中国渔业统计年鉴 2013. 北京: 中国农业出版社, 1—135
李振龙, 2014. 2013年渔业主推技术—淡水池塘养殖节能减排技术. 中国水产, (3): 45—51
李卓佳, 杨莺莺, 杨 铿等, 2008. 对虾养殖水处理专题之四:对虾养殖水环境无公害高效调控技术. 中国水产, 394(9):55—57
李烁寒, 李卓佳, 杨莺莺等, 2009. 秋冬季凡纳滨对虾养殖池塘细菌的数量动态. 暨南大学学报(自然科学版), 30(3):343—348
肖国华, 2006. 微生物在水产养殖环境生物修复中的作用机制.河北渔业, (10): 1—3
吴 伟, 范立民, 2014. 水产养殖环境的污染及其控制对策.中国农业科技导报, 16(2): 26—34
陈 洁, 刘景景, 2014. 2014年度大宗淡水鱼产业发展趋势与建议. 科学养鱼, (3): 81—84
陈捷音, 2007. 水中亚硝化细菌和硝化细菌检测方法的探讨.环境检测管理与技术, 20(2): 21—23
国家环境保护总局, 《水和废水监测分析方法》编委会, 2002.水和废水监测分析方法(第四版). 北京: 中国环境科学出版社, 1—836
罗国芝, 朱泽闻, 潘云峰等, 2010. 生物絮凝技术在水产养殖中的应用. 中国水产, (2): 62—63
杨林章, 王德建, 夏立忠, 2004. 太湖地区农业面源污染特征及控制途径. 中国水利, (20): 29—30
徐乐中, 李大鹏, 2008. 原位生物膜技术去除水源藻类研究.工业用水与废水, 39(3): 30—32
郭 印, 苌建菊, 2014. 农村水产养殖中出现的问题与对策.安徽农业科学, 42(10): 2939—2940
彭聪聪, 李卓佳, 曹煜成等, 2011. 凡纳滨对虾半集约化养殖池塘浮游微藻优势种变动规律及其对养殖环境的影响.海洋环境科学, 30(2): 193—198
彭 斌, 2008. 滨海盐场养殖池塘底质硫化物的变化及其与其它因子的关系. 海洋湖沼通报, (3): 155—160
戴吉胜, 陈贻球, 刘文君等, 2007. 异养菌总数检测方法研究.给水排水, 33(S1): 22—23
魏泰莉, 余瑞兰, 聂湘平等, 1999. 养殖水环境中亚硝酸盐对鱼类的危害及防治的研究. 水产养殖, (3): 15—17
Bonn E W, Follisb B J, 1967. Effects of hydrogen sulfide on channel catfish, Ictalurus punctatus. Transactions of the American Fisheries Society, 96(1): 31—36
Bouldin D R, Johnson R L, Burda C et al, 1974. Losses of inorganic nitrogen from aquatic systems. Journal of Environmental Quality, 3(2): 107—114
Boyd C E, 1996. Water Quality in Ponds for Aquaculture. Auburn,AL: Auburn University/Alabama Agricultural Experiment Station, 1—482
Boyd C E, Tucker C S, 1998. Pond Aquaculture Water Quality Management. Boston, Massachusetts: Kluwer Academic Publishers, 1—700
Hansell D A, Boyd C E, 1980. Uses of hydrated lime in fish ponds. Proceedings of Annual Conference of Southeast Association of Fish and Wildlife Agencies, 34: 49—58
Hopkins J S, Sandier P A, Browdy C L, 1995. Effect of two feed protein levels and feed rate combinations on water quality and production of intnsive shrimp ponds operated without water exchange. Journal of the World Aquaculture Society,26(1): 93—97
Moss S M, Pruder G D, 1995. Characterization of organic particles associated with rapid growth in juvenile white shrimp, Penaeus vannamei Boone, reared under intensive culture conditions. Journal of Experimental Marine Biology and Ecology, 187(2): 175—191
Schwedler T E, Tucker C S, Beleau M H, 1985. Non-infectious diseases. In: Tucker C S ed. Channel Catfish Culture.Developments in aquaculture and fisheries science, Vol. 15.New York: Elsevier, 497—541
Schryver P D, Crab R, Defoirdt T et al, 2008. The basics of bio-flocs technology: The added value for aquaculture.Aquaculture, 277(3—4): 125—137
Smith L L Jr, Oseid D M, Kimbakk G L et al, 1976. Toxicity of hydrogen sulfide to various life history stages of bluegill(Lempomis macrochirus). Transactions of the American Fisheries Society, 105: 442—449

