海藻酸钠凝胶(C6H7NaO6)x交联Ca2+包埋风味酶的工艺优化及应用稳定性研究*
童晓倩 黄 程 毛贵珠 刘 为 宋 茹 罗红宇
(浙江省海产品健康危害因素关键技术研究重点实验室 浙江海洋学院食品与医药学院 舟山 316022)
酶的化学本质是蛋白质, 具有很多催化优点(陈建龙等, 2006), 如: 高度的选择性、专一性, 水解条件温和, 催化效率极高等。但游离酶在使用中也存在稳定性差、反应后混入催化产物难以纯化及回收等问题。因此, 为了适应工业化生产需要, 人们模仿生物酶作用方式, 将酶束缚在特殊的相上, 让它既能保持酶特有活性, 又能长期稳定的反复使用, 同时又可以实现生产工艺的连续化和自动化, 从而实现了酶的高效利用(朱国斌等, 1996; 陆兆新, 2002; 罗发兴等,2008; Macario et al, 2009), 这就是酶的固定化技术。固定化酶除保持游离酶的催化反应特性外, 还有易分离回收、可重复多次使用、操作连续可控、工艺简便等系列优点。目前酶的固定化方法主要有吸附法、离子交换法、交联法、包埋法、共价连接物法, 其中固定化载体的研究是固定化技术的关键, 葡萄糖异构酶、葡萄糖氧化酶和青霉素酰化酶等的固定化已经获得成功并被广泛应用于食品、制药、化学分析、环境保护等各领域(韩志萍等, 2012)。如王旻(2009)采用聚丙烯酰胺凝胶包埋法对含天冬氨酸酶的大肠杆菌进行固定化, 固定化的大肠杆菌经活化后, 天冬氨酸酶活力提高了9—10倍。何国庆等(2006)将植物酯酶固定在聚苯乙烯微孔板上制成酶片, 利用酶抑制显色法检测有机磷农药和氨基甲酸酯类农药在蔬菜中的残留, 其检验灵敏度非常高, 检测限为 0.001—0.100 mg/kg。
风味酶是一种水解能力较强的外切酶。目前风味酶主要应用在食品加工过程中使风味恢复或改良(刘俊花等, 2005)。如朱一松等(2002)用生物方法获得α-L-呋喃型阿拉伯糖苷酶、α-L-鼠李糖苷酶和β-D-芹菜糖苷酶, 这类酶制剂将葡萄中不呈芳香气味的单萜烯基-β-D-葡萄糖苷水解, 使糖苷键裂解, 释放出糖苷配基, 并产生游离态的风味物质, 从而达到增强和改善葡萄汁(葡萄酒)风味的目的。镡雪莹等(2010)利用木瓜蛋白酶在加酶量为0.1%、料液比为3 : 1、温度为65°C、pH 7.0的条件下酶解1 h, 再用风味酶在加酶量为0.4%、温度为55°C、pH 6.0的条件下酶解 5 h, 得到的牛肉水解物经美拉德反应生成的反应物肉香味更加浓郁, 游离氨基酸含量较高。李丹丹等(2011)研究发现大豆蛋白水解产物中, 常含有少量产生苦味的游离氨基酸及其衍生物和小分子肽类物质,使产品带有不同程度的苦味, 直接影响了其食品的风味。利用风味酶对大豆蛋白水解液进行脱苦处理,溶液基本无苦味, 无肽损失, 明显优于活性炭脱苦效果且后者脱苦后肽损失16.3%。作为外切酶, 风味酶还可以用于制备多种活性肽。张英君(2005)研究利用风味酶水解鸭蛋蛋清制备小分子短肽取得一定的成效, 在45°C、pH 7.0条件下酶解所得酶解液热稳定性高, 水解度大。罗红宇等(2013)利用风味酶作为外切酶制备高F值寡肽。风味酶经固定化后在发挥其作用的同时, 还可以重复利用, 实现工厂可连续生产的目的, 有着较好的应用前景。
本试验采用海藻酸钠结合CaCl2溶液制成胶凝珠作为载体固定化风味酶。海藻酸钠是一种水溶性的褐藻胶多糖, 由 1,4-聚-β- D-甘露糖醛酸(M)和 α- L-古罗糖醛酸(G)组成的一种线型聚合物, G的含量决定了褐藻胶的粘度。它能与除镁汞以外的二价金属离子发生快速的离子交换反应, 生成褐藻酸盐凝胶, 其中以与氯化钙形成的凝胶薄膜性能最好(王秀娟等,2008)。此外, 海藻酸钠具有良好的生物相容性、使用安全性以及易降解等优良的性质, 海藻酸钠制备的小球具有较高的传质性能和生物活性, 是目前研究应用最广泛的包埋剂之一(武玉学等, 2012; Malik et al, 2012)。本文采用响应面分析法优化了固定化风味酶的工艺参数, 并对其使用的稳定性进行研究, 以期对固定化风味酶的实际应用提供一定的参考依据。
1 材料与方法
1.1 材料及试剂
风味酶, 10563U/g, 广西南宁庞博生物工程有限公司; 海藻酸钠, 国药集团化学试剂有限公司; 酪蛋白, 北京奥博星生物技术有限责任公司; CaCl2, 国药集团化学试剂有限公司; 三氯醋酸, 国药集团化学试剂有限公司; 福林酚, 上海荔达生物科技有限公司;蒸馏水为双蒸水; 其它试剂均为分析纯或生化试剂。
1.2 仪器与设备
SHA-C型(数显)水浴恒温振荡器, 常州国华电器有限公司; TGL-16C高速离心机, 上海安亭科学仪器厂; 奥豪斯 CP214-JY19精密电子天平, 奥豪斯仪器(上海)有限公司; 721G可见分光光度计, 上海仪电分析仪器有限公司; pHB-4型便携式pH计, 上海仪电分析仪器有限公司。
1.3 方法
1.3.1 风味酶液的配制 取 2.00g风味酶粉, 用0.02mol/L、pH 7.0的磷酸盐缓冲溶液稀释至 50mL,取10mL稀释液, 再用磷酸盐缓冲溶液稀释至100mL,配成浓度为4g/L的酶液, 置于4°C冰箱中备用。
1.3.2 风味酶的固定化 取一定量的风味酶液加入到一定量的海藻酸钠溶液中, 充分搅拌均匀。用注射器吸入上述混合液, 注入150mL 3.0%的CaCl2溶液中得到颗粒均匀、形状规则的小球。将形成的凝胶珠在0—4°C的CaCl2溶液中固定一段时间, 使其进一步硬化。然后抽滤得到硬化的凝胶珠, 用双蒸水洗涤3—5次, 以洗去表面的CaCl2溶液, 即得到球状固定化风味酶。
1.3.3 酶活力以及酶活力回收率的测定 参照标准 SB/T10317-1999, 采用福林酚法测定游离风味酶以及固定化风味酶活力(单位为 U/g), 固定化酶活力回收率按下式计算:

1.3.4 风味酶固定化工艺的优化试验 在单因素试验基础上, 确定对影响固定化酶活较大的三个因素即海藻酸钠浓度、加酶量和固定化时间进行优化。采用Box-behnken Design试验设计原理, 以海藻酸钠浓度(A)、加酶量(酶液体积/海藻酸钠体积)(B)、固定化时间(C)为自变量, 固定化酶活力回收率(Y)为响应值进行工艺优化, 采用Design Expert8.06软件进行响应面中心组合实验设计和数据处理。因素水平设计见表1。

表1 实验因素水平编码表Tab.1 Coding of the experimental design in response surface methodology (RSM)
1.3.5 固定化风味酶的应用稳定性研究
(1) 固定化酶和游离酶的热稳定性比较 取一定量的固定化酶和游离酶, 参照标准 SB/T10317-1999, 采用福林酚法, 在酶解时间 3h、pH 7条件下,分别测定 30°C、40°C、50°C、60°C、70°C、80°C 时游离酶和固定化酶的活力。
(2) pH对固定化酶和游离酶活力的影响 取一定量的固定化酶和游离酶, 参照标准 SB/T10317-1999, 采用福林酚法, 当水浴温度为 40°C、水解 3h时, 分别测定pH为6.0、6.5、7.0、7.5、8.0、8.5时固定化酶和游离酶的活力。
(3) 固定化酶的固着稳定性试验 用50mL蒸馏水将10g鱿鱼碎肉处理成匀浆, 加入固定化胃蛋白酶的量为26.83U/g(鱿鱼碎肉), 在pH 3、35°C条件下恒温振荡水解4h, 离心取上清液, 加入固定化风味酶的量为1692U/g(鱿鱼碎肉), 在pH 7、50°C恒温振荡水解 3h。在相同的条件下连续水解 5次。以初次使用前测定的酶活力为 100%, 每次水解结束后测定相对酶活力。
(4) 固定化酶储存稳定性试验 将固定化酶在4°C冰箱中分别保存7、14、21、28、35天后, 测定酶活力的残留比值。
2 结果与分析
2.1 影响风味酶固定化效果的单因素研究
2.1.1 海藻酸钠浓度对酶活力回收率的影响 固定化条件设定为常温、加酶量1:2固定化, 时间3h, 分别考察海藻酸钠浓度为1.0%、1.5%、2.0%、2.5%、3.0%、3.5%时对固定化风味酶活力回收率的影响, 结果见图1。
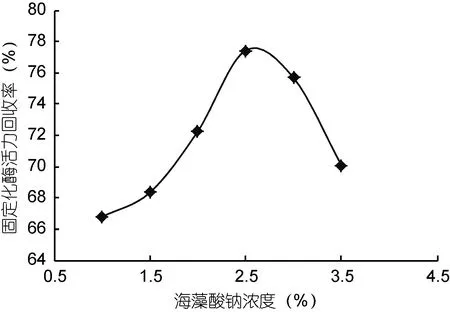
图1 海藻酸钠浓度对固定化风味酶活力回收率的影响Fig.1 Effect of sodium alginate concentration on immobilization of flavor enzyme activity
由图 1可以看出, 固定化酶活力回收率随海藻酸钠浓度的增加呈现先上升后下降的趋势。当海藻酸钠浓度为 2.5%时, 固定化酶活力回收率达到最大值77.8%。海藻酸钠有着强烈的吸附作用, 可与钙、铜等二价阳离子结合形成具有一定强度和持水力的胶凝剂, 将风味酶包埋在其凝胶网格(杨本宏等,2005)。已有研究表明, 海藻酸钠凝胶密度随其浓度的增大而增加(鲁玉侠等, 2008)。当海藻酸钠浓度较低时, 凝胶密度小, 孔径大, 酶难以固着稳定, 故固定化酶的酶活回收率低。而海藻酸钠浓度过大, 造成凝胶密度大, 孔径过小, 酶难以与底物结合, 同时也不利于酶底物和产物的扩散, 导致酶活力回收率下降。当海藻酸钠浓度为 2.5%时, 形成的凝胶孔径与风味酶的尺寸最匹配, 固着的稳定性好, 酶活回收率最高。
2.1.2 加酶量对酶活力回收率的影响 固定化条件设定为海藻酸钠浓度 2.5%, 固定化时间为 3h, 分别考察加酶量为 1:1、1:2、1:3、1:4、1:5、1:6时对固定化风味酶活力回收率的影响, 结果见图2。
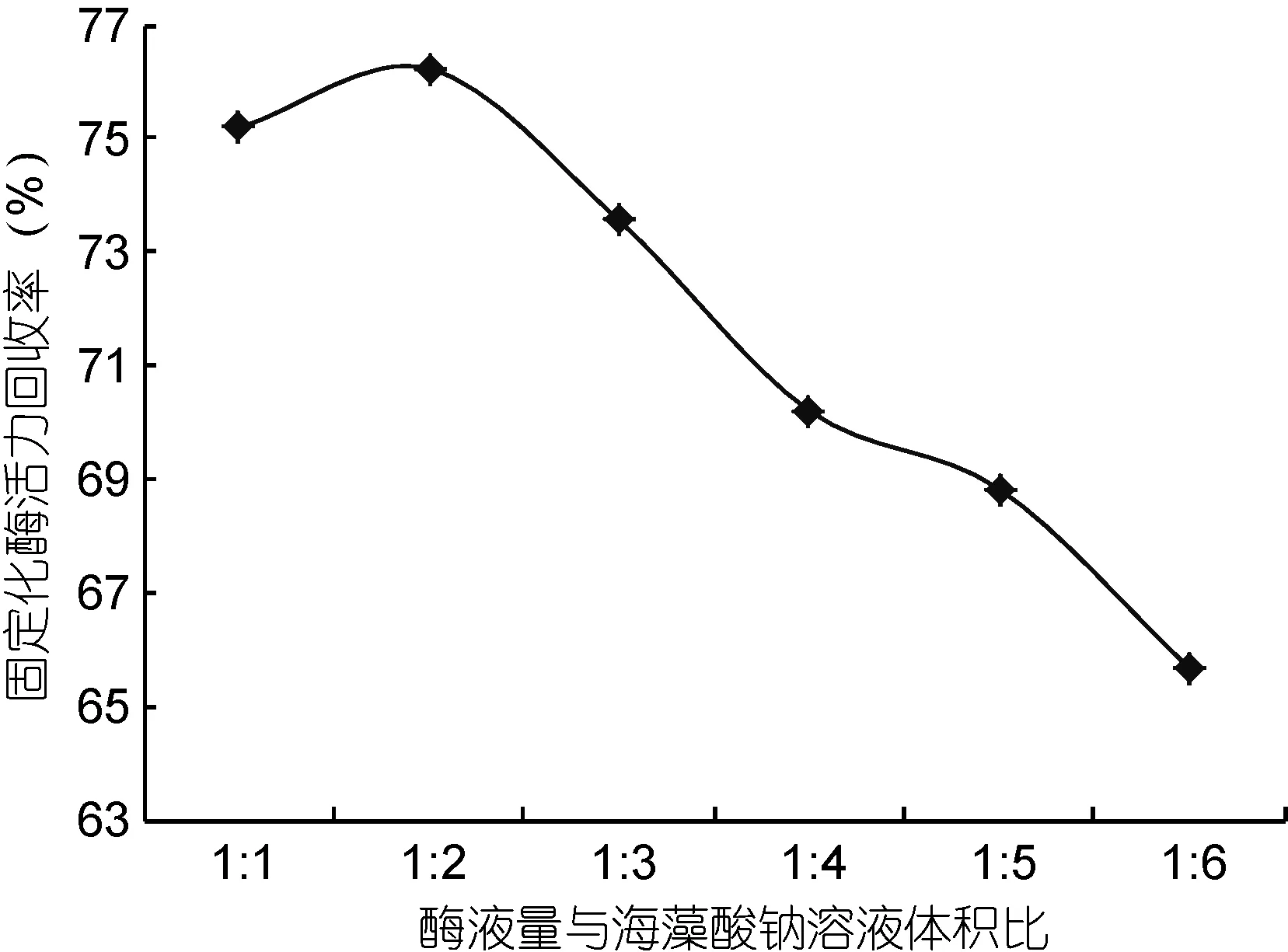
图2 加酶量对固定化风味酶活力回收率的影响Fig.2 Effect of different enzyme amounts on immobilization of flavor enzyme activity
由图2可知, 当酶量与海藻酸钠溶液的体积比为1 : 2时, 固定化酶活力达到最大值。因为当两者体积比大于1 : 2时, 海藻酸钠浓度低, 海藻酸钠包埋的酶的浓度过高, 致使酶蛋白分子不能在胶凝网格内完全伸展(杨本宏等, 2005), 以致部分酶分子的活性位点无法暴露, 难以与底物接触反应, 表现出酶活力回收率低; 而当酶液量与海藻酸钠体积比小于1 : 2时,过高浓度的海藻酸钠形成的凝胶密度大, 影响底物扩散速率, 限制酶和底物的反应。
2.1.3 固定化时间对固定化酶活力回收率的影响固定化条件设定为常温、海藻酸钠浓度2.5%, 加酶量 1:2, 分别考察固定化时间为 1h、2h、3h、4h、5h、6h时对固定化风味酶活力回收率的影响, 结果见图3。

图3 固定化时间对固定化风味酶活力回收率的影响Fig.3 Effect of time on immobilization of flavor enzyme activity
新制备的固定化酶凝胶颗粒在母液中静置的过程称为固化(鲁玉侠等, 2008)。固化时间对固定化酶活力回收率的影响如图3所示。风味酶活力回收率随固化时间的延长而逐渐升高, 当固化 3h时, 酶活力回收率达到最大值, 之后趋于稳定再缓慢下降, 表明酶的固定化时间有一个最佳值, 固化时间过长或过短均使固定化酶活力下降。这是因为时间过短, 酶未能及时地扩散到海藻酸钠凝胶网格内部(张佳宁等,2012), 完全的包埋于载体。随着时间的延长, 将达到一个最佳的固定效果。风味酶作为蛋白分子, 对金属离子不稳定, 而海藻酸钠需要结合 Ca2+才能形成优良的包埋载体。因此固定的同时, Ca2+对风味酶的活性影响作用持续加强, 以致后期造成固定化酶活力回收利率缓慢降低。
2.2 风味酶固定化工艺的响应面优化实验
通过单因素试验确定影响酶活力回收率的三个显著因素的较优水平范围。根据Box-Behnken的中心组合实验设计原理, 以海藻酸钠浓度, 加酶量、固定化时间为自变量, 固定化风味酶活力回收率为响应值(Y), 按照表 1设计三因素三水平响应面中心组合实验, 试验结果和方差分析分别见表2、表3。
采用Design Expert软件对表2中的试验数据进行多元回归拟合, 得到固定化酶活力回收率(Y)对海藻酸钠浓度(A)、加酶量(B)、固定化时间(C)的回归方程为:

对模型进行方差分析结果显示, 本试验所选用的二次多项模型极显著(P<0.01), 相关系数 R2=0.9788, 模型调整系数 R2Adj = 0.9516, 说明该方程满足了95.16%的响应值变化, 拟合程度较好。方程失拟相不显著(P>0.05), 说明试验所得到的二次方程能够很好地对试验结果进行预测。模型的一次项 B、C和二次项A2差异都极显著, 二次项B2、C2和交互相AC、BC差异显著。根据表3可推知三因素对固定化酶活力回收率的影响次序为加酶量(B)>固定化时间(C)>海藻酸钠浓度(A)。

表2 响应面设计方案及结果Tab.2 Experimental design and the result of RSM

表3 方差分析结果Tab.3 The results of variance analysis
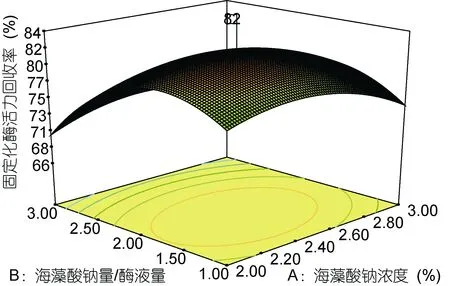
图4 海藻酸钠浓度和加酶量的交互作用对酶活力回收率影响的响应面及等高线Fig.4 The response surface and contour plot of interaction of concentration of sodium alginate and different enzyme amounts on immobilized flavor enzyme activity

图5 海藻酸钠浓度和固定化时间的交互作用对酶活力回收率影响的响应面及等高线图Fig.5 The response surface and contour plot of interaction of concentration of sodium alginate and time on immobilized flavor enzyme activity
对回归模型进行逐步回归, 再求一阶偏导, 并令其为 0, 得到最优响应面结果为海藻酸钠浓度2.43%, 酶液量/海藻酸钠量体积比1 : 1.76, 固定化时间 2.89h, 此条件下固定化酶的活力回收率可达81.88%。考虑到实际操作时参数精度的控制水平,确定风味酶的最佳固定化工艺条件为: 海藻酸钠浓度2.50%, 酶液体积/海藻酸钠体积1 : 2, 固定化时间3.0h。在此条件下进行验证试验, 得到酶活力回收率的平均值为 80.05%±1.33%。说明所得模型准确度高。
2.3 各因素及其交互作用对固定化酶的活力回收率的影响
基于回归模型方差分析, 利用软件绘制各因素对酶活力回收率影响的响应面及等高线图, 结果见图4、图5、图6。
如图所示, 加酶量和固定化时间对酶活回收率影响极为显著, 随两者的增加均呈现先升后降的趋势, 当加酶量大于1 : 2、固定化时间小于3h时, 两因素的改变对酶活回收率影响较大(曲面弧度较大), 而海藻酸钠浓度对酶活回收率的影响不显著; 海藻酸钠浓度与加酶量的交互作用对酶活回收率的影响不显著(图 4, 等高线为圆形), 而固定化时间与海藻酸钠浓度、加酶量之间的交互作用对酶活回收率的影响均显著(图5, 图6)。与方差分析及单因素试验的结果一致。说明三因素对酶活回收率的影响并不是简单的线性关系。

图6 固定化时间和加酶量的交互作用对酶活力回收率影响的响应面及等高线图Fig.6 The response surface and contour plot of interaction of concentration of time and different enzyme amounts on immobilized flavor enzyme activity
2.4 固定化风味酶的应用稳定性
按1.3.5的方法, 考察了酶解温度、pH值、储藏时间对固定化风味酶酶活力的影响, 并与游离酶进行比较, 对风味酶的固着稳定性也进行了研究, 结果如图7—图10。
由图7可知, 游离酶最适使用温度为40°C, 固定化酶最适使用温度为60°C, 在50—65°C范围内使用,酶活都在90%以上, 因为许多酶解反应在加热的条件下反应速率及水解度都有所改善(Larissa et al, 2008),因此酶经固定化后更能适应热酶解反应。这可能与载体的包埋作用有关(Santos et al, 2007), 其增加酶分子构型的牢固程度, 因此酶的热稳定性得到提高。

图7 不同温度下固定化酶和游离酶的相对酶活力Fig.7 Relative activity of free and immobilized enzyme under different temperatures
由图8可知, 固定化酶在pH值7.0—8.5之间都能保持 85%以上的相对酶活力, 其中最适 pH值为8.0。而游离风味酶的最适pH值为7.0左右, 酶活大于85%对应的pH值为6.5—7.5。表明风味酶经固定化后, 其最适使用 pH朝碱性偏移, 使用的酸碱范围有所增加, 这可能与酶被包埋后对酸碱作用的敏感性下降有关。
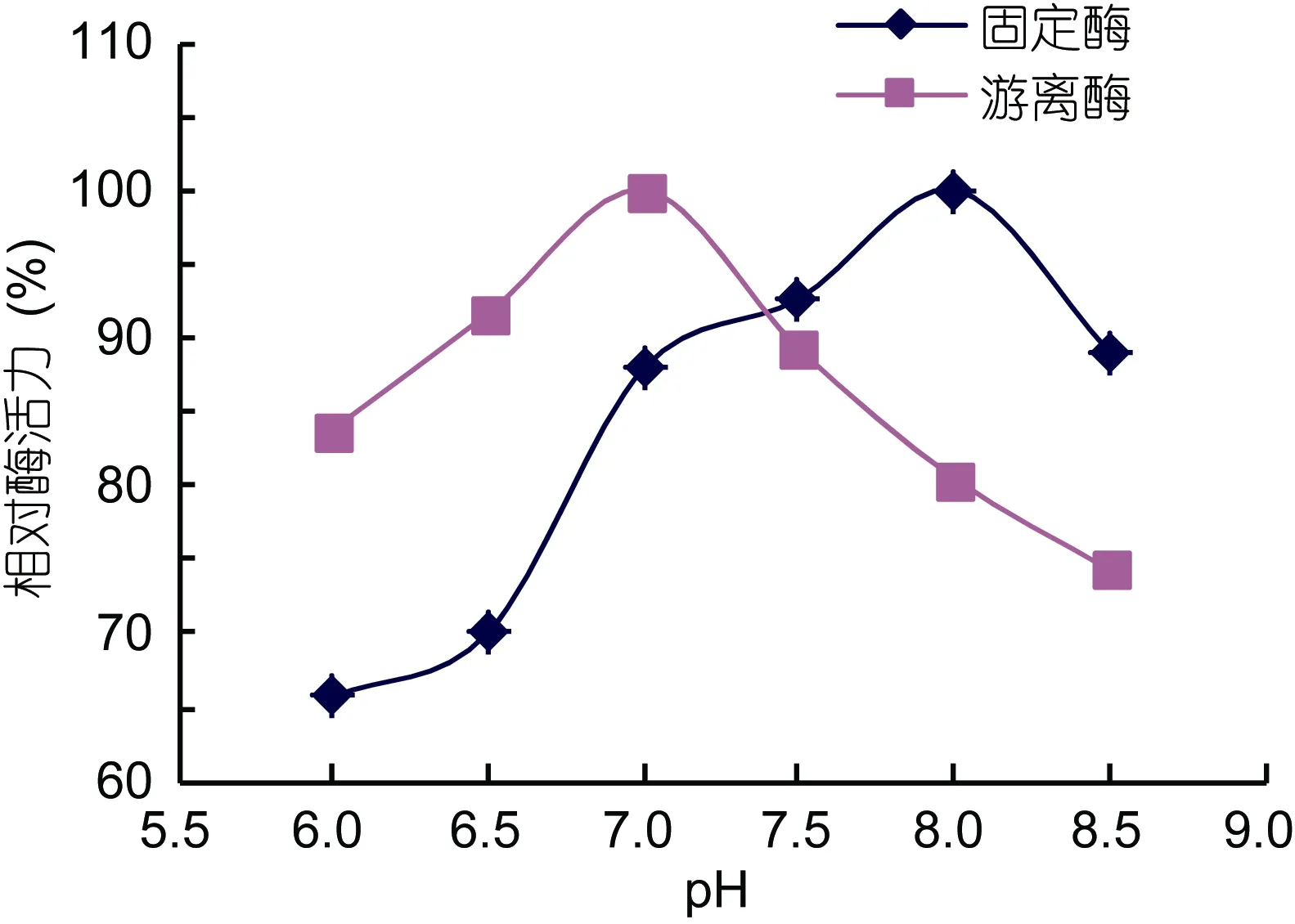
图8 不同pH时固定化酶和游离酶的相对酶活力Fig.8 Relative activity of free and immobilized enzyme under different pH values
由图 9可知, 将固定化风味酶连续使用 5次后,相对酶活力依旧可以保持在 50%以上, 说明固定化风味酶操作稳定性良好。酶活下降的主要原因一是酶解过程中的震荡操作致使一部分酶分子脱落, 经洗涤后流失, 二是一部分酶分子在外力作用下结构被破坏。此外, 水解过程也会使海藻酸钠凝胶分子结构发生一定的变化, 对维持酶蛋白稳定结构的作用力包括疏水力, 氢键、离子相互作用力以及范德华力等产生一定影响(张佳宁等, 2012), 使得部分酶蛋白活性中心的特定结构发生一定的变化, 从而造成酶活力下降。

图9 固定化酶的操作稳定性Fig.9 Operational stability of the immobilized enzyme
由图 10可知, 在冷藏条件下, 固定化风味酶储存3周以内, 相对酶活力都能保持在80%以上, 储存至5周, 相对酶活力为70%左右, 表明该酶具有良好的储藏稳定性, 为批量扩大化生产奠定了基础。

图10 固定化酶相对酶活力随时间的变化Fig.10 Relative enzyme activity of immobilized enzyme changes over time
3 结论
本文利用海藻酸钠做载体, 结合CaCl2形成凝胶珠进行固定化风味酶的制备, 利用响应面优化试验及考虑实际操作的精度控制水平, 确定了最佳的固定化工艺条件为海藻酸钠浓度 2.50%, 酶液/海藻酸钠(体积比, 酶液浓度为4g/L) 1 : 2, 固定化时间3.00h,酶活回收率达到 80.05%±1.33%。制备的固定化风味酶最适使用温度为 60°C, 比游离酶提高 20°C, 热敏性降低, 热稳定性提高; 最适 pH 8.0, 比游离酶向碱偏移了 1.0, 酸碱适用范围增大; 并可多次重复使用,储藏3周活力可保持80%以上。本法中风味酶的固定化工艺简单, 操作方便, 得到固定化酶稳定性高, 易储藏。
目前国内外利用风味酶改良食品风味, 大多数采用直接添加风味酶与前体物质反应的方法, 固定化风味酶还未真正推广应用。一方面, 由于固定化酶首次投入成本较高, 固定化过程中酶会存在一定损漏; 另一方面, 酶的固定化方法也各有优缺点: 如壳聚糖(梁足培等, 2004; 张茜等, 2012)作为天然高分子材料, 易于加工成多孔微球, 常用于固定胰蛋白酶,但其需要戊二醛作为双官能团交联剂, 制作工艺繁琐, 且交联条件较激烈, 常出现扩散限制, 使用有一定难度, 费用高(王云等, 2005)。共价结合法费用相对较低, 但是试剂对生物组织多有一定的毒性, 共价偶联反应激烈, 易引起酶失效。物理吸附法(李小冬等,2011; 游金坤等, 2012)操作简单, 费用低, 但是固定效果不佳, 酶容易流失。本试验所采用海藻酸钠包埋法固定风味酶, 操作工艺简单, 制备成本低, 并可根据生产需要做成任意大小, 使用方便。反应过程中虽存在一定的扩散阻力, 但是总体影响不大, 在适宜条件下, 酶活力依旧可以保持80%以上。说明采用海藻酸钠固定化风味酶的方法可行性高, 但仍需要对工艺放大后的稳定性进行深入研究。
王 云, 王 勇, 董 英, 2005. 壳聚糖固定化胰蛋白酶研究.安徽农业科学, 33(11): 2095, 2200
王 旻, 2009. 生物工程. 北京: 中国医药科技出版社
王秀娟, 张坤生, 任云霞等, 2008. 海藻酸钠凝胶特性的研究.食品工业科技, 29(2): 259—262
朱一松, 赵光鳌, 2002. 葡萄酒风味与风味酶的研究. 中外葡萄与葡萄酒, (6): 6—10
朱国斌, 鲁红军, 1996. 食品风味原理与技术. 北京: 北京大学出版社
刘俊花, 葛 玉, 张宝善, 2005. 食品风味酶的研究进展. 中国酿造, 147(2): 6—8
李小冬, 吴 嘉, 贾东晨等, 2011. 固定化酶的研究方法概述.中国酿造, (11): 5—9
李丹丹, 江连洲, 李 杨等, 2011. 风味酶和活性炭对大豆分离蛋白水解液脱苦效果比较研究. 中国油脂, 36(8):24—27
杨本宏, 蔡敬民, 吴 克等, 2005. 海藻酸铵固定化根霉脂肪酶的制备及其性质. 催化学报, 26(11): 977—981
何国庆, 丁立孝, 2006. 食品酶学. 北京: 化学工业出版社
张 茜, 夏文水, 2010. 壳聚糖对鲢鱼糜凝胶特性的影响. 水产学报, 34(3): 342—348
张英君, 2005. Flavourzyme风味酶水解鸭蛋蛋清研究. 南阳师范学院学报, 4(12): 63—65
张佳宁, 宋云花, 王 玥等, 2012. 海藻酸钠-壳聚糖固定化磷脂酶A2的研究. 食品工业科技, 33(21): 201—205
陆兆新, 2002. 现代食品生物技术. 北京: 中国农业出版社
陈建龙, 祁建城, 曹仪植等, 2006. 固定化酶研究进展. 化学与生物工程, 23(2): 7—9
武玉学, 靳 挺, 王建平等, 2012. 天然海藻絮凝剂海藻酸钠回收带鱼(Trichiurus haumela)鱼糜漂洗液中蛋白质的研究.海洋与湖沼, 43(2): 335—338
罗发兴, 杨景峰, 罗志刚, 2008. 高性能淀粉基酶固定化载体的制备研究. 食品科学, 29(10): 174—177
罗红宇, 杜 帅, 郑 斌等, 2013. 双酶分步水解金枪鱼(Eleotridae)碎肉制备高 F值酶解液的工艺研究. 海洋与湖沼, 44(4):906—912
梁足培, 冯亚青, 孟舒献等, 2004. 壳聚糖及其衍生物在固定化酶中的应用进展. 中国海洋药物, 23(4): 39—42
韩志萍, 叶剑芝, 罗荣琼, 2012. 固定化酶的方法及其在食品中的应用研究进展. 保鲜与加工, 12(5): 48—53
鲁玉侠, 蔡妙颜, 郭祀远等, 2007. 海藻酸钠包埋法制备固定化脂肪酶研究. 现代食品科技, 22(4): 30—32
游金坤, 余旭亚, 赵 鹏, 2012. 吸附法固定化酶的研究进展.化学工程, 40(4): 1—5
镡雪莹, 秦希杰, 查恩辉等, 2010. 酶解牛肉工艺的研究. 辽宁医学院学报, 31(5): 438—440
Macario A, Moliner M, Corma A et al, 2009. Increasing stability and productivity of lipase enzyme by encapsulation in a porous organic-inorganic system. Microporous and Mesoporous Materials, 118(1—3): 330—334
Malik B, Goyal A K, Markandeywar T S et al, 2012. Microfoldcell targeted surface engineered polymeric nanoparticles for oral immunization. Journal of Drug Targeting, 20(1): 76—84
Santos A M P, Oliveira M G, Maugeri F, 2007. Modelling thermal stability and activity of free and immobilized enzymes as a novel tool for enzyme reactor design. Bioresource Technology,98(16): 3142—3148
Serebryakova L T, Zorin N A, Karyakin A A, 2009. Improvement of hydrogenase enzyme activity by water-miscible organic solvents. Enzyme and Microbial Technology, 44(5): 329—333

