胰腺黏液性囊腺瘤和浆液性囊腺瘤的超声诊断与病理对照
骆洪浩,彭玉兰,赵海娜
(四川大学华西医院超声诊断科,成都610041)
胰腺囊性肿瘤可分为胰腺囊腺瘤和囊腺癌,囊腺瘤为良性肿瘤,约占胰腺肿瘤的1%~2%[1]。囊腺瘤又为黏液性囊腺瘤(MCA)和浆液性囊腺瘤(SEA),前者约占胰腺囊性肿瘤的10%~45%,后者约占32%~39%[2]。随着超声技术的发展和检查的广泛应用,以及健康体检的增多,无临床症状的胰腺囊性肿瘤的发现增加,但是胰腺囊腺瘤的超声诊断和鉴别诊断目前认知较少,本文回顾性分析本院67例胰腺囊腺瘤超声声像图特征,探讨超声对胰腺囊腺瘤的诊断以及鉴别诊断的价值。
1 资料与方法
1.1 一般资料 选择2003年4月至2013年8月在本院行超声检查,术后病理证实为胰腺囊腺瘤的患者67例。其中,MCA 47例,女41例,男6例,平均年龄(49.06±15.55)岁,39例因腹胀、腹痛、腹部肿块行超声检查发现,8例体检发现;SEA 20例,女14例,男6例,平均年龄(41.5±14.37)岁,5例因腹胀、腹痛、腹部肿块行超声检查发现,15例体检发现。
1.2 方法 彩色多普勒仪彩色诊断仪包括Philips IU22、Philips HDI 5000、Philips HD 11。低频凸阵探头频率2~5MHz。检查方法:患者仰卧位,充分暴露检查部位,不同断面扫查,记录肿瘤发生部位(胰腺头颈部、体尾部、全胰腺)、测量大小、观察肿瘤的边界、形态(圆形、椭圆形、分叶状),记录囊腔数(多囊型:囊腔数量大于或等于6个,包括微囊型;少囊型:囊腔数量小于6个,包括单囊)及有无钙化。
1.3 统计学处理 统计学分析采用SPSS17.0软件。计量资料用±s表示,采用t检验,如果理论频数小于5时采用Fisher精确概率检验法。计数资料用率表示,采用χ2检验,以P<0.05为差异有统计学意义。
2 结 果
本组MCA发病年龄范围约1~73岁,SEA发病年龄范围约4~70岁,两者发病年龄差异无统计学意义(t=1.862,P=0.067),MCA病灶大小范围约1~11cm,SEA病灶大小范围约1.4~7.5cm,两者在大小上差异无统计学意义(t=1.044,P>0.05);MCA最大囊径范围约1~9cm,SEA最大囊径范围约0.5~7.2cm,两者在最大囊直径比较,差异有统计学意义(t=2.542,P<0.05)。胰腺 MCA与SEA的临床资料及声像图特征见表1,不同类型的胰腺囊腺瘤声像图表现见图1~5。
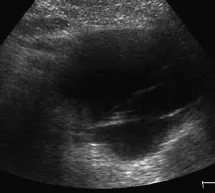
图1 少囊型胰腺MCA
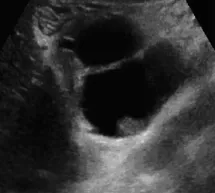
图2 囊壁结节型胰腺MCA
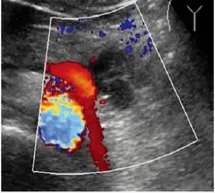
图3 多囊型胰腺SEA
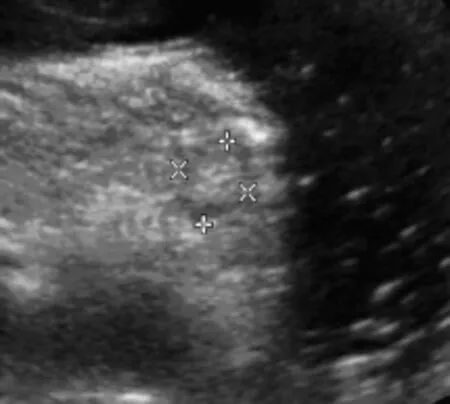
图4 微囊型胰腺SEA

表1 胰腺囊腺瘤的临床资料及超声声像图表现[n(%)]
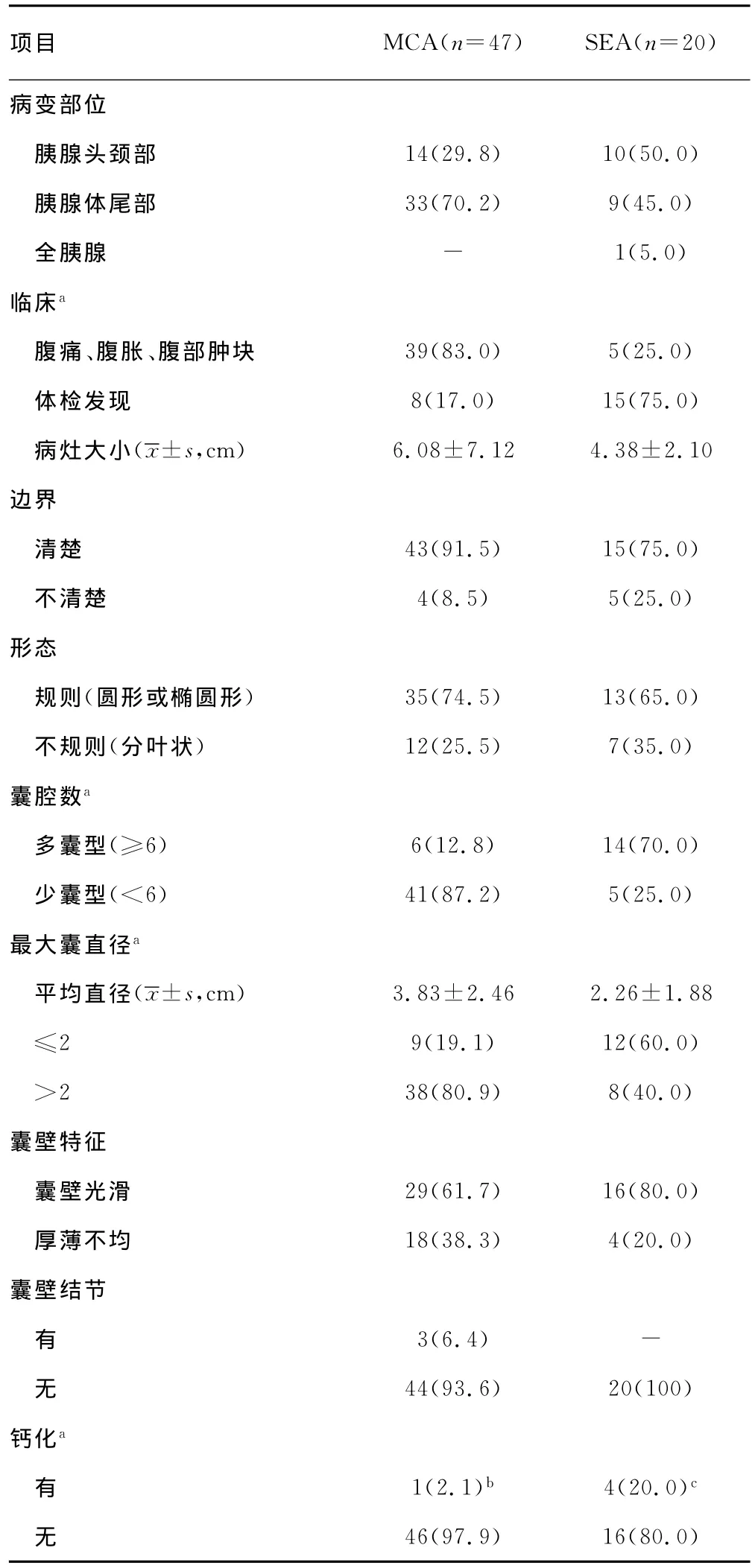
续表1 胰腺囊腺瘤的临床资料及超声声像图表现[n(%)]
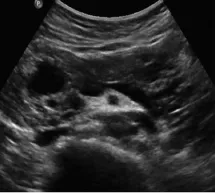
图5 多发型胰腺SEA
3 讨 论
胰腺囊腺瘤分为 MCA和SEA[3],MCA约占胰腺囊性肿瘤的一半,为单一病理类型[4];SEA分为微囊型、少囊型及少见类型[5];微囊型又分两个亚型:多囊型和蜂房型,多囊型常见,占胰腺SEA 的70%,后者占20%[6]。
胰腺MCA女性患者的发病年龄在47岁左右,女性患者所占比例超过95.0%[7]。患者常有临床表现,病灶较大时腹部可扪及肿块,少数病变在行术前一般检查或健康体检时发现,本组胰腺MCA女性患者41例,占87.2%,女性患者的平均年龄为(46.32±12.36)岁,有临床症状者39例,与以往文献报道基本一致。
胰腺SEA中老年女性亦多见,多数无临床表现,一般于健康体检或术前常规超声检查时发现,少数患者可有腹胀、腹痛而行超声检查发现,本组胰腺SEA女患者14例,占70.0%,女性患者的平均年龄为(39.8±10.12)岁,相对于 MCA女性的发病年龄较年轻,有临床症状者5例。
胰腺MCA多见于胰腺体尾部,本组体尾部33例,占70.2%,头颈部14例,占29.8%;胰腺SEA发病可发生于胰腺任何部位及整个胰腺,本组胰腺头颈部10例,占50.0%,体尾部9例,占45.0%,全胰腺1例,占5.0%。
胰腺MCA超声表现:多数为单囊或少囊型,最大囊直径通常大于2cm,圆形或椭圆形,当肿块较大时可呈分叶状,内壁光滑,可见囊壁结节样回声突入腔内,囊壁厚度各异,可见囊壁边缘钙化。
胰腺SEA根据不同病理类型可有不同的超声表现[8-9]:(1)多囊型:超声表现为边界清楚,肿块较大时呈分叶状、较小时呈圆形或椭圆形,囊腔数大于或等于6个,囊腔直径小于或等于2cm,均匀壁厚,病灶中心分隔处可见钙化。(2)微囊型:肿块呈圆形或椭圆形,边界清楚,二维超声通常显示为低回声或稍强回声的肿块,仔细观察发现肿块内见多数蜂房状的无回声区。(3)少囊型:超声表现为边界清楚、圆形、椭圆形或分叶状的肿块,可为单个囊腔,亦可为多个囊腔,但是囊腔数小于6个,囊腔直径可以大于2cm,分隔薄,有时囊壁可见钙化。(4)多发型:超声表现为胰腺体积增大,实质内多个大小不等的无回声结节,壁薄,不互通,此型见于多发性SEA,此病罕见,多见于18~30岁,发病率1/40 000~1/35 000,常染色体显性遗传疾病,可累及全身多个脏器[10],根据以往文献报道符合以下中的任何1条即可诊断:①多个中枢神经系统血管网状细胞瘤;②单个中枢神经系统血管网状细胞瘤和累及单个或多个脏器;③单个中枢神经系统血管网状细胞瘤或累及其他脏器,并有明确的家族史[11]。有文献报道胰腺多发囊肿是VHL综合征早期病变的唯一的表现,是此病的重要征象之一,超声声像图表现为胰腺实质内多发的囊肿,正常实质常难以显示[12-13]。
MCA有恶变倾向,需手术切除;SEA通常认为是良性肿瘤,有极少数的恶变病例报道,无症状的SEA无需手术,在超声声像图上鉴别两者的不同表现,可为临床提供一定的治疗方案。两者间的主要鉴别要点在于是否有临床症状、肿块内的囊腔数、单个囊腔的最大囊直径及囊壁有无钙化。临床上有腹胀、腹痛等症状,囊腔数小于6个,最大囊直径大于2cm,病变无钙化时提示MCA的可能,而当临床上没有症状,囊腔数大于或等于6个,最大囊直径小于或等于2cm,病灶有钙化时提示SEA的可能。需要特别说明的是超声对胰腺囊腺瘤钙化的检出较低,本研究MCA仅1例发现边缘钙化,SEA有4例发现中心分隔钙化,而据以往的文献显示,MCA的钙化率明显低于SEA,MCA的钙化多为囊壁钙化,相反,SEA的钙化多为中心分隔钙化,与本研究的结果大致相似[14]。
胰腺囊腺瘤还应与其他常见的胰腺囊性病变相鉴别:(1)胰腺假性囊肿:胰腺假性囊肿常发生于急慢性胰腺炎后,囊壁厚薄不均,囊腔内可见絮状弱回声,而胰腺本身可有肿大、萎缩、主胰管扩张、结石等不同的超声表现,结合临床病史鉴别不难。(2)胰腺实性假乳头状瘤:20~30岁的年轻女性多见,肿瘤通常突出于胰腺实质外,以无回声、低回声及等回声的囊实混合性回声为主,胰管无明显扩张。(3)胰腺导管内乳头状黏液瘤:好发于60~70岁的老年人,男性多见,男女比例约2∶1;多见于胰腺钩突,超声表现为胰管扩张与囊性肿块,两者相通,并可见乳头状结节,胰管阻塞至胰液流出受阻,所以常合并胰腺炎。
综上所述,本研究显示,根据超声声像图的典型表现,并与胰腺其他囊性肿瘤相鉴别,多数胰腺囊腺瘤能够得到正确的诊断,根据有无临床症状、囊腔数量、最大囊直径,以及有无钙化对MCA与SEA可作出初步的鉴别诊断。对于不典型的病例,应结合多种影像学检查来提高胰腺囊腺瘤的诊断率。
[1] Adsay NV.Cystic neoplasia of the pancreas:pathology and biology[J].J Gastrointest Surg,2008,12(3):401-404.
[2] Goh BK,Tan YM,Chung YF,et al.Pancreatic cysts:a proposed management algorithm based on current evidence[J].Am J Surg,2007,193(6):749-755.
[3] Compagno J,Oertel JE.Microcystic adenomas of the pancreas(glycogen-rich cystadenomas):a clinicopathologic study of 34cases[J].Am J Clin Pathol,1978,69(3):289-298.
[4] Fukushima N,Fukayama M.Mucinous cystic neoplasms of the pancreas:pathology and molecular genetics[J].J Hepatobiliary Pancreat Surg,2007,14(3):238-242.
[5] Capella C,Solcia A,Klöppel G,et al.Serous cystic neoplasms of the pancreas[M].Lyon:IARC Press,2000:231-233.
[6] Sarr MG,Murr M,Smyrk TC,et al.Primary cystic neoplasms of the pancreas.Neoplastic disorders of emerging importance-current state-of-the-art and unanswered questions[J].J Gastrointest Surg,2003,7(3):417-428.
[7] Sakorafas GH,Smyrniotis V,Reid-Lombardo KM.et al.Primary pancreatic neoplasms revisited:partⅡ mucinous cystic neoplasms[J].Surg Oncol,2011,20(2):93-101.
[8] Kim HJ,Lee DH,Ko YT,et al.CT of serous cystadenoma of the pancreas and mimicking masses[J].AJR,2008,190(2):406-412.
[9] Choi JY,Kim MJ,Lee JY,et al.Typical and atypical manifestations of serous cystadenoma of the pancreas:imaging findings with pathologic correlation[J]AJR,2009,193(1):136-142.
[10] Marcos HB,Libutti SK,Alexander HR,et al.Neuroendocrine tumors of the pancreas in Von Hippel-Lindau disease:spectrum of appearances at CT and MR imaging with histopathologic comparison[J].Radiology,2002,225(3):751-758.
[11] 马小龙,魏伟,汪建华,等.Von Hippel-Lindau病的影像表现[J].中华放射学杂志,2013,47(4):344-348.
[12] Maher ER,Neumann HP,Richard S.Von Hippel-Lindau disease:a clinical and scientific review[J].Eur J Hum Genet,2011,19(6):617-623.
[13] Leung RS,Biswas SV.Duncan M,et al.Imaging features of Von Hippel-Lindau disease[J].Radiographics,2008,28(1):65-79.
[14] 袁东,余卫,任小波,等.胰腺囊腺瘤的多层螺旋CT表现特征及诊断准确性[J].中国医学科学院学报,2007,29(2):232-237.

