HPLC法同时测定复方片剂中奥美沙坦酯与苯磺酸氨氯地平的含量
张 宁,孙 进
(沈阳药科大学 药学院,辽宁 沈阳 110016)
HPLC法同时测定复方片剂中奥美沙坦酯与苯磺酸氨氯地平的含量
张 宁,孙 进*
(沈阳药科大学 药学院,辽宁 沈阳 110016)
目的建立HPLC法同时测定复方片剂中奥美沙坦酯与苯磺酸氨氯地平的含量。方法采用Thermo C18色谱柱(150 mm×4.6 mm,5 μm),流动相为乙腈-15 mmol·L-1磷酸二氢钾(pH=2.5)(体积比48:52),流速为1.0 mL·min-1,紫外检测波长为237 nm,柱温为30 ℃。结果奥美沙坦酯质量浓度在0.01~0.5 g·L-1内与峰面积呈良好的线性关系(r=0.999 8),平均回收率为 99.71%;苯磺酸氨氯地平质量浓度在 5.000~125.0 mg·L-1内与峰面积呈良好的线性关系(r=0.999 9),平均回收率为 100.06%。结论本方法可用于同时测定复方片剂中奥美沙坦酯与苯磺酸氨氯地平的含量。
药剂学;含量测定;高效液相色谱法;奥美沙坦酯;苯磺酸氨氯地平
奥美沙坦酯(olmesartan medoxomil,OLM,化学结构式见图1)是选择性血管紧张素Ⅱ受体拮抗剂,它可以选择性阻断血管紧张素Ⅱ与血管平滑肌ATⅠ受体结合,从而阻断血管紧张素Ⅱ收缩血管的作用,进而起到降低血压的作用[1-2]。苯磺酸氨氯地平(amlodipine besylate,AMB,化学结构式见图 2)属于二氢吡啶类钙离子拮抗剂,它可以选择性阻断钙离子通道,松弛阻力血管平滑肌,降低外周血管阻力,起到降压作用[3-4]。目前国外已有复方奥美沙坦酯苯磺酸氨氯地平片(商品名为Azor,生产商为 Daiichi Sankyo)上市,用于高血压的治疗。有文献报道[5-7],奥美沙坦酯与苯磺酸氨氯地平联合用药可有效治疗高血压,并较其他类型的药物组合能更显著降低心血管疾病的发生率。

Fig. 1 The structure of olmesartan medoxomil (1) and amlodipine besylate (2)图 1 奥美沙坦酯(1)与苯磺酸氨氯地平(2)的化学结构式
文献报道采用分光光度法测定制剂中奥美沙坦酯和苯磺酸氨氯地平的含量[8-9],但分光光度法中波长的选择对测定结果的准确度影响很大,而且计算过程较繁琐。文献报道采用HPLC法同时测定复方制剂中奥美沙坦酯与苯磺酸氨氯地平的含量[10-13],但所采用的方法均有不足之处,如:两个药物的保留时间较长或是在保留时间短的条件下使用较为复杂的流动相或是梯度洗脱。本文作者采用高效液相色谱法,优化流动相使奥美沙坦酯与苯磺酸氨氯地平保留时间分别为4.4 min和5.3 min,保留时间较短且流动相系统简单,并对该含量测定方法进行方法学验证。经验证本法简单、快速、准确、稳定性好、适用性强,为其质量控制提供了试验依据。
1 仪器与材料
高效液相色谱仪(配有2489紫外检测器、2695输液泵、Empower 3色谱工作站,美国Waters公司),ALC-11014电子天平(德国赛多利斯科学仪器有限公司)。
奥美沙坦酯对照品(含量质量分数为99.8%,中国药品生物制品检定所,批号100864-200601),苯磺酸氨氯地平对照品(含量质量分数为99.3%,中国药品生物制品检定所,批号100374-201204),复方奥美沙坦酯苯磺酸氨氯地平片剂样品(自制,规格:每片含奥美沙坦酯40 mg、苯磺酸氨氯地平5 mg,批号:20140320、20140321、20140323)。乙腈(色谱纯,天津康科德科技有限公司),磷酸二氢钾(汕头西陇化工厂有限公司),其他试剂(分析纯,市售),纯净水(杭州娃哈哈集团有限公司)。
2 方法与结果
2.1 色谱条件与系统适用性试验
色谱柱:Thermo C18柱(150 mm×4.6 mm,5 μm);流动相:乙腈-15 mmol·L-1磷酸二氢钾缓冲液(pH=2.5)(体积比为48:52);流速:1.0 mL·min-1;检测波长:237 nm;柱温:30 ℃;理论塔板数按奥美沙坦酯峰计算大于3 000,分离度大于1.5。
2.2 溶液的配制
对照溶液:分别取奥美沙坦酯对照品约20 mg,苯磺酸氨氯地平对照品约2.5 mg,精密称定。置于100 mL量瓶中,加入流动相溶解并稀释制成奥美沙坦酯质量浓度为200 mg·L-1、苯磺酸氨氯地平质量浓度为25 mg·L-1的混合对照溶液。
供试溶液:取样品10片,研细,取适量(约相当于奥美沙坦酯20 mg,苯磺酸氨氯地平2.5 mg),精密称定。置100 mL量瓶中,加流动相适量,超声15 min,放冷,稀释至刻度,摇匀,即得。
2.3 专属性考察
按处方比例称取空白辅料,置100 mL量瓶中,加入适量流动相,超声15 min,放冷后稀释至刻度,摇匀过滤,作为空白辅料溶液。称取奥美沙坦酯对照品及苯磺酸氨氯地平对照品适量,用流动相制成奥美沙坦酯质量浓度为200.0 mg·L-1和苯磺酸氨氯地平质量浓度为25 mg·L-1混合对照溶液,作为标准溶液。取上述空白辅料溶液和标准溶液,按照“2.1”条色谱条件进样,记录色谱图,见图2。由图2可知,辅料不干扰奥美沙坦酯与苯磺酸氨氯地平的测定。

Fig. 2 HPLC chromatograms of blank excipents (A) and standard solution (B)图 2 空白辅料溶液(A)与对照溶液(B)的高效液相色谱图
2.4 线性关系考察
称取奥美沙坦酯对照品约10 mg,精密称定。置于10 mL量瓶中,用流动相溶解并稀释至刻度,摇匀,即得质量浓度为1 g·L-1奥美沙坦酯对照储备液;称取苯磺酸氨氯地平对照品约10 mg,精密称定。置于10 mL量瓶中,用流动相溶解并稀释至刻度,摇匀,即得质量浓度为1 g·L-1苯磺酸氨氯地平对照储备液。精密量取奥美沙坦酯对照储备液0.1、0.5、1、2、3、4、5 mL各置编号为1、2、3、4、5、6、7的10 mL量瓶中,再精密量取苯磺酸氨氯地平对照储备液0.05、0.1、0.2、0.25、0.5、1.0、1.25 mL依次加入上述编号为1~7的各量瓶中,用流动相稀释至刻度,摇匀,制得奥美沙坦酯与苯磺酸氨氯地平的系列混合标准溶液,按照“2.1”条色谱条件进样,记录色谱图。以峰面积(A)对质量浓度(ρ)进行线性回归,分别得奥美沙坦酯回归方程:A=2.255×104ρ-2.225×104,r=0.999 8;苯磺酸氨氯地平回归方程:A=1.534×104ρ+1.261×104,r=0.999 9。结果表明,奥美沙坦酯和苯磺酸氨氯地平质量浓度分别在0.01~0.5 g·L-1和5.000~125.0 mg·L-1内与峰面积呈良好的线性关系。
2.5 精密度试验
分别取“2.4”条下编号分别为1、4、7号的低、中、高三个质量浓度混合标准溶液,于日内每隔2 h测定一次,连续3次,另于每日进样测定1次(当天配制),连续3次,记录色谱图。通过日间精密度与日内精密度的考察,各RSD值均在限度以内,表明方法精密度良好,结果见表1。

Table 1 Precision of the method(n=9)表 1 精密度试验结果(n=9)
2.6 回收率试验
精密称取奥美沙坦酯对照品16.0、20.0、24.0 mg,分别置于100 mL量瓶中,再精密称取苯磺酸氨氯地平对照品2.0、2.5、3.0 mg,分别依次置于上述100 mL量瓶中。加入处方量混合空白辅料,用流动相制成一定质量浓度的溶液,摇匀,制成相当于含奥美沙坦酯与苯磺酸氨氯地平质量分数80%、100%、120%的溶液,滤过,作为供试溶液;另精密称取奥美沙坦酯与苯磺酸氨氯地平对照品适量,用流动相溶解并制成每1 mL中约含奥美沙坦酯200 μg、苯磺酸氨氯地平25 μg的溶液,作为对照溶液,将上述溶液按照“2.1”条色谱条件进样,记录色谱图,回收率试验结果见表2。
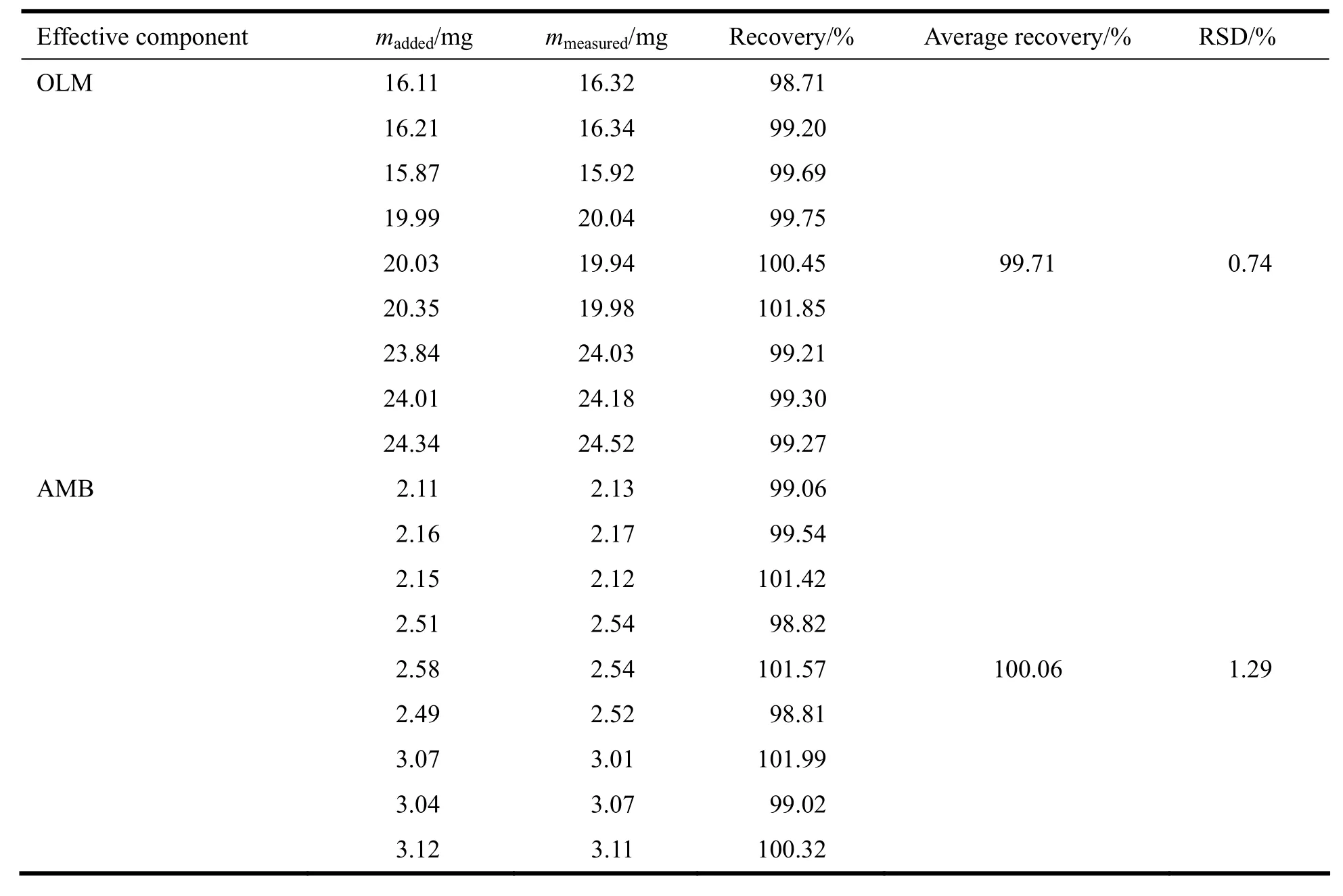
Table 2 Recoveries of the assay(n=9)表 2 回收率试验结果(n=9)
2.7 稳定性试验
按照“2.2”条方法制备供试溶液,室温放置,分别于0、2、4、6、8和10 h,按照“2.1”条色谱条件进样,记录色谱图。结果显示,在不同时间点所测奥美沙坦酯与苯磺酸氨氯地平峰面积的RSD分别为0.46%和0.83%,表明供试溶液室温放置10 h内稳定。
2.8 耐用性试验
检测方法的耐用性试验是在改变一些试验条件(包括水相pH、流速、流动相组成等)考察其检测相同样品的重复性。在流速、流动相组成等试验条件不变的情况下,改变水相pH,水相pH分别为2.4、2.5和2.6。同理,改变流动相组成,有机相与水相的体积比分别为43:57、48:52和53:47。同理,改变流速,流速分别为0.9、1.0和1.1 mL·min-1,分别在不同条件下检测相同样品的重复性。
试验结果表明该方法在适当改变检测条件时重复性良好,方法耐用性良好,结果见表 3。

Table 3 Robustness test of the method表 3 方法耐用性试验结果
2.9 样品含量测定
按照“2.2”条方法制备对照溶液及3批样品的供试溶液,进样,记录色谱图。按外标法计算样品中两主成分(以百分标示量计)含量,每批次样品测定3次,结果见表4。

Table 4 Drug content of samples表 4 样品含量测定结果
3 讨论
a. 奥美沙坦酯最大吸收波长为250 nm,苯磺酸氨氯地平最大吸收波长为237 nm,考虑在该检测条件下同时保证两药吸收较大,故选择237 nm为检测波长。
b. 奥美沙坦酯对流动相比例及水相pH较为敏感,随着水相pH值的升高,两个主药的保留时间增大,且苯磺酸氨氯地平比奥美沙坦酯增大的程度要大,最后综合考虑水相 pH值与流动相中水相与有机相的比例,选择水相pH值为2.5,水相与有机相的体积比为52:48,该分析方法快速、准确。
[1] GREAT M. Olmesartan medoxomil combined with hydrochlorothiazide for the treatment of hypertension[J]. Vasc Health Risk Manag, 2006, 2(4): 401-409.
[2] 荆珊, 孙宁玲, 柯元南, 等. 奥美沙坦酯片治疗轻中度原发性高血压的疗效和安全性[J]. 中国临床药理学杂志, 2006, 22(1): 326.
[3] KREUTZ R. Olmesartan/amlodipine: a review of its use in the management of hypertension[J]. Vasc Health and Risk Manag, 2011, 7: 183-192.
[4] 钱之玉. 药理学[M]. 北京:中国医药科技出版社, 2003: 398-400.
[5] ALAN H, JAN N, BARRY C, et al. Combination therapy in hypertension[J]. Journal of the American Society of Hypertension, 2010, 4(2): 90-98.
[6] STEVEN C, JOSEPH J, DEAN K, et al. Efficacy and safety of triple-combination therapy with olmesartan, amlodipine, and hydrochlorothiazide in study participants with hypertension and diabetes: a subpopulation analysis of the TRINITY study[J]. Journal of the American Society of Hypertension, 2012, 6(2): 132-141.
[7] 郭东华, 韩清华. 奥美沙坦酯加氨氯地平与奥美沙坦酯加氢氯噻嗪治疗原发性高血压对比观察[J]. 中西医结合心脑血管病杂志, 2011, 9: 267-269.
[8] POUMIMA P, VAISHALI B, HARINATH M, et al. Spectrophotometric method for simultaneous determination of olmesartan medoximil and amlodipine besylate from tablet dosage form[J]. Int J of Cur Pharma Res, 2011, 3: 74-79.
[9] HANY D, AHMED B. Multivariate versus classical univariate calibration methods for spectrofluorimetric data: Application to simultaneous determination of olmesartan medoxamil and amlodipine besylate in their combined dosage form[J]. J Fluoresc, 2013, 23:79-91.
[10] PATIL K R, RANEL V P, SANGSHETTI J N, et al. Stability indicating LC method for the simultaneous determination of amlodipine and olmesartan in dosage form[J]. J of Chroma Sci, 2010, 48: 601-606.
[11] ANIRUDDHA C, BHANUDAS K, SWATI J, et al. Development and validation of an RP-HPLC method for simultaneous estimation of olmesartan medoxomil and amlodipine besylate in tablet dosage form[J]. Arch Appl Sci Res, 2010, 2(4): 307-312.
[12] SYED Q, SYED R, MUHAMMAD A, et al. Simultaneous quantitation of olmesartan medoxomil and amlodipine besylate in combined tablets using HPLC[J]. J Chil Chem Soc, 2009, 54: 234-237.
[13] KARDILE D, KALYANE N, THAKKAR T, et al. Simultaneous estimation of amlodipine besylate and olmesartan medoxomil drug formulations by HPLC and UV-spectrophotometric methods[J]. J Pharm Sci & Res, 2010, 2(9): 599-514.
Simultaneous determination of the content in compound tablets of olmesartan medoximil and amlodipine besylate
ZHANG Ning, SUN Jin*
(School of Pharmacy, Shenyang Pharmaceutical University, Shenyang 110016, China)
ObjectiveTo establish an high performance liquid chromatography (HPLC) method to simultaneously determinate the content of olmesartan medoxomil and amlodipine besylate in compound tablets.MethodThe separation was achieved on the Thermo C18column (150 mm×4.6 mm, 5 μm) using a mobile phase consisting of acetonitrile-15 mmol·L-1KH2PO4(V:V=48:52) at a flow rate of 1.0 mL·min-1and UV detection at 237 nm.ResultsThe linearity of the proposed method was investigated in the range of 0.01-0.5 g·L-1(r=0.999 8) for olmesartan medoxomil and 5.000-125.0 mg·L-1(r=0.999 9) for amlodipine besylate. The recoveries were 99.71% for olmesartan medoxomil and 100.06% for hydrochlorothiazide, respectively.ConclusionThis method can be used to simultaneously determinate the content of olmesartanmedoxomil and amlodipine besylate.
pharmaceutics; content determination; HPLC; olmesartan medoxomil; amlodipine besylate
R94
A
(本篇责任编辑:马丽丽)
(2015)02-0056-07
10.14146/j.cnki.cjp.2015.02.003
2014-04-24
张宁(1988-),女(汉族),辽宁海城人,硕士研究生,E-mail zhangning-0613@163.com;*通讯作者:孙进(1975-),男(汉族),安徽金寨人,教授,博士,博士生导师,主要从事生物药剂学与药动学、基于纳米技术的药物传递系统的研究,Tel. 024-23986325,E-mail sunjin0529@aliyun.com 。
- 中国药剂学杂志(网络版)的其它文章
- 琥珀布考纳米胶束含量测定方法的研究
- 奥美沙坦酯平衡溶解度及油水分配系数的测定
- 紫杉烷及其胶束制剂的历史与发展

