非包衣乙酰化β-乳球蛋白肠溶片的制备及处方优化
陈浩宇,王 楠,叶田田,王淑君
(沈阳药科大学 药学院,辽宁 沈阳 110016)
非包衣乙酰化β-乳球蛋白肠溶片的制备及处方优化
陈浩宇,王 楠,叶田田,王淑君*
(沈阳药科大学 药学院,辽宁 沈阳 110016)
目的研究乙酰化β-乳球蛋白作为新型肠溶辅料的特性,制备乙酰化β-乳球蛋白为肠溶辅料的阿司匹林非包衣肠溶片,并对其进行处方优化。方法使用乙酸酐对β-乳球蛋白进行乙酰化改性,考察改性后的β-乳球蛋白在不同pH环境下的溶解度及稳定性。以阿司匹林为模型药物,乙酰化β-乳球蛋白为肠溶填充辅料制备非包衣肠溶片,并利用Box-Behnken法对非包衣肠溶片的处方和工艺进行优化。结果乙酰化改性使β-乳球蛋白等电点向低pH端偏移,实现了乙酰化β-乳球蛋白在pH<5.2环境下溶解度的降低和稳定性的提高,因此显现出了一定的肠溶释药性能。对制备的阿司匹林非包衣肠溶片进行处方及工艺优化后,实现了药物在酸性条件下2 h释放量低于2%且在中性环境下45 min释放量达到97%的肠溶释放效果。结论经乙酰化改性的β-乳球蛋白可作为一种新型的肠溶辅料应用于非包衣肠溶片的制备,所制备的非包衣肠溶片具有良好的肠溶释药效果。
药剂学;非包衣肠溶片;响应曲面法;乙酰化β-乳球蛋白;体外释放
生物可降解材料由于其自身具有生物相容性高、安全无毒等特点,在药物制剂领域中表现出了广阔的应用前景,尤其是多糖类和蛋白类物质作为天然的可降解高分子材料在药物传递系统中有着广泛的研究。但是天然蛋白类物质由于自身结构的原因通常功能性较差,必须对其进行适度的改性以满足功能要求。传统的蛋白改性方法主要分为四类[1]:酶法、化学法、物理法和基因工程法。其中化学法是蛋白类物质改性途径中最为常用的方法;乙酰化法作为目前最常见的蛋白化学改性手段之一,有大量的研究和文献表明经乙酰化改性后的蛋白类物质,其起泡性,乳化性、稳定性均得到了一定程度的提高[2-3]。
β-乳球蛋白(β-lactoglobulin,β-lg)是牛乳乳清中的主要蛋白质,其质量约占总乳清蛋白质量的50%及总乳蛋白质量的 12%。β-乳球蛋白作为乳清蛋白的主要成分,具有多样的功能性,经琥珀酰化改性后作为辅料用于非包衣肠溶片的制备已有文献报道[4-5]。本文作者选用了乙酸酐对β-乳球蛋白进行化学改性研究,考察乙酰化改性对β-乳球蛋白在不同pH环境下的溶解度和稳定性影响,并针对由乙酰化β-乳球蛋白为辅料制备的非包衣肠溶片进行了处方和工艺优化。
1 仪器与材料
UV-2000紫外-可见分光光度计(尤尼柯(上海)仪器有限公司),压片机(上海灵峰机械制造有限公司);ZRCD6-B 型药物溶出度测定仪(上海黄海药检仪器厂)。
β-乳球蛋白(β-lg,含量质量分数≥90.0%,上海华壹生物科技有限公司),透析袋(截流相对分子质量为1 000,上海斯百全化学有限公司),阿司匹林(aspirin,医药级,含量质量分数≥99.0%,武汉宏信康精细化工有限公司),2,2'-联喹啉-4,4'-二甲酸二钠(bicinchoninic acid hydrate disodium salt,BCA,含量质量分数≥99.0%,成都贝斯特试剂有限公司),乙酸酐、磷酸二氢钠等其他试剂(分析纯,山东禹王实业有限公司)。
2 方法与结果
2.1 乙酰化β-乳球蛋白的制备
取50 g β-乳球蛋白在40 ℃磁力搅拌条件下溶解于500 mL蒸馏水中,制成质量分数为10%的β-乳球蛋白溶液,取15 g乙酸酐在磁力搅拌条件下逐渐加入到蛋白溶液中,控制反应温度在40 ℃;反应过程中以2 mol·L-1NaOH溶液调节pH值使其保持在8.0~ 8.5;反应结束后,去离子水透析(4 ℃,24 h),冷冻干燥即得[6]。
2.2 乙酰化改性对β-乳球蛋白溶解性的影响
通过改良的氮溶解指数(nitrogen solubility index,NSI) 方法估算乙酰化改性对β-乳球蛋白在不同pH环境下溶解性的影响。在不同pH值的100 mmol·L-1磷酸盐缓冲液中加入过量的乙酰化β-乳球蛋白,室温条件下静置2 h后1 500 r·min-1离心10 min,取200 μL上清液与4 mL BCA试剂混合摇匀,37 ℃保温30 min后冷却至室温,于562 nm处测定吸光度值。β-乳球蛋白溶液作标准曲线。NSI计算公式为:NSI=[w(ProtS)/w(ProtT)]×100%。其中:w(ProtS) 为上清液蛋白质量分数,w(ProtT)为未经离心的标准蛋白分散液质量分数,其数值为0.2%[7]。
从图1可以看到,经乙酰化改性后的β-乳球蛋白的溶解特性较未改性之前存在着明显的差异。当蛋白所处溶液的pH=pI时,蛋白具有最低的溶解度,β-乳球蛋白的等电点为5.2,经乙酰化改性后蛋白等电点向低pH端偏移至3.7,β-乳球蛋白在pH<5.2环境下的溶解度显著降低。在pH>5.2环境中,经乙酰化改性的β-乳球蛋白的溶解度则在一定程度上得到了提高。

Fig. 1 The effect of acetylation on the solubility of β-lactoglobulin图1 改性反应对蛋白溶解度的影响
2. 3 模拟胃肠液中乙酰化β-乳球蛋白片的稳定性
将乙酰化β-乳球蛋白通过粉末直接压片的方式制备片重为500 mg的空白蛋白片,同法制备β-乳球蛋白片作为对照样品。将两种蛋白片分别置于在1 000 mL模拟胃液(simulated gastric fluid,SGF)和模拟肠液(simulated intestinal fluid,SIF)中,设置介质温度为37 ℃,转速为100 r·min-1,在设定时间点取样,同时补充相同体积的介质。观察片剂形态变化并使用紫外分光光度计在280 nm处检测溶出介质中的蛋白量,以此判断蛋白片在不同介质条件下的稳定性。
经观察,乙酰化β-乳球蛋白片的片剂形态在模拟胃液环境中发生了显著的变化,随着测定时间的推移逐渐由片状膨胀成为球状,但在外观上始终保持了较高的完整性;在模拟肠液中,酰化蛋白片则以较快的速度发生溶解,至70 min时片剂形态基本消失。
图2a表明,乙酰化β-乳球蛋白片和β-乳球蛋白片在模拟胃液中具有明显不同的稳定性,β-乳球蛋白片在模拟胃液中2 h已基本溶解;乙酰化蛋白片在模拟胃液中则始终保持了较高的稳定性,5 h后仅有占片剂总量质量分数1.8%的乙酰β-乳球蛋白被模拟胃液溶解。图2b表明,乙酰化β-乳球蛋白片和β-乳球蛋白片在模拟肠液中具有较为相似的稳定性,检测结果表明,乙酰化β-乳球蛋白片和β-乳球蛋白片分别在75 min和90 min时就已完全溶解。
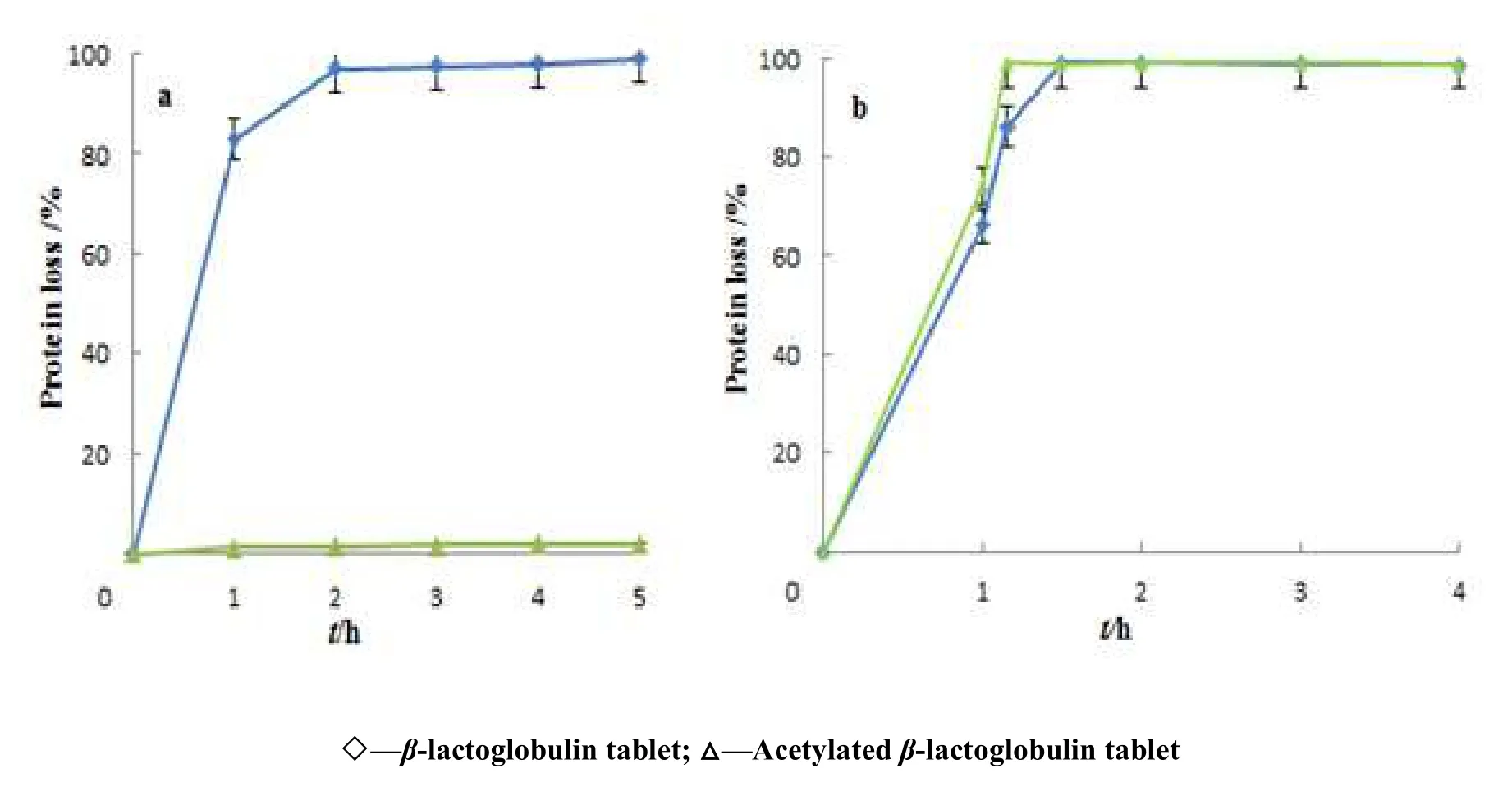
Fig. 2 The effect of acetylation on the stability of β-lactoglobulin in SGF(a) and SIF(b)图2 乙酰化改性对蛋白在模拟胃液(a)和模拟肠液(b)中的稳定性影响
2.4 阿司匹林非包衣肠溶片的制备和体外释药性能研究
以乙酰化β-乳球蛋白为辅料,采用粉末直接压片的方法制备载药量质量分数为10%的阿司匹林非包衣肠溶片。将阿司匹林和乙酰化β-乳球蛋白分别过250 μm筛后,取50 mg阿司匹林与450 mg乙酰化β-乳球蛋白混合均匀,13 mm冲直接压片,压力为0.6 MPa,得到片剂质量为500 mg的载药乙酰化β-乳球蛋白片;同法制备载药β-乳球蛋白片作为对照。按《中华人民共和国药典》2010版二部附录XD,采用溶出度测定法第一法装置考察载药蛋白片的体外释药情况[8]。以0.1 mol·L-1盐酸溶液750 mL为释放介质,转速为100 r·min-1,依法操作,2 h后加入37 ℃的0.2 mol·L-1磷酸钠溶液250 mL,混匀,用2 mol·L-1盐酸溶液或2 mol·L-1氢氧化钠溶液调节溶液的pH值为6.8,继续溶出至完全。在预设时间点取样10 mL,同时补充相同体积的介质,样品溶液滤过后在265 nm处测定吸光度,按照如下公式计算药物累积释放度:Q=[(V×∑t-1n=1c+ ct×V0)/m]×100% 。其中:Q为药物累积释放度,V为取样体积,V0为介质体积,ct为各时间点实测浓度,m为制剂中主药含量(mg)。
实验结果表明,由乙酰化β-乳球蛋白为辅料制备的载药蛋白片初步具备肠溶释放性能。图3表明,载药β-乳球蛋白片在酸中1 h药物释放量已接近100%,而载药乙酰化β-乳球蛋白片在酸性介质中2 h药物释放量仅为6%,符合《中华人民共和国药典》对阿司匹林肠溶片在酸性介质中2 h释放量不高于10%的要求;在溶出介质被更换为pH值6.8的磷酸盐缓冲液后,该片剂的释放速度明显加快,45 min后药物累积释放量为64%,略低于《中华人民共和国药典》对阿司匹林肠溶片在pH值6.8磷酸盐缓冲液中45 min释放量不低于70%的要求。因此,考虑在进一步的处方优化过程中加入少量的崩解剂,使乙酰化β-乳球蛋白片具备更好的肠溶释药性能。
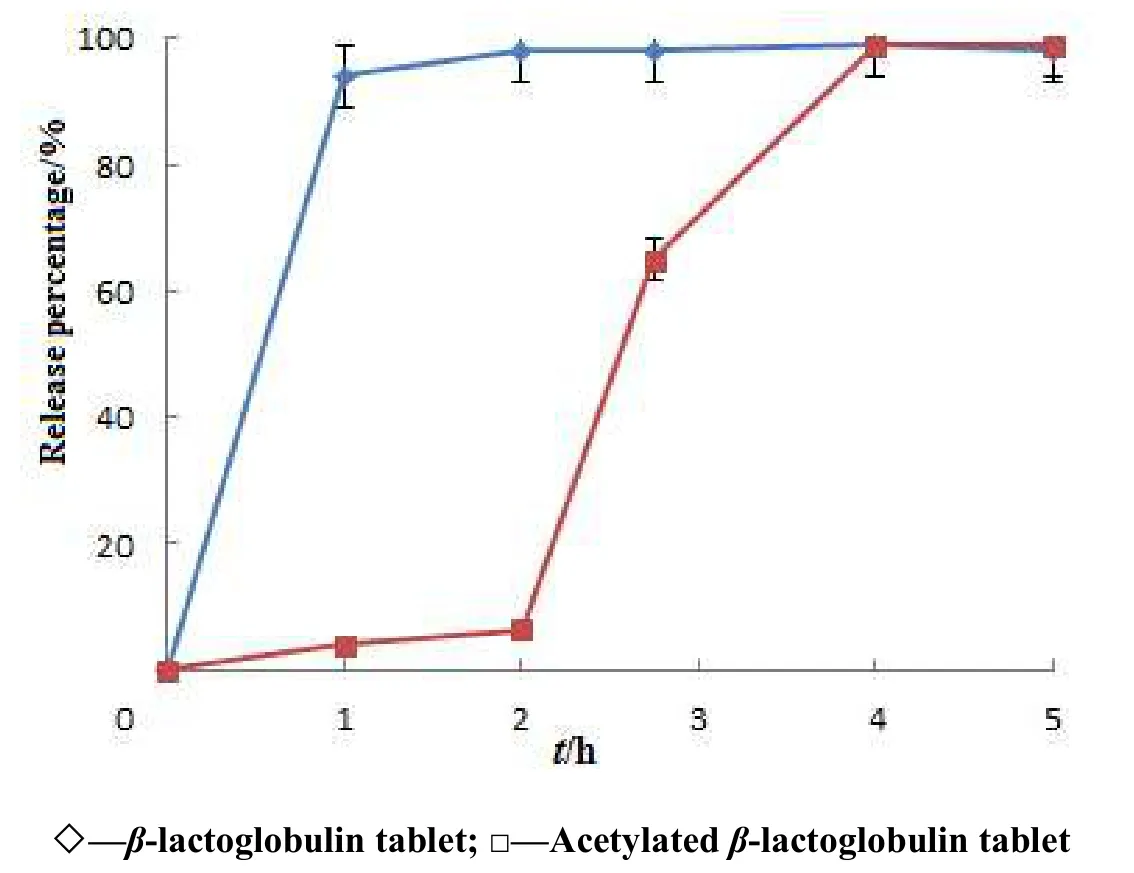
Fig. 3 Release profiles of protein tablets in 0.1 mol·L-1HCL-pH 6.8 PBS medium图3 载药蛋白片在0.1 mol·L-1盐酸溶液-pH6.8磷酸盐缓冲液中释放曲线
2.5 非包衣肠溶片的处方和工艺优化
2.5.1 处方及工艺设计
为进一步优化乙酰化β-乳球蛋白为辅料制备的非包衣肠溶片的肠溶释药效果,选取微晶纤维素(MCC)为崩解剂,采用主药(阿司匹林)与崩解剂经干法制粒后,外加乙酰化蛋白辅料混合均匀压片的方式制备非包衣肠溶片,保证药物在酸中低释放量的同时提高其在中性环境下的释放速度。
通过预实验,确定影响药物释放的主要因素为乙酰化蛋白用量 (X1)和崩解剂用量(X2)及制片压力(X3),其极值范围分别为:X1(450~550 mg)、X2(25~75 mg)和X3(0.5~1.5 MPa),采用判定公式:Y=100% -︱P1-0%︱-︱P2-100%︱(P1为药物在0.1 mol·L-1盐酸溶液中的累积释放度、P2为药物在pH值6.8磷酸盐缓冲液中的累积释放度)判断实际释放度与预期释放度(药物在0.1 mol·L-1盐酸溶液中无释放,在pH值6.8磷酸盐缓冲液中100%释放)的符合程度,计算响应值Y。
根据Box-Behnken中心组合设计的原理,每个因素设置上下限水平为X1(450~550 mg)、X2(25~75 mg)和X3(0.5 ~1.5 MPa),各因素及其水平见表1,实验设计与结果见表2。

Table 1 Independent variables and levels investigated in the BBD表1 响应面中心组合设计因素与水平表
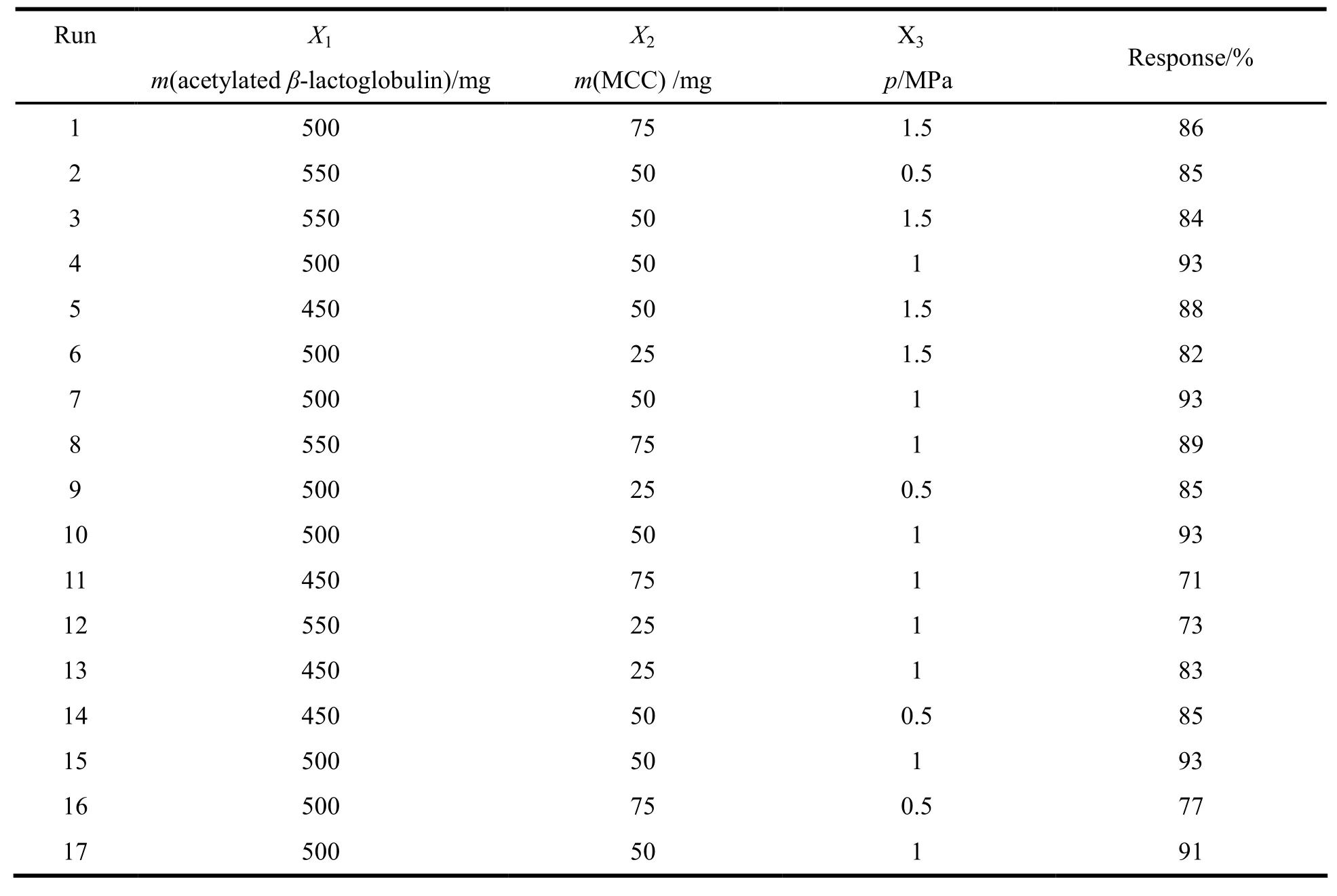
Table 2 Factor levels and observed responses for BBD表2 Box-Behnken中心组合实验设计以及效应值
2.5.2 模型拟合
将所得数据用Design-Expert 8.0.5软件进行效应面试验分析,以实际释放量与预期释放量的符合程度作为效应值进行方程拟合,经软件对表2中试验数据分析后,发现用二次阶多项式回归较优,得到以X1、X2、X3为自变量的二次回归方程模型如下:
Y= -374.0 + 1.97X1-1.68X2+ 2.60X3+ 5.60 × 10-3X1X2-4.0×10-3X1X3+ 2.4×10-2X2X3-2.2×10-3X12-1.36×10-2X22-8.0×10-2X32(R2=0.963 2,P=0.000 3<0.01)
上述方程的拟合度良好,具有统计学意义,说明多元线性模型可较好地描述各因素与指标之间的定量关系,可以用此模型进行处方分析和预测。
应用Design-Expert 8.0.5软件绘制各效应对因素的效应面图和等高线图,见图4-6。

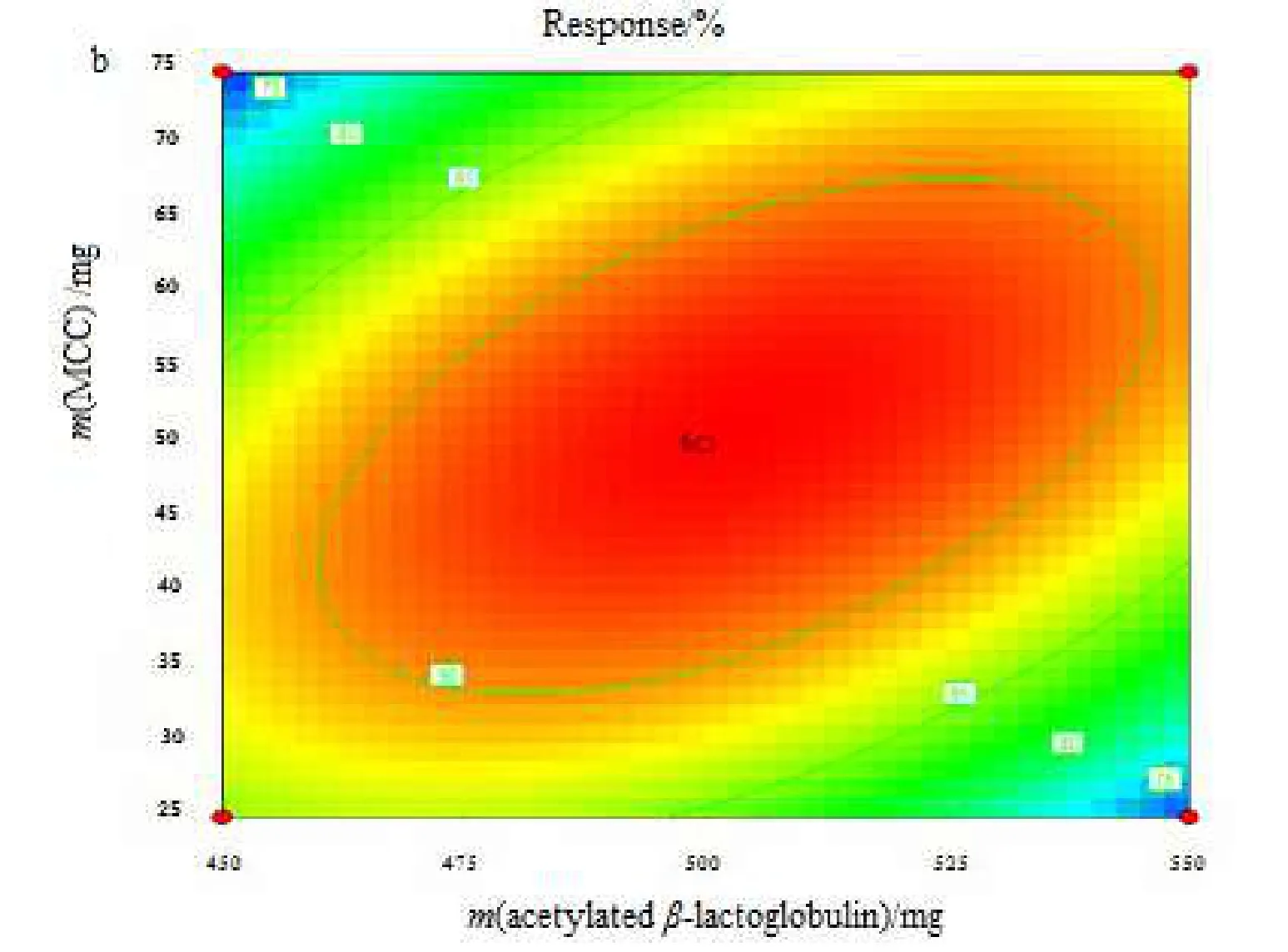
Fig. 4 Response surfaces (a) and 2D contour plot (b) with Argument X1 & X2图4 X1与X2自变量的效应面图(a)和等高线图(b)
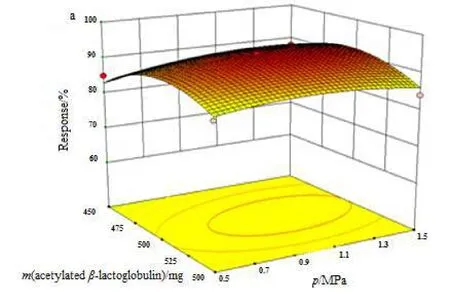
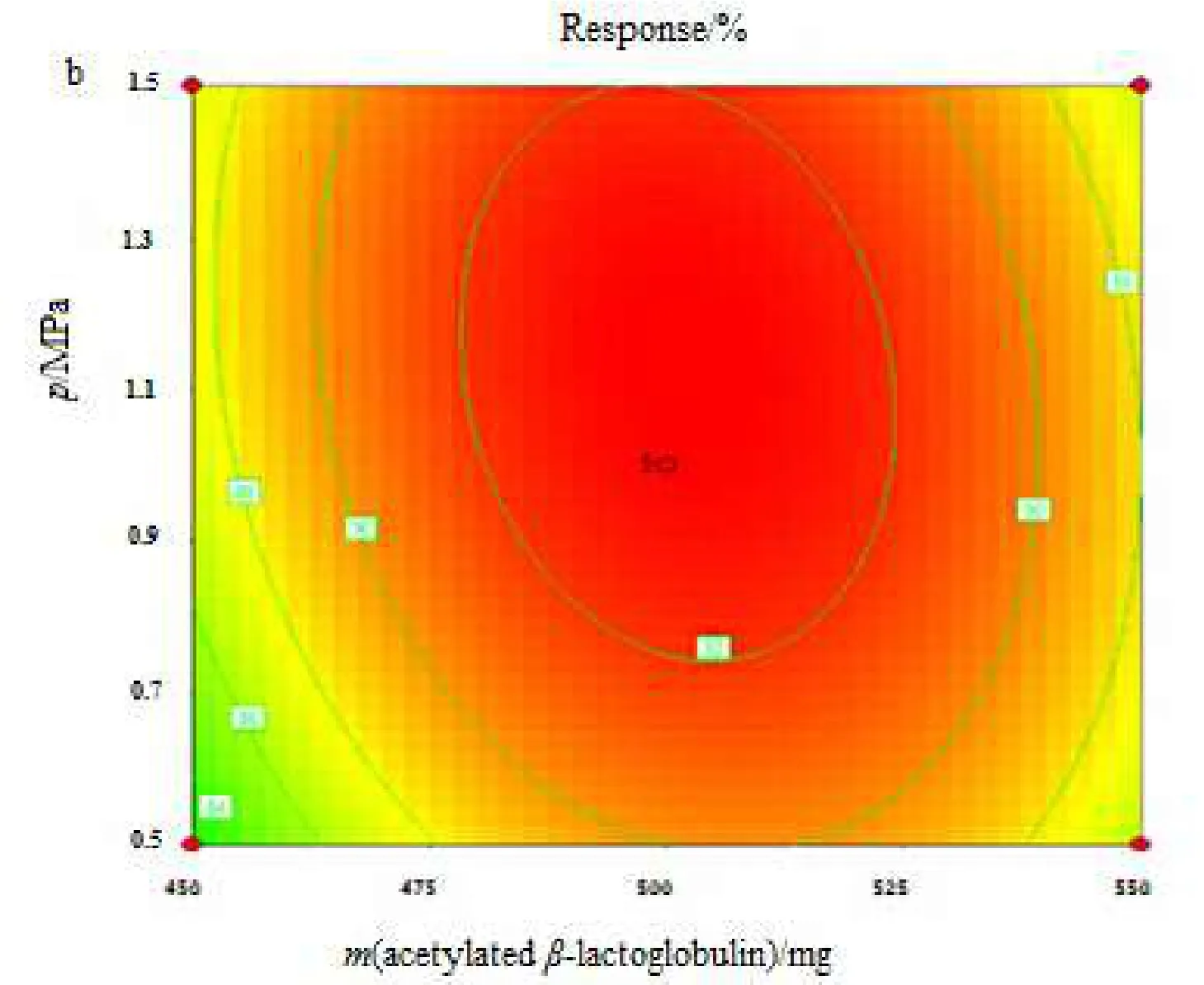
Fig. 5 Response surfaces (a) and 2D contour plot (b) with Argument X1& X3图5 X1与X3自变量的效应面图(a)和等高线图


Fig. 6 Response surfaces (a) and 2D contour plot (b) with Argument X2& X3图6 X2与X3自变量的效应面图(a)和等高线图(b)
通过各主要因素的用量范围和Design-Expert 8.0.5软件对缓释片处方进行预测,分析结果,确定最佳处方为每片(550 mg)含主药40 mg、乙酰化蛋白辅料470 mg、崩解剂微晶纤维素40 mg,制片压力为0.9 MPa。
2.5.3 处方优化验证
在预测最优处方的基础上,进行3批样品放大实验,考察0.1 mol·L-1盐酸溶液-pH值6.8磷酸盐缓冲液中的释放行为,结果见表3。

Table 3 The verification of the optimized formulation表3 优化处方的验证
由表3可知,在优化范围内,处方的理论值与实测值能够很好的吻合,符合实验预期。这表明所建立的数学模型具有良好的预测性,所选工艺条件具有较好的重现性。
3 讨论与结论
a. 乙酰化改性手段可有效地降低β-乳球蛋白在pH<5.2环境下的溶解度,提高其在模拟胃液环境中的稳定性;在pH>5.2环境中,经乙酰化改性的β-乳球蛋白的溶解性能较未改性之前有着明显的提高。这是由于乙酰化反应向β-乳球蛋白引入了中性的乙酰基基团,导致蛋白中可解离的阳离子基团减少,β-乳球蛋白的等电点向低 pH端偏移,使其在酸性环境中的电荷密度和溶解度有了明显的降低;在高于蛋白等电点区域,由于乙酰基对蛋白质分子中的氨基阳离子的封闭使得蛋白质分子间的静电作用减弱,降低了蛋白质分子间的聚集作用,使其水溶性增大[6]。采用粉末直接压片方式制备的非包衣肠溶片,虽然在酸性介质中2 h释放量符合药典对阿司匹林肠溶片释放度的相关规定,但是其在中性条件下的释放量却偏低,因此考虑向制剂中加入一定量的崩解剂以提高药物在中性环境下的释放速度。选取主药与崩解剂干法制粒后外加酰化蛋白辅料混合压片的方式制备非包衣肠溶片,既减少了药物在低 pH环境下与酸性介质的接触面积,保证了较低的药物释放量;同时在中性环境中,伴随着乙酰化β-乳球蛋白的溶解,崩解剂的加入有效地加快了药物的释放速度。
b. 改性β-乳球蛋白的这一特性能够有效地应用于口服缓控释给药系统当中,尤其是作为一种新型的辅料应用于非包衣肠溶片的制备,极大地降低了制备肠溶片的工艺难度和时间成本。此外针对其改性后在胃液环境中较好的抗酸能力和稳定性,其作为载体屏障在生物大分子类药物口服给药和结肠靶向给药方面同样具有广阔的研究和应用前景。
c. 实验结果表明,经乙酰化改性后,β-乳球蛋白的等电点由5.2向低pH端偏移至3.7。乙酰化改性可有效地降低β-乳球蛋白在pH<5.2环境中的溶解度、提高在胃液环境下稳定性,同时提高其在pH>5.2环境下的溶解度。此外通过乙酰化β-乳球蛋白与崩解剂的联合应用及Box-Behnken响应曲面法对所制备的非包衣肠溶片的处方和工艺的优化,在有效降低药物在酸性条件下释放量的同时显著的提高了药物在中性环境下的释放速度,提高了制剂的肠溶释药性能。
参考文献:
[1] 赵国华, 王亚茜, 陈宗道. 乳清蛋白改性综述[J]. 中国乳品工业, 1998, 26(4): 29-32.
[2] 张红印, 傅承新, 郑晓东, 等. 小麦面筋蛋白乙酰化及琥珀酰化改性对功能性改善效果的比较及反应机理初探[J].中国粮油学报, 2003, 18(4): 23-25.
[3] 熊国俊, 赵国华. 酰化对大豆蛋白结构和功能性质影响[J]. 粮食与油脂, 2001(9): 5-7.
[4] CAILLARD R, BOUTIN Y, SUBIRADE M. Characterization of succinylated β-lactoglobulin and its application as the excipient in novel delayed release tablets[J]. International Dairy Journal, 2011, 21: 27-33.
[5] POULIN J F, CAILLARD R, MURIEL S. β-Lactoglobulin tablets as a suitable vehicle for protection and intestinal delivery of probiotic bacteria[J]. International Journal of Pharmaceutics, 2011, 405: 47-54.
[6] 姚玉静, 杨晓泉, 唐传核, 等. 酰化对大豆分离蛋白凝胶性质的影响[J]. 食品与机械, 2008, 24(5): 9-11.
[7] CAILLARD R, PETIT A, SUBIRADE M. Design and evaluation of succinylated soy protein tablets as delayed drug delivery systems[J]. International Journal of Biological Macromolecules, 2009, 45: 414-420.
[8] 国家药典委员会. 中华人民共和国药典: 二部[M]. 北京: 中国医药科技出版社, 2010: 283-284.
The preparation of uncoated enteric tablets with acetylated β-lactoglobulin as excipients and optimization of the prescription
CHEN Hao-yu, WANG Nan, YE Tian-tian, WANG Shu-jun*
(School of Pharmacy, Shenyang Pharmaceutical University, Shenyang 110016, China)
ObjectiveThe acetylated β-lactoglobulin was studied for the application in the preparation of uncoated enteric tablet as a new excipient.MethodsThe solubility and stability of acetylated β-lactoglobulin at different pH were investigated. The aspirin uncoated enteric tablet was prepared with modified β-lactoglobulin and the formula was optimized by Box-Behnken method.Resultsthe isoelectric point and the solubility of β-lactoglobulin decreased with the modification, but the stability of protein was increased at pH<5.2. The uncoated enteric tablets with aspirin maintained the accumulated amount of drug released under 2% within 2 hours at acid pH while 97% drug released in 45 mins at intestinal pH after the optimization of the formulation.ConclusionThe β-lactoglobulin, with modification of acetylation and appropriate formula, was potentially applied in the preparation of uncoated enteric tablets.
pharmaceutics; uncoated enteric tablet; Box-Behnken; acetylated β-lactoglobulin; in vitro dissolution
R 94
:A
(本篇责任编辑:吕向一)
2014-10-09
陈浩宇(1987-),男(汉族),黑龙江哈尔滨人,硕士研究生,E-mail 383015618@qq.com;*通讯作者: 王淑君(1972-),女(汉族),辽宁沈阳人,博士,教授,主要从事药物新剂型研究,Tel. 024-23986360,E-mail xiaohu6408-cn@sina.com。
(2015)03-0107-10
10.14146/j.cnki.cjp.2015.03.004
- 中国药剂学杂志(网络版)的其它文章
- 盐酸普拉格雷固体分散体片的制备及体外溶出度考察
- 咪达那新凝胶的制备及其体外经皮透过性

