思茅松成熟胚的胚性愈伤组织诱导与增殖1)
耿菲菲 肖丰坤 吴涛 陈芳 杨宇明 王娟
(西南林业大学,昆明,650224) (云南省林业科学院)
责任编辑:程 红。
思茅松(Pinus kesiya var.langbianensis)是松科松属常绿乔木,主要分布在云南中南部海拔1 800 m以下地区,是云南省重要的速生、造林、采脂及用材针叶树种。思茅松一年可长2轮枝条,10~12年生时即可采脂,优选的高产脂植株及其它特定培育目的类型的优株亟待推广。建立无性系可将其遗传增益最大化,也是解决木材短缺、培育定向工业原料林的有效途径,其中无性系繁育是前提条件。我国学者已从扦插[1-2]、针叶束水培[3]、丛生芽诱导[4]、体细胞胚胎发生[5]等途径对思茅松无性系繁育做了许多工作。植物体细胞胚胎发生(简称体胚发生)具有数量多、速度快、结构完整、成苗率高等优点,对于生长周期较长的松属树种来说,该途径可快速形成数量多、性状稳定的再生植株,不但是遗传转化最佳的受体系统,更是最有希望大规模繁殖优良无性系的方法[6],该研究将为定向培育高产脂思茅松和速生优质思茅松个体奠定重要基础。
自1985年Hakman和von Arnold[7]首次报道挪威云杉(Picea abies)的未成熟合子胚形成体细胞胚并再生植株以来,体胚发生技术在松科植物中得到了迅速的发展和广泛的研究。目前已有糖松(Pinus lambertiana)[8]、湿地松(P.elliottii)[9]和红松(P.koraiensis)[10]等10多种松属树种通过体胚发生途径获得了再生植株。以成熟种子的合子胚作外植体,材料容易获得且不受取材时间限制,容易保存并可全年用于研究,但存在诱导困难或诱导率低的问题。吴涛等[5]以特定发育阶段的未成熟合子胚为外植体,获得了思茅松的胚性愈伤组织,但诱导率很低,不足2%;而其用成熟胚为外植体未能得到胚性愈伤组织。由于树种特性,松属植物的体胚发生研究较其它树种更为困难,胚性愈伤诱导时外植体的选择和诱导率的提高尚有很大研究空间。为建立思茅松成熟胚的体细胞胚胎发生体系,提高其胚性愈伤组织诱导及增殖率,笔者利用正交试验探索成熟胚为外植体诱导愈伤组织的最适激素质量浓度配比,采用不同培养方式对胚性愈伤组织进行增殖,以期选择出最优增殖培养基,为其无性育苗提供技术支持。
1 材料与方法
思茅松成熟种子于2013年初采于云南省西双版纳州普文镇热带林业研究所思茅松种子园内,干燥后密封,于冰箱中4℃保存。使用前先用自来水浸泡24~48 h,浮选法筛去空瘪种子,余下的饱满种子备用。
外植体消毒与接种:用医用剪刀和解剖刀将外植体种壳去掉后,再用0.1%升汞溶液分别浸泡并摇晃6、8、10、15 min进行消毒,后用灭菌的纯净水冲洗5次。用灭菌解剖刀和镊子划开胚乳,取出种胚水平接种于培养基表面。每个9 cm培养皿接种15个外植体,重复10次。接种7 d后记录外植体污染情况和生长情况,选出最佳消毒时间。
诱导培养基与培养条件:以1/2MSG培养基为基本培养基,pH=5.7~5.8、添加麦芽糖15.00 g·L-1、水解酪蛋白1.00 g·L-1、肌醇0.50 g·L-1、硝酸银0.34 mg·L-1、MES250.00 mg·L-1、活性炭50.00 mg·L-1、植物凝胶4.00 g·L-1,高温灭菌后过滤加入谷氨酰胺750 mg·L-1。附加不同浓度的激素(表1)后配置成诱导培养基。黑暗培养,温度为22~25℃。
正交试验设计:利用L9(34)正交表,考察2,4-D(2,4-二氯苯氧乙酸)、6-BA(6-苄氨基腺嘌呤)、TRIA(三十烷醇)的质量浓度对思茅松成熟胚诱导胚性愈伤组织的影响,其因素水平见表1。每试验接45个外植体,重复3次。

表1 植物激素配比对思茅松胚性愈伤组织诱导的正交设计
愈伤组织形态学与细胞学观察:接种后,每隔3~5 d观察记录愈伤组织的诱导情况,包括愈伤组织产生的时间、部位、形态、质地、大小、颜色,以及污染情况。20~30 d将诱导出来的愈伤组织挑取到载玻片上分别用蒸馏水和卡宝品红染液进行压片。用体视镜(Leica M165FC)和显微镜(Leica DMLS)进行外植体和组织细胞观察。记录并统计胚性愈伤组织诱导情况。
愈伤组织的增殖培养:将诱导出的愈伤组织接种于增殖培养基,为了保证愈伤组织的质量,增殖培养基采用激素质量浓度逐次递减的方式,即激素含量依次减为诱导培养基的1/2、2/5、1/5、1/10,其中2,4-D改用NAA代替。NAA含量逐渐降低为1.0、0.8、0.4、0.2 mg·L-1,TRIT不添加,肌醇增加到1.0 g·L-1,其它成分不变[11]。每2周继代一次,每次转接时均选取新分化的愈伤组织,并在其周围放置少量原培养基[12]。愈伤组织增殖初步效果不理想,所以另设计4种增殖培养基,以期寻找更适合增殖培养的基本培养基和激素处理。从继代3次的8号增殖培养基中,即激素质量浓度降为诱导培养基的1/5,选出一个增殖缓慢的胚性细胞系,并取出大小约为1 cm3的8块愈伤组织,分别接于A、B、C、D 4种培养基上,每种培养基接种2块。这4种培养基应用了两种基本培养基,并添加了不同质量浓度的2,4-D、NAA和6-BA。具体处理见表2。其它成分不变。
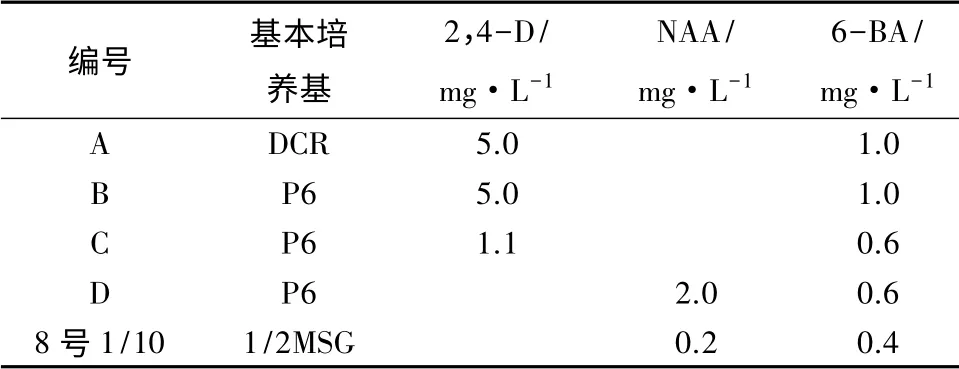
表2 新增的4种增殖培养基和原增殖培养基的成分配比
2 结果与分析
2.1 消毒时间对污染率的控制效果
试验最开始直接使用带种壳的思茅松种子进行消毒,发现将消毒时间从5 min延长至30 min,均不能很好的降低污染率,真菌和细菌污染都较为严重,推测可能是种子暴露在外界环境中时间较久,简单漂浮清洗后直接用HgCl2消毒并不能有效抑制或去除表面微生物。因此,将浮选法挑选出的种子去掉种壳后,再用0.1%HgCl2溶液进行不同时间的消毒处理,结果见表3。当消毒时间小于8 min时,污染率明显偏高;大于8 min时,污染率基本不变,但部分外植体活力降低,40 d后不膨大也不生长。据此,最佳消毒时间选定为8 min。
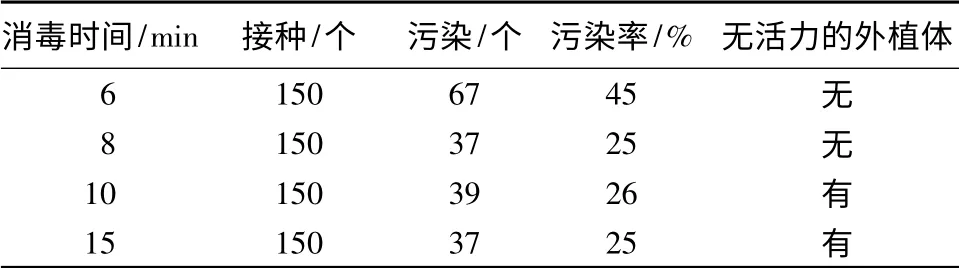
表3 消毒时间对思茅松外植体灭菌效果的影响
2.2 激素对愈伤组织诱导率的影响
9组正交试验的胚性愈伤诱导率依次为26.75%、27.07%、12.50%、86.67%、79.26%、87.77%、24.79%、43.22%、18.25%。由表4可见,影响胚性愈伤组织诱导率的因素由大到小依次为:A、C、B,即3种激素对思茅松成熟胚诱导胚性愈伤组织影响最大的是2,4-D,其次是TRIA,6-BA的影响最小。其中,A因素影响极显著,B因素和C因素影响不显著。正交试验最优组合为A2B2C1,即2,4-D为5.000 mg·L-1、6-BA为4.000 mg·L-1、TRIA为0.005 mg·L-1。为了验证所得结论的正确性,选择正交试验中胚性愈伤诱导率最高的6号与最佳组合条件比较,进行胚性愈伤诱导率的对照试验,结果表明其胚性愈伤诱导率分别为87.77%和88.35%,最佳组合条件下的胚性愈伤诱导率高于6号条件下的胚性愈伤诱导率,说明正交试验优选出的较优条件是正确的。
2.3 胚性细胞系的增殖培养
将产生的愈伤组织进行增殖培养,每14 d选取新分化的愈伤组织转接至质量浓度逐步降低的增殖培养基,胚性愈伤组织生长缓慢,部分出现褐化。20~30 d后,部分褐化的愈伤组织上会重新长出白色丝状的胚性愈伤组织。重新形成的胚性愈伤组织分裂能力强,生命力旺盛,可快速增殖。不同类型愈伤组织增殖情况见表5。胚性愈伤组织如不及时进行增殖培养,即在含高质量浓度激素的诱导培养基中培养15 d后,愈伤组织开始褐化。但即使及时继代,胚性愈伤组织也很容易褐化死亡。
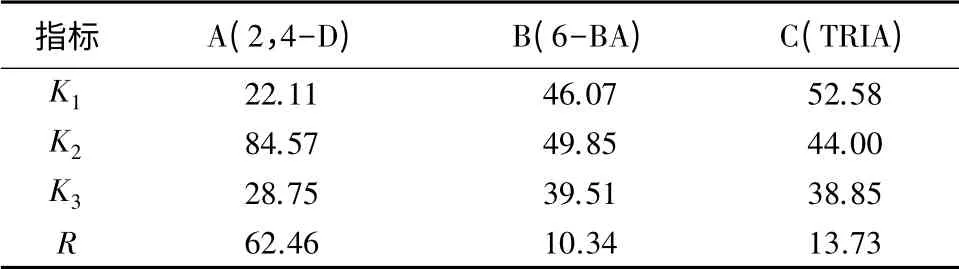
表4 植物激素配比对思茅松胚性愈伤组织诱导的正交试验结果

表5 思茅松不同愈伤组织类型的增殖培养情况
由于胚性愈伤组织在初始设计的NAA和6-BA质量浓度递减试验中增殖情况不理想,为了寻找更优的增殖培养基,设计了A、B、C、D 4种增殖培养基。胚性愈伤组织培养20 d时,4种增殖培养基和原增殖培养基的增殖情况见表6。由此可知,增殖培养基D较好。可能是增殖培养时,改用不同的基本培养基并用NAA代替2,4-D,更有利于胚性愈伤组织的增殖;也可能是D增殖培养基比较适合这一发育状态的胚性细胞系,其原因还需进一步的确定。

表6 新培养基和原增殖培养基的培养结果
2.4 外植体诱导过程中的外观和细胞组织观察
成熟合子胚在培养基中培养3 d后,明显变粗膨大,子叶展开,无愈伤组织产生(图1A);培养4~7 d,从下胚轴开始产生乳白色半透明黏状组织(图1B)。10 d后在胚轴或子叶处产生多种愈伤组织:①白色或红色、半透明丝状,晶亮有黏性,结构松软,表面具有透明凸起(图1C);②湿润浅绿色或白色透明愈伤组织,质地松软,产生于子叶或胚根(图1D);③黄白色或黄褐色,质地较坚硬,细胞排列紧密较小(图1E);④浅黄褐色,半透明,质地松软,增殖速度慢(图1F);⑤形态同第一种愈伤组织,从褐化的愈伤组织中产生(图1G)。其中①、⑤两种愈伤组织,表面都有白色,透明丝状组织,此时使用显微镜观察,可看到表面产生透明的圆丘状凸起(图1H)。压片后可见其主要由两类细胞组成:一类为细胞质浓、细胞体积较小的胚头细胞;另一类为胚柄细胞,即由一些高度液泡化,并或多或少延长的细胞组成。在大多数胚形成的早期,胚分化成明显的胚头和胚柄,其中胚柄是由胚头基部的分生组织细胞分裂、分化而成的,它对胚头可提供结构上的支持和营养物质吸收的作用,也是合成生长调节物质和储存一些产物的场所[13]。
基于对胚性愈伤组织细胞增殖分裂过程的观察,推测胚性愈伤组织的增殖过程是从某些单个细胞的快速分裂开始,逐渐形成以该细胞为分裂中心的相对独立的快速增殖的细胞团。显微镜下观察到的细胞多呈大小相似的团状,有序地聚集在一起。中心部位的细胞个体小,核质比大,含线粒体较多,无液泡,处于快速分裂中,有时形成类似四分体的形状,组织染色后可见。而外部细胞个体较大,胞质中可见一些尚不成形的大液泡(图1I~L)。胚性愈伤组织的活性可能与中心细胞的旺盛分裂能力有关。快速增殖、生长良好的愈伤组织(图1M)中,可见较多紧密成团的中心细胞。部分褐化组织上仍可长出新的愈伤组织,很可能是由于该愈伤组织中保留了较多的分裂能力强的中心细胞。
在试验中还观察到一些胚的胚根部或子叶和胚轴连接处在培养过程中膨大并形成白色或浅绿色愈伤组织,经观察此种愈伤组织可直接产生胚状体(图1N),即外植体不经过愈伤阶段而直接在表面形成胚状体。

图1 外植体诱导过程中的外观和细胞组织
3 讨论
吴子欢等[14]用思茅松成熟胚为外植体,诱导出了透明愈伤组织,但并未描述是否为胚性愈伤组织。现有研究表明,虽然思茅松体胚发生途径是其无性系造林最具优势和潜力的繁殖方式,还可为后续基因工程育种提供最佳遗传转化受体系统,但是,尚存在外植体取材范围受限、取材时期短、胚性愈伤诱导率低、体细胞胚发育不整齐等亟需解决的问题。大量试验表明,胚性愈伤组织的诱导及体胚发生过程都与外植体的生理状态、培养基的营养成分、生长调节因子以及多个胚在培养中竞争性等因素关系密切[15]。只有合子胚发育到一定时期,才对外界培养环境有反应,其发育程度对胚性愈伤组织的诱导起决定性作用[16]。通常认为分化程度较低的组织,如未成熟胚,更有利于体细胞胚胎的诱导发生[17]。但未成熟胚采集困难,受生长季节限制与地域限制较大,仅限于胚胎发育的某一时期才有较高诱导率,适宜外植体采集时间短且不好掌握。因此,本研究使用成熟胚作为外植体探索诱导胚性愈伤组织,是简化操作、降低成本的有效方法,且此方法可在大规模生产中较为方便。
有研究认为,不同品种间以及同一品种不同基因型之间,对胚性愈伤组织的诱导及后期胚胎发育方面都有很大差异[18]。在试验中,笔者发现有的胚性愈伤组织在增殖培养基上30 d不继代,也不会褐化且生长良好。这些愈伤组织可被筛选出来大量扩增,建立增殖体系。故而在进一步的体系优化研究中可从外植体的基因型筛选上进行较为系统的研究,以提高其后期的生长质量。
试验中多次发现,在诱导愈伤组织的过程中,外植体会产生抑制细菌生长的物质,即培养基受细菌污染严重时,外植体周围并无污染(图1O),但对真菌无效。可以对此物质进行进一步的研究以期能开发出新型天然杀菌(细菌)剂。
在试验过程当中观察到直接体胚发生的现象。近年来不断有松属体胚发生体系建成的报道,但指的都是间接体胚发生,直接体胚发生与此相比,具有培养程序简单、易操作和成功率高等特点,因此建立思茅松的直接体胚发生体系,是一个可深入探究的问题。
胚性愈伤组织诱导率较高,但愈伤组织产生较小且增殖缓慢,造成了后续工作的停滞,所以寻找有效的保持和增殖胚性愈伤组织的培养基,将是下一步工作中所急需解决的问题。
[1]何西林,段安安,许玉兰.思茅松嫩枝扦插繁殖研究[J].西南林学院学报,2004,24(4):68-72.
[2]李炽.思茅松无性繁殖扦插技术[J].思茅师范高等专科学校学报,2005,21(3):22-24.
[3]李福秀,张晓明,周体林,等.思茅松针叶束水培生根的研究[J].西南林学院学报,2005,25(1):24-27.
[4]李丹,陈宏伟,陈少瑜,等.思茅松丛生芽诱导及植株再生[J].西部林业科学,2010,39(1):69-72.
[5]吴涛,陈少瑜,陈芳,等.思茅松胚性愈伤组织的诱导[J].中南林业科技大学学报,2008,27(5):74-78.
[6]Gupta P K,Durzan D J.Somatic polyembryogenesis from callus of mature sugar pine embryos[J].Nat Biotechnol,1986,4(7):643-645.
[7]Hakman I,von Arnold S.Plantlet regeneration through somatic embryogenesis in Picea abies(Norway Spruce)[J].JPlant Physiol,1985,121(2):149-158.
[8]黄健秋,卫志明.针叶树体细胞胚胎发生的研究进展[J].植物生理学通讯,1995,31(2):85-90.
[9]唐巍,欧阳藩,郭仲琛.湿地松体细胞胚胎发生和植株再生[J].植物资源与环境,1997,6(2):8-11.
[10]申晓辉,蒋湘宁,Park Y S,et al.红松体细胞胚胎培养技术体系的建立[J].成都大学学报:自然科学版,2005,24(1):11-14.
[11]刘华英,萧浪涛,何长征.植物体细胞胚发生与内源激素的关系研究进展[J].湖南农业大学学报:自然科学版,2002,28(4):349-354.
[12]于大德,肖宁,王企珂,等.云南松胚性愈伤组织诱导及增殖[J].西北植物学报,2012,31(10):2119-2123.
[13]Schwartz B W,Vernon D A,Meinke D W.Development of the suspensor:differentiation,communication,and programmed cell death during plant embryogenesis[M]//Larkins B A,Vasil I K.Cellular and molecular biology of plant seed development.vol 4,Advances in cellular and molecular biology of plants.Kluwer:The Netherlands,1997:53-72.
[14]吴子欢,朱仁刚,邓桂香.思茅松成熟胚的离体培养[J].黑龙江生态工程职业学院学报,2007,20(3):44-45.
[15]Lelu M A,Bastien C,Drugeault A,et al.Somatic embryogenesis and plantlet development in Pinus sylvestris and Pinus pinaster on medium with and without growth regulators[J].Physiol Plantarum,1999,105(4):719-728.
[16]张存旭,姚增玉,赵忠.栓皮栎体胚诱导关键影响因素研究[J].林业科学,2005,41(2):174-177.
[17]唐巍,欧阳藩,郭仲琛.火炬松(Pinus taeda L.)合子胚愈伤组织的器官发生和植株再生[J].实验生物学报,1998,31(1):87-91.
[18]Tautorus T E,Fowke L C,Dunstan D I.Somatic embryogenesis in conifers[J].Can J Bot,1991,69(9):1873-1899.

