低分子量核桃仁蛋白酶水解物抑制MCF-7 细胞增殖
彭 森,陈昌旭,封晓茹,许美玉
(北京林业大学生物科学与技术学院食品科学与工程系/林业食品加工与安全北京市重点实验室,北京 100083)
核桃仁除含有营养价值高的油脂外,蛋白质含量也高达14%~17%[1]。目前人们注重核桃仁油的营养价值与利用,而制油后产生的大量的核桃仁粕还没有得到很好的利用[2]。蛋白质是脱脂核桃仁粕的主要成分,其含量可达54%,含有18 种氨基酸(包括8 种必需氨基酸)[3]。核桃仁蛋白具有抗氧化作用,随着核桃仁蛋白肽浓度的增加,其还原能力、羟自由基的清除能力和超氧阴离子清除能力增大[4]。核桃仁蛋白酶水解物对大肠杆菌、枯草杆菌和金黄色葡萄球菌均有抑制作用,且随着水解度的增加,酶解物的抑菌能力增强[5]。研究表明,核桃仁蛋白木瓜酶水解物对MCF-7 人乳腺癌细胞的增殖具有显著的抑制作用[6],然而其活性成分尚不清楚。蛋白酶水解物中,肽的分子量与生物活性具有密切关系[7-8]。研究表明,小分子量多肽具有较强的生物活性,如大豆多肽、牛乳铁蛋白、麦胚蛋白等[9-11]。本文采用超滤技术,按分子量大小对核桃仁蛋白木瓜酶水解物进行分离,对具有较强活性的组分进行氨基酸含量分析,为阐明核桃仁源抗癌活性肽结构特点提供科学依据。
1 材料与方法
1.1 材料与试剂
核桃(河北晶品果业有限公司);木瓜蛋白酶(北京科百奥生物技术有限公司);人乳腺癌细胞MCF-7(北京协和医学院细胞中心);酶标仪(BIO-RAD);MEM-EBSS、DEME (北京协和医学院细胞中心);胎牛血清(Hyclone);噻唑蓝MTT 粉剂(美国Sigma 公司);二甲基亚砜DMSO (北京化工厂);1mol/L 盐酸HCl、1mol/L 氢氧化钠NaOH、0.1 mol/L 氢氧化钠NaOH (按GB/T601 规定的方法配制和标定)。
1.2 方法
1.2.1 核桃仁蛋白的提取 根据参考文献[12],核桃仁去皮磨粉,石油醚充分提取油脂。取一定量烘干的脱脂核桃仁粉,加入1 mol/L NaOH 溶液,按照核桃仁粉:NaOH 溶液为1∶20 (W/V)配成溶液,调节pH 至9。55℃超声提取1 h,过滤、弃渣。滤液4℃,3 000r/min离心30min,取上清液。用1 mol/L HCl 调节上层清液的pH 至4.5,4℃、3 000r/min 离心10min,取下层沉淀。用少量水稀释,调pH 至7,冷冻干燥。
1.2.2 核桃仁蛋白酶水解物制备 称取3g 冷冻干燥后的核桃蛋白,加蒸馏水90mL 进行溶解,制备成核桃蛋白溶液;另称取0.3g 木瓜蛋白酶,用适量蒸馏水溶解制备成溶液。木瓜蛋白酶的最适水解条件为37℃、pH7.0,在此条件下,将木瓜蛋白酶溶液加入到核桃蛋白溶液中,振荡混匀,实时滴加0.1mol/L NaOH,控制其pH 值恒定。3h 后,水解完毕,调节pH 值至中性。在95℃高温水浴下加热处理水解液10min,用于灭活木瓜蛋白酶,以终止水解反应。用超速冷冻离心机离心,3 000r/min、2~4℃离心30min,收集上清液。用冷冻干燥机,将所得上清液冷冻干燥。
1.2.3 超滤法分离核桃蛋白酶水解物 称取一定量核桃蛋白木瓜酶水解物配制成溶液,将溶液通过0.45μm水系膜进行过滤。再将过滤后的溶液通过不同截留分子量超滤膜,依次将核桃蛋白水解产物分离为10kDa >MW >5kDa、5kDa >MW >3kDa 和MW <3kDa 等3 个不同分子量的组分,并冷冻干燥。
1.2.4 MTT 细胞增殖分析试验 用DMEM 培养基,补充10%胎牛血清、0.5%双抗(20 000 单位/mL)的完全培养液,将MCF-7 细胞悬液密度调整为3 ×104个/mL,混合均匀后接种于96 孔板,每孔100μL,放置于37℃、5%CO2细胞培养箱中孵育24h。弃去上清液,贴壁细胞用于细胞实验。以每孔100μL 于实验孔和对照孔中分别加入含有样品的及不含样品的完全培养基,放置于37℃,5% CO2细胞培养箱中孵育48h。每孔加入20μL 的5mg/mL 噻唑蓝MTT 液,放置于37℃,5%CO2细胞培养箱中继续培养5h。5h 后,吸除上清液,每孔加入200μL 的二甲基亚砜DMSO,以终止培养。置于摇床上避光低速震荡15min,使用酶标仪测定570nm 波长处的吸光度值。
1.2.5 氨基酸含量测定 制备10kDa >MW >5kDa 组分、5kDa >MW >3kDa 组分和MW <3kDa 组分,用日立L-8900全自动氨基酸分析仪(Hitachi,Tokyo,Japan)检测。
1.2.6 统计分析 数据用平均值±标准差来表示,由SPSS 软件来评价不同组中的统计学意义,P <0.05 视为显著[13]。
2 结果与分析
2.1 核桃仁蛋白酶水解物对MCF-7 细胞增殖影响
用含核桃仁蛋白酶水解物(0.5、1、2、3 和4mg/mL)的细胞培养基,孵育MCF-7 细胞48h,通过MTT细胞增殖分析试验研究对细胞生长的影响,结果显示明显的生长抑制作用,呈一定的剂量依赖性。核桃仁蛋白酶水解物的浓度为0.5mg/mL 和1mg/mL 时未显示明显的增殖抑制作用;当浓度为2mg/mL 及以上时,细胞增殖抑制作用极为显著(P <0.001),能够抑制80%的细胞增殖。核桃仁蛋白酶水解物抑制细胞生长率为50%所需作用物浓度,即IC50 值为1.62mg/mL。然而,高浓度的核桃蛋白(4mg/mL)也未显示出细胞增殖抑制作用(图1)。结果表明,核桃仁蛋白被木瓜酶水解后,产生了抑制MCF-7 细胞增殖的活性成分-活性肽。
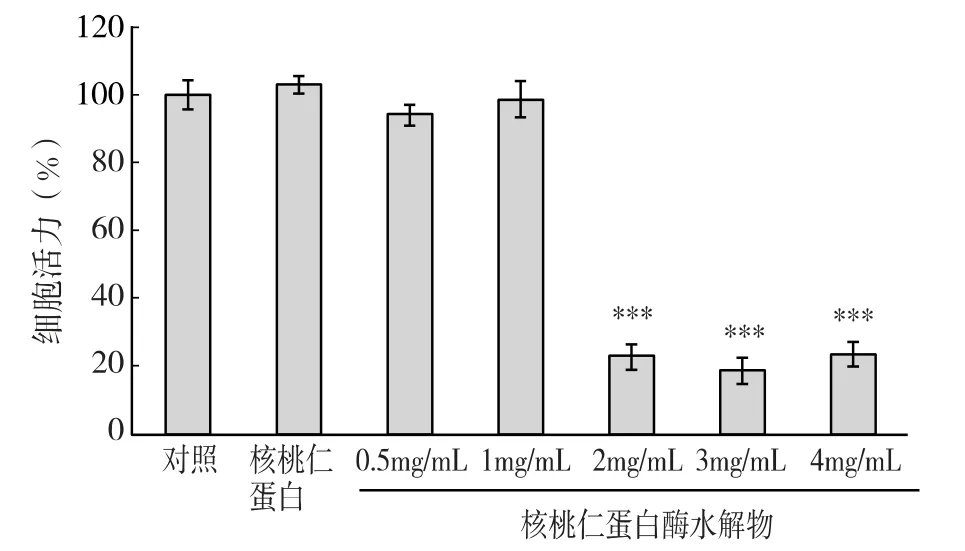
图1 核桃仁蛋白酶水解物对MCF-7 细胞增殖的影响
2.2 不同分子量核桃仁蛋白酶水解物对MCF-7 细胞增殖抑制作用比较
具有生物活性的肽类一般为小分子肽,如具有抗肿瘤活性的大豆多肽[9]、具有抗氧化活性的金丝小枣多肽[14]和鹰嘴豆肽[15]。为了研究核桃仁蛋白酶水解物中,抑制MCF-7 细胞增殖作用的活性成分,将核桃仁蛋白酶水解物,通过不同截留分子量的超滤膜,分离为10kDa>MW >5kDa、5kDa >MW >3kDa 和MW <3kDa 等3 个不同组分。在0.5、1、2、3、4mg/mL 浓度水平,用MTT 法检测不同组分对MCF-7 细胞增殖的影响,结果表明,10kDa >MW >5kDa、5kDa >MW >3kDa 和MW <3kDa 三个组分的半数抑制浓度IC50 值,分别为4.206、6.285、2.382mg/mL (图2)。MW <3kDa 组分的细胞增殖抑制作用,较10kDa >MW >5kDa 和5kDa >MW >3kDa 组分显著,表明抑制MCF-7 细胞增殖的活性成分,主要存在于MW <3kDa 小分子量组分中。10kDa >MW>5kDa 组分的作用较5kDa >MW >3kDa 组分强,表明该组分中也含有活性肽,因水解不彻底而没有完全被释放。无论是哪一种组分,其活性均低于总酶解物,提示核桃仁蛋白酶水解物的细胞增殖抑制作用,需要各种肽之间的协同作用。
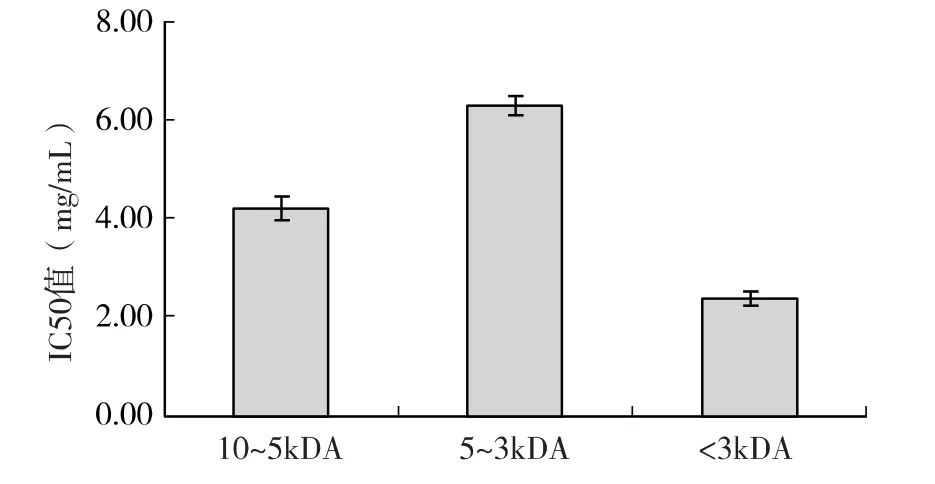
图2 不同分子量的核桃仁蛋白酶水解物对MCF-7 细胞增殖的影响
2.3 低分子量核桃仁蛋白酶水解物的氨基酸含量分析
氨基酸的含量及组成对多肽的生物活性起关键性作用[16],例如,含有色氨酸和酪氨酸的三肽化合物具有很强的清除自由基的活性[17],含极性氨基酸残基和疏水性氨基酸残基的肽段具有抗肿瘤活性[18]。附表显示,抑制MCF-7 细胞增殖活性较高的MW <3kDa 组分中,疏水性氨基酸Ala、Val、Met、Leu、Phe、Trp 含量均高于3kDa <MW <5kD 和5kDa <MW <10kDa 组分。疏水性氨基酸可提高多肽的脂溶性,从而具有更高的生物活性[19]。MW <3kDa 组分中,芳香族氨基酸Phe、Tyr 含量均有增加,中性极性氨基酸Gly、Ser、Tyr 含量均高于其他组分。MW <3kDa 组分中,Arg 含量高于其他组分(一定剂量的精氨酸对肿瘤生长有抑制作用[20])。本项研究通过以上分析认为,具有较高抑制癌细胞增殖作用的低分子量核桃仁蛋白酶水解物中,疏水性氨基酸、中性氨基酸、芳香族氨基酸及精氨酸含量较高。

附表 不同分子量的核桃仁蛋白酶水解物的氨基酸含量检测结果(%)
3 结论
核桃仁蛋白对人乳腺癌细胞MCF-7 细胞增殖,没有显示抑制作用,然而被木瓜酶水解后显示非常强烈的细胞增殖抑制作用。该结果表明,核桃仁蛋白中含有抑制癌细胞生长的生物活性肽,该活性肽经木瓜酶水解而被释放并显示其生物学作用。在蛋白酶水解物中,肽的分子量与生物活性具有密切关系。为研究该活性肽的特点,将多肽按分子量大小分为不同组分,研究其抑制癌细胞生长的作用。结果表明,MW <3kDa 的低分子量的组分,具有较高的抑制癌细胞增殖作用,表明活性成分为分子量小于3kDa。进一步研究MW <3kDa 组分的氨基酸含量,发现疏水性氨基酸、芳香族氨基酸和中性极性氨基酸含量较其他组分增加。本项研究结果为解明核桃仁蛋白酶水解物抗肿瘤作用活性成分提供重要的科学依据,为核桃仁蛋白的科学有效利用具有重要意义。
[1]Tao KWC,Sathe SK.Walnuts:proximate composition,protein solubility,protein amino acid composition and protein in vitro digestibility [J].J Sci Food Agr,2000,80(9):1393-1401.
[2]陈永浩,等.酶解方式对核桃蛋白肽及其抗氧化活性的影响[J].食品与机械,2011,27(5):63-67.
[3]Ravai M.Quality characteristics of California walnuts [J].Cereal foods world,1992.
[4]刘昭明,黄翠姬,孟陆丽,等.核桃蛋白肽的抗氧化活性研究[J].食品与发酵工业,2009,1:58-61.
[5]刘昭明,黄翠姬,周远.核桃蛋白酶水解物的抑菌性能探讨[J].四川食品与发酵,2008,44(5):20-23.
[6]翟梦新,赖莹,崔犁,等.核桃仁蛋白木瓜酶水解物抑制癌细胞增殖[J].食品科技,2013,38(9):6-10.
[7]Leonil J,et al.Application of chromatography and mass spectrometry to the characterization of food proteins and derived peptides [J].J Chromatogr A,2000,881(1):1-21.
[8]Qin L,et al.Preparation and antioxidant activity of enzymatic hydrolysates from purple sea urchin gonad [J].LWTFood Sci Technol,2011,44(4):1113-1118.
[9]Kim SE,et a1.Anticancer activity of hy-drophobic peptides from soy proteins [J].Biofactors,2000,2(1):151-155.
[10]孙金霞,等.牛乳铁素研究进展[J].特产研究,2009,4:71-79.
[11]朱志方.麦胚蛋白的酶法制备及功能特性研究[D].郑州:河南工业大学,2011.
[12]Ning Chen,et al.Purification and identification of antioxidant peptides from walnut (Juglans regia)protein hydrolysates [J].Peptides,2012,38(2):344-349.
[13]Muthaiyah B,Essa MM,ChauhanV,et al.Protective Effects of walnut extract against amyloid beta peptide-induced cell death and oxidative stress in PC12 cells [J].Neurochem Res,2011,36(11):2096-2103.
[14]孙久玉,王成忠,孙曙光,等.金丝小枣多肽功能特性的研究[J].山东食品发酵,2010,3:3-7.
[15]高捷.鹰嘴豆肽生物活性及构效关系解析[D].天津:天津化工学院,2012.
[16]Wu HC,et al.Free amino acids and peptides as related to antioxidant properties in protein hydrolysates of mackerel[J].Food Res,2003,36(9-10):949-957.
[17]Saito K,Jin DH,Ogawa T,et al.Antioxidant properties of tripeptide libraries prepared by the combinatorial chemistry [J].Agr Food Chem,2003,51(12):3668-3674.
[18]谢书越,穆丽霞,廖森泰.抗肿瘤活性肤的研究进展[C].广东省食品学会年会论文集,2013:127-134.
[19]Dong S,Zeng M,Wang D,et al.Antioxidant and biochemical properties of protein hydrolysates prepared from silver carp [J].Food Chem,2008,107(4):1485-1493.
[20]张俊,等.精氨酸剂量与肿瘤生长的相关性研究[J].数理医药学杂志,2002,15(2):129-130.

