巴西蘑菇的免疫调节效应:随机对照试验的系统评价
王 波,夏愔愔,陈 晨
(1 中国医学科学院健康科普研究中心,北京 100730;2中国疾病预防控制中心结核病控制中心,北京 102206;3中国疾病预防控制中心科技开发办公室,北京 100050)
巴西蘑菇(Agaricus blazei),又称姬松茸等,其子实体含有89%~91%的水分,总干物质中蛋白质和碳水化合物分别占约48%和18%,脂类含量仅为0.5%,此外还含有大量矿物质[1]。巴西蘑菇含有多种生物活性物质,如β-1,3-D-葡聚糖、β-1,4-D-葡聚糖、β-1,6-D-葡聚糖和蛋白多糖[2]。体外实验和动物试验提示,巴西蘑菇具有一定的免疫调节效应。研究发现,巴西蘑菇提取物能够促进鼠骨髓巨噬细胞或人单核细胞分泌TNFα、IL-1、IL-8 和NO[3],促进BALB/c 小鼠脾NK 细胞活性和抗原特异性CD8+细胞和INF-γ 的产生[4,5],通过替代途径激活人体补体系统[6],加快小鼠骨髓来源树突状细胞的成熟和IL-12 的生成[7],诱导小鼠抗体、MAC-1+和CD25+细胞群的产生[8],增加小鼠脾脏CD4+细胞、CD8+细胞的数量[9]。然而,巴西蘑菇的免疫调节效应尚未在人群研究中进行系统地评价。本研究通过对随机对照试验的综述,系统评价巴西蘑菇的免疫调节效应。
1 研究方法
1.1 研究纳入/排除标准
具体标准为:①研究设计的类型:纳入随机对照试验(包括交叉设计);排除临床对照试验、病例对照研究、队列研究、病例系列、病例报告、基础研究(体外试验和动物实验)。②研究对象的类型:纳入各年龄段人群(不论性别、种族或健康状况);排除动物。③干预的类型:纳入以巴西蘑菇为干预的研究;排除巴西蘑菇与其他免疫调节活性物质联合应用、导致巴西蘑菇的效应无法分离的研究。④对照的类型:纳入以安慰剂对照或空白对照的研究;排除活性对照研究。⑤结局的类型:主要结局为NK 细胞活性、白细胞计数、淋巴细胞计数、免疫球蛋白;次要结局为IL-6、TNF-α 和IFN-γ。
1.2 文献检索
主要检索渠道为Pubmed (1948 年—2014 年3 月)、Embase (1966 年—2014 年3 月)、CENTRAL (2014 年第3 期)、SinoMed (1978 年—2014 年3 月)、CNKI(1980 年—2014 年3 月)和万方(1980 年—2014 年3月)。此外,还对引文数据库(Science Citation Index)、合格研究和相关综述的参考文献进行了检索。文献检索时未设置日期、种族或国家限制,仅纳入以英文或中文发表的文献,最后检索日期为2014 年3 月30 日,主要检索词为巴西蘑菇对应的中英文名称。
1.3 数据收集与分析
使用Endnote 软件进行研究纳入。研究纳入时,通过阅读文献的题目与摘要判断是否符合纳入标准,必要时进一步获取全文。使用预先设计的表格进行数据信息提取。采用Cochrane Handbook 提供的方法对随机对照试验进行偏倚危险评价[10]。研究纳入、信息提取和偏倚危险评价均由2 名综述者独立进行,并通过讨论解决不一致。由于纳入的研究结局均为连续性变量,故采用均差作为效应指标,同时计算其95%可信区间。使用Chi2检验评价是否存在异质性,显著性水平设置为0.10。无论异质性检验结果是否显著,均采用随机效应模型进行研究结果合并。实施Meta 分析的软件为Revman 5.3,Meta 分析结果以森林图的形式进行表达。由于各结局上纳入研究数量均较少,因而未使用漏斗图对发表偏倚进行定性评价,也未实施任何亚组分析。
2 研究结果
2.1 纳入研究的特征
对电子数据库和其他渠道的全面检索获得了1 596篇文献,在排除了834 篇重复文献和756 篇不符合纳入标准的文献之后,获得了6 项合格的研究[11-16](图1)。纳入研究发表于1994—2012 年之间,研究开展的地点分别为 中 国(2 项)[11,12]、日 本 (2 项)[14,15]、巴 西 (1项)[13]和韩国(1 项)[16]。纳入研究包括5 项随机对照试验[11-14,16]和1 项交叉试验[15]。3 项研究的研究对象均为恶性肿瘤患者,分别为急性非淋巴细胞白血病患者[11]、消化道恶性肿瘤患者[21]和妇科恶性肿瘤患者[16];另外3项研究均在健康人群中开展,其中2 项为健康志愿者[14,15]、1 项为健康老年女性[13]。在干预措施方面,所有研究均采用口服的形式进行干预,巴西蘑菇的干预剂量范围为0.9~20g/d (1 项研究未提供干预剂量),干预的持续时间从1w~6 个月不等。4 项研究使用安慰剂作为对照[13-16]、2 项研究使用了空白对照[11,12]。在研究结局方面,3 项研究报告了白细胞计数[11,12,16]、2 项研究报告了NK 细胞活性[15,16]、1 项研究报告了淋巴细胞计数[16]、3 项研究报告了免疫球蛋白[11,12,14]、1 项研究报告了IFN-γ、TNF-α 和IL-6[13]。
2.2 纳入研究的偏倚危险
由于对方法学信息的报告严重不足,总体上纳入研究的偏倚危险不清楚。在随机序列的产生方面,仅1 项研究具有低偏倚危险[13],其他研究的偏倚危险均不清楚[11,12,14-16];所有纳入研究在分配隐藏方面的偏倚危险均不清楚;在盲法方面,3 项研究为低偏倚危险[13,15,16],其他3 项研究的偏倚危险均不清楚[11,12,14];在随访完整性方面,6 项研究均具有低偏倚危险。
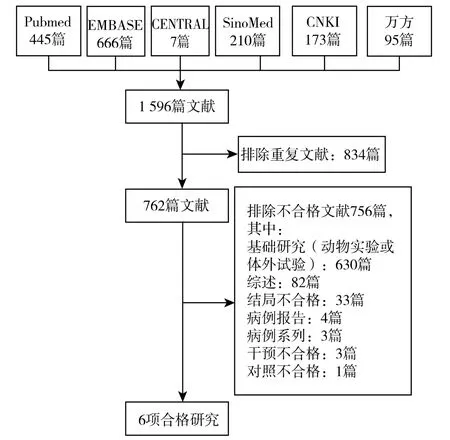
图1 合格研究的入选过程
2.3 免疫调节效应
3 项研究评价了巴西蘑菇对白细胞计数的影响[11,12,16],均纳入了Meta 分析。异质性检验提示研究之间存在显著异质性,使用随机效应模型进行合并后获得的均差为1.44 ×109/L (图2)。2 项研究评价了巴西蘑菇对NK 细胞活性的影响[15,16],但其中1 项研究未能提供干预组与对照组的结局数据[16](故未能实施Meta 分析),仅报告干预6w 后巴西蘑菇显著增加了NK 细胞的活性(P <0.002)。另外1 项研究[15]为交叉试验设计,作者未能采用合适的分析方法,按照Cochrane Handbook提供的方法进行的调整分析发现[10],巴西蘑菇使NK 细胞活性增加了7.39% (95%可信区间4.86~9.92,P <0.00001)。

图2 白细胞计数均差森林图(与安慰剂或空白对照比较)
1 项研究评价了巴西蘑菇对淋巴细胞计数的影响[16],未发现干预对淋巴细胞计数的影响(均差-0.02×109/L;95%可信区间-0.32~0.28;P=0.90)。3 项研究评价了巴西蘑菇对免疫球蛋白的影响[11,12,14],但其中1 项研究未能提供对照组干预前后的结局数据[14],该研究报告干预组6 个月后抗β-葡聚糖抗体滴度显著增加(P=0.026),而对照组无显著改变。对另外2 项研究[11,12]实施了Meta 分析,异质性检验提示研究之间不存在显著异质性(P=0.85,I2=0%),使用随机效应模型进行合并后获得的均差为3.27g/L (95%可信区间2.65~3.88;P <0.00001)。在免疫球蛋白中,IgG、IgM 和IgE均在干预后显著增加,其均差分别为2.65g/L (95%可信区间2.13~3.16;P <0.00001)、0.32g/L (95%可信区间0.27~0.37;P <0.00001)和0.30g/L (95%可信区间0.26~0.34;P <0.00001);IgA 未见显著改变(均差0.01g/L;95%可信区间-0.76~0.78;P=0.98)。
1 项研究分别评价了巴西蘑菇对IFN-γ、TNF-α 和IL-6的影响[13],未发现巴西蘑菇对IFN-γ (均差1.00pg/mL;95%可信区间-0.33~2.33;P=0.14)、TNF-α (均差- 0.01pg/mL;95% 可信区间- 0.74~0.72;P=0.98)和IL-6 (均差0.12pg/mL;95%可信区间-0.64~0.88;P=0.76)的影响。
3 讨论
系统综述的结果显示,巴西蘑菇具有一定的免疫调节效应,能够提高免疫球蛋白的水平和增强NK 细胞的活性,不过未发现其对白细胞计数、淋巴细胞计数、IFN-γ、TNF-α 和IL-6 的影响。然而,这可能与这些结局纳入的研究对象数量较少有关系(纳入研究对象数量最多的白细胞计数结局也仅为140 例,远低于400 例),相对较宽的可信区间也意味着这些结局上缺乏足够充分的证据。因此,有必要开展足够样本量的、高质量的随机对照试验,对巴西蘑菇在这些“阴性”结局上的真实效应进行评价,从而获得更加可靠的证据。1 项随机对照试验发现[17],与灵芝破壁孢子粉相比,巴西蘑菇能够显著提高白细胞计数(均差2.14 ×109/L;95%可信区间1.81~2.47;P <0.00001)和NK 细胞活性(均差8.48%;95%可信区间4.39~12.57;P <0.0001),该研究在一定程度上支持了这项系统综述的结论。使用GRADE 证据分级系统,从纳入研究的偏倚危险、证据的间接性、研究结果一致性、结果的精确度、发表偏倚等方面对各结局的证据质量进行分级后,发现几乎所有结局上的证据质量均较低。主要原因包括:①多数研究对方法学信息的报告严重不足,导致纳入研究偏倚危险总体上不清楚。②多数情况下研究之间的异质性较大(免疫球蛋白结局除外)。③所有结局上的研究对象数量均低于400。④纳入研究数量较少,难以评估发表偏倚。
目前普遍认为,巴西蘑菇中的葡聚糖是其发挥免疫调节效应的主要活性物质,主要通过作用于先天免疫系统实现[18],可能的作用机制包括:①巴西蘑菇中的β-葡聚糖能够与存在于人类单核细胞、中性粒细胞和NK细胞的补体受体-3 上面的凝集素结合位点结合,激活补体3,从而发挥免疫刺激作用[19]。②巴西蘑菇中的β-葡聚糖能够与广泛存在于巨噬细胞、中性粒细胞和树突状细胞中的C 型凝集素受体-1 (dectin-1)结合,促进TNF-α 的释放,增强抗原呈递和抗原特异性CD8+细胞的活性[20]。③巴西蘑菇提取物片段能够与Toll 样受体(主要为CD14、TLR-4、TLR-2)结合,促进巨噬细胞分泌免疫细胞生长刺激因子IL-12[21]。④巴西蘑菇提取物能够促进C-C 趋化因子、CXCL1、CXCL2、CXCL3 和前列腺素-2 的mRNA 表达,这些趋化因子能够刺激单核细胞和中性粒细胞的产生[3]。
尽管证据质量较低,现有证据支持巴西蘑菇在免疫球蛋白(增加3.27g/L,95%可信区间2.65~3.88)和NK 细胞活性 (增加7.39%,95% 可信区间4.86~9.92)上的免疫调节效应。巴西蘑菇在白细胞计数、淋巴细胞计数、IFN-γ、TNF-α 和IL-6 等结局上的效应尚缺乏足够充分的证据。需要开展大样本、方法学质量高、长期随访的随机对照试验,来评价巴西蘑菇对免疫相关结局的影响。
[1]Wisitrassameewong K,et al.Agaricus subrufescens:A review [J].Saudi J Biol Sci,2012,19(2):131-146.
[2]Lima CU,et al.Does the Agaricus blazei Murill mushroom have properties that affect the immune system?An integrative review [J].J Med Food,2011,14(1-2):2-8.
[3]Sorimachi K,et al.Secretion of TNF-α,IL-8 and nitric oxide by macrophages activated with Agaricus blazei Murill fractions in vitro [J].Cell Struct Funct,2001,26(2):103-108.
[4]Yuminamochi E,et al.Interleukin-12-and interferon-gammamediated natural killer cell activation by Agaricus blazei Murill [J].Immunology,2007,121:197-206.
[5]Zhong M,Akihiro T,Yamamoto I.In vitro augmentation of natural killer activity and interferon-γ productionin murine spleen cell with Agaricus blazei fruiting body fractions [J].Biosci Biotechnol Biochem,2005,69:2466-2469.
[6]Shimizu S,Kitada H,Yokota H,et al.Activation of the alternative complement pathway by Agaricus blazei Murill [J].Phytomedicine,2002,9(6):536-545.
[7]Kim GY,et al.Effect of water-soluble proteoglycan isolated from Agaricus blazei on the maturation of murine bone marrow-derived dendritic cells [J].Int Immunopharmacol,2005,5:1523-1532.
[8]Nakajima A,et al.Effect of hot water extract from Agaricus blazei Murill on antibody-producing cells in mice [J].Int Immunopharmacol,2002,2(8):1205-1211.
[9]Mizuno M,et al.Polysaccharides from Agaricus blazei stimulate lymphocyte T-cell subsets in mice [J].Biosci Biotechnol Biochem,1998,62(3):434-437.
[10]Higgins JPT,Green S (editors).Cochrane Handbook for Systematic Reviews of Interventions Version 5.1.0 [updated March 2011][M].The Cochrane Collaboration,2011.www.cochrane-handbook.org.
[11]田晓慧,等.姬松茸对急性非淋巴细胞白血病的临床观察[J].兰州医学院学报,1994,20(3):169-171.
[12]王镜,卯新民,陈汝贞,等.姬松茸对消化道肿瘤的疗效观察[J].甘肃医药,1994,13(1):5-6.
[13]Lima CU,et al.Agaricus blazei murrill and inflammatory mediators in elderly women:a randomized clinical trial[J].Scand J Immunol,2012,75(3):336-341.
[14]Ishibashi K,et al.Effect of oral administration of dried royal sun agaricus,agaricus brasiliensis S.Wasser et al.(Agari-comycetideae),Fruit bodies on anti-β-Glucan antibody titers in Humans [J].Int J Med Mushrooms,2009,11(2):117-131.
[15]Liu Y,et al.Immunomodulating Activity of Agaricus brasiliensis KA21 in Mice and in Human Volunteers [J].Evid Based Complement Alternat Med,2008,5(2):205-219.
[16]Ahn WS,Kim DJ,Chae GT,et al.Natural killer cell activity and quality of life were improved by consumption of a mushroom extract,Agaricus blazei Murill Kyowa,in gynecological cancer patients undergoing chemotherapy [J].Int J Gynecol Cancer,2004,14(4):589-594.
[17]范越,等.姬松茸复合颗粒联合化疗治疗胃癌临床研究[J].中成药,2006,28(9):1314-1316.
[18]Vannucci L,Krizan J,Sima P,et al.Immunostimulatory properties and antitumor activities of glucans (Review)[J].Int J Oncol,2013,43(2):357-364.
[19]Romani L.Immunity of fungal infections [J].Nat Rev Immunol,2011,11(4):275-288.
[20]Ni L,et al.Concomitant activation and antigen uptake via human dectin-1 results in potent antigen-specific CD8+T cell responses [J].J Immunol,2010,185:3504-3513.
[21]Roeder A,et al.Toll-like receptors as key mediators in innate antifungal immunity [J].Med Mycol,2004,42:485-498.

