依那西普缓解腰椎间盘突出模型大鼠的痛觉过敏并减少趋化因子CCL2和受体的表达
朱 翔,戴 林,朱鸣镝
(南通大学附属医院1.麻醉科;2.骨科,江苏南通 226001)
腰椎间盘突出症(lumbar disc herniation,LDH)是临床常见的一种慢性疾病,它能引起长期的腰痛和坐骨神经痛,严重影响患者生活质量。其发病机制目前仍不十分清楚。LDH所致的疼痛有机械因素和炎症介质参与的化学因素[1]。以往研究表明,肿瘤坏死因子(tumor necrosis factor-α,TNF-α)在炎性反应中是一个重要的靶点,此反应是神经损伤后形成神经病理性疼痛的重要因素[2-3]。TNF-α在一些神经病理性疼痛模型和椎间盘细胞中可以诱发趋化因子 CCL2的产生[4-5]。CCL2,也称为单核细胞趋化蛋白-1(monocyte chemoattractant protein-1,MCP-1),可以为暴露于炎症,感染,外伤,毒素的部位趋化补充单核细胞。证据表明CCL2通过其受体CCR2在慢性疼痛中起重要作用[6-7]。本研究探讨鞘内注射依那西普在椎间盘突出引起的神经病理性疼痛中的作用和机制。
1 材料与方法
1.1 主要材料
Trizol试剂(Invitrogen,美国),反转录试剂盒、引物[宝生物工程(大连)有限公司设计和合成](表1),染料法实时荧光定量试剂盒(Takara公司),Mouse-anti-ED-1(Millipore公司),Rabbit-anti-ATF3(Santa Cruz公司)。

表1 实时定量PCR引物序列Table 1 Real time quantitative PCR primer sequence
实验动物SPF级SD雄性大鼠[南通大学实验动物中心,许可证号:SCXK(苏)2008-0010],体质量200~250 g。
1.2 方法
1.2.1 动物模型的建立:腹腔注射戊巴比妥钠进行麻醉,消毒后以L5棘突为中心后正中旁开0.5 cm切口,显露L5、L6椎间关节,咬除L6上关节突及部分L5椎弓根及椎板,显露L5背根神经节及神经根。截断大鼠尾,取其间髓核(nucleus pulposus,NP),将其移植L5 DRG的部位。假手术组(Sham组)仅切开后暴露DRG,不移植髓核。
取髓核的方法0号线结扎大鼠尾根部,防止出血,切开椎间盘,取直径2~3 mm髓核2~3个放置事先准备的0.9%氯化钠注射液中。
鞘内注射药物 NP手术之前1 h,分别鞘内注射30 μL 0.9%氯化钠注射液、依那西普10 μg或100 μg。经异氟烷吸入麻醉,使用29 gauge(B-D公司)注射针在第3、4或第4、5腰椎棘突间注射药物到大鼠蛛网膜下隙,以尾巴出现颤动或突然侧向甩动作为穿刺成功标志[8]。
1.2.2 行为学观察:术前1 d和术后各时间点以及依那西普给药前后测定大鼠的机械性缩爪阈值(mechanical withdrawal threshold,MWT),用 von Frey纤维丝以 up-down 法测定[9]。
1.2.3 实时定量PCR检测:分别处死各组各时间段大鼠各6只,取L5节段DRG和脊髓,Trizol法提取总RNA,反转录-实时荧光定量PCR反应按Takara说明书进行操作。应用NCBI的Primer-BLAST进行引物特异性验证。PCR扩增程序:95℃ 预变性30 s 95 ℃ 5 s,56 ℃ 30 s,72 ℃ 30 s,并收集荧光,共循环40次,最后进行融解曲线检测。结果分析采用2-△△CT(Livak法)。
1.2.4 免疫荧光染色及图像分析:正常组,10 d假手术组和3,10 d NP手术组SD大鼠每组各5只,腹腔注射戊巴比妥钠,常规固定,脱水,切片,片厚14 μm,贴片于防脱载玻片上。免疫荧光染色具体操作严格按照试剂盒说明书进行。荧光显微镜下观察,拍片。过程中保持各实验组的实验条件一致。每个实验组有3张玻片,细胞统计总数>200个。使用Image J软件统计各组免疫荧光染色的平均灰度值进行分析。
1.3 统计学分析
2 结果
2.1 NP诱导快速机械触诱发痛
LDH术后,大鼠手术侧后爪的机械痛缩爪阈值(PWT)从术后开始下降,5 d最显著(P<0.001),并维持至21 d(P<0.001)。NP组的PWT在所有时间点上显著低于假手术组(P<0.001)(图1)。
2.2 NP诱导产生DRG中巨噬细胞浸润和神经元损伤
在正常组和假手术组只有少量ED-1标记的巨噬细胞存在(图2A,D),但术后3 d(P<0.001)和10 d(P <0.001)大量增加(图2B,C,E)。与正常组相比(图3A),术侧DRG中ATF3标记的受损伤神经元在NP后3 d(P<0.001)和10 d(P<0.001)有显著的增加(图3B,C,E)。同时,10 d假手术组的ATF3标记神经元(P<0.001)与正常组相比也有显著增加(图3D,E),并且10 d手术组与假手术组相比有显著增加(P<0.001)。

图1 NP诱导的大鼠机械痛敏时程的变化Fig 1 Time course of NP-induced mechanical allodynia in rats
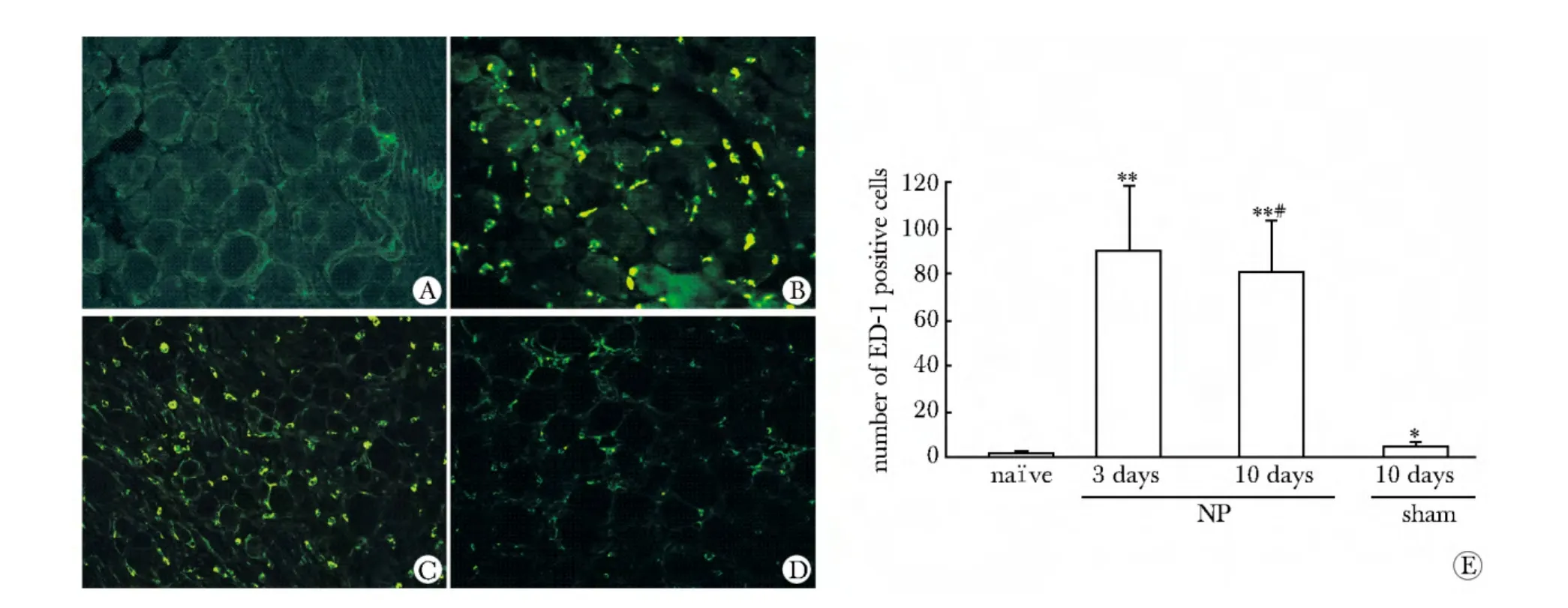
图2 NP诱导产生DRG中巨噬细胞浸润Fig 2 NP induced macrophage infiltration in rat DRG(×200)

图3 NP诱导产生DRG中神经元损伤Fig 3 NP induced and neuronal injury in rat DRG(×200)

图4 NP术后DRG和脊髓中TNF-α mRNA的表达Fig 4 NP application induces TNF-α mRNA expression in DRG and spinal cord
2.3 NP术后脊髓和DRG中TNF-α mRNA的表达增加
在DRG中,与正常组相比,TNF-α mRNA的表达在1 d(P<0.001)增高,维持3 d(P<0.05);在脊髓中TNF-α mRNA也在1 d(P<0.001)和3 d(P <0.01)增加(图4)。
2.4 鞘内注射依那西普大鼠缓解机械性痛敏
鞘内注射依那西普(100 μg)在 2 d(P<0.001),3 d(P <0.001)和4 d(P<0.001)缓解了NP诱导的机械痛觉过敏(图5)。
2.5 鞘内注射依那西普抑制DRG和脊髓中CCL2和CCR2的上调
NP术后3 d,注射依那西普后可以显著降低DRG中由NP诱发的CCL2(P<0.05)和CCR2 mRNA(P<0.05)的上调。同时也降低脊髓中CCL2(P<0.05)和CCR2 mRNA(P<0.05)的表达(图6)。
3 讨论
腰椎间盘髓核突出可致病理性神经痛,但其具体机制尚未完全明了。过去的主流理论是神经机械压迫学说。然而,大量临床图像和数据并不能支持腰椎间盘突出症患者神经压迫的程度和症状、体征有直接关联[10]。其作用机理通常是由局部炎性反应诱发为主,而并不是髓核突出的机械压迫所致。突出髓核的化学性致炎特性在椎间盘源性腰腿痛中起着重要作用[11],而受到压迫的神经根或脊神经节均会产生炎性反应,炎性介质包括:TNF-α、IL-1β、IL-6和MCP-1等。本实验结果证明,突出的髓核能诱发DRG中巨噬细胞的浸润和神经元活性的改变,并引起TNF-α等多种炎性因子的上调。TNF-α的表达大都集中在脊髓炎性反应的早期,很快升至峰值水平,在72 h内即降至基线[12]。本实验结论也显示NP能引起了DRG和脊髓中快速的TNF-α mRNA表达增加,说明TNF-α在病理性疼痛的早期产生阶段发挥重要作用,但不参与对病理性疼痛的维持。慢性病理性疼痛的产生和维持是多种炎性因子反应的结果,其中CCL2通过其受体CCR2在慢性疼痛中扮演重要的角色[6]。中枢神经系统中,CCL2在脊髓中表达并且在神经性疼痛中表达会增加。周围神经系统中,CCL2在背根神经节初级感觉神经元中表达并且在神经损害后表达上调[7]。CCL2中和抗体能够降低因脊神经结扎而导致的机械触诱发痛或慢性压迫引起的坐骨神经的损伤。但是,在椎间盘突出引起的慢性疼痛中,早期起作用的TNF-α和维持疼痛产生的CCL2/CCR2之间是否存在相关关联?目前的还没有确切的研究。行为学结果显示,鞘内注射TNF-α拮抗剂依那西普,抑制了NP诱导的机械触痛觉过敏;同时PCR结果显示,DRG和脊髓中CCL2/CCR2的表达上调也明显被抑制。初步揭示了DRG和脊髓中快速的TNF-α上调可能引发了CCL2/CCR2的上调和神经病理性疼痛的发展。

图6 鞘内注射依那西普抑制DRG和脊髓中CCL2和CCR2的上调Fig 6 Intrathecal injection of etanercept inhibited the mRNA of CCL2 and CCR2 upregulation in DRG and spine cord

图5 鞘内注射依那西普大鼠的左后爪MWT变化Fig 5 Changes of MWT after intrathecal injection of etanercept
综上所述,本实验建立了一个良好的LDH动物模型,探讨了TNF-α在自体髓核移植所致的神经病理性疼痛中的变化及所起的作用,并提出在LDH不同时期靶向作用于TNF-α和CCL2/CCR2信号也许会成为治疗慢性根性神经病理性疼痛的方法。
[1]Shamji MF,Setton LA,Jarvis W,et al.Proinflammatory cytokine expression profile in degenerated and herniated human intervertebral disc tissues[J].Arthritis Rheum,2010,62:1974-1982.
[2]Olmarker K,Larsson K.Tumor necrosis factor alpha and nucleus-pulposus-induced nerve root injury[J].Spine,1998,23:2538-2544.
[3]Xu JT,Xin WJ,Zang Y,et al.The role of tumor necrosis factor-alpha in the neuropathic pain induced by Lumbar 5 ventral root transection in rat[J].Pain,2006,123:306-321.
[4]Gao YJ,Zhang L,Samad OA,et al.JNK-induced MCP-1 production in spinal cord astrocytes contributes to central sensitization and neuropathic pain[J].J Neurosci,2009,29:4096-4108.
[5]Yoshida M,Nakamura T,Sei A,et al.Intervertebral disc cells produce tumor necrosis factor alpha,interleukin-1beta,and monocyte chemoattractant protein-1 immediately after herniation:an experimental study using a new hernia model[J].Spine,2005,30:55-61.
[6]Jung H,Bhangoo S,Banisadr G,et al.Visualization of chemokine receptor activation in transgenic mice reveals peripheral activation of CCR2 receptors in states of neuropathic pain[J].J Neurosci,2009,29:8051-8062.
[7]Jung H,Toth PT,White FA,et al.Monocyte chemoattractant protein-1 functions as a neuromodulator in dorsal root ganglia neurons[J].J Neurochem,2008,104:254-263.
[8]Hylden JL,Wilcox GL:Intrathecal morphine in mice:a new technique[J].Eur J Pharmacol,1980,67:313-316.
[9] Dixon WJ.Staircase bioassay:the up-and-down method[J].Neurosci Biobehav Rev,1991,15:47-50.
[10]Mulleman D,Mammou S,Griffoul I,et al.Pathophysiology of disk-related sciatica. I.--Evidence supporting a chemical component[J].Joint Bone Spine,2006,73:151-158.
[11]Uesugi K,Sekiguchi M,Kikuchi S,et al.The effect of repeated restraint stress in pain-related behavior induced by nucleus pulposus applied on the nerve root in rats[J].Eur Spine J,2011,20:1885-1891.
[12]Lee YL,Shih K,Bao P,et al.Cytokine chemokine expression in contused rat spinal cord[J].Neoroehem Int,2000,36:417-425.

