骨形态发生蛋白2聚乳酸缓释微球对兔骨髓间充质干细胞相容性研究*
马立坤,邓 江,黄文良,叶 鹏,田仁元,吕雪峰
(遵义医学院第三附属医院骨一科,贵州遵义563000)
重组人骨形态发生蛋白2(recombinant human bone morphogenetic protein-2,rhBMP-2)具有骨诱导能力,但在体内半衰期短,难以达到有效生理浓度[1-2]。目前,对蛋白多肽缓释载体进行了大量研究,其中,聚乳酸(poly lactic acid,PLA)具有良好的生物相容性,最终代谢产物为水(H2O)和二氧化碳(CO2),广泛用于药物缓释载体[3]。本实验在前期通过复乳干燥法制备出rhBMP-2-PLA 缓释微球,并考察微球粒径、载药率及体外缓释特性的基础上与兔骨髓间充质干细胞(bone marrow stem cells,BMSCs)体外共培养,通过MTT、ALP检测及电镜观察该微球在体外对其BMSCs生物相容性进行评价。
1 材料与方法
1.1 实验动物 新西兰种系1月龄白兔购自第三军医大学实验动物中心,实验动物生产许可证号:SCXK(渝)2012-0003。
1.2 主要试剂及仪器 rhBMP-2冻干粉(上海瑞邦生物材料有限公司);PLA(相对分子质量3×104,济南岱罡生物工程有限公司);二氯甲烷(重庆川江化学试剂厂);聚乙烯醇(PVA,天津市科密欧化学试剂有限公司);DMEM 培养基、胰酶、胎牛血清(Hyelone公司);MTT(Amresco公司);DMSO(Amresco公司);CO2细胞培养箱(美国Thermo公司);冷冻高速离心机(美国Thermo公司);超声分散器(中国);真空冷冻干燥机(美国Thermo公司);倒置显微镜(日本Olympus);超净工作台(苏州安泰有限公司);扫描电镜(日本日立S-3400N 公司);50万居里60CO 辐照装置(贵州金农辐照科技有限公司)。
1.3 方法
1.3.1 rhBMP-2缓释微球的制备[4-5]取适量rhBMP-2溶于1mL双蒸水中,使其完全溶解作为水相。准确称取100 mg PLA 溶于4mL二氯甲烷和1mL 丙酮有机溶剂中做为油相。取100μL水相与油相相混合,在冰浴下超声分散(100 W,1min)形成初乳,用注射器将初乳缓慢加入1%的PVA 溶液25mL内,冰浴下超声(200 W,3min)形成复乳。然后将此复合体系在磁力搅拌器中低速(400r/min)搅拌3~5h,使其二氯甲烷、丙酮完全挥发,所得乳液冷冻高速(12 000r/min)离心20min,收集rhBMP-2-PLA 缓释微球,用双蒸水洗3遍,冷冻干燥后用3 000Gy60Co照射消毒,密封,4 ℃保存备用。
1.3.2 兔BMSCs分离培养 采用全骨髓贴壁筛选法分离BMSCs[6]。取新西兰幼兔,麻醉后消毒铺巾,取出双侧股骨和胫骨,除去肌肉,磷酸盐缓冲液(PBS)清洗。胶骨钳咬除两端骨骺,用Hanks液(含肝素抗凝)冲出骨髓,然后用200目过滤筛过滤。1 000r/min离心5 min,用低糖DMEM 培养液(含10%胎牛血清、100U/mL链霉素、100 U/mL 青霉素)反复吹打制成单细胞悬液接种于培养瓶,放于细胞培养箱中培养。48h半换液,72h全换液,以后视情况每隔2~3d换液,待细胞生长至80%~85%时,用胰蛋白酶消化,按1∶2进行传代培养,培养条件同原代。
1.3.3 rhBMP-2-PLA 缓释微球体外毒性实验[7]精确称取200mg rhBMP-2-PLA 缓释微球加入10mL低糖DMEM 培养液(含10%胎牛血清)置于37 ℃培养箱中浸提24h分别制备100%、50%、25%组浸提液。取第3代生长良好的BMSCs,调整细胞浓度为5×104个/mL,每孔接种100μL 于96孔板中,细胞培养箱中培养24h后,弃去原液换成各浓度组浸提液,以单纯低糖DMEM 培养液(含10%胎牛血清)为对照组,继续在细胞培养箱中培养,分别于24、48、72h 随机取一96 孔板,MTT 法测定各孔光密度(OD)值。
1.3.4 rhBMP-2-PLA 缓释微球细胞增殖活力测定 实验组用含理论量为2μg rhBMP-2的缓释微球DMEM 培养液,对照组仅加入DMEM 培养液。取第3代生长良好的BMSCs,调整细胞浓度为2×104个/mL,每孔取100μL 按实验组、对照组接种于4块96孔板。分别在第1、3、5、7天随机取1板,MTT法测定各孔OD值。
1.3.5 细胞和rhBMP-2-PLA 缓释微球共培养生长情况观察 每天在倒置相差显微镜下观察细胞生长情况,用理论含量为2μg rhBMP-2的rhBMP-2-PLA 缓释微球与细胞共培养7d,取出细胞爬片用2.5%戊二醛固定2h,梯度乙醇脱水、干燥、喷金,扫描电镜下观察细胞生长情况。
1.4 统计学处理 采用SPSS 17.0统计软件进行数据处理分析,计量资料以±s表示,结果用重复测量数据的方差分析,以P<0.05为差异有统计学意义。
2 结 果
2.1 rhBMP-2-PLA 缓释微球表征 微球平均粒径839.6 nm,包封率及载药 率分别为(88.943±2.878)%、(0.026±0.001)%,体外释药第1天释药率约10.199%,至第19天累计释药率约54.643%。
2.2 BMSCs原代及传代培养形态 原代BMSCs接种48h后出现较多的贴壁细胞,经半换液、全换液除去未贴壁细胞,约72h细胞开始增殖,生长良好,BMSCs成纤维状、梭形。约7d时细胞生长融合达80%~90%,见图1。传代后细胞形态基本一致,细胞以梭形为主,增殖正常,6~8d时细胞可铺满瓶底,见图2。

图1 原代BMSCs培养第7天(×100)
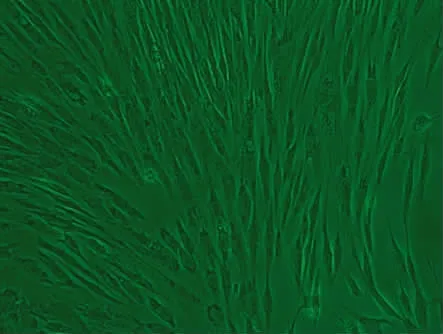
图2 第3代BMSCs培养第7天(×100)
2.3 缓释微球对细胞毒性评价结果[8]各浓度浸提液实验组的平均OD值为OD1,对照组平均OD值为OD2,通过细胞相对生长率(RGR)=OD1/OD2×100%,分别计算出各浓度实验组RGR,得出rhBMP-2-PLA 缓释微球对BMSCs无细胞毒性,见表1、2。
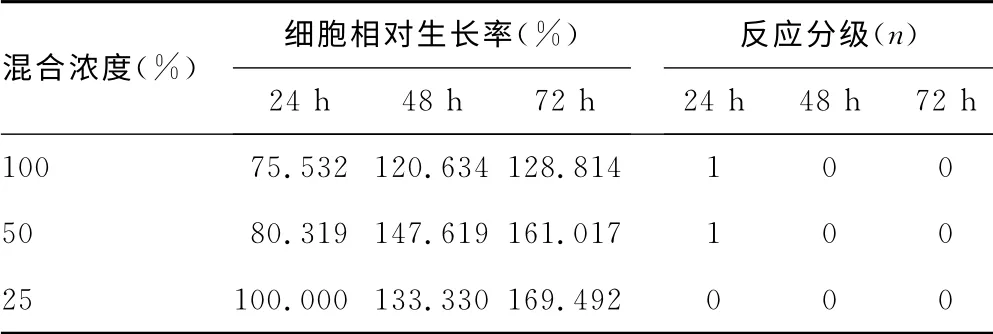
表1 rhBMP-2-PLA 缓释微球浸提液与BMSCs 培养的RGR 和CTG(n=8)
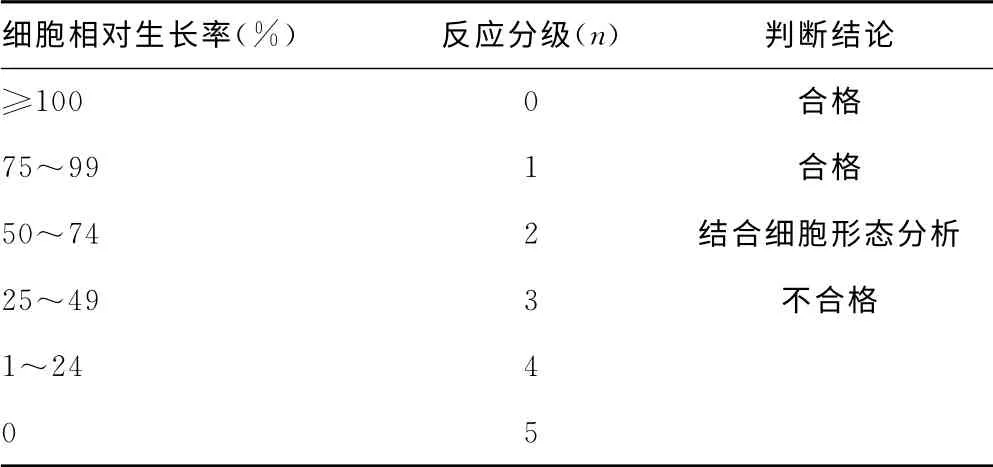
表2 细胞毒性反应分级标准
2.4 共培养细胞增殖活力测定结果 实验组与对照组4个不同时间细胞增殖OD值经重复测量方差分析得出时间之间OD值差异有统计学意义(P=0.000),实验组与对照组OD值比较差异有统计学意义(P=0.025),实验组OD值高于对照组,时间与组数有显著交互效应,二者变化趋势明显不同(P=0.006),见表3。
表3 不同时间rhBMP-2-PLA 缓释微球对细胞 增殖活力OD 值比较(±s,n=6)

表3 不同时间rhBMP-2-PLA 缓释微球对细胞 增殖活力OD 值比较(±s,n=6)
组别1d 3d 5d 7d实验组 0.077±0.034 0.094±0.019 0.128±0.012 0.365±0.083对照组 0.071±0.018 0.081±0.012 0.114±0.032 0.227±0.031
2.5 倒置相差显微镜观察共培养细胞增殖结果 能见到梭形、多角形细胞周围有大量缓释微球,并随时间延长,细胞数量逐渐增多,生长良好,见图3。

图3 rhBMP-2-PLA 缓释微球与BMSCs共培养7d(×200)
2.6 共培养细胞电镜观察结果 共培养7d时扫描电镜可见细胞伸展为长梭形,并伸出伪足黏附在缓释微球的周围,细胞分裂增殖正常,见图4。

图4 rhBMP-2-PLA 缓释微球与BMSCs共培养7dSEM(×2 000)
3 讨 论
组织工程研究主要有支架材料、细胞因子、种子细胞。大量临床研究认为rhBMP-2是体内重要的骨诱导因子。但作为外源性的细胞诱导因子在体内容易被蛋白酶分解,难以起到诱骨作用,因此,通过制备出具有缓释作用的rhBMP-2-PLA 微球从而解决了rhBMP-2在体内不能持续作用的难题。但作为修复骨缺损的骨组织工程材料首先必须具有良好的生物相容性[9]。目前,评价材料的毒性主要有体外、体内实验,而体外细胞毒性实验具有更直观、重复性好等特点,从而奠定了在评价材料生物相容性方面重要的地位[10]。目前,选用实验细胞主要有2类,一类是优先选用已建株系细胞,另一类为根据实验特需要求直接从活体组织获取的原代细胞。研究表明材料与不同组织来源细胞的相容性具有差异性,通过选取与植入或修复的组织来源一致的细胞进行实验,其结果更符合组织工程要求[11]。因此,本实验选用的实验细胞为与实验目的一致的BMSCs。
BMSCs具有取材方便、易于分离培养扩增,并且具有自我复制,在特定的诱导环境下能向成骨细胞、成软骨细胞等多向分化潜能,在连续培养和冷冻保存后仍然具有多向分化潜能,而成为骨组织工程的理想种子细胞之一[12-14]。rhBMP-2因子是参与骨、软骨损伤修复的重要因子。rhBMP-2 因子在作用条件下能促进BMSCs向成骨细胞定向分化及BMSCs增殖,且对rhBMP-2浓度具有依赖性[15]。实验组BMSCs与对照组BMSCs在第1、3、5 天增殖量方面比较,差异无统计学意义(P>0.05),在第7天实验组BMSCs增殖明显多于对照组,两组比较差异有统计学意义(P<0.05),其结果表明rhBMP-2-PLA 缓释微球与BMSCs具有良好的生物相容性且rhBMP-2在微球制备过程中没有失活。
MTT 法是间接反映细胞生长和存活的经典方法,具有经济、重复性好、易操作、灵敏度高等特点[16]。本实验制备出不同浓度组rhBMP-2-PLA 低糖DMEM 培养液(含10%胎牛血清)浸提液为实验组,以单纯低糖DMEM 培养液(含10%胎牛血清)为对照组,通过MTT 法测定不同时间的BMSCs的相对增殖率,3种浓度的浸提液反应等级为0或1,均为合格。
[1] Rey-Rico A,Silva M,Couceiro J,et al.Osteogenic efficiency of in situ gelling poloxamine systems with and without bone morphogenetic protein-2[J].Eur Cell Mater,2011,21:317-340.
[2] Schmidmaier G,Schwabe P,Strobel C,et al.Carrier systems and application of growth factors in orthopaedics[J].Injury,2008,39(Suppl 2):S37-43.
[3] Fournier E,Passirani C,Montero-Menei CN,et al.Biocompatibility of implantable synthetic polymeric drug carriers:focus on brain biocompatibility[J].Biomaterials,2003,24(19):3311-3331.
[4] Chen L,Liu L,Li C,et al.A new growth factor controlled drug release system to promote healing of bone fractures:nanospheres of recombinant human bone morphogenetic-2 and polylactic acid[J].J Nanosci Nanotechnol,2011,11(4):3107-3114.
[5] Wen J,Kim GJ,Leong KW.Poly(D,L-lactide-co-ethyl ethylene phosphate)s as new drug carriers[J].J Control Release,2003,92(1/2):39-48.
[6] 王共先,汪泱,刘伟鹏,等.骨髓间充质干细胞-聚乳酸聚乙醇酸共聚复合物支架修复组织损伤的实验研究[J].中华医学杂志,2006,86(6):403-406.
[7] 刘建华,王国海,徐栋梁.聚己内酯与左 旋聚乳酸共聚物支架的细胞相容性测定及与软骨细胞体外复合的实验研究[J].医学研究生学报,2009,22(2):131-134.
[8] 王玮,尹庆水,张余.重组人骨形态发生蛋白2壳聚糖纳米微球的制备及体外细胞毒性[J].中国组织工程研究与临床康复,2011,15(25):4611-4614.
[9] 王晶,张洹,刘华.骨髓间充质细胞与速固化磷酸钙支架共培养的实验研究[J].中国矫形外科杂志,2007,15(9):706-708.
[10] 张燕搏,姜明,王强,等.组织工程血管材料体外细胞毒性评价实验研究[J].中华实用诊断与治疗杂志,2011,25(6):539-542.
[11] 佘荣峰,邓江,黄文良,等.丝素蛋白/壳聚糖复合支架材料的细胞相容性[J].中国组织工程研究,2012,16(3):455-458.
[12] Yoshikawa T,Ohgushi H,Nakajima H,et al.In vivo osteogenic durability of cultured bone in porous ceramics:a novel method for autogenous bone graft substitution[J].Transplantation,2000,69(1):128-134.
[13] 乔丽萍,侯世科,姚利秀,等.角膜缘损伤模型静脉移植兔骨髓间充质干细胞体内动态分布特点的初步研究[J].医学研究生学报,2013,26(2):128-133.
[14] 苏寒,张森林,董震.组织工程化引导骨再生膜的构建及其修复牙槽骨缺损的实验研究[J].医学研究生学报,2013,26(9):932-936.
[15] 侯锐,毛天球,陈书军,等.rhBMP-2及rhbFGF对兔骨髓间充质干细胞分化作用长期效应的实验研究[J].医学研究生学报,2004,17(8):694-697.
[16] Qi R,Shen M,Cao X,et al.Exploring the dark side of MTT viability assay of cells cultured onto electrospun PLGA-based composite nanofibrous scaffolding materials[J].Analyst,2011,136(14):2897-2903.

