脱细胞纤维环基质对兔纤维环源干细胞分化的影响
王晟昊 王奕彬 过倩萍 刘 晨 王天鹏 杨惠林 李 斌
椎间盘退行性变发病率及致残率较高,是引起下腰痛的主要病因,严重影响患者生活质量并带来高昂的医疗花费[1]。因此,寻找合适的椎间盘退行性变治疗方法具有巨大的经济和社会意义。椎间盘摘除术、椎间融合术等手术治疗方法可有效改善疼痛等临床症状,但手术造成的脊柱结构改变可能引起邻近节段退行性变,甚至导致更严重的脊柱病变[2]。随着组织工程技术的发展,采用仿生椎间盘替换病变组织逐渐成为可能[3-6]。完整的纤维环结构对保持髓核形态位置及维持椎间盘内生理压力至关重要[7-8],如何使其再生则是组织工程研究的关键问题。
种子细胞与支架是纤维环组织工程的两大要素。既往研究[9-12]多采用纤维环细胞、髓核细胞、软骨细胞及各种来源的干细胞作为种子细胞。有研究[13-16]表明,正常及轻度退行性变椎间盘的纤维环中存在可多向分化的细胞,具有间充质干细胞(MSC)特征。这类细胞经分离纯化后具有自主向纤维环特有细胞分化的倾向,有望成为理想的种子细胞[16-17]。现有合成和复合支架材料多在成分、材料结构、力学性能等方面与实际纤维环组织相差甚远,应用受限。脱细胞基质是一类新型组织工程支架材料,其来源于天然组织基质,生物成分、力学性能均更接近于生物本体环境,且能促进细胞黏附、增殖和分化,从而影响组织生成[18-23]。DAFM 有望成为理想的新型支架材料。本研究拟探讨DAFM支架对种子细胞兔AFSC的诱导分化作用。
1 材料与方法
1.1 实验材料与试剂
健康清洁级6月龄新西兰大白兔10只,体重2.5~3 kg,由苏州大学实验动物中心提供。猪椎间盘购自市场,低糖Dulbecco改良Eagle培养基(LG-DMEM)、胎牛血清(FBS)购自美国 HyClone公司,胰蛋白酶购自美国Gibco公司,骨髓间充质干细胞(BMSC)成脂诱导分化培养基、成软骨诱导分化完全培养基购自美国Cyagen公司,地塞米松、β-甘油磷酸钠、抗坏血酸磷酸盐购自美国Sigma公司,逆转录试剂盒购自美国Thermo公司,聚合酶链式反应(PCR)试剂盒购自美国Biorad公司,PCR引物由英潍捷基(上海)贸易有限公司合成。
1.2 实验方法
1.2.1 DAFM 膜制备
从猪椎间盘获取纤维环组织,剔净内侧髓核组织及外侧筋膜、脂肪组织,用磷酸盐缓冲液(PBS)洗3次后剪碎成1 mm3大小组织块,放入研钵用液氮冷冻并进一步碾碎;加入0.25%胰酶溶液,放于37℃恒温振荡器中消化24 h,每4 h更换1次胰酶,并用PBS洗3次(每次30 min);随后加入含50 U/mL脱氧核糖核酸酶(DNase)和1 U/mL核糖核酸酶 (RNase)的 10 mmol/L 三 羟 甲 基 氨 基 甲 烷(Tris)-HCl溶液溶液(pH=7.5),37℃恒温振荡消化12 h;最后用1%聚乙二醇辛基苯基醚(Triton X-100)处理24 h,PBS洗6次(每次8 h),2 000 rpm离心10 min后将所得沉淀物溶于3%醋酸,4℃存放备用[18]。
将DAFM溶液加入24孔培养板,每孔300μL,在紫外线照射下自然晾干后获得DAFM膜,用无菌PBS溶液洗3次(每次10 min)。采用电子扫描显微镜与红外光谱分析观察DAFM膜结构及成分。
1.2.2 兔 AFSC获取
实验用兔均以耳静脉空气注射法处死。消毒取材部位后,清晰分离脊柱,剔除周围肌肉和筋膜,于两椎骨之间距上、下椎骨各2 mm处切取椎间盘组织,暂时保存于含5%双抗的LG-DMEM;于超净台中从椎间盘组织分离出纤维环,弃去髓核等其他组织后以PBS洗净并切成约1 mm3小块,每400 mg组织加入1 mL Ⅰ型胶原酶(2 mg/mL),37℃孵育消化4~6 h,每小时吹打混匀1次;200目不锈钢滤筛过滤,1000 rpm离心5 min,弃去上层清液,取下层细胞沉淀吹打混匀,37℃、5%CO2条件下采用含20%FBS的LG-DMEM细胞生长液在100 mm培养皿中进行培养。
1.2.3 诱导分化实验
诱导组分别通过成脂、成骨和成软骨3系诱导分化观察兔AFSC的分化潜能。成脂诱导分化:将第1代AFSC以3×104个/孔接种于24孔培养板,每孔加入含10%FBS的LG-DMEM1 mL,培养至细胞稳定贴合于板。采用含10%FBS LG-DMEM、0.5 mmol/L异丁基甲基黄嘌呤、100μmol/L吲哚美辛、10μg/mL胰岛素及1μmol/L地塞米松的成脂诱导培养液培养细胞,每3天换用含10%FBS LG-DMEM、10μg/mL胰岛素的成脂维持液培养1 d,共14 d。成骨诱导分化:将第1代 AFSC以3×104个/孔接种于24孔培养板,每孔加入含10%FBS的LG-DMEM1 mL,培养至细胞稳定贴合于板。采 用 含 10%FBS LG-DMEM 培 养 基、0.1μmol/L地塞米松、10 mmol/Lβ-甘油磷酸二钠、0.2 mmol/L抗坏血酸-2-磷酸酯的成骨诱导培养液培养细胞,每3天换液1次,共21 d。成软骨诱导分化:将第1代AFSC以3×104个/孔接种于24孔培养板,每孔加入含10%FBS的LG-DMEM 1 mL,培养至细胞稳定贴合于板。采用含10%FBS LG-DMEM、39 ng/mL 地塞米松、40μg/mL脯氨酸、100μg/mL丙酮酸钠、50μg/mL抗坏血酸-2-磷酸酯、50 mg/mL胰岛素-转铁蛋白-硒钠(ITS)、10 ng/mL转化生长因子(TGF)-β3的成软骨诱导液培养细胞,每3天换液1次,共21 d。
各对照组采用基础培养液,其他实验条件相同。
1.2.4 诱导分化染色结果
分别采用油红O、茜素红、番红O染色观察成脂、成骨、成软骨诱导分化结果。
对成脂诱导分化14 d的AFSC进行油红O染色:弃去细胞培养液,PBS洗3次,每次5 min;4%多聚甲醛固定细胞40 min,去离子水洗2次,每次5 min;弃去去离子水后加入0.36%油红O染色液染色1 h;以去离子水洗2次,每次5 min。
对成骨诱导培养21 d的AFSC进行茜素红染色:弃去细胞培养液,4%多聚甲醛固定细胞40 min,去离子水洗2次,每次5 min;加入0.1%茜素红染色液染色40 min;去离子水洗2次,每次5 min。
对成软骨诱导液培养21 d的AFSC进行番红O染色:弃去细胞培养液,PBS洗细胞3次,每次5 min;4%多聚甲醛固定细胞1 h,去离子水洗2次,每次5 min;加入2.5%番红O染色液染色1 d;去离子水洗细胞2次,每次5 min。
1.2.5 定量PCR检测
采用Trizol试剂抽提诱导分化(成脂诱导14 d,成骨诱导及成软骨诱导21 d)后的AFSC总信使RNA(mRNA),随后通过PCR反应获取互补DNA(cDNA)。温度条件:65℃持续5 min后立即降温至4℃,再42℃持续60 min,70℃持续5 min。定量检测干细胞的Ⅰ型胶原、Ⅱ型胶原和聚集蛋白聚糖的基因表达,以管家基因甘油醛-3-磷酸脱氢酶(GAPDH)作为对照进行检验。
1.3 统计学分析
采用SPSS 16.0软件进行统计分析,实验数据均用均数±标准差表示。采用配对样本t检验分析基因表达情况,P<0.05为差异有统计学意义。
2 结果
2.1 DAFM膜的形态结构及成分
成功制备的猪DAFM膜为半透明白色膜状物,在电子扫描显微镜下呈网状,由胶原纤维无规律排列而成,其中无细胞残留(图1),符合单纯获取细胞外基质的要求。猪DAFM膜红外光谱图上出现胶原蛋白的特征吸收峰如酰胺Ⅰ带、酰胺Ⅱ带、酰胺Ⅲ带(图2),说明其主要成分为胶原蛋白[24-25]。
2.2 兔AFSC诱导分化结果
2.2.1 成脂诱导分化结果
成脂诱导7 d左右,细胞内部开始出现小油滴,并不断增加。油红O染色结果显示,14 d后对照组和诱导组均成脂分化明显,但无DAFM膜培养皿上兔AFSC成脂分化较DAFM膜上的更明显(下页图3a)。PCR检测结果显示,诱导组中无DAFM膜(NI亚组)培养皿上细胞高水平表达过氧化物酶体增殖物激活受体(PPAR)-γ,而 DAFM 膜(MI亚组)上PPAR-γ表达水平相对较低。同时对照组中DAFM膜(MC组)上细胞PPAR-γ表达水平与较无DAFM膜(NC组)培养皿上的细胞低(下页图3b),可见细胞在DAFM膜上自发成脂分化水平较在无DAFM膜的培养皿上低,在一定程度上说明DAFM膜有利于维持AFSC原有分化特性。而PPAR-γ诱导比值(诱导组基因表达量/对照组基因表达量)MI/MC大于NI/NC,表明DAFM可维持AFSC成脂分化潜能(下页图3c)。
2.2.2 成骨诱导分化结果
成骨诱导4 d左右细胞形态开始逐渐变细长。茜素红染色结果显示,诱导21 d后诱导组可见钙结节,且MI亚组沉积显著,对照组则无红染(下页图4a)。诱导组成骨细胞特征基因RUNX-2呈高水平表达,且MI亚组更显著(下页图4b)。RUNX-2诱导比值MI/MC大于NI/NC,表明DAFM膜上成骨分化更显著,提示DAFM膜可增强AFSC成骨分化能力(下页图4c)。

图1 猪DAFM膜的大体形态(a)、电子扫描显微镜下结构(b为×5 000,c为×25 000)
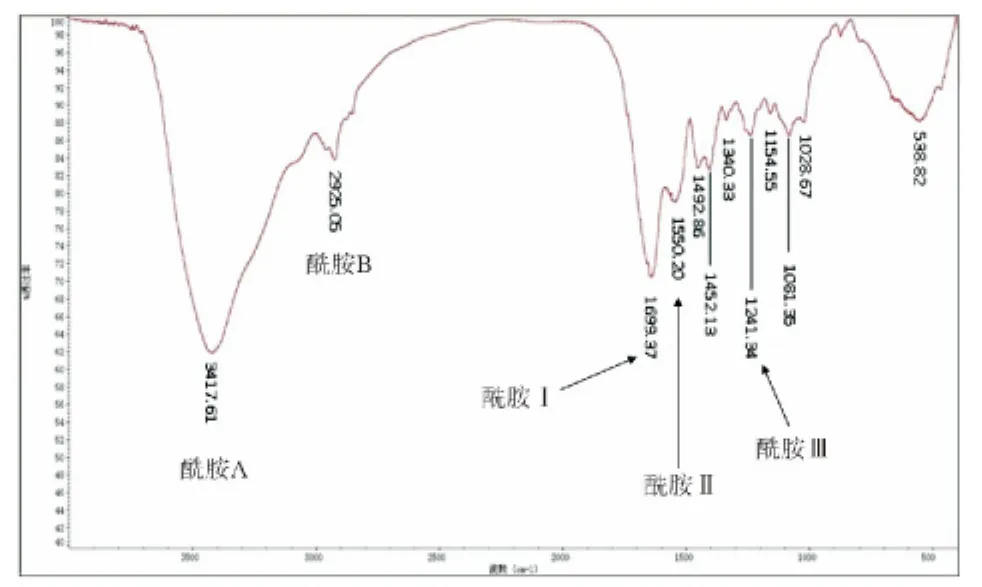
图2 猪DAFM膜的红外光谱图
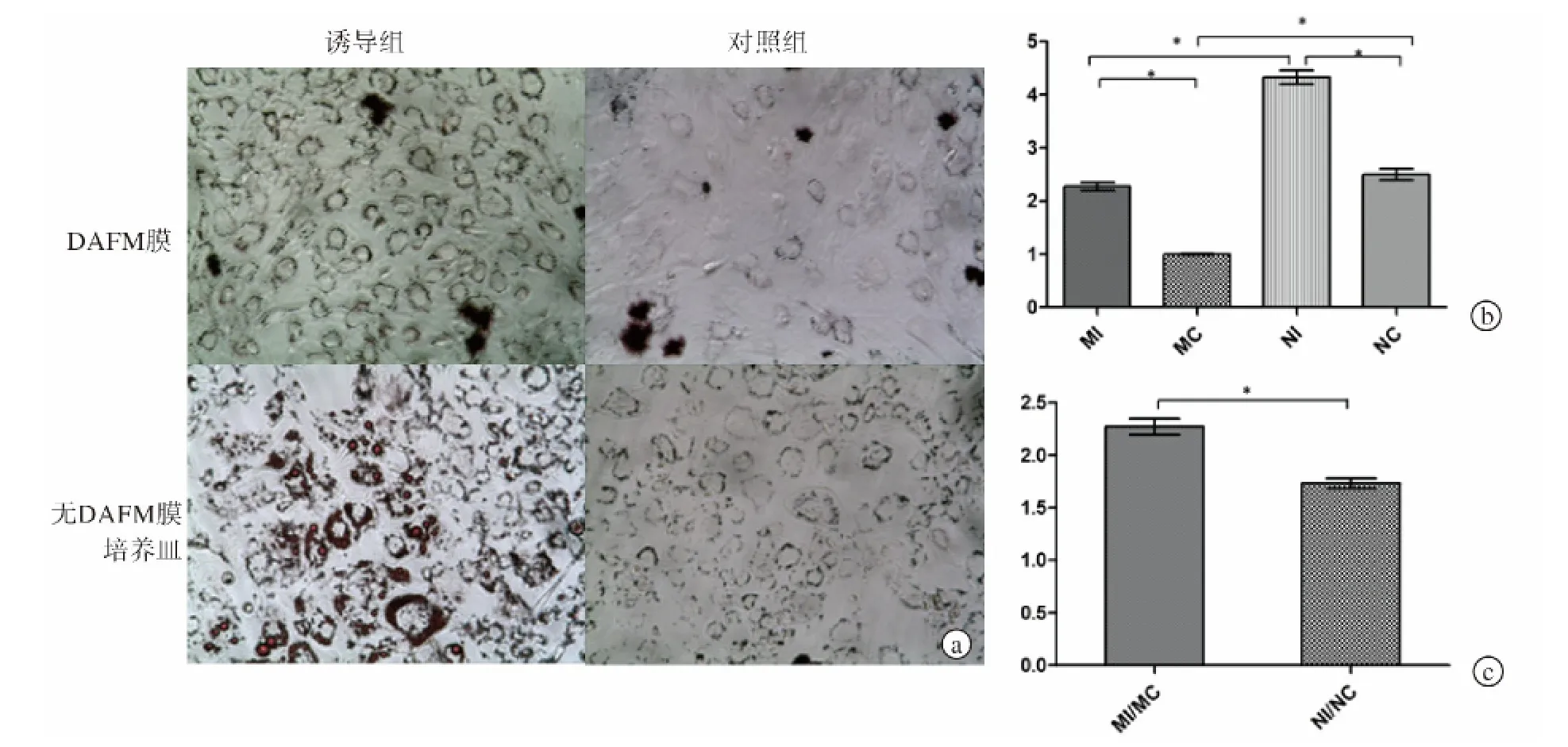
图3 兔AFSC成脂诱导分化结果 a.油红O染色结果(×100) b.成脂诱导14 d后AFSC中PPAR-γ基因表达水平的PCR检测结果 c.PPAR-γ诱导比值

图4 兔AFSC成骨诱导分化结果 a.茜素红染色结果(×40) b.RUNX2基因表达水平的PCR检测结果 c.RUNX-2诱导比值
2.2.3 成软骨诱导分化结果
成软骨诱导10 d左右细胞形态开始逐渐变圆。番红O染色结果显示,诱导21 d后诱导组出现显著红染的聚集蛋白聚糖,且NI亚组红染更明显,对照组则仅有少量红染(图5a)。
PCR检测结果显示,诱导组成软骨细胞特征基因Ⅱ型胶原均呈高水平表达,且NI亚组更明显,对照组中MC亚组Ⅱ型胶原的表达水平低于NC亚组(图5b),DAFM膜上AFSC自发成软骨分化受到抑制,其原有的分化特性得到较好保留。
Ⅱ型胶原诱导比值 MI/MC 大于 NI/NC,DAFM膜上细胞自发成软骨分化水平较无DAFM膜者低,表明DAFM可维持AFSC成软骨分化潜能(图5c)。

图5 兔AFSC成软骨诱导分化结果 a.番红O染色结果(×40) b.Ⅱ型胶原基因表达水平的PCR检测结果 c.Ⅱ型胶原诱导比值
3 讨论
诸多研究[26]显示,MSC的分化有显著组织特异性,即一般而言,来源于某组织的MSC具有自主向该组织特有的细胞类型分化的倾向,如滑膜MSC更易于向软骨细胞分化,脂肪MSC易向脂肪细胞分化,而BMSC更易向成骨细胞分化。即使在相同诱导条件下,不同来源的MSC向特定细胞类型分化的能力也不一致[17,27]。人体不同部位组织有不同类型的干细胞。兔AFSC作为来源于纤维环组织的干细胞,可能优先向兔纤维环细胞分化,是纤维环组织工程理想的种子细胞。
支架材料作为组织工程的另一重要部分,也在不断发展,主要包括天然材料(如脱细胞基质、壳聚糖等)、合成材料和复合材料3大类[28-33]。作为一类新型组织工程支架材料,脱细胞基质材料的成分、结构、力学特性均更接近生物自身环境。同源的细胞基质更接近干细胞在生物体内的环境,对于干细胞的培养及分化具有天然的促进作用。在本实验中,红外光谱分析结果显示DAFM主要成分为胶原蛋白,且电子扫描显微镜观察发现胶原纤维结构得到良好保留。这都保证了DAFM类似纤维环的生物特性,有利于同样来源的AFSC的增殖分化。DAFM有望成为纤维环组织工程的新型支架材料。
诱导分化结果表明,兔AFSC本身有较强自发成脂倾向,在对照组中也出现不少脂滴,但其在DAFM膜上的成脂诱导效果不如在无DAFM膜培养皿上好,表明猪DAFM对兔AFSC的成脂分化有一定抑制作用。而成骨诱导分化结果则正好相反。相同成骨诱导条件下,DAFM膜上钙结节数量和范围显著优于无DAFM膜者,猪DAFM膜对兔AFSC的成骨分化具有促进作用。而相同诱导分化条件下,DAFM膜上兔AFSC成软骨分化结果不如无DAFM膜者明显。这些结果说明,猪DAFM膜对兔AFSC向不同方向分化的作用有明显差异,并非单纯抑制或促进。简而言之,猪DAFM有利于促进兔AFSC成骨分化,却抑制其成脂及成软骨分化。当然,成脂分化不显著可能还与实验环境未达到纤维环的低氧、低糖生物环境有关。
比较MC组与NC组分化结果可见,兔AFSC在DAFM膜上自发分化水平均更低。DAFM膜上3系分化诱导比值MI/MC均高于无DAFM膜上的NI/NC,DAFM膜上的MI和 MC组基因表达差异性更大,其中以成骨及成软骨诱导分化更为显著,表明兔AFSC在DAFM膜上更易受诱导而向诱导方向分化,即兔AFSC在DAFM膜上分化潜能得以增强,DAFM膜可维持干细胞3系分化潜能。这或许与DAFM膜所具有的特殊纤维环胶原结构以及所含有的细胞因子有关。
此外,本研究显示猪DAFM膜可促进兔AFSC向成骨细胞分化。但AFSC是否与椎体骨质增生、骨赘形成存在关联,不同种属DAFM对于AFSC分化潜能作用是否存在差异性,其他环境因素是否对AFSC的分化潜能存在影响等问题仍有待进一步研究。
[1] Atlas SJ,Keller RB,Wu YA,et al.Long-term outcomes of surgical and nonsurgical management of sciatica secondary to a lumbar disc herniation:10 year results from the maine lumbar spine study[J].Spine(Phila Pa 1976),2005,30(8):927-935.
[2] Dewing CB,Provencher MT,Riffenburgh RH,et al.The outcomes of lumbar microdiscectomy in a young,active population:correlation by herniation type and level[J].Spine(Phila Pa 1976),2008,33(1):33-38.
[3] Nerurkar NL,Sen S,Huang AH,et al.Engineered disc-like angle-ply structures for intervertebral disc replacement[J].Spine(Phila Pa 1976),2010,35(8):867-873.
[4] Nesti LJ,Li WJ,Shanti RM,et al.Intervertebral disc tissue engineering using a novel hyaluronic acid-nanofibrous scaffold(HANFS)amalgam[J].Tissue Eng Part A,2008,14(9):1527-1537.
[5] Lazebnik M,Singh M,Glatt P,et al.Biomimetic method for combining the nucleus pulposus and annulus fibrosus for intervertebral disc tissue engineering[J].J Tissue Eng Regen Med,2011,5(8):e179-e187.
[6] Wan Y,Feng G,Shen FH,et al.Biphasic scaffold for annulus fibrosus tissue regeneration[J].Biomaterials,2008,29(6):643-652.
[7] Wilke HJ,Heuer F,Neidlinger-Wilke C,et al.Is a collagen scaffold for a tissue engineered nucleus replacement capable of restoring disc height and stability in an animal model?[J].Eur Spine J,2006,15(Suppl 3):S433-S438.
[8] Andersson GB,An HS,Oegema TR,et al.Directions for future research[J].J Bone Joint Surq Am,2006,88(Suppl 2):110-114.
[9] Nerurkar NL,Baker BM,Sen S,et al.Nanofibrous biologic laminates replicate the form and function of the annulus fibrosus[J].Nat Mater,2009,8(12):986-92.
[10] Bowles RD,Williams RM,Zipfel WR,et al.Self-assembly of aligned tissue-engineered annulus fibrosus and intervertebral disc composite via collagen gel contraction[J].Tissue Eng Part A,2010,16(4):1339-1348.
[11] Hsieh AH,Twomey JD.Cellular mechanobiology of the intervertebral disc:new directions and approaches[J].J Biomech,2010,43(1):137-145.
[12] 潘勇,周跃,郝勇,等.不同接种方法构建组织工程化椎间盘纤维环细胞支架复合体的对比研究[J].颈腰痛杂志,2009,30(1):3-7.
[13] Feng G, Yang X, Shang H, et al. Multipotential differentiation of human anulus fibrosus cells:an in vitro study[J].J Bone Joint Surg Am,2010,92(3):675-685.
[14] Henriksson H, Thornemo M, Karlsson C, et al.Identification of cell proliferation zones,progenitor cells and a potential stem cell niche in the intervertebral disc region:a study in four species[J].Spine Spine(Phila Pa 1976),2009,34(21):2278-2287.
[15] Risbud MV,Guttapalli A,Tsai TT,et al.Evidence for skeletal progenitor cells in the degenerate human intervertebral disc[J].Spine (Phila Pa 1976),2007,32(23):2537-2544.
[16] Liu C,Guo Q,Li J,et al.Identification of rabbit annulus fibrosus-derived stem cells[J].PLoS One,2014,9(9):e108239.
[17] Mimeault M,Batra SK.Recent progress on tissue-resident adult stem cell biology and their therapeutic implications[J].Stem Cell Rev,2008,4(1):27-49.
[18] Zhang J,Li B,Wang JH.The role of engineered tendon matrix in the stemness of tendon stem cells in vitro and the promotion of tendon-like tissue formation in vivo [J].Biomaterials,2011,32(29):6972-6981.
[19] Valentin JE,Turner NJ,Gilbert TW,et al.Functional skeletal muscle formation with a biologic scaffold[J].Biomaterials,2010,31(29):7475-7484.
[20] Singelyn JM,DeQuach JA,Seif-Naraghi SB,et al.Naturally derived myocardial matrix as an injectable scaffold for cardiac tissue engineering[J].Biomaterials,2009,30(29):5409-5416.
[21] Seif-Naraghi SB,Singelyn JM,Salvatore MA,et al.Safety and efficacy of an injectable extracellular matrix hydrogel for treating myocardial infarction[J].Sci Transl Med,2013,5(173):173ra25.
[22] Reing JE,Zhang L, Myers-Irvin J,et al.Degradation products of extracellular matrix affect cell migration and proliferation[J].Tissue Engg Part A,2009,15(3):605-614.
[23] Li J,Liu C,Guo Q,et al.Regional variations in the cellular,biochemical,and biomechanical characteristics of rabbit annulus fibrosus[J].PLoS One,2014,9(3):e91799.
[24] Belbachir K,Noreen R,Gouspillou G,et al.Collagen types analysis and differentiation by FTIR spectroscopy[J].Anal Bioanal Chem,2009,395(3):829-837.
[25] Petibois C,Gouspillou G,Wehbe K,et al.Analysis of typeⅠ andⅣcollagens by FT-IR spectroscopy and imaging for a molecular investigation of skeletal muscle connective tissue[J].Anal Bioanal Chemi,2006,386(7-8):1961-1966.
[26] Yoshimura H,Muneta T,Nimura A,et al.Comparison of rat mesenchymal stem cells derived from bone marrow,synovium,periosteum,adipose tissue,and muscle[J].Cell Tissue Res,2007,327(3):449-462.
[27] Liu TM,Martina M,Hutmacher DW,et al.Identification of common pathways mediating differentiation of bone marrowand adipose tissue-derived human mesenchymal stem cells into three mesenchymal lineages[J].Stem Cells,2007,25(3):750-760.
[28] Gruber HE, Fisher EC Jr, Desai B,et al. Human intervertebral disc cells from the annulus:three-dimensional culture in agarose or alginate and responsiveness to TGF-beta1[J].Exp Cell Res,1997,235(1):13-21.
[29] Di-Martino A,Sittinger M,Risbud MV.Chitosan:a versatile biopolymer for orthopaedic tissue-engineering[J].Biomaterials,2005,26(30):5983-5390.
[30] Yeganegi M,Kandel RA,Santerre JP.Characterization of a biodegradable electrospun polyurethane nanofiber scaffold:Mechanical properties and cytotoxicity[J].Acta Biomater,2010,6(10):3847-3855.
[31] Attia M,Santerre JP,Kandel RA.The response of annulus fibrosus cell to fibronectin-coated nanofibrous polyurethane-anionic dihydroxyoligomer scaffolds[J].Biomaterials,2011,32(2):450-460.
[32] Chan LK,Leung VY,Tam V,et al.Decellularized bovine intervertebral disc as a natural scaffold for xenogenic cell studies[J].Acta Biomater,2013,9(2):5262-5272.
[33] Turner KG,Ahmed N,Santerre JP,et al.Modulation of annulus fibrosus cell alignment and function on oriented nanofibrous polyurethane scaffolds under tension[J].Spine J,2014,14(3):424-434.

