脾气虚大鼠骨骼肌组织Ca2+/ CaM 信号通路关键分子动态表达规律
段永强 梁玉杰 成映霞 杜 娟 杨晓轶 程卫东 刘 靓 高建德 安耀荣 王 燕(甘肃中医学院 甘肃省中药药理与毒理学重点实验室,甘肃 兰州 73000)
脾气虚大鼠骨骼肌组织Ca2+/ CaM 信号通路关键分子动态表达规律
段永强梁玉杰1成映霞1杜娟杨晓轶程卫东2刘靓1高建德安耀荣1王燕1
(甘肃中医学院甘肃省中药药理与毒理学重点实验室,甘肃兰州730020)
〔摘要〕目的观察脾气虚大鼠骨骼肌组织Ca2+/钙调蛋白(CaM)信号通路中关键分子〔Ca2+〕i以及CaM、钙调蛋白激酶(CaMK)Ⅱ、p-CaMKⅡ蛋白表达水平的变化。方法受试动物随机分为正常对照组,脾虚模型7、14、21 d组,每组12只。除正常对照组外,其余受试动物采用复合法(苦寒破气法、游泳力竭法及饥饱失常法)成功建立脾气虚证大鼠模型,在观测各组大鼠一般生存状态、胃肠转运功能和骨骼肌组织ATP酶活性的基础上,采用激光共聚焦技术检测骨骼肌组织细胞内〔Ca2+〕i浓度,蛋白免疫印迹技术检测骨骼肌组织CaM、CaMKⅡ和p-CaMKⅡ的表达变化。结果与空白组比较,脾气虚大鼠随着造模时间的延长,胃残留率升高而小肠推进率下降(P<0.01) ;骨骼肌组织Na+-K+-ATPase和Ca2+-Mg2+-ATPase活性均降低(P<0.05,P<0.01) ;骨骼肌组织〔Ca2+〕i浓度和CaM、CaMKⅡ、p-CaMKⅡ蛋白表达量显著降低(P<0.01) ;且脾虚模型7 d、14 d、21 d组之间比较,以脾虚21 d组变化更为显著。结论脾虚大鼠骨骼肌组织Ca2+/CaM信号通路关键分子CaM、CaMKⅡ和p-CaMKⅡ蛋白以低表达为主。
〔关键词〕脾气虚证; Ca2+/CaM信号通路;骨骼肌
1甘肃中医学院甘肃省中药新产品创制重点实验室
2兰州大学基础医学院中西医结合研究所
第一作者:段永强(1974-),男,副教授,医学博士,主要从事中医临床基础,中医脾胃病的科研和临床工作。
Expression changes of Ca2+/CaM signaling pathways key factors in skeletal muscle tissue of rats with spleen-qi deficiency
DUAN Yong-Qiang,LIANG Yu-Jie,CHENG Ying-Xia,et al.
Key Laboratory of Pharmacology and Toxicology for Traditional Chinese Medicines of Gansu Province,Gansu College of TCM,Lanzhou 730020,Gansu,China
【Abstract】Objective To investigate the expression changes of Ca2+/CaM signaling pathways key factors〔Ca2+〕i,CaM,CaMKⅡand p-CaMKⅡin skeletal muscle tissue of rats with spleen-qi deficiency.Methods The rats were randomly divided into normal control,spleenqi deficient model groups(observed on 7 d,14 d and 21 d),12 rats in each.The spleen-qi deficient model rats were made by rhubarb,exhaustive and hungry method,then general existence,gastric remnant rate,intestinal propulsion rates,and ATPase activity related to metabolism were evaluated.Also,confocal laser technology was used to test cellular〔Ca2+〕i concentration and Western blot was used to test CaM,CaMKⅡ,p-CaMKⅡexpressions in skeletal muscle of spleen asthenia rats.Results Compared with that of normal group,gastric remnant rate was increased and small intestinal propulsion rates were decreased(P<0.01),the activities of Na+-K+-ATPase and Ca2+-Mg2+-ATPase were decreased significantly(P<0.01,P<0.05),and the expressions of CaM,CaMKⅡ,p-CaMKⅡin skeletal muscle tissue were decreased,these differences were obvious on spleen-qi deficient model 21 d group(P<0.01).Conclusions The〔Ca2+〕i concentrations,CaM,CaMKⅡand p-CaMKⅡabnormaly decreased might be one of the pathological mechanisms of spleen-deficiency.
【Key words】Spleen-qi deficiency; Ca2+/CaM signaling pathways; Skeletal muscle
中医认为“脾主运化”为气血生化源,“脾气散精”而将水谷精微输布全身,内至五脏六腑、外达四肢百骸,充养肌体,故有“脾主身之肌肉”之理论;如《黄帝内经·素问·藏气法时论篇》云:“脾病者,身重,善饥肉痿,足不收行,善瘈,脚下痛。虚则腹满,肠鸣飧泄,食不化”,严重脾虚会导致气血不足,肌肉失养而萎废不用。本文在研究脾气虚大鼠一般生存状态、胃肠转运功能和骨骼肌组织能量代谢相关酶活性的基础上,观察骨骼肌组织中Ca2+/CaM信号通路关键分子〔Ca2+〕i以及钙调蛋白(CaM)、钙调蛋白激酶(CaMK)Ⅱ、p-CaMKⅡ蛋白的表达变化规律。
1 材料与方法
1.1材料
1.1.1动物3月龄SPF级Wistar大鼠,雌雄各半,体质量180~190 g,甘肃中医学院医学实验中心提供,动物合格证号: SCXK(甘) 2011-0001-0001011;实验设施合格证号: SYXK(甘) 2011-0001-0000314。本实验中动物处理的相关程序遵守中国国家健康与医学研究委员会(NHNRC)动物道德准则并得到了甘肃中医学院动物实验伦理委员会的批准。
1.1.2药物与试剂中药均购自兰州复兴厚中药材有限责任公司。大黄、厚朴、枳实按2∶1∶1组成,以上方药分别常规煎煮、去渣滤出药液加热浓缩至每1 ml药液含生药2 g,冷却后置4℃冰箱备用,使用时稀释至所需浓度。
钙镁ATP酶试剂盒(Ca2+-Mg2+-ATPase,批号20130328)、钠钾ATP酶试剂盒(Na+-K+-ATPase,批号20130330),购自南京建成生物工程研究所;考马斯亮蓝蛋白测定试剂盒(批号20130326)购自南京建成生物工程研究所; Flou-3/AM钙离子荧光染色剂(批号D00147366)购自EMD Chemicals公司;抗CaM抗体、抗CaMKⅡ抗体、p-CaMKⅡ抗体(批号0002、0006)购自Cell Singaling公司;内参GAPDH(批号ZS-25778)、辣根酶标记山羊抗兔IgG(批号ZB-2301)购自北京中杉金桥;磷酸酶抑制剂混合物(批号P1260)、BSA胎牛血清白蛋白(批号1213G052)购自北京索莱宝生物科技有限公司;总蛋白提取试剂盒(批号PC0020)、蛋白质定量试剂盒(BCA法,批号P1511)购自北京普利莱基因技术有限公司;超敏发光液(批号090925)购自bio world公司;氯仿,无水乙醇,异丙嗪,甲醇均为国产分析纯试剂。
1.1.3主要仪器Biomate 3S超微量分光光度计,美国Thermo Fisher公司; Chemi DOC XRS+凝胶成像分析系统、CFX96TM Optics Module PCR仪、BIOMATE 3S核酸蛋白测定仪、Powerpac basic基础电泳仪,美国BIO-RAD公司; KDC-2044低速冷冻离心机,安徽中科中佳科学仪器有限公司; VT1000S震动切片机,德国Leica公司; Fluoview FV1000激光共聚焦显微镜,日本O-lympus公司; VELOCITY 18R高速台式低温离心机,澳大利亚Dynamically公司; Hirayama HVE-50高压灭菌器,日本Hirayama公司; P70D20P-TD(W0)微波炉,格兰仕微波炉电器有限公司。
1.2方法
1.2.1分组与造模48只SPF级Wistar大鼠适应性饲养1 w后,按体重从小到大编号,采用随机数字表法分为正常对照组、脾虚模型组(7、14、21 d),每组12只,雌雄各半分笼饲养。以苦寒破气法(大黄、枳实、厚朴)、游泳力竭法及饥饱失常法三因素复合法复制脾气虚证模型〔1,2〕: (1)苦寒破气法:造模组大鼠每日上午按7.5 g/kg大黄枳实厚朴制剂液灌胃,1次/d。(2)游泳力竭法:每日下午2∶00使大鼠负重游泳,于大鼠尾根部缠绕重量为该大鼠体重10%的保险丝,放入水深50 cm、水温20℃的水槽中游泳,并记录大鼠游泳耐力时间,以游泳力竭(即大鼠鼻尖没入水面10 s)为度,1次/d。(3)饥饱失常法:每日上午8∶00给予定量饲料,下午8∶00撤去饲料并称量剩余量,隔日再给予定量饲料,自由饮水。造模期间,正常对照组大鼠每日上午按1 ml/100 g体重灌服生理盐水,并给予抓捏刺激,每日上午、下午各1次给予定量饲料,称量剩余量,自由饮水。
1.2.2标本采集造模时分别于第7、14、21日取材并制备待检样本。各组大鼠于末次灌胃给药后,禁食不禁水24 h,乌拉坦(1 g/kg)麻醉采血后断头处死并制备待检标本。血清制备:股动脉取血4 ml,静置2 h后2 000 r/min离心10 min,取上清,放入尖底管中4℃低温冰箱保存备用。骨骼肌组织的收集:动物处死后,迅速将近股四头肌组织截取于激光共聚焦检测备用,另一部分骨骼肌组织置于用DEPC处理过的冻存管中,-80℃冷冻保存备用,检测CaM、CaMKⅡ相关蛋白表达。
1.2.3各组大鼠胃排空率和小肠推进率测定胃排空率实验〔3〕:分别随机抽取各组大鼠8只,禁食不禁水24 h后,给半固体营养糊2 ml,30 min后用10%水合氯醛麻醉后股动脉采血,制备待检标本。随后迅速打开腹腔,结扎幽门和贲门后取出胃,清除胃表面的血渍,第一次称重(胃总重)后剪开胃体,洗去胃内容物,用滤纸吸干水分第二次称重(胃净重),胃排空率按公式计算:胃排空率=(胃总重-胃净重)÷所给糊重×100%
小肠推进率实验〔4〕:结扎幽门和回盲部,分离肠系膜,测量幽门至回盲部的长度作为小肠总长度,从幽门至营养糊黑染的距离作为小肠推进长度。小肠推进率按公式计算:小肠推进率=营养糊推进距离(cm)÷小肠全长(cm)×100%。
1.2.4各组大鼠骨骼肌组织中Na+-K+-ATPase和Ca2+-Mg2+-ATPase活性测定大鼠麻醉采血后迅速断头处死,低温条件下快速取骨骼肌组织,以冰冷的生理盐水冲洗,滤纸吸干,准确称重后置于匀浆器中用9倍生理盐水匀浆(匀浆器的末端置于放冰块的冷水中),制成1%的骨骼肌组织匀浆液,后以3 500 r/min离心10 min,取上清液,同时用考马斯亮蓝法做蛋白定量,其余上清液置4℃冰箱保存备用,Na+-K+-ATPase和Ca2+-Mg2+-ATPase活性测定按照试剂盒操作步骤进行。
1.2.5激光共聚焦检测骨骼肌细胞〔Ca2+〕i浓度将一部分骨骼肌组织快速冷冻后固定于盛有培养液的振荡切片机后固定切片,切片厚度约200 μm,将切片用专用毛刷小心移入培养皿中,用PBS液冲洗骨骼肌组织切片2遍,加入10 μmol/L染料液1 ml,置于37℃的CO2孵箱里避光温育30 min。再将染色后的组织切片用PBS液冲洗三遍,加入1 ml含小牛血清的DMEM培养液后置于20倍光学显微镜观察区域及层面,用激光共聚焦显微镜观察Flou-3AM染色的组织细胞的某一层面的荧光图像;启动激光共聚焦显微镜,选择488 nm氩离子激光采集〔Ca2+〕i荧光图像并连续拍摄图片后进行扫描分析。
1.2.6蛋白免疫印迹检测骨骼肌组织中CaM、CaMKⅡ、p-CaMKⅡ蛋白表达各组分别于造模7 d、12 d及21 d结束后麻醉处死并截取骨骼肌组织。用蛋白提取试剂盒(磷酸化蛋白检测加入磷酸酶抑制剂)提取组织蛋白。BCA试剂盒进行蛋白定量,以20 μg/道上样进行SDS-PAGE电泳,转至PVDF膜后,用5%牛血清白蛋白封闭后分别加入一抗: 4℃摇床过夜,洗涤后加入HRP标记羊抗兔二抗,室温孵育1 h,采用化学发光底物进行化学发光,暗室曝光,显影定影后用Bio-RAD Quantity one图像分析软件进行扫描分析。
1.3统计学方法采用SPSS13.0软件,组间样本均数的比较选用F检验,再用q检验进行两两比较。
2 结果
2.1各组大鼠一般生存情况正常对照组大鼠始终表现为反应灵敏、活动及饮食量正常,被毛浓密柔顺而有光泽,粪便呈棕褐色颗粒状。脾虚模型各组大鼠多数在第5天即开始出现倦卧、被毛稀疏干枯;第7天后出现怠动少食、肛周污秽,甚至动作迟缓;第14天后出现怠动少食、消瘦弓背、肛周污秽,部分动物出现脱肛、动作迟缓,并逐渐出现体重减轻、大便稀软呈橘黄色,而且随着造模时间的延长上述症状表现突出;尤其在脾虚21 d组中,随着造模时间的延长,大鼠生存能力明显下降,表现为怠动少食、消瘦弓背、毛发枯槁疏散、肛周污秽,部分大鼠眯眼蜷缩,反应迟钝,体重增长明显减缓。
2.2脾虚各组大鼠胃残留率和小肠推进率的比较与正常对照组比较,脾虚模型7 d组大鼠胃残留率稍有降低趋势,但组间无统计学差异(P>0.05),脾虚模型14 d、21 d组大鼠胃残留率显著升高(P<0.05,P<0.01) ;脾虚模型7 d、14 d组大鼠小肠推进率显著升高(P<0.05,P<0.01),而脾虚模型21 d组大鼠小肠推进率显著降低,与脾虚7 d组比较有统计学差异(P<0.01),见表1。
表1 脾虚各组大鼠胃残留率和小肠推进率的比较(±s,n=8,%)

表1 脾虚各组大鼠胃残留率和小肠推进率的比较(±s,n=8,%)
与正常对照组比较: 1) P<0.05,2) P<0.01;与脾虚模型7 d组比较: 3) P<0.05,4) P<0.01;下表同
组别 胃残留率 小肠推进率正常对照组脾虚模型7 d组脾虚模型14 d组脾虚模型21 d组41.93±6.50 39.20±4.94 45.70±5.663)51.85±7.472) 4)43.55±5.95 49.98±4.391)52.80±6.782)41.14±2.894)
2.3脾虚各组大鼠骨骼肌组织Na+-K+-ATPase和Ca2+-Mg2+-ATPase活性的比较与正常对照组比较,脾虚模型7 d组大鼠骨骼肌组织Na+-K+-ATPase和Ca2+-Mg2+-ATPase活性有降低趋势,但组间无统计学差异(P>0.05),模型14 d、21 d组大鼠骨骼肌组织Na+-K+-ATPase和Ca2+-Mg2+-ATPase活性下降显著(P<0.01) ;与脾虚模型7 d组比较,模型21 d组大鼠骨骼肌组织Na+-K+-ATPase和Ca2+-Mg2+-ATPase活性降低更为显著(P<0.01,P<0.05)。见表2。
表2 脾虚各组大鼠骨骼肌组织Na+-K+-ATPase和Ca2+-Mg2+-ATPase活性比较(±s,U/mg prot)
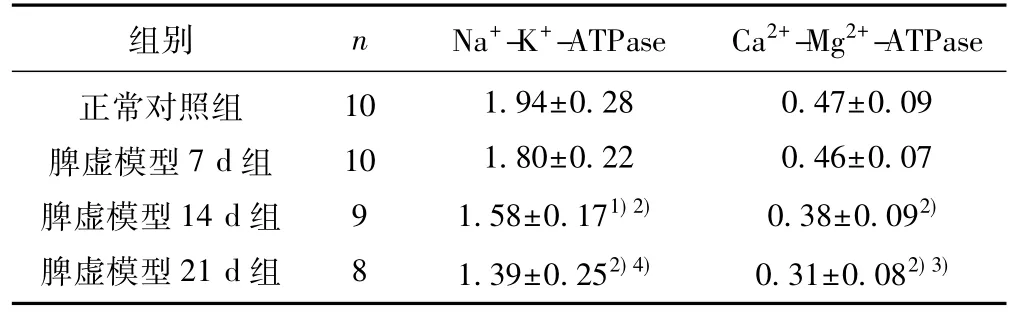
表2 脾虚各组大鼠骨骼肌组织Na+-K+-ATPase和Ca2+-Mg2+-ATPase活性比较(±s,U/mg prot)
组别 n Na+-K+-ATPase Ca2+-Mg2+-ATPase正常对照组脾虚模型7 d组脾虚模型14 d组脾虚模型21 d组10 10 98 1.94±0.28 1.80±0.22 1.58±0.171) 2)1.39±0.252) 4)0.47±0.09 0.46±0.07 0.38±0.092)0.31±0.082) 3)
2.4脾虚各组大鼠骨骼肌〔Ca2+〕i浓度的比较与正常对照组骨骼肌组〔Ca2+〕i荧光值(45.29±3.137)比较,脾虚模型7 d组、14 d大鼠骨骼肌组织〔Ca2+〕i浓度显著降低,但组间差异无统计学意义(44.25±3.318,43.60±2.127,P>0.05),模型21 d组大鼠骨骼肌组织〔Ca2+〕i浓度显著降低(41.70±2.904) (P<0.05),但各组模型间比较无统计学意义(P>0.05),见图1。

图1 脾虚各组大鼠骨骼肌组织〔Ca2+〕i浓度荧光图
2.5脾虚各组大鼠骨骼肌组织CaM、CaMKⅡ和p-CaMKⅡ蛋白表达比较与正常对照组比较,脾虚模型7、14 d组大鼠骨骼肌组织CaM、CaMKⅡ蛋白表达量有降低趋势,但组间无统计学差异(P>0.05),脾虚模型21 d组大鼠骨骼肌组织CaM、CaMKⅡ蛋白表达量显著降低,且与脾虚模型7 d组比较差异显著(P<0.05) ;而脾虚7 d组大鼠骨骼肌组织p-CaMKⅡ蛋白表达量有降低趋势,但组间无统计学差异(P>0.05),脾虚模型14、21 d组大鼠骨骼肌组织p-CaMKⅡ蛋白表达量显著降低,且与脾虚模型7 d组比较差异显著(P<0.01)。见表3,图2。
表3 脾虚各组大鼠骨骼肌组织CaM、CaMKⅡ、p-CaMKⅡ蛋白表达灰度值比较(±s,n=10)
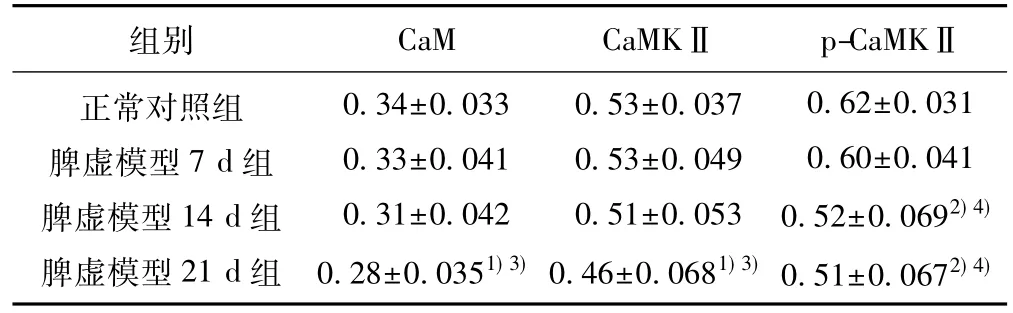
表3 脾虚各组大鼠骨骼肌组织CaM、CaMKⅡ、p-CaMKⅡ蛋白表达灰度值比较(±s,n=10)
组别 CaM CaMKⅡ p-CaMKⅡ正常对照组脾虚模型7 d组脾虚模型14 d组脾虚模型21 d组0.34±0.033 0.33±0.041 0.31±0.042 0.28±0.0351) 3)0.53±0.037 0.53±0.049 0.51±0.053 0.46±0.0681) 3)0.62±0.031 0.60±0.041 0.52±0.0692) 4)0.51±0.0672) 4)

图2 各组大鼠骨骼肌组织CaM、CaMKⅡ、p-CaMKⅡ蛋白免疫印迹表达图
3 讨论
脾气虚证作为中医临床常见的脏腑疾病证候之一,主要以消化道功能障碍或减弱为主的全身性生理功能减弱的综合临床表现。中医认为“脾主运化”,“脾气散精”而将水谷精微输布全身,内至五脏六腑、外达四肢百骸,充养肌体,故有“脾主身之肌肉”之理论;脾主运化即是现代医学所指胃肠消化吸收功能,若有脾主运化功能失调(即脾虚证)就会使消化吸收过程产生相应的病症,如纳呆少食、嗜卧倦怠、四肢无力、便溏不调等,严重脾虚可导致机体神疲乏力、形体消瘦甚至肌肉萎废不用等症状。本实验建立的脾气虚模型症候群与《实验动物和动物实验技术》〔5〕和《医学实验动物学》〔6〕描述的大鼠生理特点、《实用中医证候动物模型学》〔7〕以及总结近10年医学期刊文献资料建立的脾虚大鼠症状评价标准〔8〕的依据相吻合。同时在本实验中我们观察到,随着造模时间的延长,上述症状表现更加突出,在18 d后大鼠生存能力明显下降。
中医认为“脾主运化,胃主受纳;脾以升为健,胃以降为和”,并以此概念概括脾胃消化吸收及转运功能,所以脾胃升降运动包含着胃肠动力的生理概念;脾胃虚弱,运化无力,胃失和降,升降失常,是脾胃运化功能失常的基本病理特点〔9〕。李志等〔10〕通过临床研究证明脾虚患者胃半排空时间延长;动物实验表明脾虚大鼠存在胃肠转运功能紊乱;廖志航等〔11〕通过研究大黄水煎液所复建的脾虚小鼠模型,结果显示脾虚小鼠小肠墨汁推进率升高,而胃排空实验提示胃排空时间缩短。本研究结果表明,在造模初期,受试大鼠胃肠排空时间缩短,可能与造模药物大黄、枳实、厚朴有效组分兴奋胃肠平滑肌有关;随着造模时间延长,脾虚后期大鼠胃肠排空时间延长,存在胃肠转运功能紊乱,而在造模过程中出现小肠排空功能先兴奋后抑制的动态变化,可能与小肠消化间期移行性肌电复合波(MMC)、移行性运动复合波(MMC)以及慢波频率和快波频率紊乱有关。
同时基于脾虚证的发生涉及消化、内分泌、免疫、中枢神经、运动系统等诸多系统功能紊乱的共识〔12〕,而这些系统生理功能的紊乱必然导致某些具体器官生理功能紊乱。故本研究选取反映组织器官基本生理功能的代谢相关酶Ca2+-Mg2+-ATPase、Na+-K+-ATPase活性作为评判脾虚大鼠骨骼肌基本生理功能是否有变化。Ca2+-ATP酶(Ca2+-ATPase)亦称钙泵,是衡量细胞线粒体功能和能量代谢水平的一个重要的指标〔13〕。由于其活性依赖于ATP与Mg2+的结合,所以又称为Ca2+-Mg2+-ATPase,此酶能够催化质膜内侧的ATP水解,释放出能量,其活性降低可引起细胞离子跨膜转运障碍及胞质内Ca2+稳态失衡,导致细胞的形态结构和生理功能异常〔14〕。位于细胞膜上的Na+-K+-ATPase又称钠泵,与ATP分解和细胞内外钠、钾离子的转运密切相关,对维持细胞能量代谢和生理功能具有重要作用〔15〕,如曾益宏等〔16〕研究发现脾虚大鼠骨骼肌细胞膜Na+-K+-ATPase和Ca2+-Mg2+-ATPase的活性均显著降低。本实验条件下的研究结果表明,脾虚大鼠骨骼肌组织有关能量代谢相关酶的活性降低。
在Ca2+/CaM细胞信号通路中,CaM作为细胞内Ca2+受体可与Ca2+可逆性结合,进一步可激活下游Ca2+-CaM依赖的蛋白激酶-CaMKⅡ而发挥生物学作用,而且CaM牵连许多细胞内生理过程,包括调节骨骼肌、平滑肌的收缩和舒张〔17,18〕。在本实验条件下的研究结果表明脾虚模型大鼠骨骼肌组织〔Ca2+〕i浓度显著降低,CaM、CaMKⅡ和p-CaMKⅡ蛋白表达量亦降低,其发生机制可能与在脾虚造模过程中,多因素造模法导致大鼠摄食量减少,物质代谢降低以及便次增多(脾虚腹泻),血钙浓度下降,从而使组织细胞内〔Ca2+〕i浓度下降,并影响下游关键分子CaM、CaMKⅡ的表达以及p-CaMKⅡ的活化,故提示脾气虚大鼠骨骼肌组织Ca2+/CaM信号通路关键分子CaM、CaMKⅡ和p-CaMKⅡ蛋白以低表达为主,其中的深层次机制值得进一步研究。
4 参考文献
1陈小野,邹世洁,张智.大鼠长期脾虚造模的实验研究〔J〕.中国中医基础医学杂志,1995; 1(1) : 37-41.
2钱泽南,钱会南.脾虚大鼠脑内TGF-β1、TNF-α的变化以及益气扶正中药干预研究〔J〕.辽宁中医杂志,2012; 39(10) : 2078-9.
3陈奇.中药药理研究方法〔M〕.北京:人民卫生出版社,1993: 332-5.
4叶仁群,张光奇.二金汤镇痛作用和对胃肠运动功能影响的实验研究〔J〕.中南药学,2004; 2(1) : 39-40.
5苗明三.实验动物和动物实验技术〔M〕.北京:中国中医药出版社,1997: 15-9.
6方喜业.医学实验动物学〔M〕.北京:人民卫生出版社,1995: 20-2.
7陈小野.实用中医证候动物模型学〔M〕.北京:中国协和医科大学联合出版社,1993: 30-3.
8尚冰,丛培玮,王蕊芳,等.对脾虚大鼠模型建立模糊数学评价体系的研究〔J〕.辽宁中医药大学学报,2013; 15(3) : 64-6.
9吴敬中.胃动力障碍中虚证辨证施治〔J〕.中国中西医脾胃杂志,1999; 7(1) : 35-6.
10李志,肖国辉,徐州,等.香砂六君颗粒对脾虚患者及大鼠胃肠运动的调节作用〔J〕.世界华人消化杂志,2009; 17(5) : 512-5.
11廖志航,郑凯,李春林,等.胃康颗粒对实验性脾虚动物胃肠功能的作用〔J〕.成都中医药大学学报,2004; 27(3) : 44-6.
12马捷,李峰,宋月晗,等.脾虚证现代研究与思考〔J〕.辽宁中医药大学学报,2012; 14(11) : 41-3.
13卡尔森,张增明.生物化学精华〔M〕.上海:上海科学普及出版社,1989: 88-9.
14姚泰.生理学〔M〕.第6版.北京:人民卫生出版社,2001: 1-5.
15陈敏敏,李娟,欧阳建.Na+-K+-ATP酶α亚基表达改变对细胞生长的影响〔J〕.医学综述,2012; 18(5) : 641-3.
16曾益宏,刘友章,徐升.益气健脾法对脾虚证大鼠模型骨骼肌线粒体ATPase活性的影响〔J〕.长春中医药大学学报,2009; 25(2) : 171-2.
17Corcoran EE,Means AR.Defining Ca2+/calmodulin-dependent protein kinase cascades in transcriptional regulation〔J〕.J Biol Chem,2001; 276 (4) : 2975-8.
18Soderling TR,Chang B,Brickey D.Cellular signaling through multifunctional Ca2+/calmodulin-dependent protein kinase〔J〕.Biol Chem,2001; 276(5) : 3719-22.
〔2015-02-15修回〕
(编辑李相军)
基金项目:国家自然科学基金项目(81160420) ;甘肃省自然科学基金项目(1010RJZA148) ;甘肃省教育厅基金项目(1006-05)
〔中图分类号〕R285.5
〔文献标识码〕A
〔文章编号〕1005-9202(2015) 15-4127-04;
doi:10.3969/j.issn.1005-9202.2015.15.008

