还原型谷胱甘肽对早期糖尿病患者尿白蛋白排泄率及炎性因子的影响
王绥标
(屯昌县人民医院大内科,海南 屯昌 571600)
还原型谷胱甘肽对早期糖尿病患者尿白蛋白排泄率及炎性因子的影响
王绥标
(屯昌县人民医院大内科,海南 屯昌 571600)
摘要:目的分析还原型谷胱甘肽对早期糖尿病患者尿白蛋白排泄率及炎性因子的影响。方法选择2012年9月至2013年7月屯昌县人民医院收治的早期糖尿病肾病患者76例,采用随机数字表法分为观察组与对照组,各38例。观察组给予1.2 g还原型谷胱甘肽静脉滴注,每日1次,连续治疗28 d;对照组给予1.2 g血塞通针静脉滴注,每日1次,连续治疗28 d。同期选取38例健康体检者作为正常对照组,未给予治疗措施。对比分析治疗前及治疗28 d后3组受试者血清白细胞介素6(IL-6)、肿瘤坏死因子α(TNF-α)、C反应蛋白(CRP)水平,以及早期糖尿病肾病患者的尿白蛋白排泄率(UAER)。结果治疗前,观察组与对照组患者的血清IL-6、TNF-α及CRP水平均显著高于正常对照组(P<0.01)。治疗28 d后,观察组血清 IL-6、TNF-α及CRP水平显著下降(P<0.01)。观察组治疗前后UAER水平分别为(160±28) mg和(106±24) mg,治疗前后比较差异有统计学意义(P<0.01)。结论还原型谷胱甘肽能减轻早期糖尿病肾病患者的炎症状态,延缓糖尿病肾病的进展。
关键词:早期糖尿病肾病;还原型谷胱甘肽;尿白蛋白排泄率;炎性因子
糖尿病肾病属于糖尿病患者的常见并发症,约有30%的糖尿病患者最终出现糖尿病肾病。在糖尿病肾病早期降低微量蛋白尿与尿蛋白排除率可延缓糖尿病肾病的进展。近年来,大量文献报道,炎症在糖尿病及其血管并发症中发挥关键作用,这些炎性因子包括白细胞介素6 (interleukin 6,IL-6)、肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)、C反应蛋白(C reactive protein,CRP)、抵抗素及瘦素等[1-2]。本研究主要探讨还原型谷胱甘肽对糖尿病肾病患者微量蛋白尿及炎性因子的影响,现报道如下。
1资料与方法
1.1一般资料选择2012年9月至2013年7月屯昌县人民医院收治的早期糖尿病肾病患者76例,均符合1999年世界卫生组织制订的关于糖尿病的临床诊断标准,患者的尿白蛋白排泄率(urinary albumin excretion rate,UAER)为30~300 mg[3]。全部患者纳入研究前未见发热,且肝、肾功能无异常,均无泌尿系感染史;纳入研究前30 d均无感染病史,无各种急性、应激性疾病史,无风湿、类风湿关节炎病史,无他汀类降脂药、各种镇痛剂、类固醇、血管紧张素Ⅱ受体拮抗剂、血管紧张素转换酶抑制剂以及各类中药等服用史。将上述患者采用随机数字表法分为两组:观察组38例,男18例、女20例;年龄35~59岁,平均(47±5)岁;病程4~16年,平均(7.3±2.3)年。对照组38例,男17例、女21例,年龄34~61岁,平均(48±8)岁;病程3~16年,平均(7.4±2.6)年。选取同期38例健康体检者作为正常对照组,其中男20例、女18例,年龄32~59岁,平均(42±5)岁。3组受试者的性别、年龄等一般资料的差异无统计学意义(P>0.05),具有可比性。
1.2方法患者均给予糖尿病低钠、低蛋白饮食[<0.8 g/(kg·d)],在合理活动的前提下给予注射胰岛素等治疗措施,控制患者的空腹血糖≤7.0 mmol/L, 餐后2 h血糖≤10.0 mmol/L,血压<130/80 mmHg (1 mmHg=0.133 kPa)。观察组给予1.2 g还原型谷胱甘肽(重庆药友制药有限责任公司生产,批号:H19991067)静脉滴注,每日1次,连续治疗28 d。对照组1.2 g 血塞通针(云南白药集团股份有限公司生产,批号:Z53021499)静脉滴注,每日1次,连续治疗28 d。两组所用溶剂均为0.9%氯化钠注射液500 mL。
1.3检测指标采集两组患者在治疗前及治疗后的空腹血,在低温下通过离心法分离血清,应用IL-6、TNF-α、CRP检测试剂盒(上海森雄科技实业有限公司),通过酶联免疫吸附测定法对血清中的 IL-6、TNF-α、CRP水平进行检测;并在治疗前及治疗后留取患者的24 h尿液,应用酶联免疫吸附测定法对UAER进行测定,重复测量3次取平均值。正常对照组在体检当日晨起及28 d后分别抽取空腹静脉血,对血清IL-6、TNF-α以及CRP水平进行测定。

2结果
2.13组受检者血清IL-6、TNF-α以及CRP水平比较治疗前,观察组和对照组患者的血清IL-6、TNF-α及CRP水平均显著高于正常对照组(t=10.532,13.611,8.038;t=11.127,14.201,9.432,均P<0.01)。治疗28 d后,观察组血清 IL-6、TNF-α及CRP水平较治疗前显著下降(P<0.01),但观察组IL-6、TNF-α及CRP水平仍高于正常对照组(t=4.510,7.219,5.231,均P<0.01)。见表1。
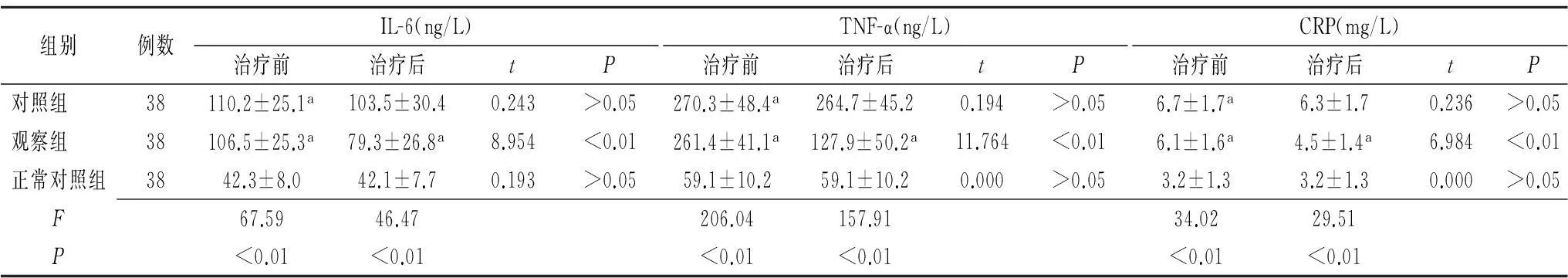
组别例数IL-6(ng/L)治疗前治疗后tPTNF-α(ng/L)治疗前治疗后tPCRP(mg/L)治疗前治疗后tP对照组 38110.2±25.1a103.5±30.40.243>0.05270.3±48.4a264.7±45.20.194>0.056.7±1.7a6.3±1.70.236>0.05观察组 38106.5±25.3a79.3±26.8a8.954<0.01261.4±41.1a127.9±50.2a11.764<0.016.1±1.6a4.5±1.4a6.984<0.01正常对照组3842.3±8.042.1±7.70.193>0.0559.1±10.259.1±10.20.000>0.053.2±1.33.2±1.30.000>0.05F67.5946.47206.04157.9134.0229.51P<0.01<0.01<0.01<0.01<0.01<0.01
IL-6:白细胞介素6;TNF-α:肿瘤坏死因子α;CRP:C反应蛋白;对照组:静脉滴注血塞通针;观察组:静脉滴注还原型谷胱甘肽;正常对照组:健康体检者;a与正常对照组比较,P<0.05
2.2观察组与对照组患者治疗前后 UAER水平对比结果观察组治疗前后UAER水平分别为(160±28)mg和(106±24) mg,比较差异有统计学意义(t=8.659,P<0.01);对照组治疗前后UAER水平分别为(160±34) mg和(159±31) mg,比较差异无统计学意义(t=1.775,P>0.05)。治疗前,两组患者的UAER水平比较差异无统计学意义(t=1.401,P>0.05);治疗28 d后,观察组UAER水平显著低于对照组,差异有统计学意义(t=8.942,P<0.01)。
3讨论
目前糖尿病肾病的确切发病机制尚不明确。糖尿病肾病是引发终末期肾功能衰竭的最主要诱因。文献报道,炎症在糖尿病以及糖尿病肾病的发病过程中起重要作用[4]。2型糖尿病患者血清中的TNF-α、IL-6以及CRP等炎性因子水平明显高于非糖尿病人群,因此认为糖尿病肾病是一类由机体代谢紊乱所致的炎症性疾病。Kang等[5]研究显示,代谢综合征患者血清CRP水平显著升高,而且与24 h尿白蛋白水平之间存在一定的相关性。本研究结果显示,早期糖尿病肾病患者的血清IL-6、TNF-α以及CRP水平均显著高于健康对照人群,这与国内外其他研究结果相符[6-7]。
糖尿病肾病的炎症发生过程十分复杂,高糖能激活单核细胞大量表达炎性因子,促进肾系膜细胞大量表达单核细胞趋化因子,单核细胞趋化因子使血液循环中的单核-巨噬细胞聚集在肾脏炎症处,发生活化后产生大量的炎性递质以及各类生长因子;长期处于高血糖状态下会加快非酶促糖基化终末产物的生成,这类产物与肾小球内皮、系膜细胞以及单核-巨噬细胞上的非酶促糖基化终末产物受体相结合,进而诱导TNF-α、单核细胞趋化因子、胰岛素样生长因子、血小板衍化生长因子以及转化生长因子等炎性因子;肾小球系膜细胞中的还原型辅酶Ⅱ氧化酶含量十分丰富,而高血糖可使该氧化酶被激活,进而加快生成活性氧类,最终激活核因子κB及活化蛋白1等转录因子,造成单核细胞趋化因子、转化生长因子与纤溶酶原激活物抑制物等高表达[8]。所以针对糖尿病肾病炎症而言,在采取降糖治疗措施的同时采取抗炎与抗氧化应激是十分必要的。
还原型谷胱甘肽由谷氨酸、半胱氨酸以及甘氨酸所组成,主要分布在心肌、肝脏、肾脏中。还原型谷胱甘肽能避免蛋白分子或酶分子中的巯基发生氧化,并与嗜电子的有毒化合物相结合,防止毒性化合物对核酸及蛋白造成损伤,避免非酶促糖基化终末产物的产生,进而控制多种炎性因子的产生[9]。本研究结果显示,早期糖尿病肾病患者给予还原型谷胱甘肽后,其血清IL-6、TNF-α以及CRP水平均显著下降,证实还原型谷胱甘肽能显著地改善早期糖尿病肾病患者的微炎症状态。
微量清蛋白尿能反映出糖尿病患者存在一定程度的内皮功能紊乱以及血管损伤。有研究已证实,炎症及氧化应激在糖尿病大血管及微血管并发症发生过程中发挥重要作用[10]。高血糖介导的超氧化物大量产生可能是激活多元醇途径、蛋白激酶 C的激活及己糖胺途径的关键环节,而炎症对糖尿病肾病进展是必需的,研究显示,糖尿病肾病患者尿中单核细胞趋化因子水平与UAER以及肾小球及间质损伤呈正相关[11]。本研究结果显示,早期糖尿病肾病患者给予还原型谷胱甘肽治疗后,其UAER水平显著下降,表明还原型谷胱甘肽能降低UAER,有效改善微炎症状态,进一步减轻血管内皮损伤,最终延缓糖尿病肾病的进展。
总之,在早期糖尿病肾病发生、发展过程中,炎症与氧化应激发挥关键的作用。在采取降糖治疗措施的前提下,还原型谷胱甘肽能降低炎症反应与氧化应激,有效改善血管内皮功能。
参考文献
[1]Holmquist P,Liuba P.Urine α-Glutathione S-transferase, systemic inflammation and arterial function in juvenile type 1 diabetes[J].J Diabetes Complications,2012,26(3):199-204.
[2]Mahmoudabadi MM,Rahbar AR.Effect of EPA and vitamin C on superoxide dismutase,glutathione peroxidase,total antioxidant capacity and malondialdehyde in type 2 diabetic patients[J].Oman Med J,2014,29(1):39-45.
[3]Kim DJ,Xun P,Liu K,etal.Magnesium intake in relation to systemic inflammation,insulin resistance,and the incidence of diabetes[J].Diabetes Care,2010,33(12):2604-2610.
[4]Fornoni A,Ijaz A,Tejada T,etal.Role of inflammation in diabetic nephropathy[J].Curr Diabetes Rev,2008,4(1):10-17.
[5]Kang ES,Kim HJ,Ahn CW,etal.Relationship of serum high-sensitivity C reactive protein to metabolic syndrome and microvascular complications in type 2 diabetes[J].Diabetes Res Clin Pract,2005,69:151-159.
[6]Li-Bo Y,Wen-Bo Q,Xiao-Hong L,etal.Intermittent high glucose promotes expression of proinflammatory cytokines in monocytes[J].Inflamm Res,2011,60(4):367-370.
[7]申兵冰,赵洪雯,干磊,等.还原型谷胱甘肽对维持性血液透析患者氧化应激和微炎症状态的影响[J].第三军医大学学报,2008,30(2):104-106.
[8]Negrean M.Advanced glycation endproducts(AGE) and their role in the pathogenesis of chronic complications of diabetes mellitus[J].J Clin Med,2006, 1(2):59-66.
[9]Silawat N,Gupta VB.Chebulic acid attenuates ischemia reperfusion induced biochemical alteration in diabetic rats[J].Pharm Biol,2013,51(1):23-29.
[10]Sato K,Yama K,Murao Y,etal.palrestat increases intracellular glutathione levels in Schwann cells through transcription regula-tion[J].Redox Biol,2013, 19(2):15-21.
[11]Hakki Kalkan I,Suher M.The relationship between the level of glutathione, impairment of glucose metabolism and complications of diabetes mellitus[J].Pak J Med Sci,2013,29(4):938-942.
Study on the Effect of Reduced Glutathione on Urine Albumin Excretion Rate and Inflammatory Factors in Patients with Early Diabetes
WANGSui-biao.
(DepartmentofInternalMedicine,People′sHospitalofTunchangCounty,Tunchang571600,China)
Abstract:ObjectiveTo analyze the effects of reduced glutathione on urine albumin excretion rate and inflammatory factors in patients with early diabetes.MethodsA total of 76 patients with early diabetic nephropathy admitted in Tunchang County People′s Hospital from Sep.2012 to Jul.2013 were randomly divided into observation group and control group,with 38 cases in each group.Patients in the observation group were given intravenous infusion of 1.2 g glutathione,once per day,continuous treatment for 28 d,while patients in the control group received intravenous injection of 1.2 g Xuesaitong,once per day,continuous treatment for 28 d.Meanwhile,another 38 healthy people underwent physical examination during the same period were selected as normal control group.The serum levels of interleukin 6(IL-6),tumor necrosis factor alpha(TNF-α),C reactive protein(CRP) of the three groups before treatment and 28 days after treatment,and urinary albumin excretion rate(UAER)in those patients with early diabetic nephropathy before treatment and 28 d after treatment were comparatively analyzed.ResultsBefore treatment,serum levels of IL-6,TNF-α and CRP in the observation group and the control group were significantly higher than those in normal control group (P<0.01),and 28 d after treatment,such levels of the observation group decreased significantly(P<0.01).Levels of UAER before and after treatment in the observation group were (160±28) mg/and (106±24) mg,the difference was statistically significant(P< 0.01).ConclusionReduced glutathione can alleviate the inflammatory status in patients with early diabetic nephropathy,and effectively slow down the progression of early diabetic nephropathy.
Key words:Early diabetic nephropathy; Reduced glutathione; Urine albumin excretion rate; Inflammatory factor
收稿日期:2014-03-28修回日期:2014-09-15编辑:伊姗
doi:10.3969/j.issn.1006-2084.2015.07.063
中图分类号:R587.2
文献标识码:A
文章编号:1006-2084(2015)07-1310-03

