糖痹康对糖尿病周围神经病变大鼠氧化应激及细胞凋亡的影响
易文明 孙文 郭翔宇 吕翠岩 刘铜华
糖尿病性周围神经病变(diabetic peripheral neuropathy,DPN)是糖尿病经常出现的慢性并发症之一,它很容易造成糖尿病足及截肢,有症状的发病率波动在50% ~70%,甚至更高,由于诊断方法不统一,有的报道发病率可高达90%以上[1-2],基于DPN非常高的发病率和致残率,DPN的预防和治疗已经成为学科内研究的重点领域。目前西药治疗DPN尚缺乏有效手段,而中医药治疗DPN积累了丰富经验,疗效确切,但作用机制亟待阐明。中药复方糖痹康经过了多年的临床应用,疗效较好,目前已获发明专利(专利申请号:200810167551.1)。本实验研究是在既往研究的基础上,选用SPF级SD大鼠,通过高脂饲料喂养后,采用小剂量链脲佐菌素(streptozotocin,STZ)腹腔注射诱发2型糖尿病,构建DPN动物模型[3],紧紧围绕DPN核心发病机制——氧化应激与细胞凋亡,观察与其密切相关的活性氧簇(reactive oxygen species,ROS)、超氧化歧化酶(superoxide dismutase,SOD)、丙二醛(malondialdehyde,MDA)、Caspase-3蛋白酶等与 DPN的关系,探讨糖痹康治疗DPN的作用机理,为临床推广应用提供理论依据,为以改善神经病变为目的的新药研发探索新靶点。
1 材料与方法
1.1 实验动物
60只纯系SPF级SD雄性大鼠,体质量(180±20)g,7周龄,从北京维通利华动物实验中心购买,生产许可证:SCXR(京)2004-0006。
1.2 材料及仪器
糖痹康(黄芪30 g、女贞子15 g、桂枝10 g、赤芍10 g、黄芩 10 g、黄连 10 g、水蛭 6 g,由北京中医药大学中药学院提供);α-硫辛酸购自Puritan’s Pride公司(100 mg×60粒,生产批号:250597-09 EXP 10/17);高脂饲料,购自北京华阜康生物科技有限公司;罗氏活力型血糖仪(购自美国罗氏公司,型号:ACCU-CHEK);丙二醛(MDA)试剂盒(购自南京建成生物工程研究所);超氧化物岐化酶(SOD)试剂盒(购自南京建成生物工程研究所);活性氧簇(ROS)试剂盒(购自南京建成生物工程研究所);VC-10(日本光电)记忆示波器,PowerLab多功能生理信号采样分析系统,SEN-3201电刺激器(购自日本光电);TUNEL试剂盒(购自美国Upstate公司);大鼠Caspase-3试剂盒(购自美国GBD公司);荧光显微镜(购自德国Zeiss公司)等。
1.3 模型建立及分组
大鼠常规饲养1周后,按体质量随机选择10只为正常组,采用普通饲料饲养,其它组大鼠采用高脂饲料喂养,8周后,禁食12小时后准备造模,造模药物链脲霉素用0.1 mmol/L枸橼酸缓冲液(pH 4.4)配成1%的浓度,剂量以35 mg/kg进行腹腔注射,72小时后检测大鼠血糖值(尾部血管取血),血糖≥16.7 mmol/L以上者视为造模成功,按大鼠体重随机分为模型组,α-硫辛酸组,糖痹康低、中、高剂量组,每组10只。
1.4 给药方法
模型复制成功3天后开始大鼠灌胃,剂量为糖痹康低剂量组4.175g/(kg·d),糖痹康中剂量组8.35 g/(kg·d),糖痹康高剂量组 16.7 g/(kg·d),α-硫辛酸组灌服 α-硫辛酸20 mg/(kg·d),每天1次,连续给药16周。实验期间各组大鼠均自由取食、饮水。
1.5 指标检测及方法
1.5.1 体重、血糖检测 灌胃前和灌胃后的第4、8、12、16周末,禁食6小时,大鼠称重及检测血糖。1.5.2 神经电生理 检测大鼠右侧坐骨神经运动神经传导速度(motor nerve conduction velocity,MNCV)。大鼠麻醉后,以俯卧位固定好,开始将刺激针电极放置在跺关节内侧面,其次放置在坐骨切迹处,波宽为0.1 ms,强度为超强刺激,用针电极记录,保持每2个刺激之间的间隔时间在5 s以上,反复测定7~10次,算出平均值。扫描速度保持在2 ms/cm,记录频率3~10000 Hz,放大倍数2 mv/cm。使大鼠后肢以自然状态与后背脊柱成45°夹角,然后向斜后方拉直,顺着坐骨神经方向,测出大鼠体表两个刺激点之间的长度,从而计算出MNCV。
1.5.3 黄嘌呤氧化酶法测定SOD含量 第16周末,用10%水合氯醛以0.4 mg/100 g剂量腹腔注射麻醉大鼠,大鼠固定于鼠板上,先切开双侧后腿中外1/3处皮肤,接着钝性分离出肌肉组织,将坐骨神经充分暴露,旁边肌肉去除,取出尽可能长的坐骨神经,用0.9%的生理盐水冲洗干净,天平称其质量后放入冻存管内,于冰壶内冷冻,最后放入-80℃冰箱保存。采用黄嘌呤氧化酶法测定SOD含量(按照试剂盒提供的操作流程进行)。
1.5.4 硫代巴比妥酸法测MDA含量 16周末,取材方法同上,按照试剂盒提供的操作流程进行。
1.5.5 比色法检测ROS含量 16周末,取材方法同上,按照试剂盒提供的操作流程进行。
1.5.6 酶联免疫吸附法测定坐骨神经caspas-3蛋白表达水平 16周末,取材方法同上,按照试剂盒提供的操作流程进行。
1.5.7 TUNEL法测定细胞凋亡 16周末,取材方法同上,按照试剂盒提供的操作流程进行。
1.6 统计学分析
各组数据用SPSS 19.0统计软件分析进行数据处理,计量资料采用均数±标准差(±s)表示,多组间比较采用单因素方差分析,本实验数据方差齐,两两比较用LSD-t检验分析,P<0.05认为差异有统计学意义。
2 结果
2.1 一般情况
造模72小时后,大鼠表现出多食多尿,体质量下降,精神萎靡,体毛色泽干枯,活动变得迟缓,在14周后还出现了身体溃疡等情况,而在α-硫辛酸组和中药糖痹康高剂量组以上情况出现的较少。
2.2 体质量称量
和正常组相比,从8周开始,模型组大鼠的体质量较前轻度下降(P<0.05);在16周后,模型组大鼠体质量明显下降(P<0.01)。和模型组比较,16周后,糖痹康低、中剂量及α-硫辛酸组体质量明显增加(P<0.01)。见表1。
表1 不同时间点各组DPN大鼠体质量的比较(g,n=10,±s
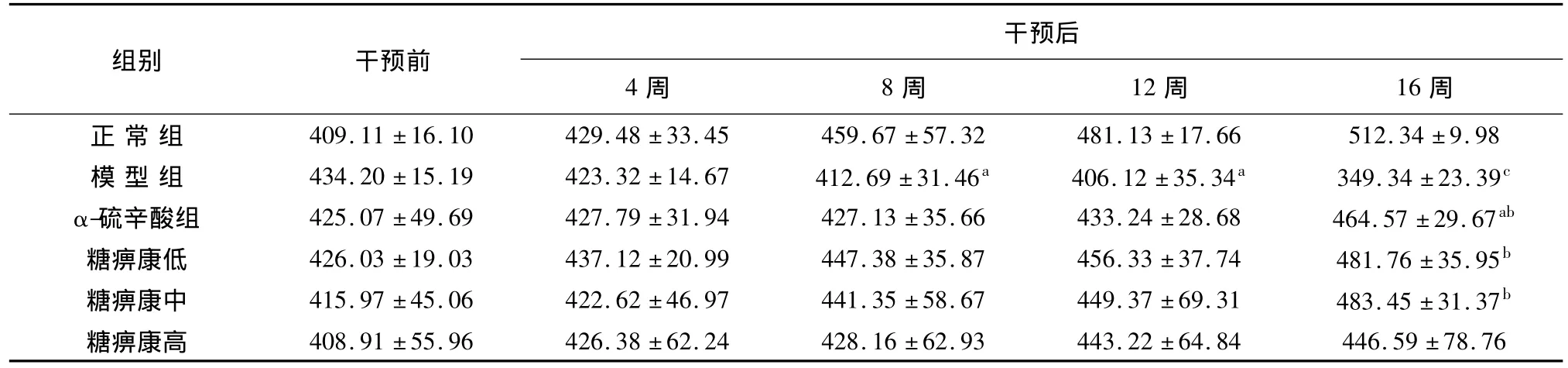
表1 不同时间点各组DPN大鼠体质量的比较(g,n=10,±s
注:与正常组比较,aP <0.05,cP <0.01;与模型组比较,bP <0.01
组别 干预前干预后4周 8周 12周 16周正 常 组 409.11 ±16.10 429.48 ±33.45 459.67 ±57.32 481.22 ±64.84 446.59 ±78.76.13 ±17.66 512.34 ±9.98模 型 组 434.20 ±15.19 423.32 ±14.67 412.69 ±31.46a 406.12 ±35.34a 349.34 ±23.39c α-硫辛酸组 425.07 ±49.69 427.79 ±31.94 427.13 ±35.66 433.24 ±28.68 464.57 ±29.67ab糖痹康低 426.03 ±19.03 437.12 ±20.99 447.38 ±35.87 456.33 ±37.74 481.76 ±35.95b糖痹康中 415.97 ±45.06 422.62 ±46.97 441.35 ±58.67 449.37 ±69.31 483.45 ±31.37b糖痹康高 408.91 ±55.96 426.38 ±62.24 428.16 ±62.93 443
表2 不同时间点各组DPN大鼠血糖的比较(mmol/L,n=10,±s)
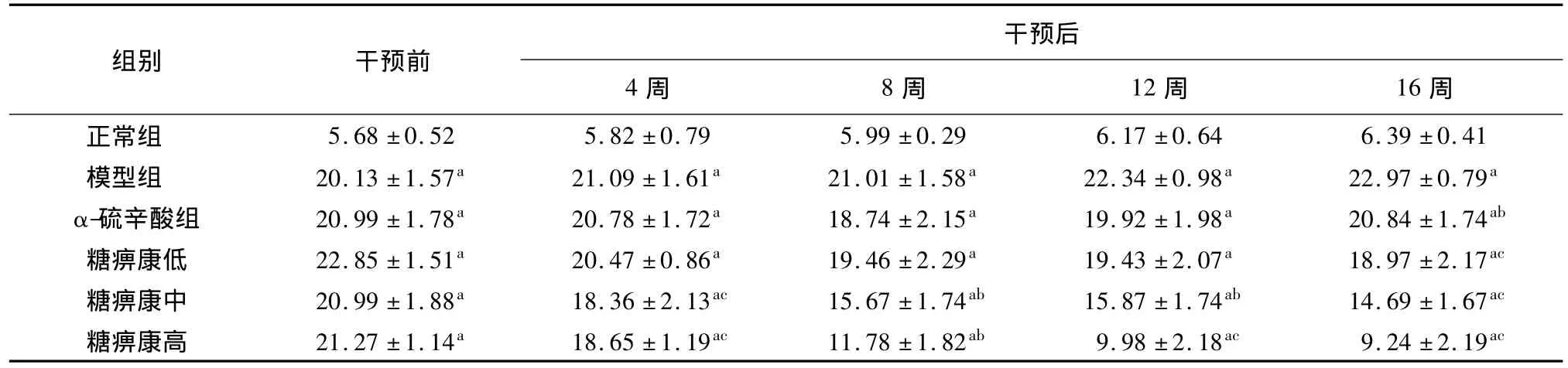
表2 不同时间点各组DPN大鼠血糖的比较(mmol/L,n=10,±s)
注:与正常组比较,aP <0.01;与模型组比较,bP <0.05,cP <0.01
组别 干预前干预后4周 8周 12周 16周39 ±0.41模型组 20.13 ±1.57a 21.09 ±1.61a 21.01 ±1.58a 22.34 ±0.98a 22.97 ±0.79a α-硫辛酸组 20.99 ±1.78a 20.78 ±1.72a 18.74 ±2.15a 19.92 ±1.98a 20.84 ±1.74ab糖痹康低 22.85 ±1.51a 20.47 ±0.86a 19.46 ±2.29a 19.43 ±2.07a 18.97 ±2.17ac糖痹康中 20.99 ±1.88a 18.36 ±2.13ac 15.67 ±1.74ab 15.87 ±1.74ab 14.69 ±1.67ac糖痹康高 21.27 ±1.14a 18.65 ±1.19ac 11.78 ±1.82ab 9.98 ±2.18ac 9.24 ±2.19正常组 5.68 ±0.52 5.82 ±0.79 5.99 ±0.29 6.17 ±0.64 6.ac
表3 各组DPN大鼠坐骨神经传导速度比较(m/s,n=10,±s)
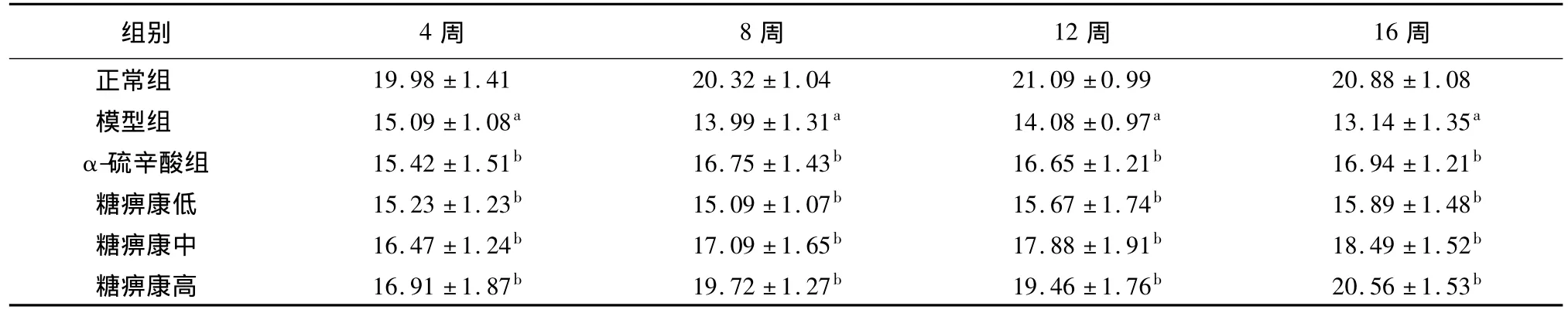
表3 各组DPN大鼠坐骨神经传导速度比较(m/s,n=10,±s)
注:与正常组比较,aP <0.01;与模型组比较,bP <0.05
组别 4周 8周 12周 16周08模型组 15.09 ±1.08a 13.99 ±1.31a 14.08 ±0.97a 13.14 ±1.35a α-硫辛酸组 15.42 ±1.51b 16.75 ±1.43b 16.65 ±1.21b 16.94 ±1.21b糖痹康低 15.23 ±1.23b 15.09 ±1.07b 15.67 ±1.74b 15.89 ±1.48b糖痹康中 16.47 ±1.24b 17.09 ±1.65b 17.88 ±1.91b 18.49 ±1.52b糖痹康高 16.91 ±1.87b 19.72 ±1.27b 19.46 ±1.76b 20.56 ±1.53正常组 19.98 ±1.41 20.32 ±1.04 21.09 ±0.99 20.88 ±1.b
2.3 血糖检测
和正常组比较,模型组大鼠血糖明显升高(P<0.01);和模型组比较,干预以后各组大鼠血糖较前都有所改善,其中α-硫辛酸组(P<0.05)和糖痹康低剂量组(P<0.01)在16周后有明显差异,而糖痹康中、高剂量组在4、8、12、16周都有明显下降(P <0.01)。见表2。
2.4 右侧坐骨神经运动神经传导速度测定
和正常组比较,模型组大鼠坐骨神经传导速度显著减慢;和模型组比较,糖痹康各剂量组及α-硫辛酸组都能提高糖尿病大鼠坐骨神经传导速度(P<0.05),组间比较,糖痹康高剂量组的效果优于α-硫辛酸组(P<0.05),糖痹康各剂量组间相对比,高剂量组改善效果更加显著(P<0.05),提示糖痹康能够提高糖尿病大鼠坐骨神经传导速度。见表3。
2.5 各组大鼠坐骨神经组织 ROS、MDA、SOD含量测定
与正常组比较,各组大鼠坐骨神经ROS、MDA含量显著升高,而SOD含量显著降低(P<0.01),说明糖尿病周围神经病变大鼠存在氧化应激状态,与模型组比较,α-硫辛酸组和糖痹康中、高剂量组ROS、MDA含量明显著减少,SOD含量显著增加(P<0.05),α-硫辛酸组和糖痹康高剂量组相比,ROS、MDA、SOD含量无明显差异,提示糖痹康可能具有抗氧化应激的作用。见表4。
表4 各组DPN大鼠ROS、SOD、MDA浓度(n=10,±s)
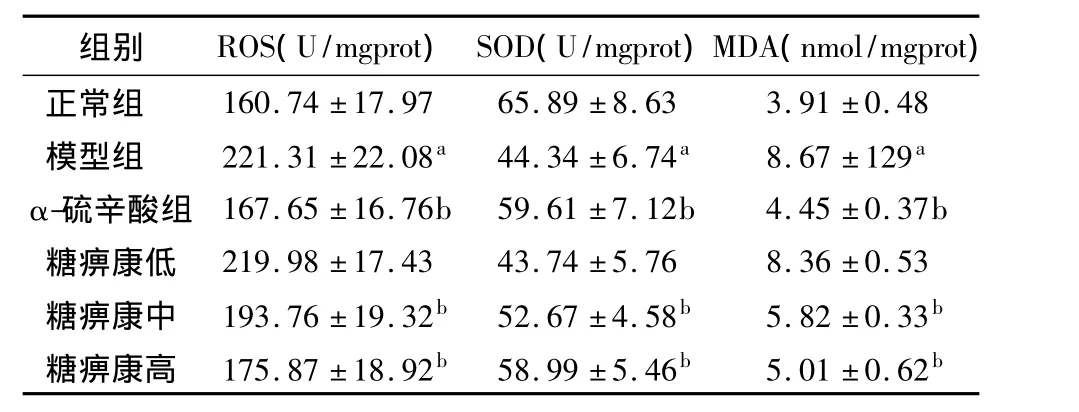
表4 各组DPN大鼠ROS、SOD、MDA浓度(n=10,±s)
注:与正常组比较,aP <0.01;与模型组比较,bP <0.05
组别 ROS(U/mgprot)SOD(U/mgprot)MDA(nmol/mgprot 160.74 ±17.97 65.89 ±8.63 3.91 ±0.48模型组 221.31 ±22.08a 44.34 ±6.74a 8.67 ±129a α-硫辛酸组 167.65 ±16.76b 59.61 ±7.12b 4.45 ±0.37b糖痹康低 219.98 ±17.43 43.74 ±5.76 8.36 ±0.53糖痹康中 193.76 ±19.32b 52.67 ±4.58b 5.82 ±0.33b糖痹康高 175.87 ±18.92b 58.99 ±5.46b 5.01 ±0.62)正常组b
2.6 TUNEL法检测神经细胞凋亡
正常组坐骨神经组织TUNEL检测没有找到阳性细胞,表明正常组坐骨神经神经元未发生凋亡。与模型组相比,α-硫辛酸组和糖痹康高剂量组发现的阳性细胞数减少(P<0.05);糖痹康高剂量组与α-硫辛酸组比较,发现的阳性细胞数略高于α-硫辛酸组(P<0.05),提示糖痹康具有抗神经元凋亡的作用。见表5。
表5 各组DPN大鼠坐骨神经神经元TUNEL阳性细胞数(n=10,±s)
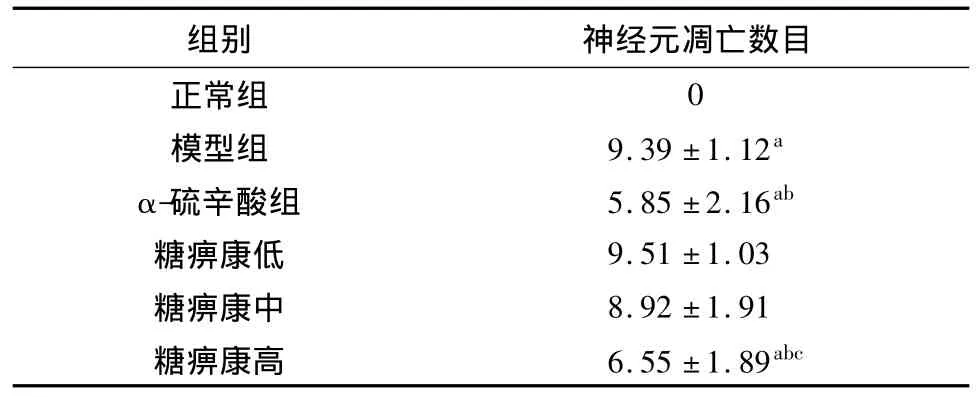
表5 各组DPN大鼠坐骨神经神经元TUNEL阳性细胞数(n=10,±s)
注:与正常组比较,aP<0.01;与模型组比较,bP<0.05;与西药组比较,cP <0.05
组别 神经元凋亡数目正常组0模型组 9.39 ±1.12a α-硫辛酸组 5.85 ±2.16ab糖痹康低 9.51 ±1.03糖痹康中 8.92 ±1.91糖痹康高 6.55 ±1.89abc
2.7 Caspase-3蛋白表达水平测定
模型组、α-硫辛酸组和糖痹康组坐骨神经组织Caspase-3蛋白明显高于正常组(P<0.05);α-硫辛酸组、糖痹康高剂量组大鼠坐骨神经组织Caspase-3蛋白表达显著低于模型组(P<0.05),两组间Caspase-3蛋白表达的差异无统计学意义。提示糖痹康可抑制Caspase-3蛋白的表达,具有抗凋亡的作用。见表6。
表6 各组DPN大鼠坐骨神经Caspase-3蛋白表达水平比较(n=10,±s)
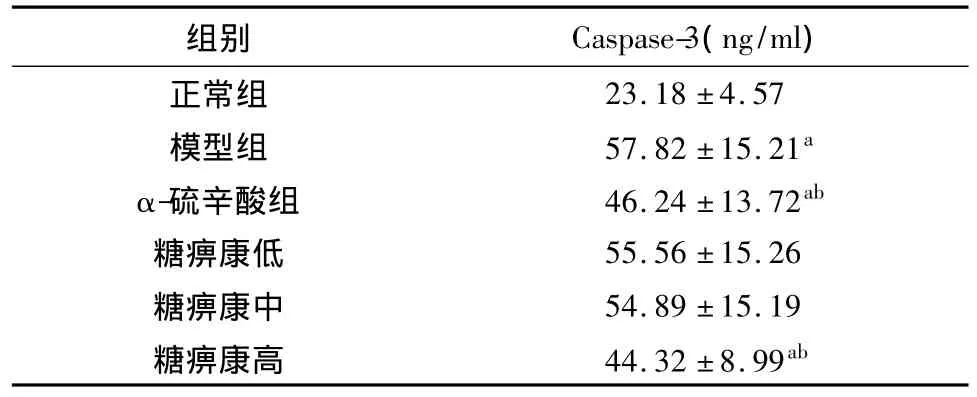
表6 各组DPN大鼠坐骨神经Caspase-3蛋白表达水平比较(n=10,±s)
注:与正常组比较,aP <0.05;与模型组比较,bP <0.05
组别 Caspase-3(ng/ml)23.18 ±4.57模型组 57.82 ±15.21a α-硫辛酸组 46.24 ±13.72ab糖痹康低 55.56 ±15.26糖痹康中 54.89 ±15.19糖痹康高 44.32 ±8.99正常组ab
3 讨论
DPN的发病机制目前还不是十分清楚,不能用单一因素来解释,而应该是多种因素相互作用的结果。其可能发病机制主要包括代谢原因和血管原因,还有多元醇途径、晚期糖基化终末产物(advanced glycation endproducts,AGEs)途径、蛋白激酶C(protein kinase C,PKC)途径、氨基已糖途径、生长因子缺乏、氧化应激、神经营养因子、免疫因素等等。很多研究提示氧化应激在DPN的众多发病机制中占有重要的地位,可能是糖尿病并发症产生的一个核心通路。大鼠链脲佐菌素DM模型的动物实验证明,糖尿病或高血糖状态下可引起背根神经节中 O2-、H2O2及过氧化物增多[4],Brownlee 提出高血糖时体内氧化应激增强,造成线粒体中超氧阴离子产生过多,最终引起包括糖尿病周围神经病变等一系列的慢性并发症[5]。生理情况下,ROS在人体内的代谢很稳定,如果在病理状态下产生了过量的ROS导致人体抗氧化系统不能清除过多的ROS时,就会启动氧化应激反应,造成机体损伤[6],SOD是人体一种重要的酶,它是自由基的清道夫,它能够将O2-转化为H2O2或者O2,通过对SOD含量进行测定,可以初步评价高血糖状态下组织抗氧化能力。MDA是一种自由基影响下多不饱和脂肪酸过氧化物的降解产物,它的含量可以提示机体脂肪过氧化速率和强度及体内的自由基代谢情况,也能够推断机体氧化应激受损程度。Caspase家族被发现与细胞凋亡密切相关,Caspase-3为Caspase家族中的凋亡执行因子,被认为是细胞凋亡过程中的关键酶之一[7-8],Caspase-3 可直接导致细胞凋亡[9]。课题组认为氧化应激引起的细胞凋亡在促进DPN的进展。
课题组前期细胞及动物实验[10-11]证明,糖痹康有缓解氧化应激的作用,阻止和延缓了DPN的病变发展进程,本研究进一步证实糖痹康对糖尿病周围神经病变大鼠的氧化应激和细胞凋亡具有对抗作用,糖尿病周围神经病变大鼠坐骨神经中SOD的含量显著下降而MAD、ROS含量明显增高,Caspase-3蛋白表达增加,氧化应激启动后细胞凋亡明显增加,而糖痹康可显著上调糖尿病周围神经病变大鼠SOD水平和下调MAD、ROS水平,可抑制Caspase-3蛋白的表达,具有抗氧化应激和细胞凋亡的作用。因此笔者认为,糖痹康具有的抗氧化应激及细胞凋亡能力可能是其对糖尿病性周围神经病变的神经保护作用的主要机制之一。
[1]钟历勇.糖尿病神经病变诊疗原则[J].中国疼痛医学杂志,2006,12(4):196.
[2]Andrew JM.Boulton,Arthur I.Vinik,Joseph C.Arezzo,et al.Diabetic Neuropathies:A statement by the American Diabetes Association[J].Diabetes Care,2005,28(4):956-962.
[3]吴晏,韩静,黄黎明,等.高脂喂养合并小剂量链脲佐菌素建立2型糖尿病大鼠模型[J].中国实验动物学报,2012,20(2):11-15.
[4]Hoeldtke RD,Bryner KD,Mcneill DR,et al.Nitrosative stress,uric acid,and peripheral nerve function in early type 1 diabetes[J].Diabetes,2006,55(9):2664.
[5]Brownlee M.The pathobiology of diabetic complications:a unifying mechanism[J].Diabetes,2005,54(6):1615-1625.
[6]赵云罡,徐建兴.线粒体,活性氧和细胞凋亡[J].生物化学与生物物理进展,2001:28(2):168-171.
[7]Rink A,Fung KM,Trojanowski JQ,et a1.Evidence of apoptotic cell death after experimental traumatic brain injury in the rat[J].Am J Pathol,1995,147:1575-1583.
[8]Colicos MA,Dash PIL,Trojianowski JQ,et al.Apoptosis morphology of dentate gyms granule cells following experimental cortical impact injury in the rats:possible role in spatial memory deficits[J].Brain Res,1996,739:120-131.
[9]Conti AC,Raghupathi 1L et al.Experimental brain injury induces regionally distinct apoptosis during the acute and delayed posttraumatic period[J].J Neurosci,1998,1 8:5663-5672.
[10]张宏,刘铜华.糖痹康对高糖损伤人脐静脉内皮细胞的保护作用[J].中华中医药学刊,2012,30(6):1248-1251.
[11]刘凤琪,许利平,郭晶晶,等.从抗氧化水平评价糖痹康对糖尿病周围神经病变大鼠的保护作用[J].国际中医中药杂志,2013,35(5):406-409.
(本文编辑:韩虹娟)

