人血小板裂解液促进人羊膜来源间充质干细胞的成骨分化
董 晶 聂李平 周 宇
人血小板裂解液促进人羊膜来源间充质干细胞的成骨分化
董 晶 聂李平 周 宇
目的:研究人血小板裂解液(HPL)对羊膜来源间充质干细胞(AMMSCs)成骨分化的作用。方法:分别以含7% HPL(HPL组)和10%胎牛血清(FBS,FBS组)的LG-DMEM培养介质扩增AMMSCs,比较两组扩增AMMSCs效率及其免疫表型SSEA-3和SSEA-4的表达差异。使用MSCs成骨分化培养液诱导AMMSCs成骨,对比观察两组钙盐沉积量、钙化结节、碱性磷酸酶(ALP)活性;提取两组成骨诱导后AMMSCs总RNA,采用RT-PCR检测成骨分化调节因子RUNX-2和ALP mRNA相对表达量。结果:HPL组扩增速度快于FBS组;AMMSCs的 SSEA-3和SSEA-4表达较FBS组明显下调(P<0.05)。HPL组钙盐沉积量、钙化结节数量、ALP活性以及RUNX-2和ALP mRNA表达量均明显高于FBS组(P均<0.05)。结论:含HPL培养介质可促进AMMSCs成骨分化。
人血小板裂解液;间充质干细胞;羊膜来源;成骨分化
研究表明,羊膜来源间充质干细胞(Amniotic Membrane-derived Mesenchymal Stem Cells, AMMSCs)的免疫表型与骨髓来源间充质干细胞(Bone Marrow-derived Mesenchymal Stem Cells, BMMSCs)相似,具有多向分化能力,并且比BMMSCs有更强的扩增能力[1,2]。羊膜来源广泛,受社会伦理学限制少,是MSCs来源的重要研究目标。血小板富含的各种生长因子能促进MSCs增殖,加速种植体周围骨再生和修补骨缺损[3]。本实验观察含人血小板裂解液(Human Platelet Lysate, HPL)培养液扩增AMMSCs并诱导其成骨分化,探讨HPL对AMMSCs成骨分化的影响,分析该方式的优势,为利用AMMSCs进行骨缺损治疗提供依据。
1 材料与方法
1.1 主要试剂和仪器
流式细胞仪(XL-4,Beckman,美国),全自动生化仪(AU-5400,Olympus,日本),基因扩增仪(ABI-7500,Gene,美国),胎牛血清(FBS,Gibco,美国,635742),LG-DMEM (Hyclone,美国,NXH0681),0.25% Trypsin (Hyclone,美国,NWD0400)。碱性磷酸酶(ALP)活性检测试剂盒(Beckman,美国,AUZ1780),Ca2+浓度检测试剂盒(Beckman,美国,AUX2129),细胞裂解液Triton X-100 (Roche,瑞士) ,胚胎干细胞标志物鼠抗人单克隆抗体SSEA-4-PE、 SSEA-3-Alexa Fluor 488及同型对照均为美国BioLegend公司产品,MSCs成骨分化诱导培养液、茜素红S均购自美国Cyagen公司。
1.2 AMMSCs的分离、扩增和成骨诱导分化
1.2.1 细胞培养液的制备及AMMSCs分离与扩增: 参照作者前期方法[2],制备含FBS或HPL的细胞培养液,根据文献[1]通过两步酶消化法分离人羊膜组织收获AMMSCs,将AMMSCs分别加入含FBS(FBS组)或HPL(HPL组)细胞培养液中并接种于培养皿,在37℃、5% CO2培养箱中培养,每3天换液1次。当细胞生长至80%-90%融合时,以0.25% Trypsin消化传代。
1.2.2 AMMSCs的成骨诱导分化:当第3代AMMSCs生长至80%-90%融合时,以0.25% Trypsin消化,中和胰酶后150g离心10min,按3 × 103/cm2接种于预先以明胶包被的6孔板,分别加入含FBS或HPL的培养液至2ml。置于37℃,5% CO2培养箱中培养24h后,吸出培养液。再各加入2ml MSCs成骨分化培养液培养。每3天换液一次,共14天。
1.3 AMMSCs的扩增速度和免疫表型鉴定
从原代培养48h开始观察,比较两组培养达到80%-90%融合时所需的时间。待第3代AMMSCs达80%-90%融合时,制成1.0×109/ L的细胞悬液,分别加入荧光标记抗体SSEA-4-PE、SSEA-3-Alexa Fluor 488及其阴性对照单抗,室温反应30min,再用PBS洗涤并重悬细胞。用流式细胞仪检测。
1.4 成骨指标的检测
1.4.1 钙盐沉积量测定:成骨诱导7天、14天后PBS洗涤培养板内细胞层,加入1mol/L HCl 2ml,充分振荡后密封置于4℃冰箱保存过夜,使沉积在胞外的钙基质充分溶解,24h后以1 500g离心10min,用Ca2+试剂盒在自动生化仪上测定上清液中的Ca2+浓度。
1.4.2 钙化结节染色:成骨诱导培养14天后PBS洗涤培养板内细胞层,4%甲醛固定30min,再次使用PBS洗涤细胞2次后,0.1%茜素红S染色3-5min,去离子水冲洗,钙化结节被染成红色。HPL组和FBS组各取3个培养孔,显微镜下每孔随机选3个视野(×100),计数钙结节数量,取9个视野均数进行统计学分析。
1.4.3 ALP活性测定:成骨诱导7天、14天PBS洗涤培养板内细胞层后,每孔加入3ml 细胞裂解液(1%Triton X-100)置于4℃冰箱内保存,12h后吹打使细胞充分破碎,1 500g离心5min,采用全自动生化仪测定上清液中ALP活性。
1.4.4 成骨相关基因RUNX-2及ALP mRNA检测:成骨诱导第7天、14天按常规方法提取AMMSCs总RNA,以1.0%琼脂糖凝胶电泳检测无降解后,取1μg总RNA反转录为cDNA作为模板,采用反转录聚合酶链反应检测RUNX-2 mRNA和ALP mRNA表达,扩增体系及反应条件均参照说明书设定。β-actin为内参,所用引物序列如表1。以目的基因与β-actin mRNA比值表示目的基因表达量。

表1 RT-PCR的引物序列
1.5 统计学处理

2 结 果
2.1 AMMSCs的生长速度和形态
AMMSCs原代培养48h后,可观察到贴壁生长的长梭形成纤维细胞样细胞小克隆形成,HPL组7-10天即可达到80%-90%融合,FBS组则需10-14天。传代后细胞呈涡旋状或平行生长(图1)。
2.2 两组AMMSCs免疫表型阳性率
流式细胞仪检测结果显示,部分AMMSCs表达胚胎干细胞标志SSEA-4和SSEA-3,HPL组AMMSCs的SSEA-4和SSEA-3阳性率显著低于FBS组(t值分别为3.843和4.608,P均<0.05),见图2和表2。
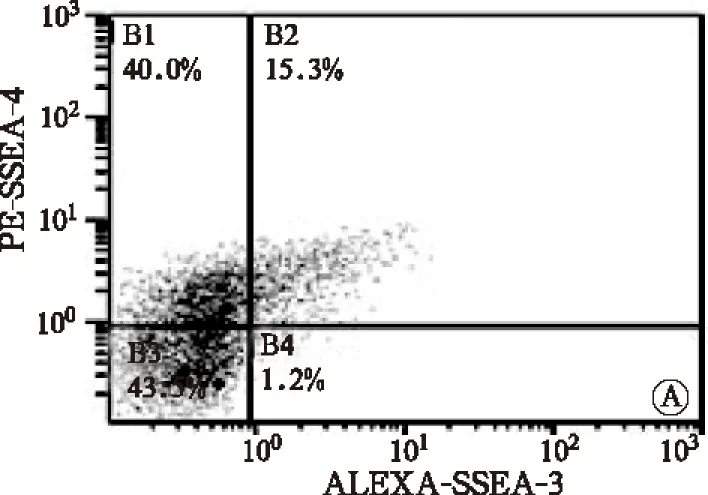
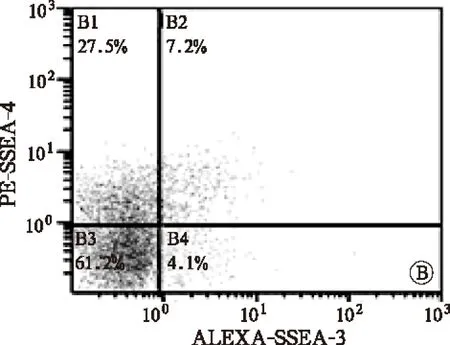
注:A,FBS组;B,HPL组图2 FBS组和HPL组第3代AMMSCs的SSEA-3和SSEA-4表达流式图
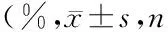
表2 两组AMMSCs的SSEA-3和SSEA-4阳性率均=5)
注:与FBS组比较,1)P<0.05
2.3 两组钙盐沉积量
AMMSCs成骨分化后第7天和第14天,HPL组的Ca2+总量均高于FBS组(表3)。差异有统计学意义(t值分别为9.439和17.750,P均<0.05)。
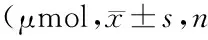
表3 两组Ca2+总量均=5)
注:与FBS组比较,1)P<0.05
2.4 两组钙化结节形成及其数量
HPL组AMMSCs成骨诱导培养2天后,细胞开始变短,外形由长梭形向多边形转变,培养7 天后细胞基质中即有钙沉积,培养14天时形成钙化结节。茜素红S染色显示HPL组钙化结节数量多于FBS组,且大而密集(图3)。计数分析结果表明两组差异有统计学意义( 22.90±6.20 vs 10.80±3.30,t=12.389,P<0.05)。
2.5 两组ALP活性
AMMSCs成骨分化后第7天和第14天,HPL组ALP活性均明显高于FBS组(表4),差异有统计学意义(t值分别为13.035和11.231,P均<0.05)。
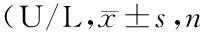
表4 两组ALP活性均=5)
注:与FBS组比较,1)P<0.05
2.6 两组成骨相关基因表达
PCR结果显示,成骨诱导第7天和第14天,HPL组的成骨分化特异性基因RUNX-2 mRNA和ALP mRNA的相对表达量均高于FBS组,差异有统计学意义(图4)。
[本文图1、图3见封3]
3 讨 论
MSCs具有多向分化潜能、低免疫原性和修复作用,这些特点使其在再生医学中有良好利用价值[4,5]。胎盘组织富含干细胞[6],足月羊膜是MSCs的高通量来源[1],对其研究不涉及伦理道德问题。HPL富含促进MSCs增殖的血小板衍生生长因子(Platelet-derived Growth Factor,PDGF)、成纤维细胞生长因子(Fibroblast Growth Factor,bFGF)、转化生长因子-β(Transforming Growth Factor-β,TGF-β)等生长因子[7],成为扩增临床应用规模MSCs最合适的人源化FBS替代品[8], 是目前骨组织工程学领域有关种子细胞的成骨分化能力和体外扩增能力研究的有益尝试。本文研究HPL对AMMSCs的扩增和成骨分化能力,为AMMSCs在临床骨组织工程学上的应用提供实验室依据。
SSEA-3和SSEA-4为胚胎干细胞的标志,在分化后的干细胞中不能被检测到[9]。本文结果中,HPL介质扩增的AMMSCs的SSEA-3和SSEA-4表达阳性率显著低于FBS介质扩增的AMMSCs,说明HPL更能促进AMMSCs的分化,而FBS介质扩增的AMMSCs处于更原始状态。与有关文献[10]认为HPL富含的TGF-β、PDGF能促进MSCs生长,同时也能诱导MSCs分化的结论一致。而且HPL中所含bFGF这一能支持未分化人胚胎干细胞生长的物质含量相对很低[11],故而不会影响HPL对MSCs的分化[6-8]。
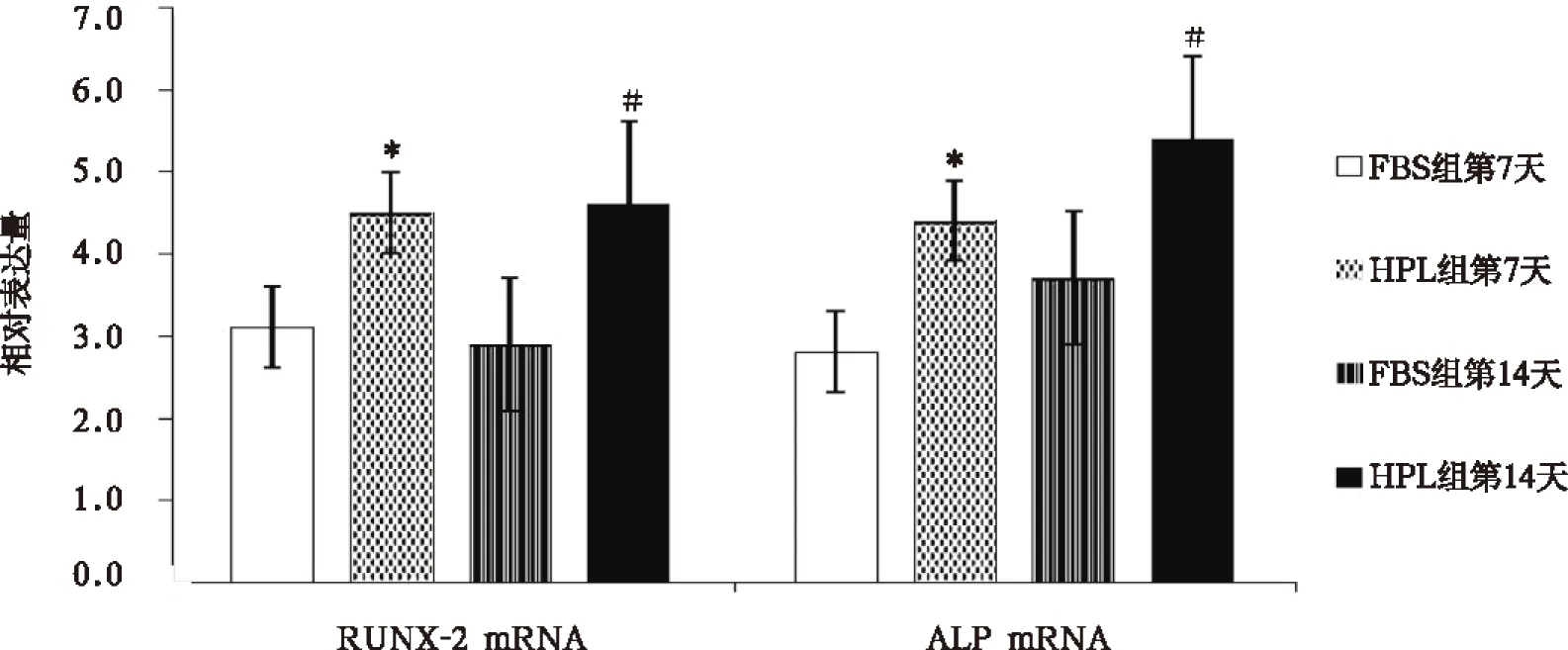
注:与FBS组第7天比较,*P<0.05;与FBS组第14天比较,#P<0.05图4 两组成骨相关基因RUNX-2 mRNA和ALP mRNA相对表达量(n均=6)
ALP能使磷酸根离子浓度增加而启动细胞钙化,尤其在钙盐沉积中起关键作用,其活性升高是成骨分化的特异性标志之一。本实验成骨分化第7天和第14天,HPL组ALP活性和Ca2+总量较FBS组均明显增高,PCR结果提示HPL组ALP mRNA明显增多,表明HPL组的AMMSCs成骨分化程度较高。钙盐是骨骼的重要组成部分,茜素红S染色显示HPL组的钙化结节较FBS组数量多且大而密集,进一步说明HPL能促进成骨过程中钙盐的沉积。
成骨分化过程经多能干细胞定向分化为前成骨细胞、幼稚的成骨细胞直至成熟的成骨细胞。RUNX-2是成骨分化过程的重要监控因子,从成骨分化的启动阶段即开始参与成骨分化的调控,通过上调I型胶原蛋白、骨桥蛋白、骨分泌蛋白和骨钙蛋白等多种骨基质蛋白基因,引导多能干细胞向非成熟成骨细胞分化,对骨组织的形成起着重要作用[12]。本文结果表明,HPL组AMMSCs的RUNX-2 mRNA表达水平明显高于FBS组,亦即HPL培养介质能更好促进AMMSCs的成骨分化。与HPL能增强BMMSCs成骨分化基因、ALP表达、矿物质沉积、增强体外成骨分化和体内异位骨形成的研究报道相符合[13,14],也与医学上应用富血小板血浆促进骨折愈合的临床实践相符合。
综上所述,含HPL的培养介质能快速扩增AMMSCs,并能促进AMMSCs成骨分化,为骨组织工程研究及临床上促进骨折愈合提供了一种新的AMMSCs扩增体系。
◀
本文第一作者简介:
董 晶(1981-),男,汉族,硕士,主管技师
1 Alviano F, Fossati V, Marchionni C, et al. Term amniotic membrane is a high throughput source for multipotent mesenchymal stem cells with the ability to differentiate into endothelial cells in vitro[J]. BMC Dev Biol, 2007, 7(11): 1-14.
2 董 晶,聂李平,周 宇,等.血小板裂解液快速扩增人羊膜来源间充质干细胞[J].微循环学杂志,2012, 22 (4): 13-16.
3 Crespo-Diaz R, Behfar A, Butler GW, et al. Platelet lysate consisting of a natural repair proteome supports human mesenchymal stem cell proliferation and chromosomal stability[J]. Cell Transplant,2011,20(6):797-811.
4 Sensebé L, Krampera M, Schrezenmeier H, et al. Mesenchymal stem cells for clinical application[J]. Vox Sang, 2010, 98(2): 93-107.
5 English K, French A, Wood KJ. Mesenchymal stromal cells: facilitators of successful transplantation[J]. Cell Stem Cell, 2010, 7(4): 431-442.
6 Parolini O, Alviano F, Bagnara GP, et al. Concise review: isolation and characterization of cells from human term placenta: outcome of the first international workshop on placenta derived stem cells[J]. Stem Cells, 2008, 26(2): 300-311.
7 Bernardo ME, Avanzini MA, Perotti C, et al. Optimization of in vitro expansion of human multipotent mesenchymal stromal cells for cell-therapy approaches: further insights in the search for a fetal calf serum substitute[J]. J Cell Physiol, 2007, 211(1): 121-130.
8 Schallmoser K, Bartmann C, Rohde E, et al. Human platelet lysate can replace fetal bovine serum for clinical-scale expansion of functional mesenchymal stromal cells[J]. Transfusion, 2007, 47(8): 1 436-1 446.
9 Takashi M, Hisako M. Glycoconjugate antigens expressed on stem cells and early embryonic cells[J]. Glycoconjugate,2004, 24(1): 41-45.
10 Ng F, Boucher S, Koh S, et al. PDGF, TGF-β, and FGF signaling is important for differentiation and growth of mesenchymal stem cells (MSCs): transcriptional profiling can identify markers and signaling pathways important in differentiation of MSCs into adipogenic, chondrogenic, and osteogenic lineages[J]. Blood, 2008, 112(2): 295-307.
11 Xu C, Rosler E, Jiang J, et al. Basic fibroblast growth factor supports undifferentiated human embryonic stem cell growth without conditioned medium[J]. Stem Cells, 2005, 23(3): 315-323.
12 Igarashi M,Kamiya N,Hasegawa M,et a1.Inductive effects of dexamethasone on the gene expression of Cbfa1,Osterix and bone matrix proteins during differentiation of cultured primary rat osteoblasts[J]. J Mol Histol, 2004, 35(1): 3-10.
13 Chen B, Sun HH, Wang HG, et al. The effects of human platelet lysate on dental pulp stem cells derived from impacted human third molars[J]. Biomaterials, 2012,33(20): 5 023-5 035.
14 Xia W, Li H, Wang Z, et al. Human platelet lysate supports ex vivo expansion and enhances osteogenic differentiation of human bone marrow-derived mesenchymal stem cells[J]. Cell Biol Int, 2011, 35(6): 639-643.
Human Platelet Lysate Enhances Human Amnion-derived Mesenchymal Stem Cells (AMMSCs) Osteogenic Differentiation
DONG Jing,NIE Li-ping,ZHOU Yu
Peking University Shenzhen Hospital,Shenzhen 518036,China
Objective: To investigate the effect of human platelet lysate (HPL) on amnion-derived mesenchymal stem cells (AMMSCs) osteogenic differentiation.Method: AMMSCs were amplified by LG-DMEM medium supplemented with 7% HPL(HPL group) or 10% fetal bovine serum (FBS,FBS group). The surface molecular markers potential SSEA-3 and SSEA-4 were compared. When AMMSCs were used for osteogenic differentiation, ALP activity and calcium deposition were comparatively observed. Total RNA was isolated and the gene expression of RUNX-2 and ALP were investigated by RT-PCR.Results: HPL-containing medium significantly accelerated MSCs proliferation as compared with FBS containing medium. Expressions of embryonic stem cell markers SSEA-3 and SSEA-4 on AMMSCs were promoted down-regulation by HPL-containing medium than that of FBS-containing medium. HPL-containing medium significantly improved ALP activity and calcium deposition, which also enhanced the mRNA level of RUNX-2 and ALP (P<0.05).Conclusion: HPL-containing medium promotes osteogenic differentiation of AMMSCs.
Human platelet lysate; Mesenchymal stem cells; Amnion; Osteogenic differentiation
北京大学深圳医院,深圳 518036
本文2015-01-10收到,2015-03-18修回
Q343.6
A
1005-1740(2015)02-0022-05