观察链脲佐菌素诱导的BALB/c糖尿病小鼠睾丸微循环损害*
张晓艳 刘明明 李炳蔚 刘淑英 李宏伟 修瑞娟
观察链脲佐菌素诱导的BALB/c糖尿病小鼠睾丸微循环损害*
张晓艳 刘明明 李炳蔚 刘淑英 李宏伟 修瑞娟#
目的:观察链脲佐菌素(STZ)诱导的BALB/c糖尿病小鼠睾丸微循环变化。方法:20只BALB/c小鼠,采用完全随机法分为糖尿病组和对照组,每组10只。糖尿病组小鼠连续5天腹腔注射40mg/kg STZ诱导糖尿病模型,对照组注射柠檬酸缓冲液。一周后,应用激光多普勒成像系统(Moor LDLS)检测两组小鼠下腹-外阴部皮肤微循环血流灌注水平;分离腹膜,暴露睾丸,应用激光多普勒血流灌注检测系统(Moor VMS-LDF)检测两组小鼠睾丸微循环血流量及睾丸微血管自律运动。心脏灌流后取两组小鼠睾丸制作组织切片,HE染色观察睾丸微血管形态,免疫组织化学染色两步法观察睾丸微血管内皮细胞抗血小板内皮细胞黏附分子-1(PECAM-1)表达水平。结果:糖尿病组小鼠下腹-外阴部皮肤总血流灌注量低于对照组(P<0.01);睾丸平均血流灌注水平和微血管自律运动频率和振幅均显著低于对照组(P<0.01);糖尿病组小鼠生精上皮受损,成熟生精细胞减少;睾丸间质微血管增多。睾丸间质微血管内皮细胞PECAM-1表达水平低于对照组(P<0.01)。结论:STZ诱导的BALB/c糖尿病小鼠睾丸微循环存在较多损害。
糖尿病小鼠; 睾丸; 微循环
生育能力降低和不育是男性糖尿病患者常见并发症之一[1]。近年研究表明,微循环功能可能参与了糖尿病及其并发症的发病机制[2-4]。睾丸微血管内皮细胞及其维系的睾丸微血管自律运动对睾丸血流灌注至关重要,是睾丸生精功能的结构和功能基础[5]。目前,糖尿病时睾丸微循环功能异常与睾丸生殖功能损害的关系仍未阐明。本研究通过链脲佐菌素(STZ)诱导BALB/c小鼠糖尿病模型,初步观察其睾丸微循环和组织病理学改变,为糖尿病生殖功能损害机制提供相关依据。
1 材料与方法
1.1 实验动物、试剂和仪器
实验动物:SPF级雄性BALB/c小鼠20只,体质量20-25g,购自中国医学科学院实验动物研究所[SCXK(京)2009-0007]。本研究方案经中国医学科学院微循环研究所伦理委员会审核批准。
主要试剂及仪器:STZ冻干粉(S0130,Lot No.18883-66-4,美国Sigma公司,使用时用柠檬酸缓冲液配成悬液)。山羊抗小鼠血小板内皮细胞黏附分子-1抗体(PECAM-1,sc-1506,Lot No.G0113,美国Santa Cruz公司);4%多聚甲醛(P1110,Lot No.20140113,中国索莱宝公司),Polink-2 Plus山羊超敏两步法免疫组化检测试剂盒(PV9003,Lot No.K132415A,中国中杉金桥公司);柠檬酸(10007118,Lot No.20130704)、柠檬酸三钠(10019492,Lot No.20130718)均购自中国国药集团。微量血糖仪及配套血糖试纸(强生稳豪型,Lot No.3623898,美国强生公司);激光多普勒扫描成像系统(Moor LDLS)和激光多普勒血流灌注监测系统(Moor VMS-LDF)均为英国Moor公司产品。
1.2 动物分组处理
BALB/c小鼠饲养于室温22-25℃、空气湿度50%左右、12h明暗交替环境,自由饮水进食。适应性喂养一周后,称取基线体质量,并测定空腹血糖。采用完全随机法分为对照组(n=10)和糖尿病组(n=10)。糖尿病组小鼠造模前禁食6h,连续5天腹腔注射STZ(40mg/kg),一周后,采尾静脉血检测其空腹血糖值,大于16.7mmol/L为成模[6]。对照组连续5天腹腔注射等量柠檬酸缓冲液。
1.3 局部皮肤微循环血流灌注量检测
采用Moor LDLS检测两组小鼠下腹-外阴部皮肤微循环血流灌注水平。1.5%戊巴比妥钠腹腔注射麻醉小鼠后,将其腹部向上固定于扫描台,分别应用单幅、连续重复图像扫描、单线及多通道进行数据采集。扫描分辨率及扫描速度100ms/line,扫描视距12cm。连续重复扫描间隔时间5s,采样显示频率5Hz。扫描宽度64像素,轮廓50像素,单次扫描时间1min,时程3min。设定小鼠下腹-外阴局部皮肤为兴趣区域(ROI),测量其总血流灌注量(PU)。
1.4 睾丸微循环血流灌注水平和微血管自律运动检测
十字切口切开小鼠近会阴部皮肤,分离腹膜,提拉附着于附睾的白色脂肪以暴露小鼠睾丸。应用Moor VMS-LDF(VP4针式探针)检测小鼠睾丸微循环血流量及睾丸微血管自律运动。LDF监测基带带宽15kHz,血流量输出5V=1 000Units,时间常数0.5s。单次扫描时间1min,时程3min。通过Moor VMS PC 2.1软件提取各时相的睾丸血流灌注水平(PU),计算平均灌注量(PU/min),通过单位时间内多普勒血流图波峰或波谷频数计算睾丸微血管自律运动频率(cycles/min),通过单位时间内多普勒血流图波峰与波谷血流灌注单位差值计算睾丸微血管自律运动振幅(△PU)。
1.5 心脏灌流取材
微循环活体测量完成后行心脏灌流取材。小鼠胸部纵形皮肤切开,于左侧肋骨与胸骨交界处开胸,打开心包,暴露心脏;7号钝头空心针经左心室插管至主动脉,动脉夹固定钝头针。剪开右心耳,注入37℃肝素化生理盐水(4 000U/L),起始灌流速度0.015L/min,4min后以0.01L/min再灌5min,至流出液透明无血色为止。分离附睾及脂肪,将睾丸置于4%多聚甲醛固定液中。
1.6 组织切片HE染色
取出固定后睾丸组织进行常规梯度酒精脱水、透明、石蜡包埋,切片(5μm)和HE染色。光镜下观察睾丸生精小管及间质微血管形态结构的改变。
1.7 免疫组织化学染色
采用两步法检测PECAM-1在睾丸微血管内皮细胞中的表达。采用常规方法对石蜡切片进行脱蜡、水化、蒸馏水冲洗后,用3% H2O2孵育10min去除内源性过氧化物酶,3%牛血清白蛋白室温封闭30min,按1∶50加入山羊抗小鼠PECAM-1抗体,4℃过夜,磷酸盐缓冲液(PBS)清洗3次,每次5min;滴加高分子聚合物辅助剂Polymer Helper,室温孵育20min,PBS清洗3次;滴加辣根过氧化物酶标记的抗山羊二抗(poly-HRP anti goat IgG),室温孵育20min,PBS清洗3次;DAB溶液显色,自来水充分冲洗、苏木素复染细胞核;蒸馏水浸泡3min,梯度酒精脱水,二甲苯透明,中性树胶封片后镜检。应用Image J(1.48v)进行PECAM-1表达水平的比较,选择两组小鼠睾丸微血管内皮细胞阳性表达区域(棕色)进行积分光密度(IOD)的定量分析。
1.8 统计学处理

2 结 果
2.1 实验小鼠成模情况
糖尿病组10只小鼠腹腔注射STZ一周后空腹血糖均超过16.7mmol/L(19.80±2.06mmol/L),并表现出多饮、多尿、多食及体重降低等糖尿病典型临床表现,全部成模。对照组小鼠血糖水平未见异常(5.62±0.59mmol/L)。
2.2 两组小鼠下腹-外阴部血流灌注量
与对照组小鼠相比,糖尿病组小鼠下腹-外阴部局部皮肤总血流灌注量明显降低(2 300.08±327.09PU vs 1 308.34±303.70PU,t=7.027,P<0.01)。
2.3 两组小鼠睾丸血流灌注水平及睾丸微血管自律运动
对照组小鼠睾丸血流灌注连续稳定,糖尿病组小鼠失去正常节律。与对照组比较,糖尿病组平均血流灌注量显著降低(466.20±15.00PU/min vs 113.50±18.60PU/min,t=46.670,P<0.01)、睾丸微血管自律运动频率降低(89.30±3.50cycles/min vs 30.70±3.50cycles/min,t=20.460,P<0.01)、自律运动振幅亦降低(364.50±43.10ΔPU vs 69.10 ± 22.80ΔPU,t=10.500,P<0.01)。见图1。
2.4 两组小鼠睾丸组织形态观察
对照组小鼠生精上皮细胞完整,各级生精细胞有序排列,并可见成熟生精细胞及长形精子,睾丸间质可见微血管分布。糖尿病组小鼠睾丸间质疏松,微血管及间质细胞数量增多;生精小管直径缩小,曲细精管内生精上皮受损,表现为生精上皮变薄甚至呈空泡样改变,细胞残体增多,生精细胞退化, 排列紊乱,成熟生精细胞减少。见图2。
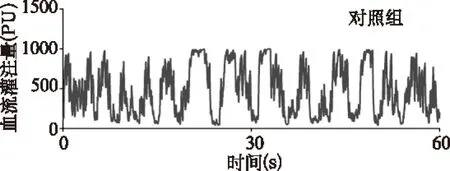
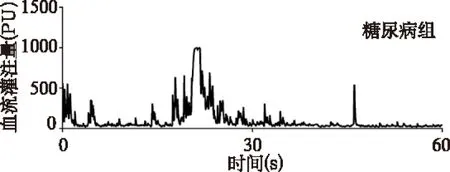
图1 两组小鼠睾丸血流灌注图
2.5 两组小鼠睾丸PECAM-1表达水平
对照组小鼠睾丸间质血管内皮细胞PECAM-1连续完整(IOD=106.60±6.90);糖尿病组小鼠睾丸间质内皮细胞PECAM-1表达缺乏连续性,PECAM-1表达水平(IOD=49.40±6.00)显著低于对照组小鼠(t=12.525,P<0.01)。见图3。
[本文图2、图3见封2]
3 讨 论
随着糖尿病发病年龄的年轻化,糖尿病对生殖功能的影响逐渐受到关注。有文献报道糖尿病初期睾丸细胞抗氧化能力显著下降,能量、物质代谢水平异常[7];糖尿病患者睾丸细胞功能障碍,可能与持续高血糖导致的氧化应激、活性氧生成增多有关[8-10];高血糖可破坏Sertoli细胞/血-睾屏障功能,损伤精子质量和生育能力[11]。睾丸微血管内持续而稳定的血流灌注对维持睾丸细胞正常生精功能及内环境稳定起着极为重要的作用[12]。因此,睾丸微循环损害可能参与了糖尿病时睾丸细胞的病理改变。
机体微血管(包括睾丸微血管)自律运动指微血管自主收缩和舒张,其节律沿微血管管壁呈波浪式传播,从而控制血液呈单向连续流动[13],调节微循环血流灌注量及其再分布[14],是评价机体微循环和睾丸微循环功能状态的重要指标。本研究中糖尿病小鼠睾丸血流灌注水平降低,睾丸微血管自律运动失去正常频率和振幅可能影响睾丸微循环血液灌注的有效分配,以及血液与组织间激素[15]、营养物质的运输和代谢产物的交换,是睾丸细胞生殖功能异常的原因之一。
睾丸微血管内皮细胞是睾丸微循环的结构基础[16],其结构及功能的完整是保证睾丸微血管内血液稳定灌注的必要条件。高糖毒性可能造成睾丸微血管内皮细胞损伤,间接影响精子的发生。本研究证实糖尿病小鼠睾丸生精细胞形态结构异常,成熟生精细胞减少。为探讨原因,笔者检测了对维持微血管内皮细胞完整性至关重要的PECAM-1。结果表明,糖尿病小鼠睾丸微血管内皮细胞PECAM-1表达显著减少,并失去连续性,甚至表达缺失。进一步提示糖尿病造成了睾丸微血管内皮细胞损伤以及睾丸生精功能受损。此外,有文献报道,糖尿病还引起睾丸微动脉管壁增厚,管径变小,从而加重缺氧诱导的睾丸细胞损伤,影响精子产生,造成男性不育[17, 18]。
综上所述,糖尿病时睾丸微血管内皮细胞功能损害及睾丸微循环自律运动异常可能是糖尿病导致睾丸生殖功能受损的机制之一。改善睾丸微循环及睾丸微血管自律运动可能是临床治疗男性糖尿病患者生精功能障碍的新靶点。
◀
本文第一作者简介:
张晓艳(1967-),女,汉族,博士,助理研究员,研究方向为睾丸微循环
1 La Vignera S, Condorelli R, Vicari E, et al. Diabetes mellitus and sperm parameters[J]. J Androl, 2012, 33(2):145-153.
2 Arcidiacono MV, Traveset A, Rubinat E, et al. Microangiopathy of large artery wall:a neglected complication of diabetes mellitus[J]. Atherosclerosis, 2013, 228(1):142-147.
3 Rai A, Riemann M, Gustafsson F, et al. Streptozotocin-induced diabetes decreases conducted vasoconstrictor response in mouse cremaster arterioles[J]. Horm Metab Res, 2008, 40(9):651-654.
4 刘明明,张晓艳,李炳蔚,等. 糖尿病小鼠皮肤与胰腺微循环功能受损[J]. 基础医学与临床, 2014, 34(12):1 674-1 681.
5 Boybeyi O, Yazici I, Unlu G, et al. Intravital microscopic evaluation of cremasteric microcirculation in experimental testicular torsion[J]. Journal of Pediatric Urology, 2013, 9(6):940-944.
6 Moriya J, Wu X, Zavala-Solorio J, et al. Platelet-derived growth factor C promotes revascularization in ischemic limbs of diabetic mice[J]. J Vasc Surg, 2014, 59(5):1 402-1 409.
7 Rato L, Duarte AI, Tomas GD, et al. Pre-diabetes alters testicular PGC1-alpha/SIRT3 axis modulating mitochondrial bioenergetics and oxidative stress[J]. Biochim Biophys Acta, 2014, 1 837(3):335-344.
8 Mulholland J, Mallidis C, Agbaje I, et al. Male diabetes mellitus and assisted reproduction treatment outcome[J]. Reprod Biomed Online, 2011, 22(2):215-219.
9 Ge ZJ, Liang QX, Hou Y, et al. Maternal obesity and diabetes may cause DNA methylation alteration in the spermatozoa of offspring in mice[J]. Reprod Biol Endocrinol, 2014, 12(1):29-36.
10 Amaral S, Oliveira PJ, Ramalho-Santos J. Diabetes and the impairment of reproductive function:possible role of mitochondria and reactive oxygen species[J]. Curr Diabetes Rev, 2008, 4(1):46-54.
11 Alves MG, Martins AD, Cavaco JE, et al. Diabetes, insulin-mediated glucose metabolism and Sertoli/blood-testis barrier function[J]. Tissue Barriers, 2013, 1(2):e23992.
12 顾 磊,金保方,张新东,等. 睾丸微循环结构及功能调控的研究进展[J]. 微循环学杂志, 2014,24(3):65-67.
13 Pradhan RK, Chakravarthy VS. Informational dynamics of vasomotion in microvascular networks:a review[J]. Acta Physiol (Oxf), 2011, 201(2):193-218.
14 Xiu RJ, Zweifach BW. Microvascular vasomotion-II. Vasomotion in skeletal muscle[J]. Zhonghua Yi Xue Za Zhi, 1985, 65(4):203-207.
15 Ohtsuka A. Microvascular architecture of the pampiniform plexus-testicular artery system in the rat:a scanning electron microscope study of corrosion casts[J]. Am J Anat, 1984, 169(3):285-293.
16 Bajory Z, Varga R, Janovszky A, et al. Microcirculatory effects of selective endothelin-a receptor antagonism in testicular torsion[J]. J Urol, 2014, 192(6):1 871-1 877.
17 Cai L, Chen S, Evans T, et al. Apoptotic germ-cell death and testicular damage in experimental diabetes:prevention by endothelin antagonism[J]. Urol Res, 2000, 28(5):342-347.
18 Kyathanahalli C, Bangalore S, Hanumanthappa K, et al. Experimental diabetes-induced testicular damage in prepubertal rats[J]. J Diabetes, 2014, 6(1):48-59.
Impairment of Testicular Microcirculation in STZ induced BALB/c Diabetic Mice
ZHANG Xiao-yan, LIU Ming-ming, LI Bing-wei, LIU Shu-ying, LI Hong-wei, XIU Rui-juan#
Institute of Microcirculation, Key Laboratory of Microcirculation, Ministry of Health, CAMS & PUMC, Beijing 100005, China;#Corresponding author
Objective:To investigate changes of testicular microcirculation in STZ induced BALB/c diabetic mice. Method:20 BALB/c mice were randomly divided into diabetic group (n=10) and control group (n=10). Diabetic mice were treated with 40 mg/kg STZ for 5 consecutive days while control group was injected with citric acid buffer intraperitoneally. After one week, blood perfusion of lower abdominal - genital skin was evaluated by Moor LDLS, while testicular blood perfusion and microvascular vasomotion were detected by Moor VMS LDF after exposing. Followed cardiac perfusion, the testis of two group mice were prepared. HE staining was used to observe morphological and pathological of testicular micro-vessels, immunohistochemistry staining was employed to determine the expression of PECAM-1. Results:Compared with control group, diabetic mice had decreased lower abdominal - genital skin total blood perfusion (P<0.01), decreased average blood perfusion, frequency and amplitude of vasomotion of testicular micro-vessels (P<0.01, respectively), damaged seminiferous epithelium, decreased matured spermatid, increased interstitial testicular capillaries and discontinuous expression of PECAM-1 (P<0.01). Conclusion:Testicular microcirculation impairs in STZ induced BALB/c diabetic mice.
Diabetic mice; Testis; Microcirculation
中央高校基本科研业务费专项资金资助(33320140193)
中国医学科学院、北京协和医学院微循环研究所;卫生部微循环重点实验室,北京100005;#
,E-mail:xiurj@imc.pumc.edu.cn
本文2015-01-30收到,2015-05-13修回
R587.1
A
1005-1740(2015)03-0001-04