微沸法合成纳米莫来石及活化能的研究
杨中正,姚亚刚,WONG C P,陆跃军
(1 华北水利水电大学 河南省重点材料实验室,郑州 450011;2 乔治亚理工学院 材料科学与工程学院,亚特兰大 30332-0245)
微沸法合成纳米莫来石及活化能的研究
杨中正1,姚亚刚2,WONG C P2,陆跃军1
(1 华北水利水电大学 河南省重点材料实验室,郑州 450011;2 乔治亚理工学院 材料科学与工程学院,亚特兰大 30332-0245)
以硝酸铝和硅溶胶为原料,采用微沸法对合成纳米莫来石及其活化能进行研究,并用热重-差示扫描热量计(TG-DSC)、X射线衍射仪(XRD)和扫描电子显微镜(SEM)对合成莫来石的粒度、相组成和形貌进行分析。结果表明:在原料中的铝硅摩尔比为3∶1的条件下,温度为854℃时莫来石开始形成,温度为920℃时Al-Si尖晶石开始转变为莫来石,温度为1200℃时莫来石化完成,合成莫来石的活化能为(634.52±28.90)kJ·mol-1。经过1200℃煅烧后,莫来石含Al2O3的摩尔分数为59.8%,平均粒度约为31.7nm,形状为针状,并由这些针状莫来石构成连续的网络结构。随着铝硅摩尔比的增加,合成莫来石的温度降低,活化能降低。当铝硅摩尔比增加至6∶1,合成莫来石的活化能降至(514.73±14.40)kJ·mol-1。
微沸法;纳米莫来石;活化能
不同的合成方法对莫来石的温度、纯度和粒径起着重要作用,进而影响到莫来石制品的性能。研究者已经采用多种方法制备出莫来石。在诸多方法中,液相法具有成本低,设备简单,便于大规模生产等特点,只要严格控制工艺条件,就可以制得粒径小,粒度分布窄、纯度高的纳米材料,因此被研究者广为采用。目前,已经采用沉淀法[9, 14-16],水热法[17,18],溶胶-凝胶法[8, 19,20]等液相法制备出莫来石。但是,作为液相法之一的微沸法在制备莫来石的文献中鲜有报道。微沸法是在溶液微沸的条件下,使原料获得较高的混合度,进而加速溶液中的离子反应,制备出粒度分布均匀的纳米材料。在长期的莫来石制备研究过程中,不断摸索采用这种简单易行的微沸法对不同起始原料制备纳米莫来石及其活化能进行研究,并取得了一些进展和成果。本文主要将以硝酸铝和硅溶胶为起始原料,用微沸法合成纳米莫来石及其活化能的研究进行阐述。
1 实验
1.1 实验原料和方法
采用九水硝酸铝Al(NO3)3·9H2O及粒径为10~20nm,SiO2质量数为30%的硅溶胶作为制备莫来石的起始原料。
试样的制备:称取一定量的硝酸铝和硅溶胶,分别加入适量蒸馏水配制成0.2mol·L-1的硝酸铝溶液和硅溶胶溶液。按照铝硅摩尔比为3∶1的要求,取150mL的0.2mol·L-1硝酸铝溶液放入500mL的三口烧瓶中,然后将三口烧瓶置于加热台上加热至微沸;接着向烧瓶中缓慢加入50mL的 0.2mol·L-1的硅溶胶溶液,保持微沸状态4h,之后将混合溶液置于100℃的烘箱中烘干;烘干后样品研磨成粉状,即得试样A。实验过程中,三口烧瓶中间口连接有蛇形冷凝管,从而把沸腾挥发成气体的溶液回收。
按照上述同样的方法,通过改变加入硝酸铝溶液和硅溶胶溶液的量分别制备出铝硅摩尔比为4∶1,5∶1和6∶1的试样B,C和D。
烧结实验:将试样置于电炉中,以升温速率为4℃·min-1将试样分别加热至1000,1100,1200℃和1300℃,并保温0.5h,然后自然冷却至室温后,获得煅烧试样。
1.2 分析方法
1.2.1 活化能
用SDT Q600型TG-DSC对样品进行热效应分析和活化能的研究。实验条件:试样置于刚玉坩锅中,氮气流速为10mL·min-1,加热速率为20℃·min-1。
活化能测定:将试样以不同的升温速率加热至1250℃,然后根据Kissinger-Akahira-Sunose公式计算活化能E,见式(1)。
(1)
式中:β为升温速率,℃·min-1;Tp为相变温度,K;E为活化能,kJ·mol-1;R为气体常数,8.314×10-3kJ·(mol·K)-1;C为常数。实验通过获得的Tp和β可绘出ln(β/Tp2)和1/Tp的关系曲线,进而通过线性拟合得斜率K,然后根据K=-E/R可得到E值。
1.2.2 相组成和显微结构
采用 X’Pert Pro型XRD对煅烧后试样的相组成和晶粒度进行分析,实验用铜靶Ka辐射,电压为40kV,电流为40mA。采用LEO-1530型SEM对烧结样的形貌进行观察分析。
2 结果与讨论
2.1 热性能分析
图1为试样A从室温加热至1250℃的TG-DSC曲线。从图1中TG曲线可知,在加热过程中,随温度的升高,试样质量损失逐渐降低,温度超过800℃后,试样质量基本保持不变。表明温度超过800℃后,随温度的升高,试样不再产生挥发性物质。从图1中DSC曲线可知,在800℃之前,试样分别在100,230℃和400℃处出现三个吸热峰,这是试样在加热过程中脱除残余的吸附水、结晶水和有机物质等过程中吸收热量所致;当温度超过800℃后,试样在854℃和920℃处出现两个放热峰,这分别是加热过程中相变形成莫来石以及Al-Si尖晶石转变为莫来石放出热量所致[20,21]。本实验形成莫来石的温度低于Sembiring等[8]和Yoshida等[18]采用沉淀法(950~1250℃)、水热法(1000~1300℃)[17,18]及溶胶-凝胶法(1000~1150℃)[8,19,20]合成莫来石所需的温度。说明采用本方法原料的混合度很高,其铝硅离子混合达到原子水平,否则开始形成莫来石的温度较高(如≥1200℃)[2,22]。加热形成莫来石过程中的主要化学反应式见式(2)~(5)。

图1 试样A煅烧过程的TG-DSC曲线Fig.1 TG-DSC curves of sample A during calcining process
Al(NO3)3+3H2O= Al(OH)3+3HNO3
(2)
6Al(OH)3+ 2SiO2=3Al2O3·2SiO2+9H2O
(3)
4Al(OH)3+ 3SiO2=2Al2O3·3SiO2+6H2O
(4)
3(2Al2O3·3SiO2)=2(3Al2O3· 2SiO2)+5SiO2
(5)
综上所述,试样在煅烧过程中,大部分质量损失发生在800℃之前;温度为854℃时,莫来石已经开始形成,至920℃时,Al-Si尖晶石开始转变为莫来石。
2.2 相组成和显微结构分析
图2为试样A经过不同温度煅烧后的XRD图谱。从图2可知,经过1000℃煅烧后,试样主晶相为莫来石,并含有少量的石英;经过1100℃煅烧后,试样中莫来石含量增加,SiO2含量降低。表明温度升高,形成莫来石的过程继续进行。而经过1200℃煅烧后,SiO2消失,呈单一莫来石相,至1300℃煅烧后,晶相仍为莫来石相,且莫来石含量不再增加。说明试样经过1200℃煅烧后,莫来石化已经完成。而莫来石化完成温度是考察Al和Si混匀度的一个重要标准。如果Al和Si混匀度在微米尺寸(如采用Al2O3和SiO2为原料制备莫来石),莫来石化完成温度一般在1600~1700℃之间,如Al和Si混匀度达到原子水平则莫来石化完成温度一般为1000~1200℃[5]。本实验莫来石化完成温度为1200℃,说明Al和Si混匀度较高,处在原子水平,结果与TG-DSC分析相一致。

图2 试样A经过不同温度煅烧后的XRD图谱Fig.2 XRD patterns of sample A calcined at different temperatures
图3为试样A经过1200℃烧结后得到的XRD图谱,结合Ban-Okada公式(6)[7],得出莫来石中Al2O3的摩尔分数为59.8%,与标准化学计量莫来石中Al2O3的理论含量(60%)一致,说明本方法制备出的莫来石纯度很高。
Al2O3=44.17×I(220)/I(111)+27.6
(6)
式中:I(220)和I(111)分别为莫来石晶面(220)和(111)晶面的衍射峰强度。
根据Debye-Scherrer公式(7)进行莫来石的平均晶粒度的计算。为了降低误差,统计晶粒度Dhkl时,尽量选用较大θ角的衍射峰进行。本研究选取2θ为50~90°之间的15个衍射峰进行莫来石的晶粒度统计。结果表明,莫来石的平均晶粒度约为31.7nm,多数在20.3~51.5nm之间,粒度分布均匀。
(7)
式中:Dhkl为在晶面(hkl)法线方向上的平均尺寸,nm;k为形状因子,取0.89;Bhkl为衍射峰的半高宽,rad;θ为衍射半角,rad;λ为X射线波长(本实验采用铜靶,λ为0.15406nm),nm。

图3 试样A经过1200℃烧结后的XRD图谱Fig.3 XRD pattern of sample A sintered at 1200℃
图4为试样A经过1200℃煅烧后的SEM图片。从图4可知,莫来石呈针状,粒径多数分布在20~55nm之间,这与XRD统计的结果一致。同时可以看出,这些针状莫来石构成连续的网络结构,从而有利于莫来石的高温性能的改善。

图4 试样A经过1200℃烧结后的SEM图Fig.4 SEM micrograph of sample A sintered at 1200℃
XRD和SEM分析结果表明,采用微沸法制备的莫来石纯度高,粒度均匀,呈针状,并由针状莫来石构成连续的网络结构。
2.3 不同铝硅比对莫来石的活化能的影响
图5为铝硅比为3∶1的试样A在不同加热速率下的DSC曲线。从图5可知,加热速率β分别为10,20,30℃· min-1和40℃· min-1时,放热峰温度Tp分别为844,854,862℃和866℃。将Tp和β在Origin Pro 8中进行线性拟合得到ln(β/Tp2)和1/Tp的关系曲线,如图6所示。从图6可知,该直线的斜率k为-76314.94917±3476.41535。根据公式(1)可知k=-E/R,由此得到合成莫来石的活化能E为(634.5228.90±28.90)kJ·mol-1。该值低于文献[15]~[19]报道的活化能(见表1),表明铝硅反应生成莫来石较容易,就是说,本方法合成莫来石的原料混合程度较高。
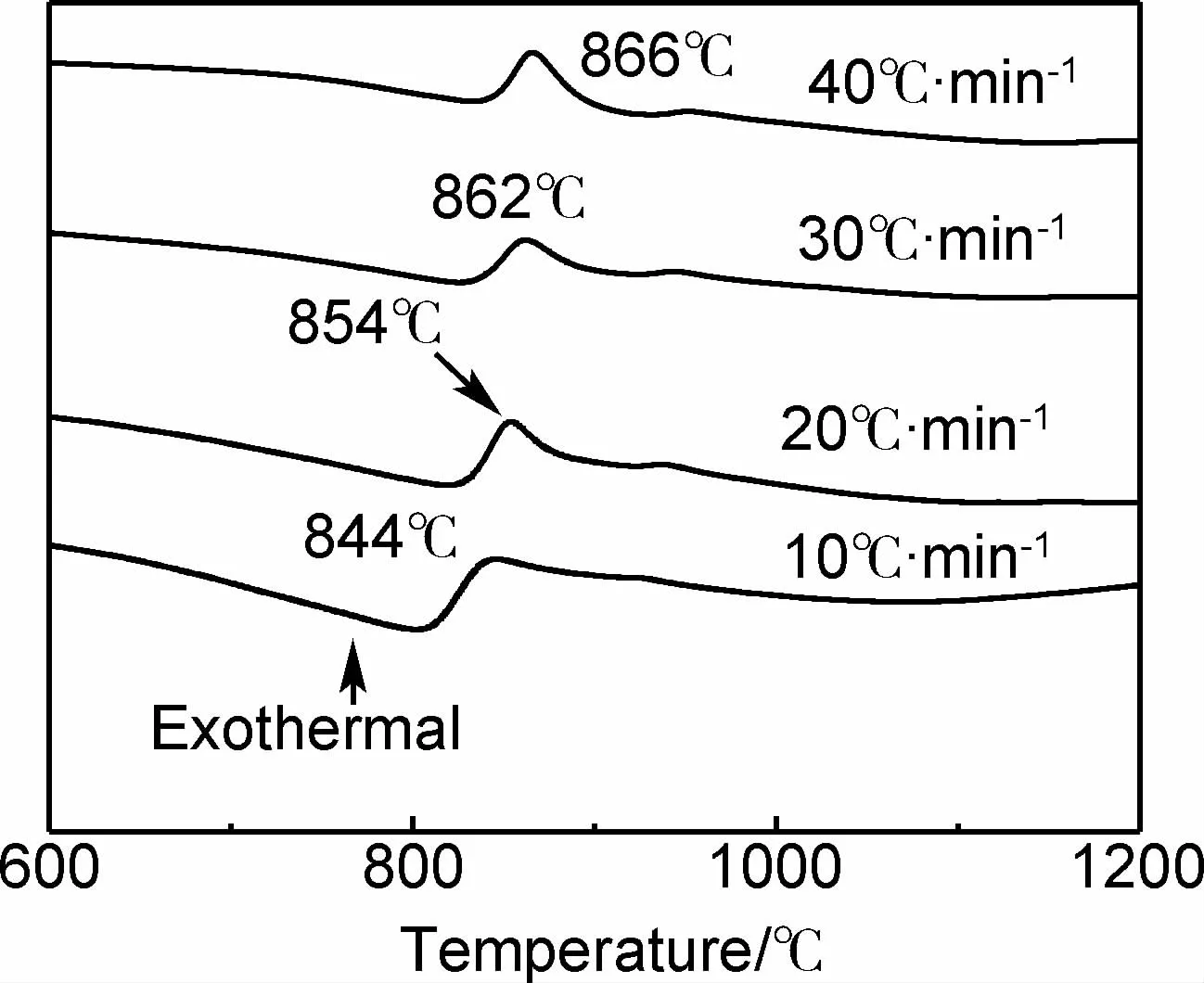
图5 试样A在不同升温速率下的DSC曲线Fig.5 DSC curves of sample A at different heating rates
Note:AIP-aluminum isopropoxide;TEOS -tetraethyl orthosilicate
图7为不同铝硅比的试样在加热速率为20℃·min-1时的DSC曲线。从图7可知,铝硅摩尔比为3∶1,4∶1,5∶1 和6∶1的试样的放热峰温度分别为854,853,851℃和849℃。说明随铝硅摩尔比的增加,试样的放热峰温度下降。由于放热峰温度为开始形成莫来石的温度,表明随着铝硅摩尔比的增加,形成莫来石的温度降低。同时说明形成莫来石的铝硅混合程度很高,达到原子水平[2]。如果混合水平程度为分子水平,则原料中铝硅比的变化对形成莫来石的温度几乎没有影响[2]。结果表明,在实验范围内,随铝硅比的增加,开始形成莫来石的温度降低。进而可知,开始形成莫来石的活化能将降低。

Fig.7 不同铝硅比的试样在加热速率为 20℃·min-1时的DSC 曲线Fig.7 DSC curves of samples with different Al/Si molar ratios at 20℃·min-1
图8为铝硅比为6∶1的试样D在不同加热速率β下得到吸热峰温度Tp在Origin Pro 8中进行线性拟合得到ln(β/Tp2)和1/Tp的关系直线。由图8可知,该直线的斜率k为-61911.36235±1732.39041,进而根据k=-E/R得合成莫来石的活化能E为(514.73±14.40)kJ·mol-1。与铝硅比为3∶1的试样A相比,铝硅比为6∶1的试样D的活化能大幅降低,约降低120kJ·mol-1。

图8 试样D的和ln(β/Tp2)的关系图Fig.8 Relationship between and ln(β/Tp2) for sample D
3 结论
(1)在微沸法合成莫来石的过程中,当起始原料的铝硅比为3∶1时,经过1200℃煅烧后,所得莫来石中Al2O3的摩尔数为59.8%,平均粒度约为31.7nm,多数分布在20~55nm之间,形状为针状,并由这些针状莫来石构成交错连续的网络结构,从而有利于莫来石的高温性能的改善。
(2)在微沸法合成莫来石的过程中,当温度为854℃时开始形成莫来石,920℃时,Al-Si尖晶石开始转变为莫来石,至1200℃莫来石化完成,合成莫来石的活化能为(634.52±28.90)kJ·mol-1。
(3)随着铝硅摩尔比的增加,合成莫来石的活化能降低。铝硅摩尔比从3∶1增加至6∶1,合成莫来石的活化能约降低120kJ·mol-1。
[1] REINHARD X,FISCHER H S,DIETMAR V. Formation of aluminum rich 9∶1 mullite and its transformation to low alumina mullite upon heating [J]. Journal of the European Ceramic Society,1996, 16 (3): 109-113.
[2] MANUELA J A. Synthesis and phase transformations of mullites obtained from SiO2-Al2O3gels [J]. Journal of the European Ceramic Society,1996, 16 (2): 781-789.
[3] 杨中正, 赵顺波, 邢振贤, 等. 高铝矾土和煤矸石合成矾土基莫来石料的研究 [J]. 材料工程, 2010,(5): 51-55.
YANG Zhong-zheng,ZHAO Shun-bo,XING Zhen-xian,et al.Preparation of bauxite-based homogenized mullite grogs with bauxite and coal gangue[J].Journal of Materials Engineering,2010,(5):51-55.
[4] BELHOUCHET H, HAMIDOUCHE M, TORRECILLAS R, et al. The non-isothermal kinetics of mullite formation in boehmite-zircon mixtures [J]. Journal of Thermal Analysis and Calorimetry, 2014, 116 (2): 795-803.
[6] LI J H, MA H W, HUANG W H. Effect of V2O5on the properties of mullite ceramics synthesized from high-aluminum fly ash and bauxite [J]. Journal of Hazardous Materials, 2009, 166 (2-3): 1535-1539.
[7] LI S, DU H, GUO A. Preparation of self-reinforcement of porous mullite ceramics through in situ synthesis of mullite whisker in fly ash body [J]. Ceramics International, 2012, 38 (2): 1027-1032.
[8] SEMBIRING S, SIMANJUNTAK W, MANURUNG P, et al. Synthesis and characterisation of gel-derived mullite precursors from rice husk silica [J]. Ceramics International, 2014, 40 (5): 7067-7072.
[9] SANAD M M S, RASHAD M M, ABDEL-AAL E A, et al. Effect of Y3+, Gd3+and La3+dopant ions on structural, optical and electrical properties of o-mullite nanoparticles [J]. Journal of Rare Earths, 2014, 32 (1): 37-42.
[10] WANG Y, CHENG H, LIU H, et al. Microstructure and room temperature mechanical properties of mullite fibers after heat-treatment at elevated temperatures [J]. Materials Science and Engineering: A, 2013, 578: 287-293.
[11] SARIN P, YOON W, HAGGERTY R P, et al. Effect of transition-metal-ion doping on high temperature thermal expansion of 3:2 mullite—Aninsitu, high temperature, synchrotron diffraction study [J]. Journal of the European Ceramic Society, 2008, 28 (2): 353-365.
[12] SCHNEIDER H, SCHREUER J, HILDMANN B. Structure and properties of mullite—A review [J]. Journal of the European Ceramic Society, 2008, 28 (2): 329-344.
[13] 王法辉, 刘 莹. 莫来石纤维含量对陶瓷基摩擦材料摩擦磨损性能的影响 [J]. 材料工程, 2012, (12): 61-65.
WANG Fa-hui,LIU Ying.Effects of mullite fiber content on friction and wear properties of ceramic-based friction material[J].Journal of Materials Engineering,2012,(12):61-65.
[14] WANG S, SHEN X Q, YAO H C, et al. Synthesis and sintering of pre-mullite powders obtainedviacarbonate precipitation [J]. Ceramics International, 2010, 36 (2): 761-766.
[15] SUEYOSHI S S,CONTRERAS-SOTO C A. Fine pure mullite powder by homogeneous precipitation [J]. Journal of the European Ceramic Society, 1998, 18 (2): 1145-1152.
[16] SANAD M M S, RASHAD M M, ABDEL-AAL E A, et al. Optical and electrical properties of Y3+ion substituted orthorhombic mullite Y(x)Al(6-x)Si2O13nanoparticles [J]. Journal of Materials Science: Materials in Electronics, 2014, 25 (6): 2487-2493.
[17] KUTTY T R N,NAYAK M. Photoluminescence of Eu2+-doped mullite (xAl2O3·ySiO2;x/y=3/2 and 2/1) prepared by a hydrothermal method [J]. J Materials Chemistry and Physics 2000, 65 (2): 158-165.
[18] YOSHIDA K, HYUGA H, KONDO N, et al. Synthesis of precursor for fibrous mullite powder by alkoxide hydrolysis method [J]. Materials Science and Engineering: B, 2010, 173 (1-3): 66-71.
[19] WANG W, WENG D, WU X. Structure evolution and thermal stability of La2O3-doped mullite fibersviasol-gel method [J]. Journal of Rare Earths, 2012, 30 (2): 175-180.
[20] GUO X, LI W, NAKANISHI K, et al. Preparation of mullite monoliths with well-defined macropores and mesostructured skeletonsviathe sol-gel process accompanied by phase separation [J]. Journal of the European Ceramic Society, 2013, 33 (10): 1967-1974.
[21] SANTANA L N L, GOMES J, NEVES G A, et al. Mullite formation from bentonites containing kaolinite: Effect of composition and synthesis parameters [J]. Applied Clay Science, 2014, 87: 28-33.
[22] RUIZ DE SOLA E, ESTEVAN F, ALARC N J. Low-temperature Ti-containing 3∶2 and 2∶1 mullite nanocrystals from single-phase gels [J]. Journal of the European Ceramic Society, 2007, 27 (7): 2655-2663.
Activation Energy and Synthesis of Nano-mullite by Micro-boiling Method
YANG Zhong-zheng1,YAO Ya-gang2,WONG C P2,LU Yue-jun1
(1 Henan Provincial Key Material Laboratory, North China University of Water Resources and Electric Power,Zhengzhou 450011,China; 2 School of Materials Science and Engineering, Georgia Institute of Technology,Atlanta 30332-0245,USA)
Nano-mullite was synthesized by micro-boiling method using aluminium nitrate and silica sol as raw materials, and the activation energy was studied. Grain size, phase composition and morphology of the mullite were analyzed by means of thermogravimetry-differential scanning calorimeter(TG-DSC), X-ray diffraction (XRD) and scanning electron microscope (SEM), respectively. The results show that when Al/Si mole ratio is 3∶1 in the raw materials, mullite starts forming at 854℃, Al-Si spinel starts transforming into mullite at 920℃, mullitization is completed at 1200℃, and activation energy of mullite synthesis is (634.52±28.90) kJ·mol-1. After mullite is calcined at 1200℃, and the mole fraction of mullite containing Al2O3is 59.8%, the average particle size is 31.7nm, with needle shape, and with these needle shape mullite forming a continuous network structure. The synthesizing temperature of mullite and activation energy decrease as mole ratio of Al/Si increases. Activation energy of synthesizing mullite decreases to (514.73 ± 14.40) kJ·mol-1when mole ratio of Al/Si increases to 6∶1.
micro-boiling method; nano-mullite; activation energy
10.11868/j.issn.1001-4381.2015.06.005
TG174
A
1001-4381(2015)06-0026-05
2013-10-12;
2014-08-28
杨中正(1967—),男,教授,主要从事无机材料的加工和性能研究,联系地址:河南省郑州市北环路36号华北水利水电大学河南省重点材料实验室(450011),E-mail: yangzz01@163.com

