自体干细胞治疗在缺血性糖尿病足病中的应用
邓琳 赵湜* 毛红
武汉市中心医院内分泌科
* 通讯作者:zhaoshiwuhan@126.com
自体干细胞治疗在缺血性糖尿病足病中的应用
邓琳 赵湜* 毛红
武汉市中心医院内分泌科
* 通讯作者:zhaoshiwuhan@126.com
目的比较自体干细胞治疗(autologous stem cell therapy,ASCT)和经皮腔内血管成形术(percutaneous transluminal angioplasty,PTA)治疗缺血性糖尿病足病(ischemia diabetic foot,IDF)的效果。方法 84例IDF患者纳入研究,28例患者进行PTA治疗,32例患者接受自体干细胞治疗(外周血干细胞治疗13例,骨髓干细胞治疗19例),24例无法或不愿接受PTA或ASCT治疗的患者作为对照组,随访12月,对截肢率、经皮氧分压(TcPO2)和伤口愈合进行了评估。结果 随访6月和12月后ASCT和PTA组的截肢率显著低于对照组(P=0.002和P=0.003),而ASCT和PTA组之间没有显著差异。对于TcPO2的改善,ASCT和PTA组之间也没有显著差异(二者均与基线相比P<0.05),而对照组的TcPO2在随访期间无明显升高。我们观察到ASCT组的溃疡愈合率高于PTA组和对照组(81.2%对55.2%与21.3%,P<0.05)。结论 本研究表明ASCT 和PTA治疗均能显著降低IDF患者的截肢率,ASCT治疗对于溃疡愈合有更显著的疗效。本研究结果支持ASCT是一种潜在的极有前途的治疗IDF的方法。
缺血性糖尿病足病,经皮腔内血管成形术,自体干细胞治疗
近年来糖尿病患病率在全球呈快速增长趋势,随着糖尿病病程的延长,糖尿病下肢缺血发病率将达到50%,糖尿病足病的发生率约为0.9%~1.7%,它是一种降低患者生活质量、致残率较高的糖尿病慢性并发症,成为患者和社会的巨大负担。世界卫生组织(World Health Organization,WHO)将糖尿病足病定义为糖尿病患者因合并各种不同程度末梢血管病变和神经病变导致下肢感染、溃疡和/或深部组织破坏。传统的糖尿病足病的治疗方法包括药物、血管搭桥、介入手术和截肢术等,尤其是血管搭桥术和腔内血管重建介入手术可以显著提高患者的保肢率。尽管如此,仍有近三分之一的患者因为广泛或位于远端动脉闭塞而无法进行血管搭桥术和腔内血管重建介入手术,只能选择药物保守治疗,因此新的治疗技术,例如自体干细胞疗法(ASCT),给这些“无法选择”的患者带来了希望。
正常状态下,干细胞主要存在于骨髓中,外周血的干细胞数量仅为骨髓中的0.1%~1%,CD34+细胞仅占外周血单个核细胞的0.01%~0.1%[1]。我们采用的是经过分离和纯化的自体骨髓来源的单核细胞和外周血来源的单个核细胞,这两种类型的干细胞已经被用于肢体缺血性疾病的多个多中心随机对照临床研究中[2,3]。最近发表的荟萃分析表明,ASCT能改善肢体缺血,提高经皮氧分压(TcPO2)或踝肱指数,促进伤口愈合,减轻患者疼痛,降低截肢率[4,5]。既往的临床研究表明ASCT并不增加血清促血管生成细胞因子的水平和视网膜上新生血管形成的风险,也进一步证实其安全性。我们研究的目的是比较ASCT与PTA和保守药物治疗IDF的疗效。
研究对象和方法
我们纳入84例2010年1月至2013年12月之间我院收治的IDF患者进行这项回顾性研究,符合PTA治疗适应症的患者纳入PTA组(n=28),无法进行血运重建的患者则选择ASCT(n=32)治疗,对照组(n=24)选择的是采取药物保守治疗的患者。
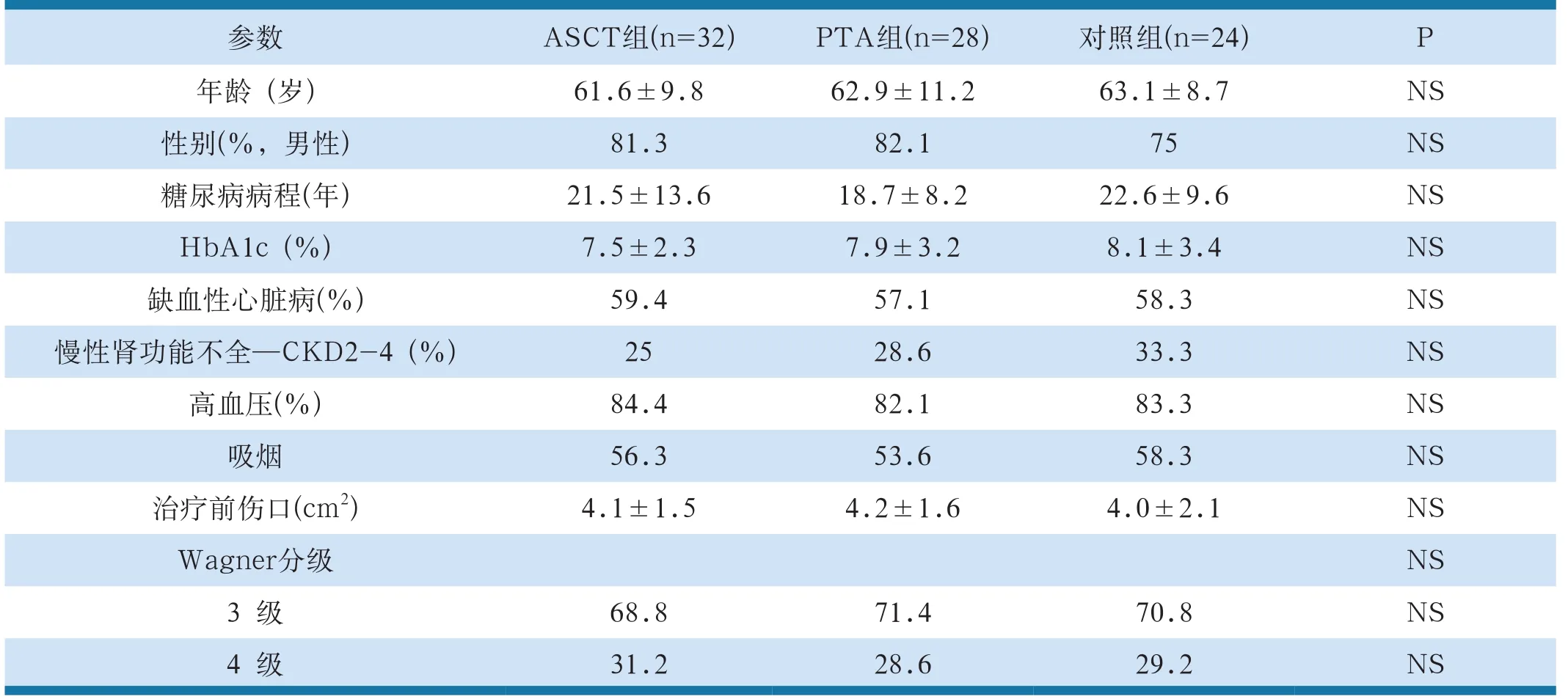
表1 各组基线特征
所有患者经血管造影确诊为下肢动脉闭塞症,足部溃疡的严重程度按Wagner分级法处于3~4级,TcPO2<30毫米汞柱或踝肱指数<0.6。
干细胞治疗的患者签署书面知情同意书,并接受了入组前的检查,包括肿瘤的筛查和血管造影检查。所有患者均在我们的糖尿病足病门诊随访治疗。对于感染性溃疡,我们根据药敏试验采取适当的抗生素治疗。合并有深静脉血栓、肿瘤性疾病以及进展性糖尿病视网膜病变的患者被除外。
ASCT包括骨髓干细胞治疗(19例)和外周血干细胞治疗(13例)。在既往的临床研究中发现这两类干细胞悬液治疗肢体缺血性疾病的疗效无显著差异[6]。自体外周血干细胞治疗应用粒细胞集落刺激因子(G-CSF)450~600μg/d皮下注射,连用5d,每天监测血象变化。为防止高细胞血症引起重要脏器血栓形成,当WBC>20×109/L时,应用低分子肝素钙4100U皮下注射。第5~6d用COBE Spectra Version 4血细胞分离机单采干细胞,配成1×108/ml细胞混悬液供移植用。自体骨髓干细胞治疗应用多侧孔骨穿针分别垂直穿刺两侧髂后上嵴,各抽取100ml骨髓液,送实验室行人工干细胞分离,配成1×108/ml细胞悬液供移植用。无论是骨髓干细胞还是外周血干细胞, 一旦分离纯化后即可以将纯化后富含CD34+的干细胞悬液在手术室静脉麻醉后,无菌条件下,将干细胞悬液按3cm×3cm间距进行肌肉注射,病变严重的按1cm×1cm间距注射到溃疡伤口的边缘。随访12月,对截肢率、经皮氧分压(TcPO2)和伤口愈合进行了评估。
采用SPSS 19.0统计软件分析,计量资料采用平均值±标准差(X±s)来表示,使用Mann-Whitney检验、Kruskal-Wallis检验,P<0.05为组间差异有统计学意义。
结果
三组患者的年龄、性别、糖化血红蛋白、糖尿病病程、合并症以及下肢特征无显著的差异。随访12月,ASCT组的32例患者中4例死亡,6例截肢;PTA组28例患者中,3例死亡,5例截肢;对照组的24例患者中,4例死亡,11例截肢。随访6月和12月ASCT和PTA组的截肢率显著低于对照组(P=0.002和P=0.003),而ASCT和PTA组之间没有显著差异。
随访12月以后,TcPO2在两个治疗组的非截肢患者中有显著增加(ASCT组15.3~39.5mmHg,PTA组16.2~41.2mmHg,二者均P<0.05),而对照组中非截肢患者的TcPO2无显著变化(14.1~15.9mmHg,P=NS)。ASCT组中截肢的5例患者中有3例是因为严重的足部感染病原菌耐药,尽管其TcPO2有明显提升,仍然无法避免截肢。另2例患者由于缺血和感染的进展最终选择截肢。随访期间的ASCT组的伤口愈合率显著高于PTA组和对照组,3个月相比(47.2%对23.5%与16.9%,P<0.05),6个月相比(61.7%对32.5%与11.6%,P<0.05)和12个月相比(81.2%对55.2%与21.3%,P<0.05)。

表2 随访期TcPO2变化(mmHg)
ASCT组中无严重不良事件发生,PTA组中出现 1例严重急性出血事件。ASCT组中(n=7,21.8%)发生一般不良事件包括下肢水肿,骨髓采集后臀部血肿,PTA组(n=5,17.85%)中少数患者出现腹股沟区穿刺部位的裂开。
讨论
干细胞是一类具有自我更新和多向分化潜能的细胞,可在一定条件下向特定类型的细胞分化。我们选用的骨髓干细胞和外周血干细胞属成体干细胞,它是一种多能干细胞,具有不受伦理、法律限制,且免疫排斥低、肿瘤风险小等优点,具有广泛的应用前景。自体干细胞治疗肢体缺血性疾病主要是根据自体干细胞在一定条件下,可诱导分化为血管内皮细胞和平滑肌细胞,同时合成分泌大量的促血管生成因子,形成新生血管的原理,以改善下肢血流。2002年Tateishi-Yuyama等[7]首次报道了应用自体骨髓干细胞移植治疗下肢缺血性疾病的临床研究,结果显示,侧支循环显著改善,未观察到任何明显的移植相关副作用。2008年谷涌泉等[8]采用局部肌肉注射和动脉注射两种方法,将骨髓原始单个核细胞移植到缺血肢体,两组患者经皮氧分压、踝肱指数、侧枝循环形成等客观指标都得到了提高,二者之间没有统计学差异。近几年来, 外周血干细胞移植发展很快,也显示出良好的疗效。Kawamura等[9]采用自体外周血单个核细胞移植治疗糖尿病或闭塞性动脉硬化所致的下肢溃疡,有效率达70%。国内黄平平等[10]采用自体外周血单个核细胞移植治疗14 例糖尿病肢体缺血患者,与对照组比较,溃疡愈合加快,血流灌注、踝肱指数等客观指标提高,移植后没有出现不良反应。这些资料表明自体外周血单个核细胞移植是治疗糖尿病下肢缺血的一种简单、安全、有效的新疗法。张会峰等[11]报道了52例有糖尿病下肢血管病的患者采用骨髓干细胞移植和外周血干细胞移植治疗,结果发现在主观和客观疗效评价方面均无明显差异(P>0.05),提示二种不同来源干细胞治疗下肢缺血在血管新生方面疗效相当。2006年Vojtasslk J等[12]将自体骨髓细胞直接涂布于糖尿病足患者的溃疡面,并且注射于创缘,明显加速溃疡的愈合。ASCT治疗的益处在多个荟萃分析中也得以证实[13,14]。
PTA作为治疗IDF的传统疗法其疗效已被公认。我们的研究显示ASCT在IDF患者中获得了堪比PTA手术的疗效。与PTA和保守治疗相比,ASCT后伤口愈合更快,可能是注射的干细胞和血管生长因子共同作用的结果。对于生长因子的研究最多的是血管内皮生长因子(VEGF),研究表明VEGF 可以动员干细胞的增生,动员细胞在血管内皮的微环境内扎根从而加速伤口愈合。两种积极治疗的方法均优于保守治疗。
移植的干细胞是未分化细胞,是否会在移植部位分化成其他组织,是否会激发或者促进体内潜在恶性肿瘤及血管瘤的生长,是否会促进糖尿病眼底增殖病变的恶化,目前报道的临床研究尚未观察到严重不良反应,但是由于样本量较小,时间尚短,这些问题仍需密切关注。我们的研究也未观察到ASCT治疗的任何严重的不良事件,也没有任何证据提示增加肿瘤的发病率以及眼底增殖病变的恶化。截肢作为自体干细胞治疗糖尿病足病的不良结果被认为是糖尿病足和下肢缺血性疾病的临床结局,而不是ASCT产生的不利影响。
感染是糖尿病足发生的诱导因素和加重因素,糖尿病足患者感染率达到58%。包括革兰阳性球菌、革兰阴性杆菌在内的多种需、厌氧细菌和真菌的混合感染。所有入选患者均根据药敏结果给予抗生素进行适当的抗感染治疗,对溃疡的愈合起到至关重要的作用。
我们的研究随访期12月,所有患者均在采用标准化方法在我中心治疗,三组患者的临床特征具有可比性。但这项研究的局限性在于它被设计为一个回顾性比较研究。
自体干细胞治疗是治疗糖尿病足病的的一项新技术,其在国内外临床研究中取得了广泛认可, 使一部分患者免于截肢的痛苦,提高患者的生活质量。但这一技术的具体机制仍未完全阐明,远期是否有致瘤性等副作用,仍需进一步前瞻性的临床研究。
总之,在我们的临床研究中发现自体干细胞治疗糖尿病足病和对照组相比截肢率有显著下降,同时加速溃疡的愈合。这进一步证实自体干细胞治疗不仅用于肢体缺血性疾病,在改善伤口愈合方面是一种很有前途的方法。随着对干细胞研究的不断深入,干细胞在临床的应用前景越来越广泛,将为糖尿病足病患者享受健康人生带来希望。在干细胞移植选择上,由于外周血与骨髓来源干细胞受数量、质量及移植相关风险等影响,临床应用中受到一定限制,将来需要进一步深入干细胞的生物学特性、疗程和致瘤性等方面研究,提高临床治疗的效果。
1 To LB, Haylock DN, Simmons PJ, Juttner CA. The biology and clinical uses of blood stem cells. Blood,1997,89(7):2233-2258.
2 Powell RJ, Marston WA, Berceli SA, et al. Cellular therapy with ixmyelocel-T to treat critical limb ischemia: the randomized, doubleblind, placebo-controlled RESTORE-CLI Trial. Mol Ther,2012,20:1280-1286.
3 Prochazka V, Gumulec J, Jaluvka F, et al. Cell therapy, a new standard in management of chronic critical limb ischemia and foot ulcer. Cell Transplant,2010,19:1413-1424.
4 Fadini GP, Agostini C, Avogaro A. Autologous stem cell therapy for peripheral arterial disease meta-analysis and systematic review of the literature. Atherosclerosis,2010,209:10-17.
5 Lawall H, Bramlage P, Amann B. Stem cell and progenitor cell therapy in peripheral artery disease. A critical appraisal. Thromb Haemost, 2010,103:696-709.
6 Dubsky M, Jirkovska A, Bem R, et al. Both autologous bone marrow mononuclear cell and peripheral blood progenitor cell therapies similarly improve ischaemia in patients with diabetic foot in comparison with control treatment. Diabetes Metab Res Rev,2013,29:369-376.
7 Tateishi-Yuyama E,Matsubara H, Murohara T,et al. Therapeutic angiogenesis for patients with limb ischaemia by autologous transplantation of bone-marrow cells: a pilot study and a randomised controlled trial. Lancet,2002,360(9331): 427-435.
8 Gu YQ, Zhang Jian, Guo LR,et al.Transplantation of autologous bone marrow mononuclear cells for patients with lower limb ischemia. Chinese Medical J, 2008,121(11):963-967.
9 Kawamura A, Horie T, Tsuda I, et al. Prevention of limb amputation in patients with limbs ulcers by autologous peripheral blood mononuclear cell implantation. Ther Apher Dial,2005,9(1):59-63.
10 Huang P, Li S, Han M, et al.Autologous Transplantation of Granulocyte Colony-Stimulating Factor Mobilized Peripheral Blood Mononuclear Cells Improves Critical Limb Ischemia in Diabetes.Emerging Treatments and Tec hnologies,2005,28(9):2155-2160.
11 Zhang Hui-feng, Zhao Zhi-gang. Comparison of autologous peripheral blood stem cell and bone marrow stem cell transplantation in the treatment of 52 cases of diabetic peripheral arterial occlusive disease. The Chinese tissue engineering research and clinical rehabilitati on,2009,13(6):1109-1112.
12 Prochzka V,Gumulec J, Chmelovt J,et a1.Autologous bone marrow stem cell transplantation in patients with end-stage chronical critical limb ischemia and diabetic foot.Vnitr Lek,2009,55(3):173-178.
13 Powell RJ, Marston WA, Berceli SA, et al. Cellular therapy with ixmyelocel-T to treat critical limb ischemia: the randomized, doubleblind, placebo-controlled RESTORE-CLI Trial. Mol Ther,2012,20:1280-1286.
14 Teraa M, Sprengers RW, van der Graaf Y, et al. Autologous bone marrow-derived cell therapy in patients with critical limb ischemia:a meta-analysis of randomized controlled clinical trials. Ann Surg,2013,258:922-929.
10.3969/j.issn.1672-7851.2015.08.011

