高效液相色谱法测血清中25-羟维生素D3
刘怡欣,赛 娜,赵世晶,李紫薇,黄国伟(天津医科大学公共卫生学院营养与食品卫生学系,天津 300070)
论著
高效液相色谱法测血清中25-羟维生素D3
刘怡欣,赛 娜,赵世晶,李紫薇,黄国伟
(天津医科大学公共卫生学院营养与食品卫生学系,天津 300070)
目的:建立检测血清中25-羟维生素D3[25(OH)D3]的高效液相色谱分析方法。方法:样品用甲醇沉淀蛋白,以正己烷提取后,离心取上清液过膜。甲醇-水(95∶5)为流动相,选用Venusil MP-C18(250 mm×4.6 mm,5 μm)色谱柱进行色谱分离,流速为1.0 mL/min,紫外检测波长265 nm,柱温30℃。结果:25(OH)D3在线性范围4.00~160.00 μg/L内与其响应值线性关系良好(r= 0.999 9),4.00、8.00、16.00、80.00 μg/L的25(OH)D3的平均回收率分别为85.22%、92.50%、100.75%、109.50%,RSD分别为4.32%、2.91%、2.25%、1.78%(n=4),测健康成年人血清25(OH)D3浓度为(38.14±14.74)μg/L。结论:该方法准确可靠,可用于血清中25(OH)D3的检测。
高效液相色谱法;25-羟维生素D3;血清
维生素D是一种脂溶性维生素,也是一种类固醇衍生物,主要来源于食物及皮肤合成。近年来研究显示,维生素D不仅能够调节钙磷平衡和骨骼代谢,还具有调节免疫、抗肿瘤、调控细胞增殖、防治代谢综合征、抗炎、保护心血管健康等多种生物学功能[1]。临床和流行病学证据也表明,维生素D对胰岛具有保护作用,并且是维持正常的胰岛素分泌和糖耐量所必需的物质[2]。维生素D缺乏的状况在全球范围内普遍存在。按照国际上对维生素D状态评价的普遍标准[3],全球已有50%的人口存在维生素D缺乏的风险[4]。因此,有必要探索建立一种可靠、高效的测定方法,为维生素D的检测、相关疾病的研究与诊断提供强有力的科学依据。目前临床上普遍接受维生素D的评价指标是25-羟维生素D3[25-hydroxyvitamin D,25(OH)D3],因为它的生物半衰期是3周左右,较1,25-二羟维生素D3[1,25-dihydroxyvitamin D,1,25(OH)2D3](半衰期4~6 h)更为稳定[5]。常用的测血液中25(OH)D3的方法有竞争蛋白结合法(CPBA)、放射免疫法(RIA)、ELISA、高效液相色谱法(HPLC)[6]等,本研究参考相关文献[7-8],采用HPLC法建立血清25(OH)D3的检测方法,并应用于健康成年人的检测。
1 材料与方法
1.1 仪器和试剂 600E高效液相色谱仪(美国Waters公司);BSA224S电子分析天平(北京赛多利斯科学仪器有限公司,d=0.1 mg);Venusil MP-C18色谱柱(250 mm×4.6 mm,5 μm);QL-901漩涡混合器(江苏海门市麒麟医用仪器厂);2-16PK型离心机(美国Sigma公司);超纯水系统(Mili-Q integral 10,美国密理博公司)。
25(OH)D3对照品(美国Sigma公司,705888-1 MG),纯度>98%(HPLC级);人血清(天津市和平区健康教育指导中心);甲醇、正己烷(天津博纳艾杰尔科技有限公司,色谱纯);高纯氮气(天津赛米气体有限公司)。
1.2 研究对象的一般情况 收集2014年天津市和平区健康教育指导中心的健康体检者血清样本30例,男、女比例为1∶1,平均年龄(50.95±10.94)岁。所有研究对象均未患糖尿病、肥胖、甲状腺功能不全、肿瘤等疾病,近期无外伤、感染,且连续3个月没有服用维生素D及其衍生物和钙剂。研究对象均签署知情同意书。
1.3 方法
1.3.1 色谱条件与系统适用性试验 色谱柱:Venusil MP-C18柱(250 mm×4.6 mm,5 μm);流动相:甲醇-水(95∶5)溶液;流速:1.0 mL/min;柱温:30℃;紫外检测波长:265 nm;进样量:20 μL。
1.3.2 对照品溶液的制备 精密称取25(OH)D3对照品5 mg,置于10 mL量瓶中,用甲醇溶解并定容至刻度,即为500 μg/mL对照品溶液,使用时用甲醇稀释。
1.3.3 血清样品处理 精密量取0.5 mL血清置于15 mL离心管中,加入0.8 mL甲醇,漩涡震荡2 min,加入4 mL正己烷,漩涡震荡2 min,5 000 r/min 4℃离心5 min,精密吸取上层清液于室温(25℃)氮气吹干,吹干后残渣立即用150 μL甲醇溶液复溶。
1.3.4 供试品溶液的制备 准确量取按照“1.3.3”项下处理的血清样本溶液150μL,用0.22μm的微孔滤膜过滤后,将液体注入样品瓶中,即得供试品溶液。1.3.5 阴性对照溶液的制备 准确量取0.5 mL空白血清,按照“1.3.3”及“1.3.4”项下的步骤,制备成空白对照溶液。
1.3.6 专属性试验 分别取对照品溶液、供试品溶液各20 μL,按“1.3.1”项下色谱条件进样测定。
1.3.7 线性关系考察 精密量取10 μL 500 μg/mL的对照品溶液,置于50 mL量瓶中,用甲醇稀释,制备成4.00、8.00、16.00、80.00、160.00 μg/L浓度梯度的系列对照溶液。分别按照“1.3.1”项下的色谱条件进样20 μL,进行测定。
1.3.8 精密度试验 (1)日内精密度:取25(OH)D3对照品溶液适量,按“1.3.1”项下的色谱条件连续进样测定5次,进样量20 μL,记录峰面积;(2)日间精密度:取25(OH)D3对照品溶液适量,按“1.3.1”项下的色谱条件分别于0、1、2、3、4 d进样测定,记录峰面积。
1.3.9 稳定性试验 (1)室温稳定性:取同一供试品溶液适量于室温下(25℃)避光放置,按“1.3.1”项下的色谱条件分别于制备后0、2、4、6 h进样20 μL测定,记录峰面积;(2)冷藏稳定性:取同一供试品溶液适量置于4℃条件下,按“1.3.1”项下的色谱条件分别于制备后0、1、2 d进样测定,记录峰面积;(3)冷冻稳定性:取同一供试品溶液适量置于冰冻条件下(-20℃),按“1.3.1”项下的色谱条件分别于制备后0、3、6、9 d进样测定,记录峰面积。
1.3.10 重复性试验 精密量取同一血清样品适量,共3份,分别按照“1.3.3”项下供试品制备方法制备供试品溶液,按照“1.3.1”项下的色谱条件各取20 μL进样测定,记录峰面积。
1.3.11 加样回收率试验 精密量取同一血清样品适量,共4份,分别加入浓度为4.00、8.00、16.00、80.00 μg/L的25(OH)D3对照品溶液,按照“1.3.3”项下供试品制备方法制备供试品溶液,按照“1.3.1”项下的色谱条件各取20 μL进样测定,记录峰面积,计算方法的加样回收率。
1.3.12 样品含量测定 取30例健康成年人的血清样本,分别按照“1.3.3”项下供试品制备方法制备供试品溶液,按照“1.3.1”项下的色谱条件各取20 μL进样测定,记录峰面积,计算25(OH)D3的浓度。
1.4 统计学方法 采用SPSS16.0统计软件对结果进行统计分析。
2 结果
2.1 专属性试验结果 按照HPLC测定方法及相应浓度,绘制色谱图,见图1。由图可知该液相条件下,25(OH)D3的保留时间为12.55 min,出峰时间适宜,峰形良好,且能与其他峰有效地分离。

图1 25(OH)D3对照品(a)、供试品(b)和阴性对照品溶液(c)的HPLC色谱图
2.2 线性关系考察结果 以25(OH)D3浓度(X)为横坐标,峰面积(Y)为纵坐标作线性回归,得线性方程为:Y=1 900.7X+67.086(r=0.999 9,n=5)。结果表明25(OH)D3在4.00~160.00 μg/L浓度范围内与峰面积分值线性关系良好,最低定量限(LOQ)为4.00 μg/L。
2.3 精密度试验结果 血清25(OH)D3的日内精密度RSD为2.00%~4.62%,日间精密度RSD为2.68%~5.15%,表明该方法的重现性良好,符合要求。
2.4 稳定性试验结果 (1)血清25(OH)D3室温稳定性RSD为3.60%,表明血清样品在室温下6 h内稳定性良好;(2)血清25(OH)D3冷藏定性RSD为3.10%,表明血清样品在4℃下3 d内稳定性良好;(3)血清25(OH)D3冷冻稳定性RSD为2.92%,表明血清样品在-20℃下9 d内稳定性良好。
2.5 重复性试验结果 25(OH)D3的血清样品溶液重复性RSD=0.93%(n=3),表明本方法重复性良好。2.6 加样回收率试验结果 测定结果见表1。
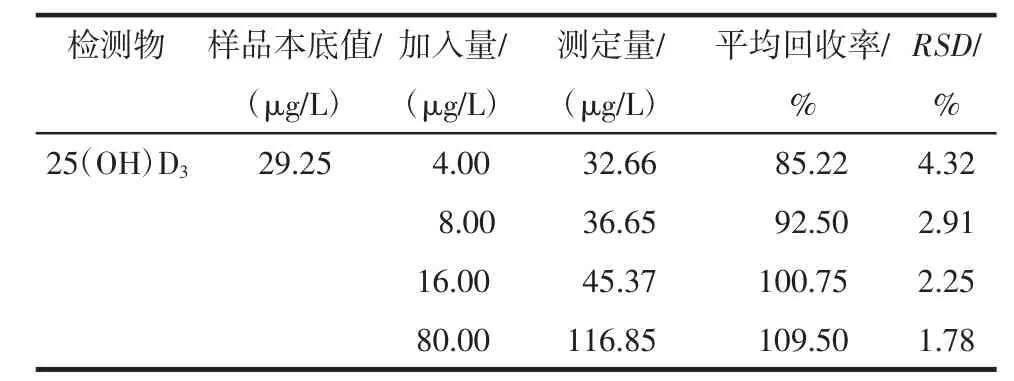
表1 25(OH)D3的平均加样回收率(n=4)
2.7 样品含量测定结果 30例健康成年人血清25 (OH)D3平均浓度为(38.14±14.74)μg/L,RSD小于4%。
3 讨论
3.1 测定方法的评价 CPBA、RIA法使用放射性核素、分析费时、不同试剂盒间存在差异,且抗体之间的交叉反应会导致免疫分析方法的特异性不足,而HPLC法不存在上述缺点,HPLC仪器复杂,但分析操作省时、省力,具有分离效能高、分析速度快、重复性好、节约成本、精确度高、可自动化等优点[9]。3.2 色谱条件的选择 (1)测定波长的选择:对25 (OH)D3标准溶液进行波长扫描,结果表明其最大吸收在波长265 nm处,故选择在此波长下进行25 (OH)D3的测定,避免了血清内源性杂质的干扰,提高了灵敏度。(2)色谱条件的确定:有文献采用乙腈作为流动相[10],考虑到乙腈毒性较大、价格昂贵,故改用甲醇-水为流动相。经多次试验,最终将流动相比例调为甲醇-水(95∶5),流速为1.0 mL/min,在此条件下,25(OH)D3出峰时间适宜,峰形良好,待测物能与其他杂质较好地分离。(3)样品提取溶剂的选择:曾分别用氯仿、正己烷提取血清中25(OH)D3,氯仿作为提取剂时,氮气吹干的时间较正己烷长,根据提取效果,最后确定用正己烷进行液-液萃取,血中杂质不影响被测组分的检出,同时获得了较高且稳定的提取回收率。
3.3 检测方法的应用 本研究的临床应用结果显示,健康成年人的血清25(OH)D3的均值为(38.14± 14.74)μg/L。这与相关文献[11]报道基本一致,表明本试验方法的准确性良好。
综上所述,本试验建立并验证了血清中25 (OH)D3的高效液相色谱测定方法,总体来说回收率高,精密度、准确性较好,可应用于未来血清25 (OH)D3的检测。
[1] Holick M F.Vitamin D:extraskeletal health[J].Rheum Dis Clin North Am,2010,39(2):381
[2] Kayaniyil S,Vieth R,Retnakaran R,et al.Association of vitamin D with insulin resistance and beta-cell dysfunction in subjects at risk for type 2 diabetes[J].Diabetes Care,2010,33(6):1379
[3] Gordon C M,Feldman H A,Sinclaer L,et al.Prevalence of vitamin D deficiency among healthy infants and toddlers[J].Arch Pediatr Adolesc Med,2008,162(6):505
[4] Mente A,Yusuf S,Islam S,et al.Metabolic syndrome and risk of acute myocardial Infarction a case-control study of 26903 subjects from 52 countries[J].J Am Coll Cardiol,2010,55(21):2390
[5] Christakos S,Ajibade D V,Dhawan P,et al.Vitamin D[J].Rheum Dis Clin North Am,2012,31(2):1
[6]云春凤,陈竞,柳桢,等.血清中25(OH)D3检测方法的研究进展[J].卫生研究,2014,43(4):661
[7] Kand’Ar R,Zakova P.Determination of 25-hydroxyvitamin D3in human plasma using HPLC with UV detection based on SPE sample preparation[J].J Sep Sci,2009,32(17):2953
[8] 王剑,朱玮琪,沈立松.高效液相色谱法测定血清中25-羟基维生素D3[J].检验医学,2008(4):380
[9] 刘春芳,刘彦华,汪云利,等.高效液相色谱法同时测定儿童血清中视黄醇、25-OH-维生素D3和α-生育酚浓度[J].现代生物医学进展,2009,9(1):131
[10]许强,刘金生,王轶鹏,等.反相高效液相色谱法测定维生素D2和维生素D3[J].理化检验(化学分册),2011(10):1168
[11]Zhang W,Stoecklin E,Eggersdorfer M.A glimpse of vitamin D status in Mainland China[J].Nutrition,2013,29(7):953
(2014-11-14收稿)
R15
A
1006-8147(2015)04-0348-03
刘怡欣(1988-),女,硕士在读,研究方向:营养与慢性病防治;通信作者:黄国伟,E-mail:huangguowei@tijmu.edu.cn。

