沉水植物恢复对湖泊沉积物产甲烷菌的影响研究
徐 思张 丹王艳云周巧红王亚芬刘碧云贺 锋吴振斌
(1. 武汉理工大学资源与环境工程学院, 武汉 430070; 2. 中国科学院水生生物研究所, 武汉 430072)
沉水植物恢复对湖泊沉积物产甲烷菌的影响研究
徐 思1, 2张 丹2王艳云2周巧红2王亚芬2刘碧云2贺 锋2吴振斌2
(1. 武汉理工大学资源与环境工程学院, 武汉 430070; 2. 中国科学院水生生物研究所, 武汉 430072)
为探明沉水植物恢复对湖泊沉积物中产甲烷菌的影响, 本文选用杭州西湖沉水植物恢复区域进行研究, 同时对比分析未进行沉水植物恢复区域。产甲烷菌多样性和群落结构分析采用限制性片段长度多态性分析(PCR-RFLP)及分子克隆等技术。研究结果表明, 沉水植物恢复区产甲烷菌OTU类型均数为13种, 高于沉水植物匮乏区域的9种; 并且沉水植物恢复区的Shannon指数、Simpson多样性指数较对照区分别高21.7% 和9.5%, 表明沉水植物的恢复有利于提高沉积物中产甲烷菌群落结构多样性。就产甲烷菌种类而言, 沉水植物的恢复对甲烷微菌纲 Methanomicrobia等影响不显著, 恢复区和匮乏区分别占 43.6%—67.4%、41.5%—58.1%。甲烷球菌纲Methanococci在沉水植物恢复区和匮乏区的存在量较少, 分别占1.7%和4.1%。而沉水植物的恢复一定程度上提高甲烷杆菌纲Methanobacteria的比例, 较匮乏区高14.6%, 且仅在恢复区检测到甲烷杆状热菌科Methanothermaceae和甲烷八叠球菌科Methanosarcinaceae。
沉水植物恢复; 沉积物; 产甲烷菌; 限制性片段长度多态性; 克隆
甲烷(CH4)是产甲烷菌在厌氧条件下分解有机质而产生的温室气体, 它对全球气候变暖的贡献仅次于CO2[1, 2]。自20世纪80年代, 甲烷的温室效应已达到20%, 且每年以0.8%—1.0%的速度增加, 可见甲烷对温室效应的作用越来越大。湖泊是大气CH4的主要来源, 目前国内对湖泊 CH4总释放量的研究主要集中在源与汇的探讨上[3—5]。在低温条件下, 我国八大淡水大型湖泊作为大气 CH4的源, 主要源于沉积物的产甲烷古菌, 其在厌氧条件下, 利用有机质作为能量来源, 以H2或甲酸盐为电子受体,产生并释放甲烷[6]。因此, 为全面了解甲烷释放的根源, 开展湖泊沉积物中产甲烷菌多样性和群落结构的研究显得尤为必要, 将为准确估算湖泊沉积物中CH4排放量提供数据支撑。
富营养化已日益成为一个全球范围内的水环境污染问题, 富营养化的加剧, 常伴随着藻类水华的暴发、水生动植物的急剧减少等现象[7]。目前湖泊沉水植物的恢复已经成为重建湖泊生态系统的重要措施之一[8]。研究表明沉水植物可改变湖泊沉积物的局部氧化还原状态, 影响着沉积物中微生物的活动及组成[9, 10]。作为湖泊沉积物中的厌氧功能细菌产甲烷菌, 其群落结构和多样性受沉水植物恢复的影响研究却少有报道[11]。为此, 本文以西湖为实验对象, 采用 PCR-RFLP和克隆文库的分子生物学方法, 通过对比沉水植物恢复湖区和未恢复湖区的产甲烷菌群落结构的差异性, 反映沉水植物的恢复对产甲烷菌群落结构的影响, 为揭示沉水植物在恢复过程中对湖泊甲烷气体的影响提供生物学支撑。
1 材料与方法
1.1 样品采集
样品采自杭州西湖沉水植物恢复区, 包括茅家埠、乌龟潭、浴湖湾(编号1Y、2Y、3Y), 以及沉水植物匮乏区, 包括外湖湖心、西里湖、北里湖(编号1N、2N、3N), 共 6个采样点, 中心位置为N30°14′45″, E120°08′30″, 采样点如图1。其中茅家埠、乌龟潭、浴湖湾在“十一五”水专项的支持下从2011年开始恢复沉水植物, 至采样期间水生植物盖度达到30%—70%, 而西湖外湖湖心、西里湖、北里湖湖区未进行水生植物恢复, 沉水植物盖度低于2%。
2013年 12月于相应位点采用柱状采泥器随机采集表层0—20 cm底泥样品3份, 混匀, 转移至实验室–80℃冰箱中保存, 以备后期DNA的提取和产甲烷菌群落结构的分析, 并采用哈希HQ40d便携式在线监测仪器监测记录水样相关理化指标, 手持测深仪(Speedtech SM-5)测定水深。
1.2 测定方法
沉积物含水率测定采用干燥恒重法, 土壤活性有机碳采用333 mmol/L KMnO4氧化法, 底泥总磷测定采用钼酸铵分光光度法(GB11893-89), 总氮采用过硫酸盐消化法(GB11894-89)。
1.3 DNA提取和PCR
沉积物总DNA提取采用SDS高盐抽提法, 并测定DNA的浓度和纯度。采用古菌16S rRNA的特异性引物对其进行PCR扩增, 正向引物A109f (5′-A CKGCTCAGTAACACGT-3′), 反向引物是 A912rt (5′-GTGCTCCCCCGCCAATTCCTTTA-3′)[12, 13]。30 μL 的PCR反应液组成: TaKaRa Taq HS(5 U/μL)0.2 μL、10×PCR Buffer 3 μL、dNTP Mixture (Mg2+) 2.4 μL、DNA Template 1 μL、引物各1 μL, 灭菌蒸馏水稀释至30 μL。PCR反应条件为: 94℃预变性5min, 94℃变性60s、54℃退火90s、72℃延伸60s, 反应35个循环, 最后72℃延伸6min, 4℃保温。采用Gel Extraction Kit (EZgeneTM)对3次的PCR平行产物进行切胶纯化回收目的片段, 以去除小片段的 DNA分子等杂质。
1.4 克隆及RFLP

图1 杭州西湖采样位点图(黑色方块)Fig. 1 Sampling sites in the West Lake, Hangzhou (Black block)
将PCR产物连接到pMD18-T Vector (TakaRa),然后转入大肠杆菌 DH5α, 建立克隆文库, 其中10 μL的连接液组成: Insert DNA 4.5 μL、pMD18-T Vector 1 μL, 灭菌蒸馏水稀释至10 μL。每个文库选取45个阳性克隆, 通过16S rRNA的引物对A109f/ A912rt进行扩增, 产物用限制性内切酶HaeⅢ于37℃酶切3—4h, 产物通过2.0%的琼脂糖凝胶电泳检测,具有相同酶切条带的阳性克隆子定义为一个分类操作单元, 即OTU。将不同的OTU进行测序分析, 测序由上海睿迪生物科技有限公司完成。16S rRNA基因的测序结果通过BLAST(http://www.Ncbi.nlm.nih. gov/blast)进行数据库比对, 然后使用 MEGA (Molecular Evolutionary Genetics Analysis)软件, 运用最相似进化距离法(MJ法)构建系统发育树。
1.5 数据处理与分析
数据的统计分析主要使用Excel软件、origin软件进行, 产甲烷菌群落结构和多样性分析采用克隆文库覆盖率、Shannon指数和Simpson指数等指标,其中计算公式如下:

其中, i为第i个采样点; s为采样咪总数; ni为第i个采样点的OUT种类数; Ni为第i个采样点的阳性克隆子数; Pi为第i个采样点的OUT种类数占阳性克隆子数的比例。
2 结果
2.1 采样区理化指标分析
沉水植物恢复区(1Y、2Y和3Y)主要为狐尾藻、菹草, 且透明度见底, 而沉水植物匮乏区(1N、2N、3N)几乎无沉水植物存在, 采样点各理化指标如表1。其中, 湖泊沉水植物恢复区的水深较匮乏区存在显著差异, 均值相差90 cm。沉水植物恢复区的水体pH均值为7.78, 较匮乏区的均值pH低0.23。种植沉水植物的湖泊区域, 其底泥温度普遍较匮乏区的低, 同一时期最大温差达2.0℃。对于采样点的底泥含水率, 沉水植物恢复区的含水率集中在 50.0%—65.0%, 而匮乏区的底泥含水率均高于前者, 其最大含水率较沉水植物恢复区含水率的均值高出39.2%,表明沉水植物的根系环境对湖泊底泥起到一定的固定作用, 从而影响微生物的栖息区域。相对于匮乏区, 沉水植物恢复区的氧化还原电位(ORP)较低,约为–130 mV, 可能因为冬季部分沉水植物根系逐渐衰亡腐败, 生物残留使得沉积物局部缺氧[14]。另外, 沉水植物恢复区沉积物的氮均值显著高于匮乏区, 约为2.608 g/kg, 而恢复区和匮乏区的沉积物中总磷含量相差不大, 集中在0.508—0.797 g/kg。恢复区中活性有机碳最大值较匮乏区活性有机碳均值低 16.34 mg/kg, 该差值几乎占到恢复区活性有机碳均值的 36.4%, 说明沉水植物的恢复在一定程度上促进细菌包括产甲烷菌群落对活性有机碳的间接利用率。
2.2 克隆文库分析
沉水植物恢复区和匮乏区的16S rRNA克隆文库的阳性克隆子总数分别为132、124, 阳性克隆经过限制性酶 HaeIII酶切, 凝胶电泳分析后, 共得到24种不同条带类型, 分别命名为OTU1-OTU24, 其中沉水植物恢复区和匮乏区的克隆文库 OTU类型数分别为 16、15种。6个克隆文库的覆盖率介于67.4%—81.4%, 说明实验分析的阳性克隆子数较好地反映采样位点处产甲烷菌群落结构的多样性, 代表性比较高。反映克隆文库中 OTU的丰度和均匀度的综合性指标Shannon指数、Simpson多样性指数如表2, 可以得出, 沉水植物恢复区的多样性指数较匮乏区分别高21.7%、9.5%, 表明基于16S rRNA的产甲烷菌群落结构多样性在沉水植物恢复区表现得更高。
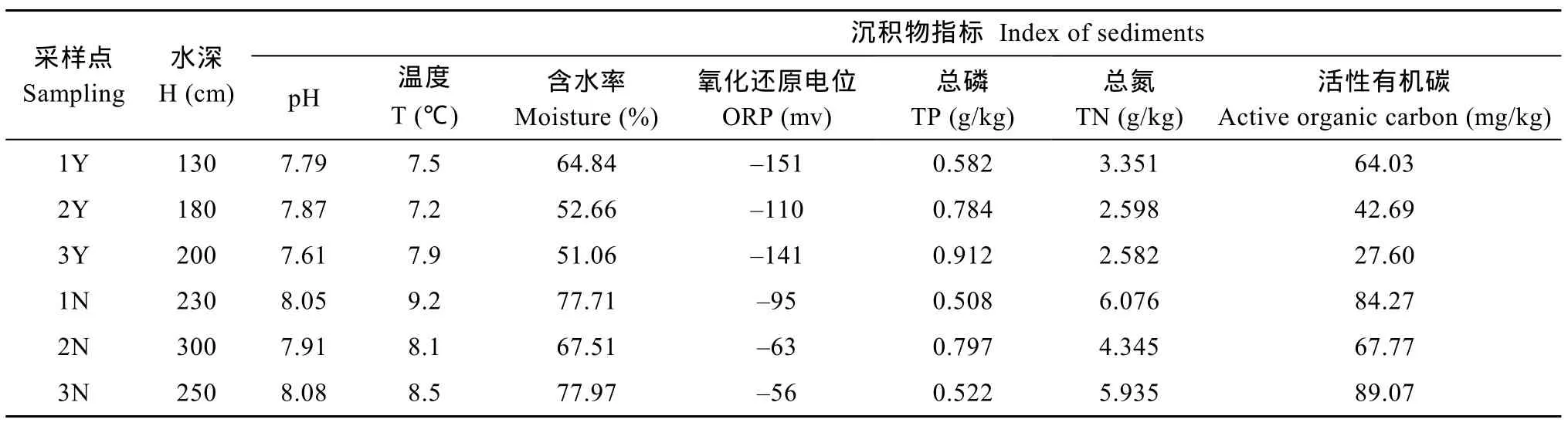
表1 湖泊沉水植物恢复区和匮乏区的主要理化指标Tab.1 Major physicochemical indicators of the submerged macrophytes rehabilitation (SMR) areas and scarce areas
2.3 限制性片段长度多态性分析RFLP
沉水植物恢复区和匮乏区所对应各采样点, 各个克隆文库的 OTU所占比值如图 2所示。其中, OTU1、OTU9共同存在于沉水植物恢复区和匮乏区的采样点中, 分别占两者总 OTU数量的 47.0%和53.0%, 为湖泊产甲烷菌群落优势种的条带类型。OTU6、OTU7、OTU19、OTU20、OTU22共5种OTU类型均匀的分布在恢复区和匮乏区。从表3可以得出, 沉水植物恢复区的独特 OTU类型数达到 9种,较匮乏区的独有OTU类型数多2种, 两采样区的独特OTU统计如表3, 恢复区的独特OTU类型主要分布在典型和常见OTU类型中, 占该采样区总OTU类型数的50.0%。而匮乏区的独特OTU类型主要为罕见OTU类型, 占该匮乏区总OTU类型数的30.0%。
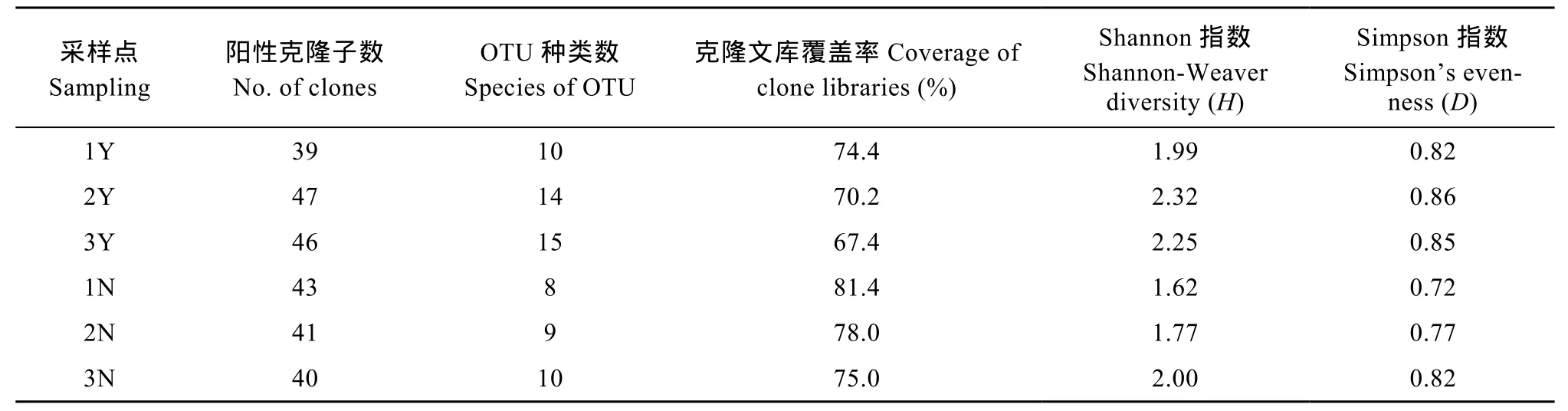
表2 基于RFLP类型的沉水植物恢复区和匮乏区的克隆文库多样性指标Tab. 2 The diversity indices of the SMR areas and the scarce areas based on RFLP patterns

图2 沉水植物恢复区(1Y、2Y、3Y)和匮乏区(1N、2N、3N)的OTU所占比例图Fig. 2 OTU proportion of the SMR areas and the scarce areas

表3 沉水植物恢复区和匮乏区的OTU分类统计表Tab. 3 OTU classification of the SMR areas and the scarce areas
2.4 系统发育树分析
产甲烷菌 16SrRNA的测序结果与已知系列进行比对, 相似度为 83%—100%, 其中相似度达到97%的序列占到 60.0%。产甲烷菌属于古菌域的广古菌界, 目前主要分为甲烷微菌目 Methanomicrobiales、甲烷八叠球菌目Methanosarcinales、甲烷杆菌目 Methanobacteriales、甲烷球菌目 Methanococcales、甲烷火菌目Methanopyrales, 前四者在本次研究中均有检测到。根据产甲烷菌的生存环境和形态的差异性, 各甲烷菌目可衍生出群落结构多样性的甲烷菌科和甲烷菌属等。
产甲烷古菌16S rRNA的系统发育树如图3, 文库中 53.4%的序列为甲烷微菌纲 Methanomicrobia,如属于甲烷微菌目 Methanomicrobiales的甲烷产生菌属Methanogenium、甲烷囊菌属Methanoculleus、Methanoregulaceae和甲烷蝇菌属Methanolinea等。其中, 与甲烷八叠球菌目 Methanosacrinales相近的菌群主要来源于三峡库区的稻田底泥和 Monoun湖区的缺氧沉积物, 相似度达到 97%; 与 Methanoregulaceae相近的菌群主要来源于厌氧消化器中的微生物群落, 该菌大量的存在于春季的沼泽地中。
西湖沉水植物恢复区和匮乏区沉积物产甲烷菌测序结果表明, 甲烷微菌纲 Methanomicrobia在两大采样区中的差异性不显著, 其作为优势纲, 分别占到43.6%—67.4%、41.5%—58.1%, 主要有甲烷微菌目Methanomicrobiales、甲烷八叠球菌目Methanosacrinals, 其中甲烷微菌目Methanomicrobiales分别占沉水植物恢复区和匮乏区中甲烷微菌纲Methanomicrobia的93.5%和78.8%, 说明种植沉水植物对西湖底泥产甲烷菌的优势种甲烷微菌纲 Methanomicrobia影响不大。甲烷杆菌纲Methanobacteria在匮乏区的仅一个采样点存在, 约为该采样点总菌数的2.4%, 比例较低, 但在沉水植物恢复区的三个采样点均有检测到, 部分比例高达 17.0%, 受沉水植物的影响比较显著。甲烷球菌纲Methanococci在沉水植物恢复区和匮乏区的存在量较少, 分别占到1.7% 和4.1%。在沉水植物恢复区和匮乏区中, 同时存在大部分未知古菌。
沉水植物恢复区和匮乏区的四大产甲烷菌目下级的各产甲烷菌科的比例如图 4所示, 甲烷微菌科Methanomicrobiaceae大量的存在于采样区域, 为优势产甲烷菌科, 与其同属于产甲烷微菌目的甲烷八叠球菌科Methanosarcinaceae仅在沉水植物恢复区中发现。另外, 甲烷鬃菌科Methanoseataceae、甲烷暖球菌科 Methanocaldococcaceae、甲烷杆菌科Methanobacteriaceae这3种产甲烷菌科均存在于两大采样区, 而前两者在沉水植物恢复区的比例明显较匮乏区低。甲烷热菌科 Methanothermaceae仅存在于沉水植物恢复区。
3 讨论
现阶段, 国内外对湖泊沉水植物的恢复对沉积物中产甲烷菌群落结构和多样性的研究较少, 产甲烷菌作为专性厌氧菌, 理论上仅能生存于低含氧量且含有 H2/甲酸盐的环境中, 其群落结构多样性的研究也大部分集中在自然湿地等厌氧生境[15—20]。佘晨兴等[21]研究表明, 在闽江口芦苇沼泽湿地存在着3大类群: 甲烷杆菌目 Methanobacteriales、甲烷微菌目Methanomicrobiales、甲烷八叠球菌目Methanosarcinales, 且该区域不同土壤深度的甲烷菌群落分布呈现出不同的特征。Galand等[22]采用DGGE和RFLP等方法, 研究表明泥炭地中施灰肥对甲烷的潜在产生力和产甲烷菌群落结构没有显著影响, 且深层和浅层泥炭层中主要存在着氢营养型产甲烷菌。Glissmanm等[23]研究德国东北部Dagow湖泊沉积物发现, 温度变化首先会影响产甲烷菌的功能活性, 其次是产甲烷菌群落结构。上述也为在沉水植物恢复区和匮乏区的底泥中检测到大量的产甲烷菌群落的研究提供实例支撑。
沉水植物作为湖泊水体中的高等植物, 对水生生态系统的维持、物质循环和能量传递中起着重要的调控作用[24]。本文研究发现沉水植物恢复区产甲烷菌群落结构的多样性均较匮乏区的高, 主要表现在沉水植物恢复区的克隆子经过限制性片段长度的多态性分析, 湖区的 OTU类型平均数多达13种, 明显高于匮乏区平均9种OTU类型。在沉水植物恢复区, 植物根系和沉积物大面积地接触,根系黏附作用吸附根系局部区域凝集的菌胶体,可防止由于水流的搅动而破坏细菌的生态位, 为产甲烷菌的生存提供较大的固定空间, 从物理层面上解释沉水植物恢复区中产甲烷菌群落结构多样性较匮乏区的高。

图3 沉水植物恢复区和匮乏区基于16S rRNA的系统发育树Fig. 3 The phylogenetic tree of the SMR areas and the scarce areas based on 16S rRNA

图 4 各产甲烷菌科在沉水植物恢复区和匮乏区的比例图(‘M.’为‘Methano’缩写)Fig. 4 The proportion of methanogens in the SMR areas and the scarce areas (‘M.’ for ‘Methano’)
在沉水植物存在下, 沉积物中氮磷浓度会呈现不同程度的降低[25]。在本研究中沉水植物恢复区总氮也有一定的降低, 但沉积物总磷在恢复区和匮乏区中差异不显著。可能原因是野外试验各区域中本底营养盐浓度的差异; 已有的研究主要采用室内实验进行相应环境因子的人为控制, 进而能比较出沉水植物对沉积物中营养盐的影响。
沉水植物恢复区的ORP值较匮乏区的低, 原因可能是沉水植物最适生长季节的差异性, 使得临近冬季采样时, 恢复区中部分种类的沉水植物处于生长旺盛期, 比如菹草, 而狐尾藻、金鱼藻等沉水植物开始出现衰亡现象, 衰亡沉水植物根系的腐败引起沉积物中厌氧微生物的活性增强, 碳源消耗速率加快。虽然旺盛期沉水植物根系具有泌氧功能, 但对沉积物ORP的贡献率较前者小, 两者的综合作用使得恢复区的ORP较低, 也为厌氧菌产甲烷菌的群落结构多样性提供依据。
Lee等[26]通过DNA稳定同位素13C探针检测方法, 证实在甲酸盐和 H2/CO2存在的土壤微环境中,亦存在着甲烷八叠球菌属 Methanosarcina、甲烷杆菌属Methanobacterium等的生长。Leybo等[27]研究表明在稳定条件下, 乙酸、H2/CO2两种营养型产甲烷菌比例为 2∶1, 其中仅属于甲烷八叠球菌科Methanosarcinaceae的甲烷菌群可以利用乙酸、甲酸和甲基, 其他产甲烷菌目皆只能利用H2/CO2或甲酸基质[28]。这说明Methanosarcinaceae可利用的营养基质较其他产甲烷菌丰富, 沉水植物根部吸收底泥中的营养物质, 通过同化作用将营养物质转化为自身生长所需的物质, 同时也不断地向沉积物中分泌大量的有机化合物(碳水化合物、氨基酸以及有机酸等)[29], 可供根系产甲烷菌利用; 另外部分发酵性细菌可代谢这些有机物, 产生多种有机酸(主要成分为乙酸)[30], 而丰富的代谢基质也选择性存在着结构多样性的产甲烷菌, 这也解释仅在沉水植物恢复区中检测到 Methanosarcinaceae, 且甲烷杆菌目在恢复区中大量存在。由于氢营养型的甲烷微菌目Methanomicrobiales生长周期较其他产甲烷菌目短, 且营养利用效率高, 故在沉水植物恢复区和匮乏区都是作为优势种存在, 没有显著差异。在我国鄱阳湖、洪泽湖和青藏高原若盖尔湿地均有检测出该菌[31, 32]。
从微生物角度开展沉水植物恢复对湖泊沉积物中产甲烷菌群落结构和多样性的影响研究, 为更深层次的研究湖泊甲烷释放提供生物学支撑。对单种沉水植物或者其覆盖率、不同生长期对产甲烷菌结构多样性的影响是否存在, 后期还需通过大量的实验来佐证。并且湖泊底泥产甲烷菌的群落多样性及其分布与甲烷气体的最终逸出量的相互关系也是今后研究的一大重点, 将沉水植物的恢复情况与甲烷气体释放的紧密结合也是湖泊研究需考虑的热点。
致谢:
本研究采样过程中课题组常驻西湖工作站同学提供诸多帮助, 及资料整理过程中, 左进城博士提供相关数据, 在此表示感谢; 并感谢课题组张甬元、刘保元老师的悉心指导。
[1] Xing Y, Xie P, Yang H, et al. Methane and carbon dioxide fluxes from a shallow hypereutrophic subtropical Lake in China [J]. Atmospheric Environmeny, 2005, 39(30): 5532—5540
[2] Pangala S R, Reay D S, Heal K V. Mitigation of methane emissions from constructed farm wetlands [J]. Chemosphere, 2010, 78(5): 493—499
[3] Ai Y P, Wang X K, Gong X F, et al. Evolutions and seasonal characteristics of methane concentrations on urban lake in Beijing [J]. Urban Environment & Urban Ecology, 2009, 22(6): 1—5 [艾永平, 王效科, 弓晓峰, 等. 北京市城市湖泊上空甲烷浓度水平和季节特征. 城市环境与城市生态, 2009, 22(6): 1—5]
[4] Sha C Y. Methane emissions from seasonal created riverine wetland [J]. Ecology and Environmental Science, 2012, 21(7): 1271—1276 [沙晨燕. 季节性人工河滨湿地甲烷排放. 生态环境学报, 2012, 21(7): 1271—1276]
[5] Zhao W, Zhu K X, Huang W M, et al. Temporal-spatial patterns of methane emission flux and itsinfluence factors in Hubei part of Three Gorges Reservoir [J]. Acta Hydrobiological Sinica, 2013, 37(4): 776—779 [赵玮, 朱孔贤, 黄文敏, 等. 三峡水库湖北段甲烷排放通量时空特征及其影响因素分析. 水生生物学报, 2013, 37(4): 776—779]
[6] Chen Y G, Bai X H, Li X H, et al. A primary study of the methane flux on the water-air interface of eight lakes in winter, China [J]. Lake Sciences, 2007, 19(1): 11—17 [陈永根, 白晓华, 李香华, 等. 中国8大湖泊冬季水-气界面甲烷通量初步研究. 湖泊科学, 2007, 19(1): 11—17]
[7] Ning M, Ye W H. Analysis and guaranteeing countermeasures for water environment security of China freshwater lake [J]. Acta Scientiarum Naturalium Universitatis Pekinensis, 2009, 45(5): 848—854 [宁淼, 叶文虎. 我国淡水湖泊的水环境安全及其保障对策研究. 北京大学学报, 2009, 45(5): 848—854]
[8] Zhang C, He F, Gao X H, et al. Restoration efficiency of submerged macrophytes with three planting patterns [J]. Bulletin of Botanical Research, 2012, 32(5): 603—608 [张聪,贺锋, 高小辉, 等. 3种种植方式下沉水植物恢复效果研究.植物研究, 2012, 32(5): 603—608]
[9] Clarke S J, Wharton G. sediment nutrient characteristics and aquatic macrophytes in lowland englishrivers [J]. Sciences of the Total Environment, 2001, 266(1-3): 103—112
[10] Li L L, Tang X M, Gao G, et al. Influence of submerged vegetation restoration on bacterial diversity and community composition in West Lake [J]. Journal of Lake Science, 2013, 25(2): 188—198 [李琳琳, 汤向明, 高光, 等. 沉水植物生态恢复对西湖细菌多样性及群落结构的影响. 湖泊科学, 2013, 25(2): 188—198]
[11] Galand P E, Fritze H, Yrjala K. Microsite-dependent changes in methanogenic popμlations in a boreal oligotrophic fen [J]. Environmental Microbiology, 2003, 5(11): 1133—1143
[12] Danielsson R, Schnürer A, Arthurson V, et al. Methanogenic population and CH4Production in swedish dairy cows fed different levels of forage [J]. Applied and Environmental Microbiology, 2012, 78(17): 6172—6179
[13] Banning N, Brock F, Fry J C, et al. Investigation of the methanogen population structure and activity in a brackish lake sediment [J]. Environmental Microbiology, 2005, 7(7): 947—960
[14] Desmet N J S, Belleghem S V, Seuntjens P, et al. Quantification of the impact of macrophytes on oxygen dynamics and nitrogen retention in a vegetated lowland river [J]. Physics and Chemistry of the Earth, 2011, 36(12): 479—489
[15] Sun C L, Brauer S L, Cadillo-Quiroz H, et al. Seasonal changes in methanogenesis and methanogenic community in three peatlands, New York State [J]. Frontiers in Microbiology, 2012, 3(81): 1—5
[16] Görres C M, Conrad R, Petersen S O. Effect of soil properties and hydrology on Archaeal community composition in three temperate grasslands on peat [J]. Fems Microbiology Ecology, 2013, 85(2): 227—240
[17] Conrad R, Klose M, Noll M. Functional and structural response of the methanogenic microbial community in rice field soil to temperature change [J]. Environmental Microbiology, 2009, 11(1): 1844—1853
[18] Watanabe T, Asakawa S, Nakamura A, et al. DGGE method for analyzing 16S rDNA of methanogenic archaeal community in paddy field soil [J]. Fems Microbiology Letters, 2004, 232(2): 153—163
[19] Conrad R, Klose M. Dynamics of the methanogenic archaeal community in anoxic rice soil upon addition of straw [J]. European Journal of Soil Science, 2006, 57(4): 476—484
[20] Liu G C, Tokida T, Matsunami T, et al. Microbial community composition controls the effects of climate change on methane emission from rice paddies [J]. Environmental Microbiology Reports, 2012, 4(6): 648—654
[21] She C X, Tong C. Vertical distribution of methan- ogen community structures in Phragmites australis marsh soil in the Min River estuary [J]. Acta Ecologica Sinica, 2012, 32(17): 5299—5308 [佘晨兴, 仝川. 闽江口芦苇沼泽湿地土壤产甲烷菌群落结构的垂直分布. 生态学报, 2012, 32(17): 5299—5308]
[22] Galand P E, Juottonen H, Fritze H, et al. Methanogen communities in a drained bog: Effect of ash fertilization [J]. Microbial Ecology, 2005, 49(2): 209—217
[23] Glissman K, Chin K J, Casper P, et al. Methano- genic pathway and archaeal community structure in the sediment of eutrophic Lake Dagow: Effect of temperature [J]. Microbial Ecology, 2004, 48(3):389—399
[24] Liu Y C, Lei Y J, Liang C, et al. Changes of submerged macrohhyte community structure and water quality in the process of ecosystem restoration of a shallow eutrophic lake [J]. Ecological Science, 2008, 27(5): 376—379
[25] Wang L Z, Wang G X, Yu Z F, et al. Influence of submerged Macrophytes on Phosphorus transferce between sediment and overlying water in the growth period [J]. Environmental Science, 2012, 33(2): 387—390 [王立志, 王国祥, 俞振飞, 等. 沉水植物生长期对沉积物和上覆水之间磷迁移的影响, 环境科学, 2012, 33(2): 387—390]
[26] Lee C G, Watanabe T, Murase J, et al. Growth of methanogens in anoxic soil microcosm: Elucidation by a DNA-SIP experiment using13C-labeled dried rice callus [J]. Applied Soil Ecology, 2012, 58(2012): 37—44
[27] Leybo A I, Netrusov A I, Conrad R. Effect of hydrogen concentration on the community structure of hydrogenotrophic methanogens studied by T-RFLP analysis of 16S rRNA gene amplicons [J]. Microbiology, 2006, 75(6): 683—688
[28] Avery G B, Shannon R D, White J R, et al. Controls on methane production in a tidal freshwater estuary and apeatland: methane production via acetate fermentation and CO2reduction [J]. Biogeochemistry, 2003, 62(1): 19—37
[29] Wang C, Wang P F, Tang J S, et al. Ammonia sorption and retention characters in the riparian reed zone [J]. Advances in Water Science, 2003, 14(3): 311—317 [王超, 王沛芳, 唐劲松, 等. 河道沿岸芦苇带对氨氮的削减特性研究. 水科学进展, 2003, 14(3): 311—317]
[30] Wang H, Pang Y, Liu S B, et al. Research progress on influencing of environmental factors on the growth of submersed macrophyte [J]. Acta Ecologica Sinica, 2008, 28(8): 3958—3967 [王华, 逢勇, 刘申宝, 等. 沉水植物生长影响因子研究进展, 生态学报, 2008, 28(8): 3958—3967]
[31] Liu D Y, Ding W X, Jia Z J, et al. The impact of dissolved organic carbon on the spatial variability of methanogenic archaea communities in natural wetland ecosystems across China [J]. Applied Microbiology and Biotechnology, 2012, 96(1): 253—256
[32] Zhang G S, Jiang N, Liu X L, et al. Methanogenesis from Methanol at Low Temperatures by a Novel Psychrophilic Methanogen, “Methanolobuspsychrophilus” sp. nov., Prevalent in Zoige Wetland of the Tibetan Plateau [J]. Applied and Environmental Microbiology, 2008, 74(19): 6114—6120
IMPACTS OF SUBMERGED MACROPHYTES REHABILITATION ON THE METHANOGENIC COMMUNITY IN THE SEDIMENT OF FRESHWATER LAKES
XU Si1, 2, ZHANG Dan2, WANG Yan-Yun2, ZHOU Qiao-Hong2, WANG Ya-Fen2, LIU Bi-Yun2,
HE Feng2and WU Zhen-Bin2
(1. School of Resource & Environmental Engineering, Wuhan University of Technology, Wuhan 430070, China; 2. Institute of Hydrobiology, Chinese Academy of Sciences, Wuhan 430072, China)
In this study, we investigated the impacts of submerged macrophytes rehabilitation (SMR) on the methanogenic community structure in the lake sediments. We compared the diversity and structure of methanogenic populations between the SMR areas and the plant scarce areas in the West Lake of Hangzhou by using restriction fragment length polymorphism (PCR-RFLP) and molecular cloning techniques. The results showed that the average OTU type number in the SMR areas was 13, and the number was 9 in the scarce areas. Shannon-Weaver diversity and Simpson’s evenness in the SMR areas were 21.7% and 9.5% respectively, which were higher than those in the control areas. This indicated that the diversity of the methanogenic community structure could be improved by the rehabilitation of submerged macrophytes. The in-depth analysis suggested that SMR had no significant effect on Methanomicrobia that accounted for 43.6%—67.4% and 41.5%—58.1% in the SMR areas and the scarce areas respectively. Methanococci was rare in both the SMR areas (1.7%) and the scarce areas (4.1%). We also found that the proportion of Methanobacteria in the SMR areas was 14.6% higher than in the scarce areas. Methanothermaceae and Methanosarcinaceae were only detected in the SMR areas.
Submerged macrophytes rehabilitation; Sediment; Methanogens; RFLP; Clone
X172
A
1000-3207(2015)06-1198-09
10.7541/2015.156
2014-09 -30;
2015-05-25
水体污染控制与治理科技重大专项(2012ZX07101007-005); 国家自然科学基金(31123001); 湖北省自然科学基金(2010CDA066)资助
徐思(1990—), 女, 湖北随州人; 硕士; 主要研究环境微生物学。E-mail: xusi1990@126.com
周巧红(1977—), 女, 湖北罗田人; 副研究员, 硕士生导师; 主要从事环境微生物学研究。E-mail: qhzhou@ihb.ac.cn
——以武汉紫阳湖为例

