日本沼虾MT基因克隆、组织差异性表达及与饲料铜、锌含量的相关性
孔有琴陈立侨丁志丽李二超叶金云杜震宇
(1. 华东师范大学生命科学学院, 上海 200241; 2. 湖州师范学院生命科学学院,浙江省水生生物资源养护与开发技术研究重点实验室, 湖州 313000)
日本沼虾MT基因克隆、组织差异性表达及与饲料铜、锌含量的相关性
孔有琴1, 2陈立侨1丁志丽1, 2李二超1叶金云2杜震宇1
(1. 华东师范大学生命科学学院, 上海 200241; 2. 湖州师范学院生命科学学院,浙江省水生生物资源养护与开发技术研究重点实验室, 湖州 313000)
为了更全面理解日本沼虾(Macrobrachium nipponense)的铜/锌营养生理作用, 研究利用RACE技术从日本沼虾肝胰腺中克隆获得一金属硫蛋白基因cDNA全长(mn-MT), 并对该基因分子特征、组织表达谱和饲料铜/锌水平对其表达的影响进行分析。结果显示: (1)mn-MT cDNA全长665 bp, 含编码59个氨基酸的180 bp的开放阅读框, 预测该多肽的理论分子量为6.085 kD, 等电点为7.73。该蛋白中半胱氨酸含量最高(30.5%),其次是赖氨酸(16.95%)和丝氨酸(10.17%)。相似性分析显示 mn-MT氨基酸序列与美洲海螯虾、斑节对虾和中华绒螯蟹MT的相似性分别达到78%、75%和75%。(2)qRT-PCR分析显示, mn-MT mRNA在肝胰腺、血细胞、鳃、胃、卵巢、肠和肌肉中都有表达, 其中肝胰腺中表达量最高。(3)用4组铜添加量分别为0、20、40及160 mg/kg的饲料和3组锌添加水平分别为0、35和210 mg/kg的饲料饲喂初重为(0.101±0.002) g日本沼虾56d后, 分析各组虾肝胰腺的mn-MT mRNA表达。mn-MT mRNA表达随饲料铜水平的提高而升高, 到40 mg/kg组达到最高(P<0.05), 而后开始下降; 饲料中高锌(210 mg/kg)显著提高mn-MT表达(P<0.05), 0和35 mg/kg组间差异不显著(P>0.05)。结果表明饲料中铜/锌均可影响mn-MT表达, 且呈现不同的剂量依赖效应。
日本沼虾; 金属硫蛋白; 铜; 锌; mRNA表达
金属硫蛋白(Metallothionein, MT)是一类低分子量、分布广、保守的金属结合蛋白, 其氨基酸组成中含有大量半胱氨酸, 对金属离子具有高亲和力,参与微量元素的吸收、代谢, 还具有清除自由基、增强机体免疫力和抗应激的作用[1, 2]。1957年, MT首次在马(Equus caballus)肾中被发现[3]。MT作为一种可被诱导的蛋白质, 其表达受多种金属暴露[4—6]、感染和辐射等其他物化处理[7, 8]的诱导, 其中金属离子是主要的诱导因子, 如水体镉、铜或锌暴露均可显著提高朝鲜(Hemibarbus mylodon)肝脏和肾脏中MT表达水平[9]。
铜和锌均是动物体生长和代谢活动所必需的微量元素, 具重要生理功能[10], 金属硫蛋白对它们具有较强的结合力, 形成铜/锌-金属硫蛋白复合物[11]。迄今, 学者对水体中铜/锌暴露对水生动物MT表达影响研究较多, 且侧重于探讨 MT作为水环境污染生物标记分子的筛选等[5]。铜/锌是动物体所必需的微量元素, 分析饲料中铜/锌水平与MT表达间关系可以更全面、深入理解铜/锌的营养生理, 此类研究多见于脊椎动物[12]。
日本沼虾(Macrobrachium nipponense)又称河虾、青虾, 属甲壳纲、十足目、长臂虾科, 是我国主要淡水养殖品种之一。近年来, 我国日本沼虾养殖业快速发展, 推动对其生物学特性、营养生理学研究的需求, 但目前对日本沼虾的基础研究还较薄弱。关于微量元素铜/锌只有饲料中适宜需求量确定、铜/锌水平对虾的生长性能、抗氧化力影响等的报道[13, 14]。为深入理解营养素的功能和作用机制,探讨分析营养素对相关基因表达的影响已成为水产动物营养学研究重点之一。本研究通过克隆日本沼虾 MT基因, 并分析各组织中的表达变化, 旨在了解日本沼虾MT基因的结构、功能和组织表达特征;同时观测饲料中铜/锌水平变化对MT基因表达的影响, 以期为日本沼虾 MT基因作用机制和微量元素代谢机理提供理论依据。
1 材料与方法
1.1 实验材料
实验用日本沼虾于2013年3—5月购于上海市普陀区铜川路水产市场, 先于实验室内用曝气自来水暂养一周, 而后选取健康活泼的个体, 活体解剖取肝胰腺、鳃、肠、肌肉、卵巢和胃等组织, –80℃保存, 用于总RNA提取。同时用1 mL无菌注射器从日本沼虾第三步足基部采集血淋巴, 加入等量预冷的抗凝剂[15], 4℃、8000 ×g离心10min, 收集血细胞, –80℃保存, 用于总RNA提取。
1.2 总RNA提取及反转录
采用组织/细胞 RNA快速提取试剂盒(Aidlab,北京)提取总RNA, 提取的总RNA用1%琼脂糖凝胶电泳检测RNA的完整性, 与此同时, RNA纯度和浓度用Thermo NanoDrop 2000核酸蛋白测定仪检测。用 Takara (大连)反转录试剂盒 PrimeScriptTMRT reagent Kit将总RNA反转录合成cDNA, 并于–20℃保存备用。
1.3 mn-MT基因cDNA克隆
从本实验室的日本沼虾cDNA文库中获得一条MT的EST序列。根据该EST序列设计引物mnMT-3′GSP和 mnMT-5′GSP(生工合成, 上海, 表 1)各一条用于3′和5′-RACE扩增mn-MT cDNA全长。运用SMARTerTMRACE cDNA Amplification Kit (Clonch,美国)将日本沼虾肝胰腺总 RNA分别反转录合成3′-RACE cDNA和5′-RACE cDNA, 而后根据该试剂盒推荐的条件以这些cDNA为模板进行PCR反应。PCR产物用柱式DNA胶回收试剂盒(生工, 上海)回收纯化后与pUCm-T载体(生工, 上海)连接, 转化至大肠杆菌感受态细胞 DH5α, 选择阳性克隆进行测序(生工, 上海)。所得序列经NCBI的BLAST比对确定属于MT基因。
1.4 mn-MT序列分析
用 NCBI的 ORF Finder程序(http://www.ncbi. nlm.nih.gov/gorf/)寻找 mn-MT序列的开放阅读框和预测编码氨基酸序列; 用NCBI BLAST程序(http:// www.ncbi.nlm.nih.gov/)比较 MT的序列相似性; 日本沼虾MT基因的氨基酸序列与NCBI数据库中其他动物 MT的氨基酸序列的多重比对分析使用ClustalX软件, 而后使用MEGA 5.1程序(http://www. megasoftware.net/)中的Neighbor Joining法构建系统树。
1.5 mn-MT在不同组织中的表达
用荧光定量PCR (qRT-PCR)对MT在日本沼虾肝胰腺、肌肉、鳃、肠、血细胞、卵巢和胃中表达进行定量分析, β-actin作为qRT-PCR反应中的内参基因。qRT-PCR中, mn-MT和β-actin基因的特定引物分别是mnMT-s、mnMT-a、β-actin-s 和β-actin-a(表 1)。采用 Takara的实时荧光定量试剂盒 SYBR Premix Ex Taq 进行 PCR反应。PCR反应体积为20 μL, 包括10 μL 2 × SYBR Green Premix Ex Taq、引物(10 μmol/L)各 0.2 μL、1 μL cDNA、8.6 μL ddH2O。qRT-PCR反应条件为: 95℃预变性30s; 94℃变性15s、58℃退火20s、72℃延伸 20s, 共40个循环; PCR反应后绘制融解曲线以判断扩增产物的正确性, 温度以0.5℃/5s的速度从60℃上升到95℃。使用2–ΔΔCt方法对mn-MT表达水平进行分析[16]。

表1 引物序列Tab. 1 The primer sequence
1.6 饲料中铜/锌水平对mn-MT mRNA表达的影响
以酪蛋白和鱼粉作为蛋白源, 鱼油和大豆油作为脂肪源配制半纯化基础饲料。根据日本沼虾对饲料铜/锌的需求量[13, 14], 添加相应含量硫酸铜/硫酸锌(分析纯试剂, 国药集团, 上海)到基础饲料中, 配制4组铜添加量分别为0、20、40和160 mg/kg饲料的实验饲料和 3组锌添加量分别为 0、35和210 mg/kg饲料的实验饲料。实验饲料按照Li等[17]方法制作自然风干后用自封袋密闭封装于–20℃保存备用。饲料配方和主要营养成分分析见表 2。饲料中铜含量的实测值分别为 2.8、20.9、43.1和157.1 mg/kg, 锌含量的实测值分别为 10.3、45.2和211.2 mg/kg。养殖实验于2013年7—9月在上海市金山区漕泾名特优水产品养殖示范基地进行。实验用日本沼虾购自浙江省湖州市南浔区一养殖场, 正式实验前先暂养1周。而后选择健康活泼、平均初始体重为(0.101±0.002) g的虾随机放入到21只体积为300 L的塑料水箱中, 每只水箱中放入50尾虾。养殖实验共分为7组, 每组3个平行, 正式养殖实验时间共持续 56d。实验期间连续充氧保持溶氧>6.5 mg/L。养殖的水质条件为: 水温27—30℃, 总氨氮<0.1 mg/L。养殖期间光照为自然光照。养殖水为自然河水, 水中铜含量为 1.2—1.6 μg/L、锌含量为14—18 μg/L。在56d养殖结束后, 养殖虾停止饲喂12h, 活体解剖虾取肝胰腺–80℃保存用于总RNA提取。用 qRT-PCR分析饲料铜/锌水平对 mn-MT mRNA表达的影响。
1.7 统计分析
所有实验数据的表示方式为平均值±标准差(Mean ± SD), 采用SPSS 16.0软件对实验数据进行单因素方差分析(one-way ANOVA), 若处理组间存在显著差异, 再进行 Duncan’s多重比较, 显著性差异设置水平为P<0.05。

表2 实验饲料配方和营养成分分析Tab. 2 Ingredients and approximate compositions of experimental diets (%)
2 结果
2.1 mn-MT序列特征
通过RACE技术, 克隆获得mn-MT cDNA全长为665 bp(GenBank登录号为KJ415090), 包括75 bp 的5′-非翻译区、410 bp含polyA的3′-非翻译区和180 bp的开放阅读框(ORF)。ORF编码59个氨基酸的多肽, 其蛋白质的理论分子量为6.085 kD、等电点为7.73。该蛋白中半胱氨酸含量最高, 达30.5%, 其次是赖氨酸、丝氨酸、脯氨酸和甘氨酸, 含量分别为16.95%、10.17%、8.47%和8.47%, 不含有芳香族氨基酸和组氨酸等, 含有无脊椎动物金属硫蛋白的特征序列Cys-X-Cys、Cys-X-X-Cys和Cys-X-X-X-Cys。
NCBI的BLAST比对分析结果显示, 日本沼虾MT的氨基酸序列与其他无脊椎动物 MT氨基酸序列相似性较高, 其中与美洲海螯虾(Homarus americanus)、斑节对虾(Penaeus monodon)和中华绒螯蟹(Eriocheir sinensis)的相似性分别达到78%、75%和75%。运用Mega 5.1软件中NJ法对24种MT氨基酸序列构建系统发育树(图1)。发育树中脊椎动物和无脊椎动物各分为一支, 在无脊椎动物分支中, 日本沼虾与斑节对虾、罗氏沼虾(M. rosenbergii)等归为一分支。
2.2 mn-MT在日本沼虾不同组织中的表达
qRT-PCR结果显示 mn-MT在所检测的日本沼虾各组织中都有表达, 其中肝胰腺中表达量最高并显著高于所检测的其他组织(P<0.05), 其次是血细胞(P<0.05), 鳃、胃、卵巢、肠和肌肉中表达量最低,有些组织甚至几乎检测不到(图2)。
2.3 饲料铜/锌水平对mn-MT mRNA表达的影响
qRT-PCR结果显示, 日本沼虾幼虾肝胰腺 MT mRNA的表达水平随饲料铜水平升高而升高, 到40 mg/kg组达到最大(P<0.05), 而后开始下降, 0、20 和160 mg/kg组间的MT mRNA表达量没有显著差异(P>0.05, 图3)。饲料锌水平也显著影响日本沼虾肝胰腺MT mRNA表达, 高锌(210 mg/kg)显著提高MT表达(P<0.05), 0和 35 mg/kg组间差异不显著(P>0.05, 图4)
3 讨论
3.1 mn-MT分子特征
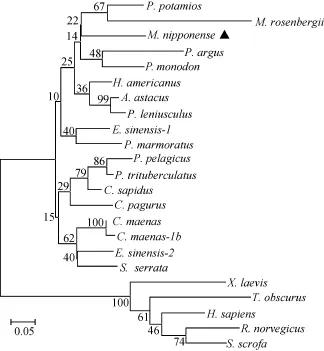
图1 基于MT氨基酸序列建立的系统发育树Fig. 1 The phylogenetic tree based on the sequences of metallothionein from different species

图2 mn-MT基因在各组织的相对表达量Fig. 2 The expression of mn-MT in different tissues shown by qRT-PCR

图3 饲料铜水平对mn-MT mRNA表达的影响Fig. 3 The effect of dietary copper on the relative expression of mn-MT
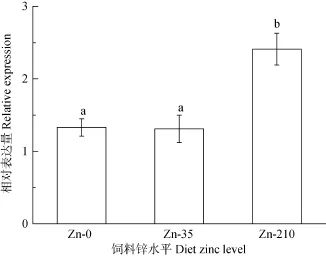
图4 饲料锌水平对mn-MT mRNA表达的影响Fig. 4 The effect of dietary zinc on the relative expression of mn-MT
MT是一种富含半胱氨酸的小分子量蛋白质,主要生理功能是重金属解毒、清除自由基和参与一些微量元素代谢等[18—20]。本研究克隆mn-MT cDNA全长并分析其表达特征。mn-MT编码的 59个氨基酸的多肽具有分子量小、半胱氨酸含量最高、赖氨酸和脯氨酸含量也相对较高等特征, 这与其他甲壳动物研究结果类似[21], 半胱氨酸残基数与甲壳动物特有的18个半胱氨酸残基数一致[22, 23]。在多肽序列中, 赖氨酸残基多数伴随着半胱氨酸残基出现, 且含量仅次于半胱氨酸, 这可能与稳固金属硫蛋白与金属离子的相互作用有关[24]。mn-MT中的半胱氨酸分布也具有典型的无脊椎动物金属硫蛋白的结构特征, 有5个Cys-X-Cys重复(CDC、CQC、CKC、CEC、CKC)、2个Cys-X-X-Cys重复(CTSC、CDPC)和3 个Cys-X-X-X-Cys重复(CKTGC、CASKC、CAKNC),这些结构的重复数与中华绒螯蟹 MT完全一致[25],但与斑节对虾稍有差异[21]。mn-MT特征序列(CEKCASKCECS)与已报道的无脊椎动物 MT的特征序列(CKCXXXCXCX, X为除了半胱氨酸之外的其他氨基酸)只有一个氨基酸的差别。mn-MT中半胱氨酸的这些重复分布结构可能与金属离子的螯合有关[26, 27]。
基于 MT氨基酸序列建立的系统发育树中, 脊椎动物和无脊椎动物分为两个独立的分支, 这与传统的分类学结果一致。mn-MT与其他甲壳动物 MT的相似性很高, 如与美洲海螯虾和斑节对虾的相似性分别达到78%和75%, 说明mn-MT很保守、同属于甲壳动物家族的MT具有类似的特有序列、在进化上也相关[28]。
3.2 mn-MT在各组织种的表达
MT参与机体的多种生物过程[29], 所以研究者发现 MT在所检测组织中基本都有表达, 而且不同物种中其组织表达有一定的差异。在脊椎动物中, MT在卵巢、睾丸、肝脏、肾脏、鳃、肠、大脑、眼中都有一定量的表达[4, 9]; 在无脊椎动物中, MT在肝胰腺、心脏、生殖腺、肾脏、神经组织和消化腺组织等表达量都较高[8, 24, 30—32]。在本研究中, mn-MT在所分析的虾的肝胰腺、血细胞、胃、肠、卵巢、鳃和肌肉各组织中都有表达, 肝胰腺中表达量最高, 这与石蟹(Charybdis japonica)[31]、龙虾(Homarus americanus)[30]、眼斑龙虾(Panulirus argus)[8]和中华绒螯蟹[25]等结果类似, 可能是因为甲壳动物肝胰腺作为一种多功能器官, 在维持体内金属元素动态平衡和解毒重金属中毒方面所起的核心作用有关[33, 34]。mn-MT在卵巢中也有一定的表达,说明可能与太平洋牡蛎(Crassostrea gigas)[35]、中华绒螯蟹[25]、斑节对虾[21]类似, mn-MT在虾发育中也起着重要作用, 但具体机制需要深入研究。
3.3 饲料中铜/锌水平对mn-MT mRNA表达的影响
MT氨基酸组成中含有大量半胱氨酸, 对金属离子具有高亲和力, 其表达量受多种重金属暴露的诱导[36]。大量研究显示动物的金属硫蛋白表达量受水体铜[8, 25]、锌[8, 37]等金属元素浓度的影响。如随着水体暴露铜浓度的升高, 中华绒螯蟹MT mRNA表达表现出先升高后下降的趋势[25]; 按3 mg/kg体重的剂量给大鼠腹腔单独注射铜也会显著提高其肝脏MT含量, 但饲喂铜含量为1.8 g/kg的饲料并不能提高大鼠 MT的表达, 作者认为可能是因为铜剂量太低或是时间太短不足以诱导MT的高表达[12]。据报道饲料中添加高锌也可显著提高大鼠肝脏[38]、斜纹夜蛾(Spodoptera litura)中肠[39]的MT水平。目前关于饲料中铜、锌水平对甲壳动物金属硫蛋白表达影响的还鲜有报道。本研究结果显示日本沼虾肝胰腺MT mRNA表达均受饲料铜、锌水平的影响, 且都显示出剂量依赖效应。mn-MT mRNA表达随着饲料铜水平的升高而升高, 在40 mg/kg组达到最大, 而后呈下降趋势, 与水体铜浓度对中华绒螯蟹 MT表达影响的变化趋势类似[25]。同样mn-MT表达也随着饲料锌水平的升高而升高, 高锌组达到最高。徐振华等[40]研究发现饲料锌水平也显著影响新西兰肉兔肝脏 MT表达水平, 且表现出先升高后下降的趋势。可见, 饲料锌水平对机体 MT表达的影响存在物种差性, 且mn-MT表达随饲料铜、锌水平变化对也表现出不同剂量依赖效应, 具体机制还需进一步深入研究。
[1] Vašák M. Advances in metallothionein structure and functions [J]. Journal of Trace Elements in Medicine and Biology, 2005, 19(1): 13—17
[2] Lu J G, Xu J, Zhang P X, et al. Analysis of functional compensation of two different metallothionein subfamilies from Tetrahymena thermophila [J]. Acta Hydrobiologica Sinica, 2014, 38(2): 249—256. [卢剑功, 许静, 张鹏幸, 等.嗜热四膜虫两类不同金属硫蛋白的功能补偿分析. 水生生物学报, 2014, 38(2): 249—256]
[3] Margoshes M, Vallee B L. A cadmium protein from equine kidney cortex [J]. Journal of the American Chemical Society, 1957, 79(17): 4813—4814
[4] Gao A, Wang L, Yuan H. Expression of metallothionein cDNA in a freshwater crab, Sinopotamon yangtsekiense, exposed to cadmium [J]. Experimental and Toxicologic Pathology, 2012, 64(3): 253—258
[5] Hauser-Davis R A, Bastos F F, Tuton B, et al. Bile and liver metallothionein behavior in copper-exposed fish [J]. Journal of Trace Elements in Medicine and Biology, 2014, 28(1): 70—74
[6] Lü D, Luo K Y, Pan B P, et al. Expression of metallothionein and thioredoxin gene in Cyclina sinensis exposed to cadmium [J]. Oceanologia et Limnologia Sinica, 2012, 43(1): 47—51 [吕达, 罗凯娅, 潘宝平, 等. 青蛤(Cyclina sinensis)金属硫蛋白及硫氧还蛋白基因的克隆与表达分析. 海洋与湖沼, 2012, 43(1): 47—51]
[7] Pedersen S N, Pedersen K L, Hojrup P, et al. Primary structures of decapod crustacean metallothioneins with special emphasis on freshwater and semi-terrestrial species [J]. Journal of Biochemistry, 1996, 319(3): 999—1003
[8] Moltó E, Bonzón-Kulichenko E, Arco A D, et al. Cloning, tissue expression and metal inducibility of an ubiquitous metallothionein from Panulirus argus [J]. Gene, 2005, 361: 140—148
[9] Cho Y S, Lee S Y, Kim K Y, et al. Gene structure and expression of metallothionein during metal exposures in Hemibarbus mylodon [J]. Ecotoxicology and Environmental Safety, 2008, 71(1): 125—137
[10] Watanabe T, Kiron V, Satoh S. Trace minerals in fish nutrition [J]. Aquaculture, 1997, 151(1—4): 185—207
[11] Wang W X, Rainbow P S. Significance of metallothioneins in metal accumulation kinetics in marine animals [J]. Comparative Biochemistry and Physiology-Part C: Toxicology & Pharmacology, 2010, 152(1): 1—8
[12] Irato P, Albergoni V. Interaction between copper and zinc in metal accumulation in rats with particular reference to the synthesis of induced-metallothionein [J]. Chemico-Biological Interactions, 2005, 155(3): 155—164
[13] Kong Y Q, Ding Z L, Du Z Y, et al. Dietary copper requirement of juvenile oriental river prawn Macrobrachium nipponense, and its effects on growth, antioxidant activities and resistance to Aeromonas hydrophila [J]. The Israeli Journal of Aquaculture-Bamidgeh, IJA_66. 2014.1017, 11
[14] Guo J L, Chen J M, Sun L H, et al. Dietary zinc requirement of juvenile oriental river prawn (Macrobrachium nipponense) [J]. Chinese Journal of Animal Nutrition, 2013, 25(3): 661—668 [郭建林, 陈建明, 孙丽慧, 等. 日本沼虾幼虾对饲料中锌的需求量. 动物营养学报, 2013, 25(3): 661—668]
[15] Zhao D X, Song S H, Wang Q, et al. Discovery of immune-related genes in Chinese mitten crab (Eriocheir sinensis) by expressed sequence tag analysis of haemocytes [J]. Aquaculture, 2009, 287(3—4): 297—303
[16] Livak K J, Schmittgen T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2–ΔΔCtmethod [J]. Methods, 2001, 25(4): 402—408
[17] Li E C‚ Yu N, Chen L Q, et al. Dietary Vitamin B6requirement of the pacific white shrimp‚ Litopenaeus vannamei‚ at low salinity [J]. Journal of World Aquaculture Society, 2010, 41(5): 756—763
[18] Xiang D F, Zhu J Q, Jin S, et al. Expression and function analysis of metallothionein in the testis of Portunus trituberculatus exposed to cadmium [J]. Aquatic Toxicology, 2013, 140—141: 1—10
[19] Felix-Portillo M, Martinez-Quintana J A, Peregrino-Uriarte A B, et al. The metallothionein gene from the white shrimp Litopenaeus vannamei: Characterization and expression in response to hypoxia [J]. Marine Environmental Research, 2014, 101: 91—100
[20] Siscar R, Koenig S, Torreblanca A, et al. The role of metallothionein and selenium in metal detoxification in the liver of deep-sea fish from the NW Mediterranean Sea [J]. Science of the Total Environment, 2014, 466—467: 898—905
[21] Zheng L M, Zhou F L, Yang Q B, et al. Molecular cloning and expression analysis of metallothionein from Penaeus monodon [J]. Acta Hydrobiologica Sinica, 2011, 35(6): 913—919 [郑丽明, 周发林, 杨其彬, 等. 斑节对虾金属硫蛋白cDNA克隆与表达分析. 水生生物学报, 2011, 35(6): 913—919]
[22] Hamer D H. Metallothionein 1, 2 [J]. Annual Review of Biochemistry, 1986, 55: 913—951
[23] Peng J X, Fang Z F, Wei P Y, et al. Sequence and expression analysis of metallothionein from Litopenaeus vannmei [J]. Acta Hydrobiologica Sinica, 2013, 37(4): 678—683 [彭金霞,房振峰, 韦嫔媛, 等. 凡纳滨对虾 MT基因序列及其在卵巢发育和低温胁迫中的表达分析. 水生生物学报, 2013, 37(4): 678—683]
[24] Cody C W, Huang P C. Replacement of all alpha-domain lysines with glutamates reduces metallothionein detoxification function [J]. Biochemical and Biophysical Research Communications, 1994, 202(2): 954—959
[25] Ren F, Jiang H, Sun J L, et al. Cloning, characterization, expression, and copper sensitivity of the metallothionein-1 gene in the Chinese mitten crab, Eriocheir sinensis [J]. Molecular Biology Reports, 2011, 38(4): 2383—2393
[26] Viarengo A, Nott J A. Mechanisms of heavy metal cation homeostasis in marine invertebrates [J]. Comparative Biochemistry & Physiology-Part C: Toxicology & Pharmacology, 1993, 104(3): 355—372
[27] Kagi J H, Schaffer A. Biochemistry of metallothionein [J]. Biochemistry, 1988, 27(23): 8509—8515
[28] Binz P A, Kägi J H R. Metallothionein: molecular evolution and classification [A]. In: Klaassen C (Eds.), Metallothionein IV [C]. Basel: Birkhauser Verlag. 1999, 7—13
[29] Mao H, Wang D H, Yang W X. The involvement of metallothionein in the development of aquatic invertebrate [J]. Aquatic Toxicology, 2012, 110—111: 208—213
[30] Zhang J Q, Wang J, Gui T S, et al. A copper-induced metallothionein gene from Exopalaemon carinicauda and its response to heavy metal ions [J]. International Journal of Biological Macromolecules, 2014, 70: 246—250
[31] Mao H, Tan F Q, Wang D H, et al. Expression and function analysis of metallothionein in the testis of stone crab Charybdis japonica exposed to cadmium [J]. Aquatic Toxicology, 2012, 124—125: 11—21
[32] Aceto S, Formisano G, Carella F, et al. The metallothionein genes of Mytilus galloprovincialis: Genomic organization, tissue expression and evolution [J]. Marine Genomics, 2011, 4(1): 61—68
[33] Canli M, Stagg R M, Rodger G. The induction of metallothionein in tissues of the Norway lobster Nephrops norvegicus following exposure to cadmium, copper and zinc: the relationships between metallothionein and the metals [J]. Environmental Pollution, 1997, 96(3): 343—350
[34] Mouneyrac C, Amiard-Triquet C, Amiard J C, et al. Comparison of metallothionein concentrations and tissue distribution of trace metals in crabs (Pachygrapsus marmoratus) from a metal-rich estuary, in and out of the reproductive season [J]. Comparative Biochemistry and Physiology-Part C: Toxicology & Pharmacology, 2001, 129(3): 193—209
[35] Meistertzheim A L, Lejart M, Goïc N L, et al. Sex-, gametogenesis, and tidal height-related differences in levels of HSP70 and metallothioneins in the Pacific oyster Crassostrea gigas [J]. Comparative Biochemistry and Physiology-Part A: Molecular & Integrative Physiology, 2009, 152(2): 234—239
[36] Wang C L, Zhang F T, Cao W X, et al. The identification of metallothionein in rare minnow (Gobiocypris rarus) and its expression following heavy metal exposure [J]. Environmental Toxicology and Pharmacology, 2014, 37(3): 1283—1291
[37] Wu J P, Chen H C. Metallothionein induction and heavy metal accumulation in white shrimp Litopenaeus vannamei exposed to cadmium and zinc [J]. Comparative Biochemistry and Physiology-Part C: Toxicology & Pharmacology, 2005, 140(3—4): 383—394
[38] Irato P, Albergoni V. Interaction between copper and zinc in metal accumulation in rats with particular reference to the synthesis of induced-metallothionein [J]. Chemico-Biological Interactions, 2005, 155(3): 155—164
[39] Shu Y H, Zhang G R, Wan J W. Response of the common cutworm Spodoptera litura to zinc stress: Zn accumulation, metallothionein and cell ultrastructure of the midgut [J]. Science of the Total Environment, 2012, 438: 210—217
[40] Xu Z H, Li F C, Qin Y H. Effects of dietary Zn levels on the production performance, antioxidase activity in serum and liver, and metallothionein (MT)-1 mRNA expression of growing rabbits [J]. Chinese Journal of Animal Nutrition, 2008, 20(3): 337—342 [徐振华, 李福昌, 秦应和. 日粮锌水平对生长肉兔生产性能、血清肝脏抗氧化酶活性和金属硫蛋白-1基因表达的影响. 动物营养学报, 2008, 20(3): 337—342]
MOLECULAR CLONING, TISSUE-SPECIFIC EXPRESSION AND RELEVANCE TO DIETARY COPPER AND ZINC OF GENE METALLOTHIONEIN IN MACROBRACHIUM NIPPONENSE
KONG You-Qin1, 2, CHEN Li-Qiao1, DING Zhi-Li1, 2, LI Er-Chao1, YE Jin-Yun2and DU Zhen-Yu1
(1. College of Life Sciences, East China Normal University, Shanghai 200241, China; 2. Zhejiang Provincial Key Laboratory of Aquatic Resources Conservation and Development, College of Life Sciences, Huzhou University, Huzhou 313000, China)
Metallothionein (MT) is a metal binding protein with low molecular weight. The expression of MT can be induced by minerals such as copper or zinc, and it is involved in the metabolism of trace elements. To better understand the physiological and nutritional effects of copper and zinc on Macrobrachium nipponense, we cloned mn-MT from the oriental river prawn using rapid amplification of the cDNA ends (RACE), and evaluated the effects of dietary copper and zinc on the expression of MT. The full length of mn-MT cDNA was 665 bp, and it had a 180 bp open reading frame (ORF) encoding a 59aa peptide. The calculated molecular weight of the peptide was 6.085 kD and the predicted isoelectric point was 7.73. The most abundant amino acid in this protein was cysteine residues (30.5%), followed by lysine (16.95%) and serine (10.17%). The similarity analysis showed that mn-MT shared the similarities of 78%, 75% and 75% with the counterparts in the Homarus americanus, Penaeus monodon and Eriocheir sinensis respectively. Quantitative real-time RT-PCR (qRT-PCR) analysis showed that the mn-MT mRNA was expressed in the hepatopancreas, gill, hemocytes, intestine, ovary, muscles and stomach, with the highest level in the hepatopancreas. M. nipponense were fed for 56 days with seven different diets supplemented with Cu at 0, 20, 40 and 160 mg/kg diet and Zn at 0, 35, 210 mg/kg diet, and then we analyzed the expression of mn-MT mRNA in the hepatopancreas. The expression of mn-MT mRNA was first elevated along with the increase in dietary Cu level, reached to the maximum at 40 mg/kg diet, and then dropped as the Cu concentration was further increased. The expression of mn-MT mRNA was higher in prawns fed with high Zn (210 mg/kg diet) than that in prawns fed with 35 mg Zn/kg diet or 0 mg Zn/kg diet (P<0.05). There was no significant difference between the 0 mg Zn/kg group and the 35 mg Zn/kg group (P>0.05). These results suggested that the expression of mn-MT mRNA could be affected by dietary copper and zinc with different dose-dependent response curves.
Macrobrachium nipponense; Metallothionein; Copper; Zinc; mRNA expression
S966.1
A
1000-3207(2015)06-1126-08
10.7541/2015.148
2014-11-20;
2015-03-10
公益性行业(农业)科研专项(201003020, 201203065);“十二五”国家科技支撑计划课题(2012BAD25B00); 国家自然科学基金项目(31172422); 上海市科委重点项目(10JC1404100); 浙江省自然科学基金项目(LQ14C190004)资助
孔有琴(1977—), 女, 浙江长兴人; 博士; 主要从事水产动物营养与饲料研究。E-mail: susankuq@hutc.zj.cn
陈立侨, 教授, 博士生导师; E-mail: lqchen@bio.ecnu.edu.cn

