饲料中添加叶酸和VB12对中华绒螯蟹幼蟹生长、非特异性免疫和抗病力的影响
魏建军张 帆田文静李二超吴强强陈立侨
(1. 华东师范大学生命科学学院, 上海 200241; 2. 通威股份有限公司, 成都 610041)
饲料中添加叶酸和VB12对中华绒螯蟹幼蟹生长、非特异性免疫和抗病力的影响
魏建军1张 帆1田文静1李二超1吴强强2陈立侨1
(1. 华东师范大学生命科学学院, 上海 200241; 2. 通威股份有限公司, 成都 610041)
为研究叶酸和VB12协同作用对中华绒螯蟹(Eriocheir sinensis)幼蟹生长、非特异性免疫和抗病力的影响, 选取初始体重为(2.57±0.03) g的幼蟹600只, 随机分成4组, 每组5个重复, 每个重复30只幼蟹, 分别投喂对照组(不添加叶酸和 VB12), 单一 VB12组(0.2 mg/kg), 单一叶酸组(2.3 mg/kg)和联合处理组(0.2 mg/kg VB12+ 2.3 mg/kg叶酸)的饲料8周。在养殖实验结束后, 先统计成活率和称重, 然后从每个处理组随机选取30只幼蟹, 用2×108CFU/mL的嗜水气单胞菌注射攻毒2周。实验结果表明: 幼蟹的增重率、特定生长率、饲料效率和存活率在联合处理组最高, 显著高于对照组(P<0.05), 但与单一叶酸或 VB12组相比不存在显著差异(P>0.05)。联合处理组的血清酚氧化酶活性显著高于对照组(P<0.05), 但与单一叶酸或VB12组也无显著性差异(P>0.05)。同时, 联合处理组的血清酸性磷酸酶、碱性磷酸酶、溶菌酶活性和血细胞总数等指标最高, 其次是单一叶酸组和VB12组, 而对照组最低。投喂联合处理组饲料幼蟹的肝胰腺超氧化物歧化酶活性最高, 而丙二醛含量和累积死亡率最低。以上结果表明, 叶酸和 VB12对幼蟹的生长、生理代谢和免疫性能均可能有互补和协同作用, 养殖生产中建议饲料中叶酸和VB12添加量分别为2.3 mg/kg和0.2 mg/kg。
中华绒螯蟹; 叶酸; VB12; 生长; 非特异性免疫力; 嗜水气单胞菌
叶酸作为一碳单位的供体和受体, 以其辅酶四氢叶酸的形式参与氨基酸、核苷酸代谢等许多生理反应[1]。叶酸是细胞分裂和增殖所必需的微量成分[2]。当叶酸缺乏或不足时, 水生动物会表现出明显的缺乏症, 如贫血、生长缓慢、饲料转化率低、死亡率高和免疫力低下等症状[3]。维生素B12是血细胞正常发育和成熟、脂肪酸代谢、同型半胱氨酸甲基化转变为蛋氨酸, 以及四氢叶酸正常循环等所必需的[3]。已有研究表明, 维生素 B12的缺乏症与叶酸的缺乏症相似[3]。
叶酸和维生素B12都是水生动物维持正常生理状态所必需的微量营养素。对于水生脊椎动物, 叶酸的需求量仅见于虹鳟(Oncorhynchus mykiss) (0.3—0.6 mg/kg)[4]、斑点叉尾
(Ictalurus punctatus) (1.5 mg/kg)[5]、奥尼罗非鱼(Oreochromis niloticus × Oreochromis aureus) (0.82 mg/kg)[6]和石斑鱼(Epinephelus malabaricus) (0.8 mg/kg)[7]等种类; 而维生素B12需求量的报道也非常有限, 仅限于大西洋鲑(Oncorhynchus keta) (0.015—0.02 mg/kg)[9]、黄条(Serioda lalandi) (0.053 mg/kg)[10]和草鱼(Ctenopharyngodon idella) (0.094 mg/kg)[11]。对于水生无脊椎动物, 斑节对虾(Penaeus monodon)对叶酸和维生素 B12的适宜需求量分别为1.9—2.1 mg/kg[2]和0.2 mg/kg[12]; 而皱纹盘鲍(Haliotis discus hannai Ino)对叶酸的需求量为2.62—5.29 mg/kg[8]。此外, 根据本实验室对叶酸和维生素 B12需求量的研究, 中华绒螯蟹(Eriocheir sinensis)幼蟹对叶酸和 VB12的适宜需求量分别为2.29—2.90 mg/kg和0.20—0.22 mg/kg[13]。综合已有的研究结果, 水生脊椎动物对叶酸和维生素 B12的需求量比水生无脊椎动物要低。
在水生动物中, 有关叶酸和维生素 B12可能交互作用的研究非常有限。John和Mahajan[14]报道, 用不添加叶酸和维生素 B12的饲料投喂南亚野鲮(Labeo rohita Ham)幼鱼[(2.35±0.82) g] 105d后, 发现幼鱼生长缓慢、饲料转化率低并呈现明显的贫血症状, 表明叶酸和维生素 B12对鱼类的正常代谢和生长有互补和交互作用。Shiau和 Lung[12]报道, 投喂不添加叶酸和维生素 B12饲料的斑节对虾[(0.57±0.03) g] 在 8周后生长性能最差, 同样表明叶酸和维生素 B12在对虾的生理代谢中可能有互补和协同作用。但迄今有关叶酸和维生素 B12对甲壳动物免疫性能的可能协同效应尚未见报道。本实验以中华绒螯蟹(Eriocheir sinensis)幼蟹为研究对象,研究了添加叶酸和维生素 B12对幼蟹的生长、体成分、免疫性能和抗病力的影响, 结果可为中华绒螯蟹高效配合饲料的研制和人工养殖提供参考。
1 材料与方法
1.1 实验饲料
本实验以不含维生素的酪蛋白和明胶(Sigma-Aldrich Co., 上海, 中国)为蛋白源, 以鱼油(Xiamen Xinsha Pharmaceutical Co. Ltd, 厦门, 中国)和大豆油(金龙鱼有限公司, 上海, 中国)为脂肪源, 玉米淀粉为糖源, 饲料的基础配方见表1。同时, 补充添加含甘氨酸、谷氨酸、丙氨酸和甜菜碱的诱食剂, 以提高幼蟹的食欲和摄食效率。饲料中复合维生素的添加参考已有对虾蟹类的维生素营养研究结果, 复合矿物质的添加参考 Shiau和 Hsu[15]的研究。在饲料中添加叶酸和VB12分别为0和0 mg/kg (对照组)、0和0.2 mg/kg (单一VB12组)、2.3和0 mg/kg (单一叶酸组)、2.3和0.2 mg/kg (联合处理组)。饲料中叶酸和 VB12的实际含量采用微生物分析法测定分别为0.08和2.39 mg/kg、0和0.19 mg/kg[16]。实验饲料的准备和储存参照陈立侨等[17]报道的方法。
1.2 实验动物驯化、分组和管理
养殖实验为期 8周, 在上海市金山区漕泾镇特种水产养殖基地进行。实验用幼蟹购于上海崇明养殖场, 实验开始前, 将所购幼蟹放在水泥池(6.0 m × 3.0 m × 1.5 m)中暂养2周, 暂养期间投喂商业饲料(9812, Shanghai Harmony Feed CO., LTD.)。然后, 挑选规格接近、完整活泼、平均体重为[(2.57±0.02) g]的幼蟹随机分成4组, 每组5个平行, 置于20个容积为500 L的聚乙烯塑料箱中, 每箱放养30只, 并且在每箱中放置6块瓦片和足量的PVC管作为躲避物。养殖期间, 每天用相应的饲料饱食投喂两次(09:00和17:00), 同时设一空白投饲组, 以计算扣除溶失率后的摄食量。及时将死蟹取出并称重, 并于下次投喂前回收残饵, 将水体中的粪便和残饵吸走,并补充经消毒、除氯和充分曝气处理的养殖用水,每天换水量1/3左右。在养殖期间, 不间断的对养殖水体充氧, 水体溶解氧为 7.7—8.2 mg/L, 水温为(28±2)℃, pH为7.5—7.9, 总氨氮≤0.01 mg/L。8周结束后, 每个处理组选取30只幼蟹随机放入3个塑料箱中, 用嗜水气单胞菌感染进行2周的攻毒实验。

表1 基础饲料配方Tab. 1 The composition of basal diets
1.3 取样、样品处理和分析
在养殖实验结束后, 所有幼蟹停止投喂 24h,对每个水箱中幼蟹的分别进行计数和称重, 相关生长指标的计算公式如下:

其中, Wt和W0分别为养殖实验结束和开始时幼蟹的平均体重(g), N0实验开始时幼蟹的个体数(只), Nt为养殖过程中幼蟹的死亡数, 而 WF则为经溶失校正后的实际摄食量(g), 即在养殖实验条件下, 将各组饲料分别投喂到不含幼蟹的水箱中, 并于下次投喂时回收, 用于WF的计算。
称重后, 随机从每个水箱中选取 5只幼蟹保存于–20℃冰箱中用于体成分的测定。其中, 粗蛋白的含量采用杜马斯燃烧法(Leco FP-528), 粗脂肪的测定采用索氏抽提法(2055 Soxhlet Avanti; Foss Tecator, Hoganas Sweden), 水分测定采用 105℃烘干至恒重法, 而灰分则先用电炉炭化后, 550℃马弗炉灼烧至恒重法。
剩余的幼蟹置于冰上麻醉后, 用 1 mL的注射器于第三步足基部抽取血淋巴。所收集的血淋巴一部分与等体积的抗凝剂(0.20 mol/L NaCl, 0.17 mol/L葡萄糖, 50.00 mmol/L 柠檬酸三钠, 43.33 mmol/L柠檬酸, 16.67 mmol/L EDTA-Na2, pH 6.5)混匀, 用相差显微镜进行血淋巴细胞的计数。另一部分不添加抗凝剂, 置于 4℃冰箱中过夜, 自然凝结, 然后, 5000 r/min离心10min, 分离血清用液氮速冻后, 保存于–80℃冰箱中, 用于酚氧化酶(Phenoloxidase, PO)、溶菌酶(Lysozyme, LZM)、酸性磷酸酶(Acid phosphatase, ACP)和碱性磷酸酶(Alkaline phosphatase, AKP)的测定。其中, 酚氧化酶的测定依据Ashida[18]的方法, 溶菌酶的测定根据Hultmark等[19]改进的方法, 酸性和碱性磷酸酶则依照Gonzalez等[20]改进的方法。所用试剂盒均购自南京建成生物工程研究所,具体操作按照使用说明进行。
冰浴麻醉后的幼蟹, 立即解剖取肝胰腺, 液氮速冻后, 置于–80℃冰箱保存, 用于叶酸和 VB12含量以及超氧化物歧化酶(Superoxide dismutase, SOD)活性和丙二醛(Malondialdehyde, MDA)含量的测定。其中, 叶酸和 VB12含量的测定采用免疫酶联法(伊莱瑞特生物科技有限公司), 超氧化物歧化酶活性和丙二醛含量的测定分别参照 Wang和 Chen[21]、Uchiyama和Mihara[22]的方法, 试剂盒购于南京建成生物工程研究所, 按具体说明进行操作。
1.4 攻毒实验
攻毒实验所用嗜水气单胞菌(Aeromonas hydrophila)菌种由华东师范大学生命科学学院实验中心提供。实验开始前, 分别采用1010、109、108、107、106和105CFU/mL浓度的嗜水气单胞菌菌悬液注射幼蟹, 每只0.05 mL, 以0.86%的生理盐水作为对照,统计 96h内幼蟹的累积死亡率, 嗜水气单胞菌对幼蟹的96h半致死浓度为2.0×108CFU/mL。然后, 利用 2.0×108CFU/mL的嗜水气单胞菌注射各个水箱中的幼蟹进行攻毒实验, 实验为期 2周。在实验结束后, 统计各水箱中幼蟹的累计死亡率, 以此指标评价幼蟹抵抗嗜水气单胞菌感染的能力。
1.5 数据分析
所有实验数据采用SPSS 19.0软件进行单因素方差分析(ANOVA), 若存在显著差异(P<0.05), 再用Duncan’s多重比较法来确定组间差异, 所得结果均以 5个平行处理组数据的平均值±标准误(Mean± SE)表示。
2 结果
2.1 生长和存活
从表 2可见, 投喂联合处理组饲料的幼蟹, 其增重率、特定生长率、饲料效率和存活率最高, 并且显著高于对照组(P<0.05), 但与单一叶酸组、单一VB12组的蟹没有显著性差异。
2.2 体成分
由表 3可知, 投喂联合处理组和单一叶酸组饲料的幼蟹, 其体粗蛋白含量要显著高于其他各组(P<0.05)。投喂对照组饲料的幼蟹, 其粗脂肪含量要显著低于其他各实验组(P<0.05), 而各组蟹体的水分和灰分则不存在显著差异。
2.3 非特异性免疫指标
幼蟹的血清酚氧化酶、溶菌酶、酸性磷酸酶、碱性磷酸酶活性和血细胞总数的测定结果如表4所示。其中, 投喂联合处理组饲料幼蟹的酚氧化酶最高, 显著高于对照组(P<0.05), 但与单一叶酸组和单一VB12组均无显著性差异。溶菌酶、酸性磷酸酶、碱性磷酸酶和血细胞总数均以联合处理组最高, 其次是单一叶酸组和单一VB12组, 均不添加的对照处理组则最低。
2.4 抗氧化指标
由表 5可知, 肝胰腺超氧化物歧化酶活性在联合处理组最高, 其次是单一叶酸组和单一 VB12组,对照处理组最低。然而, 丙二醛的含量变化趋势则与之相反, 在联合处理组幼蟹肝胰腺丙二醛的含量最低, 其次是单一添加叶酸组和单一 VB12组, 对照组的最高。
2.5 抗病力
由图 1可知, 在各实验组中, 联合处理组的累积死亡率最低, 仅为 26.67%, 并且显著低于对照组的46.67% (P<0.05), 单一添加叶酸和VB12处理组的累积死亡率分别为 33.33%和 36.67%。从以上结果可知, 饲料中联合添加叶酸和 VB12, 可以有效地提高幼蟹抵抗嗜水气单胞菌感染的能力。

表2 饲料中叶酸和VB12联合添加对中华绒螯蟹幼蟹增重率、特定生长率、饲料效率和存活率的影响Tab. 2 The effects of combined dietary folic acid and vitamin B12on the weight gain (WG), special growth rate (SGR), feed efficiency (FE) and survival of juvenile Chinese mitten crab Eriocheir sinensis

表3 饲料中叶酸和VB12联合添加对中华绒螯蟹幼蟹体生化成分的影响(湿重基础, g)Tab. 3 The effects of combined dietary folic acid and vitamin B12on the body composition of Chinese mitten crab Eriocheir sinensis (wet weight basis, g)

表4 饲料中叶酸和VB12联合添加对中华绒螯蟹幼蟹酚氧化酶(PO)、溶菌酶(LZM)、酸性磷酸酶(ACP)、碱性磷酸酶(AKP)和血细胞总数(THC)的影响Tab. 4 The effects of combined dietary folic acid and vitamin B12on the activities of phenoloxidase, lysozyme, acid phosphatase, alkaline phosphatase, and on the total hemocyte count of Chinese mitten crab Eriocheir sinensis
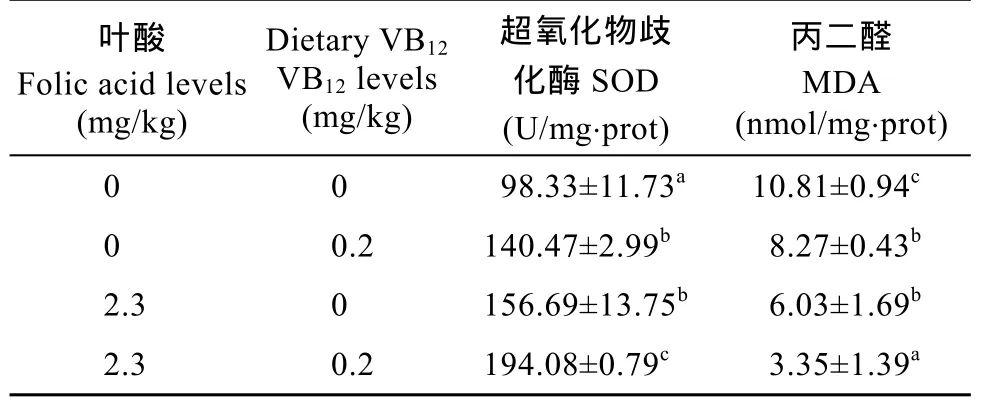
表 5 饲料中叶酸和 VB12联合添加对中华绒螯蟹幼蟹超氧化物歧化酶(SOD)和丙二醛(MDA)含量的影响Tab. 5 The effects of combined dietary folic acid and vitamin B12on the activity of superoxide dismutase and the level of malondialdehyde in the hepatopancreas of Chinese mitten crab Eriocheir sinensis

图 1 饲料中叶酸和 VB12联合添加对中华绒螯蟹幼蟹感染嗜水气单胞菌后累积死亡率的影响Fig. 1 The effects of combined dietary folic acid and vitamin B12on the cumulative mortality of Chinese mitten crab Eriocheir sinensis after infection with Aeromonas hydrophila
3 讨论
本研究发现, 饲料中单一添加叶酸或VB12均可有效提高幼蟹的生长性能和存活率, 当两者联合添加时, 对动物的生长性能和存活率的影响则更明显,而饲料中叶酸和VB12均不补充时, 幼蟹则表现为生长缓慢, 饲料转化率低下, 对病菌的易感性提高,累计死亡率则明显高于单一添加叶酸、VB12和联合添加处理组。以上结果与对南亚野鲮(Labeo rohita Ham)[14]和斑节对虾(P. mondon)[12]的研究是一致的,提示饲料中合理补充叶酸和 VB12除了有助于促进幼蟹的生长, 提高饲料效率外, 同时对增强机体的免疫性能和抗病力也是有益的。
叶酸和 VB12均是血细胞正常分裂和增值所必需的[2, 3, 7]。由于叶酸和VB12均与蛋氨酸和S-腺苷甲硫氨酸的合成有关[23], 并且在 DNA的代谢中起到重要作用[24]。所以, 当 VB12缺乏或不足时, S-腺苷甲硫氨酸合成减少, 且5,10-亚甲基四氢叶酸转化为5-甲基四氢叶酸的过程受阻, 从而导致DNA受损和血细胞不能正常成熟和发育, 最终会导致巨幼红细胞贫血[25]。John和 Mahajan[14]研究发现, 用同时缺乏叶酸和 VB12的饲料投喂南亚野鲮(L. rohita Ham)幼鱼, 幼鱼会表现出比单一缺乏组更为严重的贫血症状。Christian和 Greger[26]报道, 合理添加叶酸可以缓解由VB12缺乏引起的贫血。Shiau和Lung[2]的研究表明, 与其他实验组相比, 投喂同时缺乏叶酸和VB12的斑节对虾生长性能最差, 从而推断添加叶酸和VB12对斑节对虾(P. mondon)的正常生长、生理代谢具有协同作用。在本实验中, 投喂联合处理组饲料幼蟹的血淋巴细胞密度最大, 其次是单一添加叶酸组和单一添加VB12组, 而对照组最低。同时,可用来反映水生动物健康的指标如酚氧化酶、溶菌酶、酸性磷酸酶和碱性磷酸酶等, 也表现出与血淋巴细胞密度类似的变化趋势。提示合理添加叶酸和VB12对中华绒螯蟹的正常生长、生理代谢和免疫性能的提高, 均可能有协同和互补的作用。
然而, 有关叶酸和VB12在生理代谢中的关系也存在一定的争议。其中, Castle等[27]的报道中提到,早期有学者假定, 在VB12的生理代谢利用过程中涉及一种内因子(叶酸或蝶酰谷氨酸聚合物)和外因子(一种糖蛋白), 而研究证明, 这个内因子可能是叶酸或者是蝶酰谷氨酸的异构体。Herbert和Zalunsky[28]报道, 通过对叶酸和 VB12生物化学相互关系的大量研究, 得出了甲基四氢叶酸陷阱(Methyl tetrahydrofolate trap)的假说。该假说认为, 当 VB12缺乏时, 同型半胱氨酸转化为蛋氨酸的过程受阻,使甲基四氢叶酸不能形成四氢叶酸[29], 这一假设得到了一些学者的认同。此外, Weissbach和Taylor[30]研究认为, VB12可以通过转甲基酶调节叶酸的代谢。本研究的结果表明, 叶酸和 VB12对中华绒螯蟹(E. sinensis)幼蟹的生长、非特异性免疫力和抗病力均有协同作用。但是, 有关叶酸和 VB12在水生动物生理代谢中的作用过程和可能机制, 包括是否存在“甲基四氢叶酸陷阱”现象等, 还需要进一步探讨和研究。
4 结论
中华绒螯蟹(E. sinensis)幼蟹摄食缺
乏叶酸和
VB12的饲料会表现出生长缓慢、饲料转化效率低、死亡率高和易感染致病菌等症状, 单一补充叶酸或
VB12可以改善幼蟹的生长性能, 提高免疫性能和抗病力, 而同时补充适量的叶酸和 VB12则效果更明显。实验结果提示, 叶酸和VB12在幼蟹的生长和生理代谢中具有协同作用, 建议在幼蟹人工饲料中适量补充叶酸(2.3 mg/kg)和VB12(0.2 mg/kg)。
[1] Stokstad E L R, Koch J. Folic acid metabolism [J]. Physiological Reviews, 1967, 47(1): 83—116
[2] Shiau S Y, Huang S Y. Dietary folic acid requirement determined for grass shrimp, Penaeus monodon [J]. Aquaculture, 2001, 200(3-4): 339—347
[3] NRC (National Research Council). Nutrient Requirements of Fish and Shrimp [M]. National Academy Press, Washington, DC, USA. 2011, 114
[4] Cowey C B, Woodward B. The dietary requirement of young rainbow trout (Oncorhynchus mykiss) for folic acid [J]. Journal of Nutrition, 1993, 123(9): 1594—1600
[5] Duncan P L, Lovell R T, Butterworth C E, et al. Dietary folate requirement determined for channel catfish, Ictalurus punctatus [J]. Journal of Nutrition, 1993, 123(11): 1888—1897
[6] Shiau S Y, Huang S Y. Dietary folic acid requirement for maximal growth of juvenile tilapia, Oreochromis niloticus× O. aureus [J]. Fisheries Science, 2001, 67(4): 655—659
[7] Lin Y H, Lin Y H, Shiau S Y. Dietary folic acid requirement of grouper, Epinephelus malabaricus, and its effects on non-specific immune responses [J]. Aquaculture, 2011, 317(1-4): 133—137
[8] Miao S Y, Zhang W B, Xu W, et al. Dietary folic acid requirement of juvenile abalone, Haliotis discus hannai Ino [J]. Aquaculture, 2013, 400—401: 73—76
[9] Halver J E. The vitamins in Fish Nutrition [M]. In: Halver J E (Eds.). New York: Academic Press. 1972, 29—103
[10] Shimeno S. Yellowtail, Seriola quinqueradiata. In: Handbook of Nutrient Requirements of Finfish [M]. In: Wilson R P (Eds.). CRC Press, Boca Raton, FL. 1991, 181—191
[11] Wu F, Wen H, Jiang M, et al. Effects of dietary vitamin B12on growth, body composition and hemopoiesis of juvenile grass carp (Ctenopharyngodon idellus) [J]. Journal of Jilin Agricultural University, 2007, 29(6): 695—699 [吴凡, 文华,蒋明, 等. 维生素 B12对草鱼幼鱼生长、体组分和造血机能的影响. 吉林农业大学学报, 2007, 29(6): 695—699]
[12] Shiau S Y, Lung C Q. Estimation of the vitamin B12requirements of grass shrimp, Penaeus mondon [J]. Journal of Animal Science, 1993, 72: 477—482
[13] Wei J J, Yu N, Tian W J, et al. Dietary vitamin B12requirement and its effect on non-specific immunity and disease resistance in juvenile Chinese mitten crab Eriocheir sinensis [J]. Aquaculture, 2014, 434: 179—183
[14] John M J, Mahajan C L. The physiological response of fishes to a deficiency of cyanocobalamin and folic acid [J]. Journal of Fish Biology, 1978, 14: 127—133
[15] Shiau S Y, Hsu C W. Dietary pantothenic acid requirement of juvenile grass shrimp, Penaeus monodon [J]. Journal of Nutrition, 1999, 129(3): 718—721
[16] Association of Official Analytical Chemists (AOAC). Official Methods of Analysis of Official Analytical Chemists International (16th ed) [M]. Association of Official Analytical Chemists, Arlington, VA. 1995
[17] Chen L Q, Ai C X, Wen X B, et al. Studies on vitamin C requirements of juvenile crab (Eriocheir sinensis) [J]. Acta Oceanologica Sinica, 2005, 27(1): 130—136 [陈立侨, 艾春香, 温小波, 等. 中华绒螯蟹幼蟹维生素C营养需求研究.海洋学报, 2005, 27(1): 130—136]
[18] Ashida M. Purification and characterization of pre-prophenoloxidase from hemolymph of the silkworm, Bombyx, Mori Arch [J]. Archives of Biochemistry and Biophysics, 1971, 144(2): 749—762
[19] Hultmark D, Steiner H, Rasmusn T. Insect immunity: purification and properties of three inducible bactericidal proteins from hemoloymph of immunized pupae of Hyalophera cecropia [J]. European Journal of Biochemistry, 1980, 106: 7—16
[20] Gonzalez F, Esther Ferez-Vidal M, Arias J M, et al. Partial purification and biochemical properties of acid and alkaline phosphatases from Myxococcus coralloides D J. Applied Bacteriology [J]. Journal of Applied Microbiology, 1994, 77: 567—573
[21] Wang S H, Chen J C. The protective effect of chitin and chitosan against Vibrio alginolyticus in white shrimp, Litopenaeus vannamei [J]. Fish Shellfish Immunology, 2005, 19: 191—204
[22] Uchiyama M, Mihara M. Determination of malonaldehyde precursor in tissue by thiobarbituric acid test [J]. Annual Review of Biochemistry, 1978, 86: 271—278
[23] Fenech M F, Dreosti I E, Rinaldi J R. Folate, vitamin B12, homocysteine status and chromosome damage rate in lymphocytes of older men [J]. Carcinogenesis, 1997, 18: 1329—1336
[24] Wagner C. Biochemical Role of Folate in Cellular Metabolism [M]. In: L B Bailey (Eds.), Folate in Health and Disease, Marcel Dekker Inc Publ. 1995, 23—42
[25] Wang J Y, Zhu S G, Xu C F. Biochemistry [M]. 3rd ed, Beijing: Higher Education Press. 2002, 454—458 [王镜岩,朱圣庚, 徐长法. 生物化学. 3版, 北京: 高等教育出版社. 2002, 454—458]
[26] Christian J L, Greger J L. Nutrition for Living [M]. The Benjamin/Cummings Publishing Company, Redwood City, California, USA. 1994, 621
[27] Castle W B, Ross J B, Davidson C S, et al. Extrinsic factor in pernicious anemia: ineffectiveness of purified casein and of identified components of the vitamin B complex [J]. Science (New York, NY), 1944, 100: 81
[28] Herbert V, Zalusky R. Interrelations of vitamin B12and folic acid metabolism: folic acid clearance studies [J]. Journal of Clinical Investigation, 1962, 41(6): 1263
[29] Chanarlin I, Deacon R, Lumb M, et al. Cobalamin-folate interrelations: a critical review [J]. Blood, 1985, 66: 479—489
[30] Weissbach H, Taylor R T. Roles of vitamin B12and folic acid in methionine synthesis [J]. Vitamins and Hormone, 1970, 28: 415—440
THE EFFECTS OF DIETARY FOLIC ACID AND VITAMIN B12ON THE GROWTH PERFORMANCE, NON-SPECIFIC IMMUNITY AND THE DISEASE RESISTANCE OF
JUVENILE CHINESE MITTEN CRAB ERIOCHEIR SINENSIS
WEI Jian-Jun1, ZHANG Fan1, TIAN Wen-Jing1, LI Er-Chao1, WU Qiang-Qiang2and CHEN Li-Qiao1
(1. College of Life Science, East China Normal University, Shanghai 200241, China; 2. Tongwei Company Limited, Chengdu 610041, China)
In this study, we aimed to determine the combined effects of dietary folic acid and vitamin B12on the growth, non-specific immunity, and the disease resistance of juvenile Chinese mitten crab Ericheir sinensis. The crabs [initial weight, (2.57 ± 0.02) g] were fed with 4 experimental diets containing 2 concentrations of folic acid (0 and 2.3 mg folic acid/kg diet) and vitamin B12(0 and 0.2 mg vitamin B12/kg diet). Each diet group had 5 replicates and was fed for 8 weeks. This was followed by an Aeromonas hydrophila challenge for 2 weeks. E. sinensis fed with 2.3 mg folic acid/kg and 0.2 mg vitamin B12/kg showed significantly higher weight gain, specific growth rate, feed efficiency and survival rate than those fed without folic acid and vitamin B12supplementation. The activity of phenoloxidase was the maximum in juveniles fed with 2.3 mg folic acid/kg and 0.2 mg vitamin B12/kg. Juveniles fed with both folic acid and vitamin B12supplementation had the highest levels of total haemocyte count, lysozyme, and activities of acid phosphatase and alkaline phosphatase, followed by crabs fed with either folic acid or vitamin B12only, and the group without folic acid or vitamin B12supplementation was the lowest. Crabs fed with 2.3 mg folic acid/kg and 0.2 mg vitamin B12/kg exhibited the highest activity of superoxide dismutase but the lowest level of malondialdehyde and the cumulative mortality. These results indicated that folic acid and vitamin B12had an interactive effect on the growth, non-specific immunity and the disease resistance of juvenile E. sinensis. The optimal concentrations of dietary folic acid and vitamin B12should be 2.3 mg/kg diet and 0.2 mg/kg diet respectively.
Eriocheir sinensis; Folic acid; Vitamin B12; Growth performance; Non-specific immunity; Aeromonas hydrophila
Q142
A
1000-3207(2015)06-01069-07
10.7541/2015.141
2014-10-30;
2015-03-02
公益性行业(农业)科研专项(No.201003020, 201203065); “十二五”国家科技支撑计划课题(2012BAD25B00); 国家自然科学基金项目(No.31172422); 上海市中华绒螯蟹现代农业产业技术体系建设和通威股份有限公司科技创新基金部分资助
魏建军(1988—), 男, 山东临朐人; 硕士研究生; 主要从事水生动物营养研究。E-mail: weijianjunhao@126.com
陈立侨(1962—), 男, 教授, 博士生导师; 主要从事水生动物营养学、水生动物种质遗传学和水生生物学研究。E-mail: lqchen@bio.ecnu.edu.cn

