铜离子急性胁迫对虎纹蛙肝脏中三羧酸循环及自由基代谢的影响
李 斌 黄 艳 邵 晨 王 宇
(浙江师范大学生态研究所, 金华 321004)
铜离子急性胁迫对虎纹蛙肝脏中三羧酸循环及自由基代谢的影响
李 斌 黄 艳 邵 晨 王 宇
(浙江师范大学生态研究所, 金华 321004)
为探明铜离子(Cu2+)对两栖动物肝脏线粒体中三羧酸(Tricarboxyl acid, TCA)循环及自由基代谢的毒理作用, 采用静水暴露实验, 研究了 Cu2+不同浓度和不同暴露时间对虎纹蛙(Hoplobatrachus chinensis)肝脏线粒体中异柠檬酸脱氢酶(ICDHm)活性、α-酮戊二酸脱氢酶(α-KGDH)活性、抗超氧阴离子(anti-·O2–)活性、过氧化氢(H2O2)含量、抑制羟自由基(inhabit-·OH)活性、一氧化氮(NO)含量以及一氧化氮合成酶(NOS)活性的影响。暴露实验共设置6个Cu2+浓度组(0.0、2.0、4.0、6.0、8.0和10.0 mg/L), 分5个暴露时间(0、24h、48h、72h和96h)取材, 对每个浓度的不同暴露时间分别取6个样本, 测定TCA循环及自由基代谢的相关指标。结果显示, 在TCA循环中随着Cu2+浓度的增加和暴露时间的延长, 时间和浓度因素对ICDHm活性影响无显著性交互作用(P>0.05), 暴露时间的延长对 ICDHm 活性无显著性影响(P>0.05), 但随着 Cu2+浓度的增加ICDHm 活性逐渐减小; 而时间和浓度因素对 α-KGDH 活性影响有显著交互作用(P<0.05), 暴露处理后α-KGDH活性下降, 分别在24h和96h的4.0、6.0 mg/L时活性最低。在自由基代谢中, 时间和浓度因素对抗·O2–活性、H2O2含量影响有显著交互作用(P<0.05), 而对抑制·OH活性、NO含量、NOS活性的影响无显著性交互作用(P>0.05)。不同时间随着 Cu2+浓度的增加, 抗·O2–活性均呈现出逐渐下降的趋势; 实验处理后H2O2含量升高, 在24h的6.0 mg/L时含量最大; 随着暴露时间的延长和Cu2+浓度的增加抑制·OH活性均逐渐降低; 而NO 含量和NOS 活性的变化趋势基本相同, 即随着Cu2+浓度的增加先增加后减少并趋近0浓度组, 且都在6.0 mg/L时达到最大。研究结果表明急性Cu2+暴露对虎纹蛙肝脏线粒体中TCA循环及自由基代谢有显著的毒性作用。
虎纹蛙; 铜离子; TCA循环; 自由基代谢; 毒性效应
铜是生物体所必须的微量元素之一, 对生物体的生长发育和繁殖起着重要的作用, 但过量的铜离子(Cu2+)则会对机体产生毒害作用[1, 2]。Cu2+是水体中常见的重金属, 主要来源于铜锌矿开采和冶炼、金属加工、机械制造、钢铁生产等工业废水[3]。含铜废水的排放不仅污染环境, 同时对栖息于其中的动植物产生极大的影响[4, 5]。两栖动物作为脊椎动物从水生过渡到陆生的重要类群, 其生命活动的各个环节均离不开水环境。因此, 以铜为代表的重金属污染被认为是导致当今全球两栖动物急剧下降的重要原因之一[6]。
近年来, 虎纹蛙(Hoplobatrachus chinensis)由于栖息地破坏、环境污染和人类过度捕猎等因素, 其野生种群濒临灭绝, 已被列为国家Ⅱ级重点保护野生动物, 并被列入中国濒危动物红皮书。虎纹蛙主要生活于稻田、鱼塘、水坑和沟渠内, 对水体污染反应敏感。目前关于虎纹蛙的研究主要集中于形态学[7]、细胞生物学[8]、分子遗传学[9]、生理生态[10]等方面, 而有关 Cu2+对虎纹蛙的急性毒性效应, 以及由此引起的三羧酸(Tricarboxyl acid, TCA)循环和自由基代谢方面的研究尚未见报道。本研究拟通过实验室急性胁迫实验, 研究 Cu2+对虎纹蛙肝脏线粒体中TCA循环及自由基代谢的毒理作用, 以期可为探讨重金属污染导致的两栖类种群下降机制的讨论和含铜废水排放标准的制定提供理论依据, 同时也可为该物种的野外保护提供重要的数据支持。
1 材料与方法
1.1 实验动物
本研究用虎纹蛙种群来自浙江省金华市的虎纹蛙养殖场。将虎纹蛙置于圆柱形水族箱(半径0.5 m× 高0.8 m)驯化饲养, 提供充足的水陆环境和遮蔽物,自然光照, 温度为(25±1) , ℃ 饲养密度为 30只/缸,每日以虎纹蛙养殖专用饲料(漳州市联泰饲料有限公司)投食 1次, 并定时用经曝气脱氯的自来水[pH: 7.5±0.1, 溶氧量: (8.7±0.2) mg/L]换水1次, 清除死亡个体、记录死亡率, 驯化时间为1周。
1.2 半致死浓度实验
在预实验的基础上, 用分析纯五水硫酸铜(CuSO4·5H2O)分别配制铜离子(Cu2+)浓度为8.0、10.0、20.0、40.0、60.0、80.0和100.0 mg/L的溶液15 L, 每个处理组设置2个平行, 另设空白对照组(0 mg/L)。向每个实验水族箱中放置15只体表无伤、大小均一[体重: (178.01±1.77) g; 体长: (12.30±0.13) cm]的虎纹蛙成体, 实验处理过程中不喂食, 每日定时更换实验溶液1次, 观察并分别记录每个水族箱中24h、48h、72h 和96h虎纹蛙的累积死亡个数, 及时清除死亡个体。
1.3 暴露实验
用分析纯 CuSO4·5H2O分别配制 Cu2+浓度为2.0、4.0、6.0、8.0和10.0 mg/L的溶液15 L, 每个Cu2+浓度设置 2个平行组, 另设空白对照组(0 mg/L)。每个实验水族箱中放置30只体表无伤、大小均一[体重: (178.01±1.77) g; 体长: (12.30± 0.13) cm]的虎纹蛙成体。实验过程中不喂食, 每日定时换溶液 1次, 注意观察并及时清除死亡个体。分别于暴露时间0、24h、48h、72h和96h在每个浓度组中随机取活体虎纹蛙 6只进行解剖, 并将所获取的肝脏组织置于–80℃冰箱中保存待用。
1.4 检测方法
采用差速离心法分离肝脏细胞中的线粒体, 操作方法详见试剂盒说明书(苏州科铭生物技术有限公司), 并将分离获取的线粒体置于–80℃冰箱中保存。
TCA 循环中异柠檬酸脱氢酶(Isocitrate dehydrogenase, ICDHm)和 α-酮戊二酸脱氢酶(α-ketoglutarate dehydrogenase, α-KGDH)的活性采用试剂盒测定(苏州科铭生物技术有限公司)。自由基代谢中抗超氧阴离子(anti-·O2–)活性、过氧化氢(H2O2)含量、抑制羟自由基(inhabit-·OH)活性、一氧化氮(NO)含量、一氧化氮合成酶(NOS)活性及线粒体中蛋白含量均采用试剂盒测定(南京建成生物工程研究所)。上述指标在每个样本中均重复测定3次, 并取平均值, 测定程序参照试剂盒说明书。
1.5 数据分析
实验数据采用SPSS 21.0数据包进行统计分析,并以平均值±标准误(Mean±SE)表示检测结果。以时间和浓度为自变量进行双因素方差分析(Two-way ANOVA), 若二因素间出现显著交互作用, 则固定其中一个因素, 以另一个因素做单因素方差分析(One-way ANOVA)或 t检验; 若二因素间无交互作用, 则进行两因素主效应分析, 并用 LSD进行组间差异显著性检验。显著性水平α=0.05。
2 结果
2.1 虎纹蛙的半致死浓度
采用直线内插法计算得出(图1): Cu2+对虎纹蛙的24h半致死浓度(24h LC50)为62.5 mg/L, 48h LC50为 24.7 mg/L, 72h LC50为 9.5 mg/L, 96h LC50为8.2 mg/L。
2.2 Cu2+对TCA循环中关键酶的影响

图1 虎纹蛙在不同浓度铜离子下的累积死亡率Fig. 1 The cumulative mortality rate of H. chinensis under various concentrations of Cu2+
Cu2+浓度和暴露时间双因素对虎纹蛙肝脏细胞线粒体中 ICDHm活性的影响无交互作用(P>0.05)(表1)。两因素主效应分析结果显示: 随着Cu2+浓度的增加, ICDHm活性呈现逐渐减小的趋势, 而暴露时间对ICDHm活性无影响(P>0.05)(图2)。
Cu2+浓度和暴露时间双因素对虎纹蛙肝脏细胞线粒体中α-KGDH活性的影响有极显著的交互作用(P<0.01)(表1)。在24h、48h和96h三个处理组中随着Cu2+浓度的增加α-KGDH活性均出现先减小后增大的趋势, 但其酶活均小于或等于对照组的酶活力;而在72h处理组中α-KGDH的活性只呈现出下降的趋势。相同 Cu2+浓度在不同暴露时间下, 随着处理时间的延长, α-KGDH活性均呈现出先减小后增大再减小的趋势(图3)。
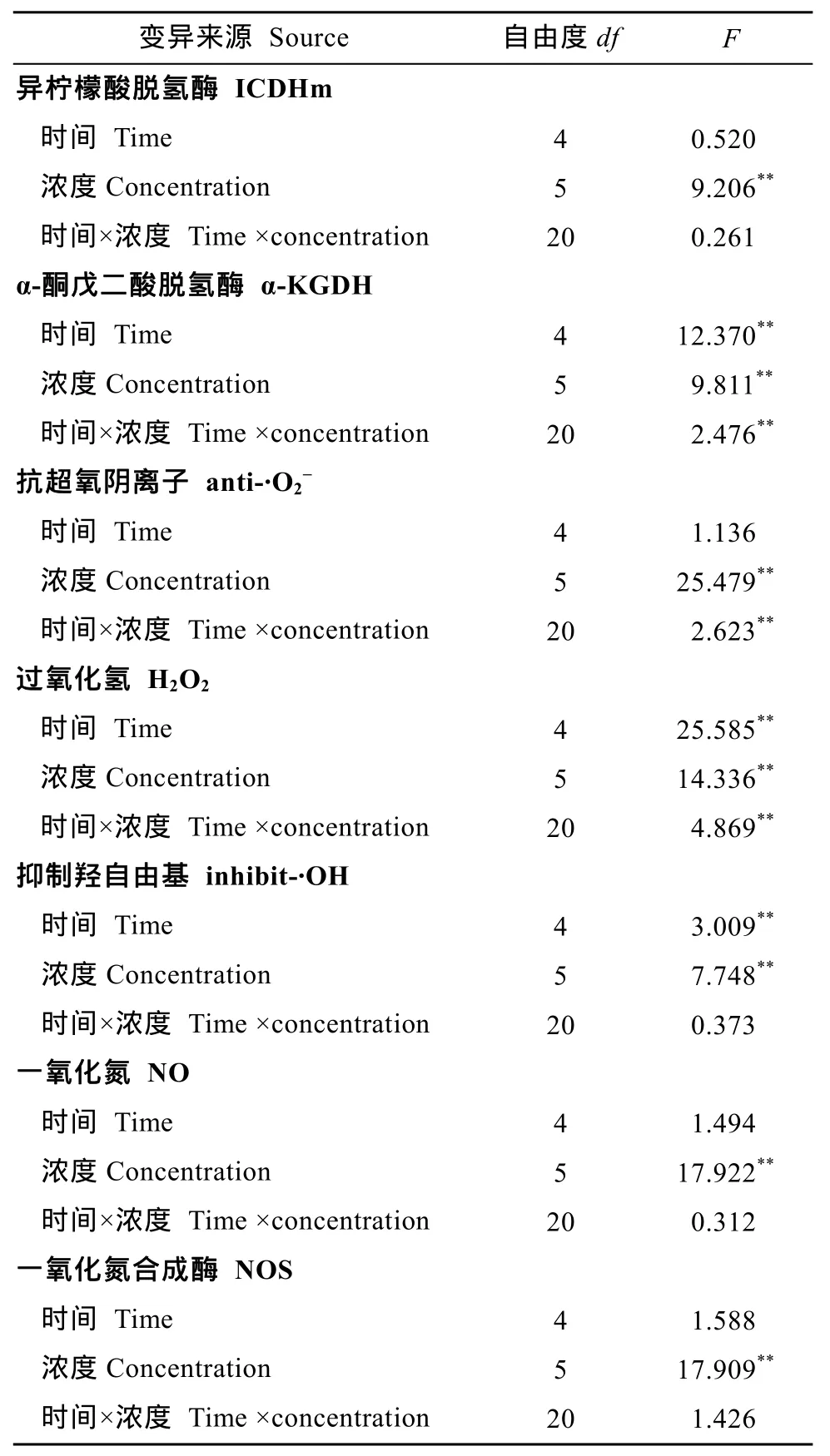
表1 铜离子浓度和作用时间对虎纹蛙肝脏细胞线粒体TCA循环关键酶和自由基代谢的双因素方差分析Tab. 1 Two-way ANOVA analysis of the effects of various copper ion concentrations and exposure time on the key enzymes in TCA cycle and free radical metabolism in the mitochondria of the liver of H. chinensis
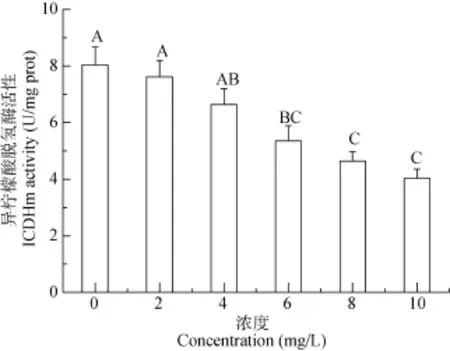
图 2 铜离子浓度对虎纹蛙肝脏细胞线粒体中异柠檬酸脱氢酶活性的影响Fig. 2 The effects of Cu2+concentrations on the activity of ICDHm in the mitochondria of the liver of H. chinensis
2.3 Cu2+对自由基代谢的影响
Cu2+浓度和暴露时间双因素对虎纹蛙肝脏细胞线粒体中的抗超氧阴离子活性及 H2O2含量的影响有极显著的交互作用(P<0.01)(表1)。在相同时间下,随着Cu2+浓度的增加抗超氧阴离子活性均有逐渐降低的趋势(图4)。在24h和48h处理组中, H2O2的含量随着Cu2+浓度的增加而呈现出先增大后减小的趋势, 但其含量均高于对照组; 而在72h和96h处理组中, H2O2的含量则是呈逐渐增加的趋势。在同一Cu2+浓度处理组中, 随着时间的延长, H2O2的含量呈逐渐减小的趋势(图5)。
暴露浓度和时间双因素对虎纹蛙肝脏细胞线粒体中抑制羟自由基活性、NO含量和NOS活性的影响无交互作用(P>0.05)(表1)。两因素主效应分析结果显示: 暴露时间显著影响抑制羟自由基的活性,抑制羟自由基活性随暴露时间的延长而呈现逐渐减小的趋势(图6), 然而暴露时间对NO含量和NOS的活性无显著影响(P>0.05); 抑制羟自由基的活性随Cu2+浓度的增加而呈现逐渐减小的趋势(图7), NO含量和NOS的活性则呈现先增大后减小的趋势(图8)。
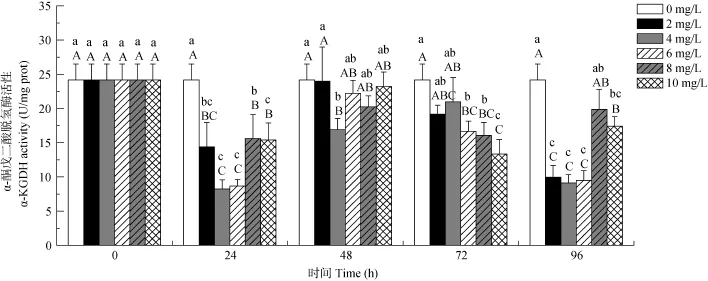
图3 铜离子对虎纹蛙肝脏细胞线粒体中α-酮戊二酸脱氢酶活性的影响Fig. 3 The effects of Cu2+exposure on the activity of α-KGDH in the mitochondria of the liver of H. chinensis

图4 铜离子对虎纹蛙肝脏细胞线粒体中抗超氧阴离子活性的影响Fig. 4 The effects of Cu2+exposure on the anti-·O2–activity in the mitochondria of the liver of H. chinensis
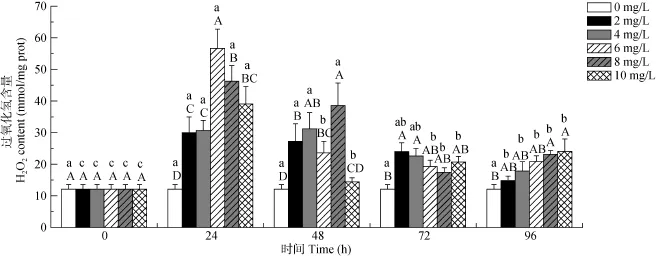
图5 铜离子对虎纹蛙肝脏细胞线粒体中过氧化氢含量的影响Fig. 5 The effects of Cu2+exposure on the H2O2content in the mitochondria of the liver of H. chinensis
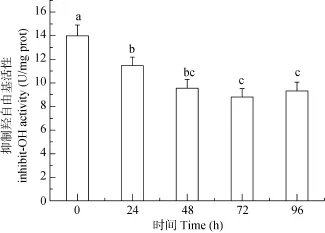
图 6 暴露时间对虎纹蛙肝脏细胞线粒体中抑制羟自由基活性的影响Fig. 6 The effects of exposure time on the inhibit-·OH activity in the mitochondria of the liver of H. chinensis

图 7 铜离子浓度对虎纹蛙肝脏细胞线粒体中抑制羟自由基活性的影响Fig. 7 The effects of Cu2+concentration on the inhibit-·OH activity in the mitochondria of the liver of H. chinensis
3 讨论
肝脏是糖类、脂类和蛋白质等进行代谢的主要场所, 其在维持生物体的代谢平衡方面起着重要的作用。此外, 肝脏也是机体的解毒器官, 可将来自体内外的各种有毒物质经过生物代谢转化为无毒或低毒的物质。肝脏细胞中含有大量的线粒体, 线粒体不仅是细胞的“能量工厂”, 而且在维持细胞功能上也发挥着重要作用[11]。肝脏细胞中的线粒体在合成ATP的同时会生成活性氧自由基(ROS), 二者在正常机体内处于动态平衡之中, 其含量共同调节着机体的生长发育、细胞凋亡、氧化应激、基因表达等生理生化活动[12, 13]。然而, 当机体受到外界不良环境的胁迫时(如高盐、低温等), 机体将产生过量的ROS积累, 造成线粒体损伤和细胞凋亡[14]。
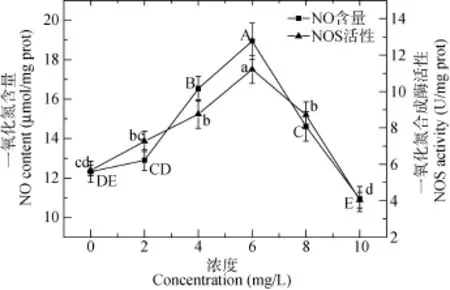
图 8 铜离子浓度对虎纹蛙肝脏细胞线粒体中一氧化氮含量和一氧化氮合成酶的影响Fig. 8 The effects of Cu2+concentration on the NO content and NOS activity in the mitochondria of the liver of H. chinensis
3.1 Cu2+对TCA循环的影响
TCA循环作为生物体能量代谢的重要途径, 不仅是糖、脂和蛋白质代谢的最终代谢通路, 也是糖、脂和蛋白质代谢联系的枢纽。ICDHm和 α-KGDH 是TCA循环中的关键酶, 对调节TCA循环具有重要的作用[15, 16]。
研究显示, TCA循环中NADPH的生成主要受到ICDHm活性的影响, 同时活性氧自由基(ROS)在体内的代谢又受到 NADPH所提供质子数量的影响[17],因此ICDHm在TCA循环中的活性将影响到对ROS的清除能力[18]。本研究结果显示随着Cu2+浓度的增加, ICDHm的活性将逐渐降低, 这与李明达等[19]对酿酒酵母体内 ICDHm活性研究结果一致, 说明Cu2+的胁迫能够对ICDHm活性产生显著影响。
α-KGDH则是TCA循环的限速酶, 在TCA循环中α-KGDH催化α-酮戊二酸生成琥珀酰-CoA和NADH。NADH在机体的电子呼吸链中可与FADH2共同作用促使 ADP和 Pi反应合成 ATP[20]和产生ROS[21]。因此, α-KGDH的活性将直接影响线粒体的能量代谢和ROS的生成[22]。在不良环境中, ROS的积累将会降低α-KGDH的活性[23], 且过量的ROS将引起机体组织慢性缺氧, 促使机体产生适应性调节,并诱导α-KGDH活性的回升[24]。本研究结果与此基本一致, 虎纹蛙在经Cu2+处理24h和48h后, α-KGDH的活性呈现出先降低后回升的趋势; 而在处理 72h后由于机体受损程度已超过机体的适应性调节范围,因而造成自身调节失效并引起α-KGDH活性的逐渐下降; 随着处理时间继续延长, 96h后α-KGDH的活性在锐减后回升, 这可能是因为外界伤害超过机体适应性调节范围后触发了机体的某种补偿机制。同样, 在相同离子浓度不同暴露时间的分析上也说明可能存在这种补偿机制。在2、4、6和8 mg/L的处理组中, 随着处理时间的延长, α-KGDH活性呈现出先下降后回升再下降的趋势; 而在 10 mg/L的处理组中α-KGDH的活性除了先下降后回升再下降的趋势外, 其酶活性还有再次回升的趋势。虎纹蛙机体中出现的关于α-KGDH活性的补偿目前尚不清楚其机制, 还有待后续研究。然而, 经 Cu2+处理后无论是机体自身的适应性调节还是机体触发的补偿机制所导致α-KGDH活性的回升, 其活性均小于或等于对照组的酶活性。
3.2 Cu2+对自由基代谢的影响
重金属对生物体的毒性效应主要表现在自由基介导的生物氧化损伤[21], 而生物体的氧化胁迫又可诱导生物体产生过量的 ROS[25]并降低生物体清除ROS的能力[26]。在线粒体中, ROS主要包括·O2–、H2O2、·OH和NO等几种。其中·O2–是一种在线粒体中具有高度生物活性的自由基[26], 可由呼吸链在进行电子传递时形成[27], 是形成 H2O2和·OH 的前体。·OH 是·O2–经过歧化反应和 Fenton反应及Haber-Weiss反应生成, 可与大多数细胞发生反应造成氧化损伤或过氧化损伤[28]。H2O2则是·O2–反应生成·OH的中间产物, 其在机体内的含量直接影响对ROS的清除能力和抗氧化系统的稳定性[21]。
在本研究中, 虎纹蛙在 Cu2+水溶液暴露后, 线粒体抗超氧阴离子和抑制羟自由基的活性均呈逐渐下降的趋势。抗超氧阴离子和抑制羟自由基是机体内清除·O2–和·OH的主要物质, 在Cu2+作用下, 二者的含量和活性均受到严重的抑制而降低[4, 29, 30], 并导致机体对ROS清除能力的下降。本实验的结果与用镉对河南华溪蟹(Sinopotamon henanense)肝胰腺线粒体自由基代谢的研究结果大致相同[21]。而H2O2的含量则在外界 Cu2+的影响下, 出现有规律的变化。在相同Cu2+浓度或较短时间(24h和48h)暴露后, H2O2的含量都表现出随暴露时间延长或 Cu2+浓度的增加呈现先上升后下降的趋势。这说明机体在面对 Cu2+的胁迫时, 首先其生成了大量的 ROS, 随后大量的ROS触发机体的适应性调节, 并产生抗氧化物使得H2O2的浓度随之降低。然而在较长时间(72h 和96h)暴露后, H2O2的含量则随Cu2+浓度的增加只表现出上升的趋势。这说明在较长时间的污染下,大量的H2O2引起机体抗氧化系统的紊乱, 导致ROS的积累; 同时机体自身对不良环境的适应性调节已失效, 因而其H2O2浓度呈单调上升的趋势。本实验的结果与对中国花鲈(Lateolabrax maculatus)幼鱼的毒性研究结果类似[4]。
NO作为线粒体中具有高度生物活性的另一种自由基, 在调节线粒体氧化呼吸和能量代谢方面起到重要的作用[21]。存在于线粒体内膜上的钙依赖性NOS可通过氧化L-精氨酸形成NO, 且其活性受到线粒体内膜的影响[31]。本研究结果显示, 经 Cu2+处理后, NO的含量和NOS的活性均随着Cu2+浓度的增大而出现先上升后下降的变化, 这与用镉对河南华溪蟹的相关研究结果相一致[21]。低浓度的Cu2+在机体内可作为微量元素被吸收[32], 从而诱导NOS活性的增加, 并促使 NO合成量的增大; 随着 Cu2+浓度的不断增大, NOS的活性和NO的含量均不断增加; 大量的NO一方面将与O2竞争性的与呼吸链复合体Ⅳ结合, 降低呼吸链活性, 减少 O2的消耗, 导致机体产能受阻[33]; 另一方面, 大量的 NO 还可与·O2–发生反应生成活性更强的过氧化亚硝酸离子(ONOO–)[34], 导致呼吸链受损和脂质过氧化, 使机体的ATP合成受到阻碍[35]。此后, 随着Cu2+浓度继续增大, 高剂量的 Cu2+不仅导致机体的呼吸链受损、产能受阻, 还可直接与NOS作用而改变其分子构型[32], 最终导致NOS活性和NO生成的下降。
综上所述, 急性 Cu2+暴露对虎纹蛙肝脏线粒体中TCA循环及自由基代谢有显著的毒性作用, 其不仅可通过影响虎纹蛙肝脏线粒体中 TCA循环关键酶ICDHm和α-KGDH的活性降低TCA循环的转化效率, 而且可通过降低虎纹蛙肝脏线粒体中抗自由基的生成能力和增加线粒体中自由基的含量破坏线粒体的自由基代谢平衡。
致谢:
感谢代亚如、程岩岩、朱丽丽和金芬对本实验相关数据的处理和文稿的校对。感谢孙梅好教授对英文摘要进行润色。
参考文献:
[1] De Boeck G, Meeus W, Coen W D, et al. Tissue-specific Cu bioaccumulation patterns and differences in sensitivity to waterborne Cu in three freshwater fish: rainbow trout (Oncorhynchus mykiss), common carp (Cyprinus carpio), and gibel carp (Carassius auratus gibelio) [J]. Aquatic Toxicology, 2004, 70(3): 179—188
[2] Wu F C, Feng C L, Cao Y J, et al. Aquatic life ambient freshwater quality criteria for copper in China [J]. Asian Journal of Ecotoxicology, 2011, 6(6): 617—628 [吴丰昌,冯承莲, 曹宇静, 等. 我国铜的淡水生物水质基准研究.生态毒理学报, 2011, 6(6): 617—628]
[3] Wang H D, Fang F M, Xie H F. Research situation and outlook on heavy metal pollution in water environment of China [J]. Guangdong Trace Elements Science, 2010, 17(1): 14—18 [王海东, 方凤满, 谢宏芳. 中国水体重金属污染研究现状与展望. 广东微量元素科学, 2010, 17(1): 14—18]
[4] Zhu Y F, Hong W S, Lin J Z. Toxicity of Cu2+to juvenile perch Lateolabrax maculatus [J]. Asian Journal of Ecotoxicology, 2011, 6(3): 331—336 [朱友芳, 洪万树, 林金忠. 铜离子对中国花鲈幼鱼的毒性研究. 生态毒理学报, 2011, 6(3): 331—336]
[5] Zhang F, Liu H W, Song Z D. Effects of some heavy metals on superoxide anion (O2–) production by coelomocytes of Stichopus japonicus [J]. Journal of Agro-Environment Science, 2006, 25(suppl): 100—103 [张峰, 刘洪伟, 宋志东.几种重金属对刺参体腔细胞超氧阴离子(O2–)产生的影响.农业环境科学学报, 2006, 25(增刊): 100—103]
[6] Gascon C, Collins J P, Moore R D, et al. Amphibian Conservation Action Plan. IUCN/SSC Amphibian Specialist Group [M]. Gland, Switzerland and Cambridge, UK. 2007, 64
[7] Lin Z H, Ji X. Sexual dimorphism in morphological traits and food habits in tiger frogs, Hoplobatrachus rugulosus in Lishui, Zhejiang [J]. Zoological Research, 2005, 26(3): 255—262 [林植华, 计翔. 浙江丽水虎纹蛙形态特征的两性异形和食性. 动物学研究, 2005, 26(3): 255—262]
[8] Lin X, Wang S K, Chen M F, et al. Study on tryptase in the mast cell in the digestive tract of indian bullfrog (Rana tigrina rugulosa) by an immunohistochemical method [J]. Acta Hydrobiologica Sinica, 2010, 34(1): 29—34 [林旋, 王寿昆, 陈梅芳, 等. 虎纹蛙消化道肥大细胞类胰蛋白酶免疫组化研究. 水生生物学报, 2010, 34(1): 29—34]
[9] Shao C, Wang Y, Qiao N. Isolation and characterization of microsatellite loci in tiger frog (Hoplobatrachus rugulosus) [J]. Conservation Genetics, 2009, 10(5): 1601—1603
[10] Wang N, Shao C, Xie Z G, et al. Viability and changes of physiological functions in the tiger frog (Hoplobatrachus rugulosus) exposed to cold stress [J]. Acta Ecologica Sinica, 2012, 32(11): 3538—3545 [王娜, 邵晨, 颉志刚, 等. 低温胁迫下虎纹蛙的生存力及免疫和抗氧化能力. 生态学报, 2012, 32(11): 3538—3545]
[11] Gunter T E, Yule D I, Gunter K K, et al. Calcium and mitochondria [J]. Febs Letters, 2004, 567(1): 96—102
[12] Wallace D C. A mitochondrial paradigm of metabolic and degenerative diseases, aging, and cancer: a dawn for evolutionary medicine [J]. Annual Review of Genetics, 2005, 39: 359—407
[13] Navarro A, Boveris A. The mitochondrial energy transduction system and the aging process [J]. American Journal of Physiology-Cell Physiology, 2007, 292(2): C670—C686
[14] Xu Z K, Guan G Q, Yin H, et al. Mitochondrial research of animal piroplasms [J]. Chinese Journal of Animal Infectious Diseases, 2011, 18(6): 67—73 [徐宗可, 关贵全, 殷宏, 等.动物梨形虫线粒体研究进展. 中国动物传染病学报, 2010, 18(6): 67—73]
[15] Hao Z F, Yuan J C, Liu Y H. Role of isocitrate dehydrogenase on oxidative stress in plants [J]. Biotechnology Bulletin, 2012, (6): 32—35 [郝兆丰, 袁进成,刘颖慧. 异柠檬酸脱氢酶在植物抗氧化胁迫中的作用. 生物技术通报, 2012, (6): 32—35]
[16] Li K, Guo X, Yang Y, et al. Effects of high humidity environment on isocitrate dehydrogenase and alpha ketone glutaric acid dehydrogenase in liver of rat [J]. Journal of Third Military Medical University, 2013, 35(23): 2595—2596 [李昆, 郭鑫, 杨芸, 等. 高湿环境对大鼠肝脏异柠檬酸脱氢酶及 α-酮戊二酸脱氢酶的影响. 第三军医大学学报, 2013, 35(23): 2595—2596]
[17] Jo S H, Lee S H, Chun H S, et al. Cellular defence against UVB-induced phototoxicity by cytosolic NADP+-dependent isocitrate dehydrogenase [J]. Biochemical and Biophysical Research Communications, 2002, 292(2): 542—549
[18] Jo S H, Son M K, Koh H J, et al. Control of mitochondrial redox balance and cellular defense against oxidative damage by mitochondrial NADP+-dependent isocitrate dehydrogenase [J]. Journal of Biological Chemistry, 2001, 276(19): 16168—16176
[19] Li M D, Zhao R, Jiang X L, et al. Effects of adding intermediate material in tricarboxylic acid cycle on the activity of key enzymes of Saccharomyces cerevisiae [J]. Microbiology China, 2010, 37(3): 331—335 [李明达, 赵睿,姜晓雷, 等. TCA循环中间产物对酿酒酵母胞内代谢关键酶活性的影响. 微生物学通报, 2010, 37(3): 331—335]
[20] Liu L M, Li Y, Shi Z P, et al. Enhancement of pyruvate productivity in Torulopsis glabrata: Increase of NAD+availability [J]. Journal of Biotechnology, 2006, 126(2): 173−185
[21] Jin F F, Wang L. Effects of cadmium on hepatopancreas mitochondrial free radical metabolism in freshwater crab Sinopotamon henanense [J]. Acta Scientiae Circumstantiae, 2012, 32(2): 457—464 [金芬芬, 王兰. 镉对河南华溪蟹肝胰腺线粒体自由基代谢的影响. 环境科学学报, 2012, 32(2): 457—464]
[22] Starkov A A, Fiskum G, Chinopoulos C, et al. Mitochondrial α-ketoglutarate dehydrogenase complex generates reactive oxygen species [J]. Journal of Neuroscience, 2004, 24(36): 7779—7788
[23] Huang H M, Ou H C, Xu H, et al. Inhibition of α-ketoglutarate dehydrogenase complex promotes cytochrome c release from mitochondria, caspase-3 activation, and necrotic cell death [J]. Journal of Neuroscience Research, 2003, 74(2): 309—317
[24] Lu Z F, Jia F, Qiu Y M, et al. Effect of mild hypothermia on the activities of α-ketoglutarate dehydrogenase of mitochondria following traumatic brain injury [J]. Chinese Journal of Neurosurgery, 2007, 22(11): 659—662 [陆兆丰,贾锋, 邱永明, 等. 亚低温对创伤性脑损伤后线粒体 α-酮戊二酸脱氢酶活性的影响. 中华神经外科杂志, 2007, 22(11): 659—662]
[25] Sarkar B. Metal replacement in DNA-binding zinc figer protein and its relebance to mutagenicity and carcinogenicity through free radica feneration [J]. Nutrition, 1995, 11(5 Suppl): 646—649
[26] Del-Rio D, Stewart A J, Pellegrini N. A review of recent studies on malondialdehyde as toxic molecule and biological marker of oxidative stress [J]. Nutrition Metabolism and Cardiovascular Diseases, 2005, 15(4): 316—328
[27] Gill S S, Tuteja N. Reactive oxygen species and antioxidant machinery in abiotic stress tolerance in crop plants [J]. Plant Physiology and Biochemistry, 2010, 48(12): 909—930
[28] Anwer T, Sharma M, Pillai K K, et al. Protective effect of bezafibrate on streptozocin-induced oxidative stress and toxicity in rats [J]. Toxicology, 2007, 229(1/2): 165—172
[29] Wang C G, Yu Q, Yu A, et al. Effect of benzo(a)pyrene and pyrene exposure on hepatic superoxide dismutase in Mugil so-iuy [J]. Marine Environmental Science, 2002, 21(4): 10—13 [王重刚, 余群, 郁昂, 等. 苯并(a)芘和芘暴露对梭鱼肝脏超氧化物歧化酶活性的影响. 海洋环境科学, 2002, 21(4): 10—13]
[30] Hultberg B, Andersson A, Isaksson A. Alterations of thiol metabolism in human cell lines induced by low amounts of copper, mercury of cadmium ions [J]. Toxicology, 1998, 126(3): 203—212
[31] Riobó N A, Melani M, Sanjuán N, et al. The modulation of mitochondrial nitric-oxide synthase activity in rat brain development [J]. Journal of Biological Chemistry, 2002, 277(45): 42447—42455
[32] Knowles R G, Moncada S. Nitric oxide synthases in mammals [J]. Biochemical Journal, 1994, 298(Pt 2): 249—258
[33] Solien J, Haynes V, Giulivi C. Differential requirements of calcium for oxoglutarate dehydrogenase and mitochondrial nitric-oxide synthase under hypoxia: impact on the regulation of mitochondrial oxygen consumption [J]. Comparative Biochemistry and Physiology Part A: Molecular & Integrative Physiology, 2005, 142(2): 111—117
[34] Ghafourifar P, Colton C A. Mitochondria and nitric oxide [J]. Antioxidants & Redox Signaling, 2003, 5(3): 249—250
[35] Brown G C, Borutaite V. Nitric oxide and mitochondrial respiration in the heart [J]. Cardiovascular Research, 2007, 75(2): 283—290
THE EFFECTS OF ACUTE COPPER STRESS ON TCA CYCLE AND FREE RADICAL METABOLISM IN THE LIVER OF HOPLOBATRACHUS CHINENSIS
LI Bin, HUANG Yan, SHAO Chen and WANG Yu
(Institute of Ecology, Zhejiang Normal University, Jinhua 321004, China)
In this study, we applied acute toxicity test to investigate the toxic effects of copper ion (Cu2+) on tricarboxylic acid cycle (TCA) and free radical metabolism in the mitochondria of the liver of Hoplobatrachus chinensis. We treated the animals with Cu2+at different concentrations and for different exposure time, and tested the activities of TCA-related enzymes and free radicals. We found that although Cu2+at high concentrations could reduce the activity of ICDHm, prolonged exposure time had no significant effect on ICDHm (P > 0.05). We did not observe cross effects between the concentration of Cu2+and the exposure time on the activity of ICDHm (P > 0.05). However there were significant cross effects between the exposure time and the concentration of Cu2+on the activity of α-KGDH (P < 0.05). The activity of α-KGDH decreased when exposed to Cu2+, and the lowest activities were detected when the exposure times were 24h and 96h and concentrations were 4.0 and 6.0 mg/L. In terms of free radical metabolism, the exposure time and copper concentration had strong cross effects on the activities of anti-·O2–and H2O2(P < 0.05), but not on the activity of inhibit-·OH, the content of NO, and the activity of NOS. The activities of anti-·O2–decreased along with the increase in the concentration of Cu2+. The content of H2O2increased after the treatments and perked at 24h and 6.0 mg/L. There was a negative correlation between the activity of inhibit-·OH and the exposure time and the concentration of Cu2+. Along with the increase in the concentration of Cu2+, the content of NO and the activity of NOS first increased and then decreased to the values of the control group, and the maximum values appeared in the 6.0 mg/L group. Our study demonstrated that the acute exposure of Cu2+could have significant toxic effects on TCA cycle and free radical metabolism in the mitochondria of the liver of H. chinensis.
Hoplobatrachus chinensis; Copper ion; TCA cycle; Free radical metabolism; Toxic effect
Q593+.1
A
1000-3207(2015)06-1160-09
10.7541/2015.152
2014-11-10;
2015-04-17
国家自然科学基金(31400472); 浙江省自然科学基金(LQ14C040001); 浙江师范大学博士科研启动基金(ZC304013020)资助
李斌(1988—), 男, 湖北孝感人; 硕士; 研究方向为动物资源与保护生物学。E-mail: libinldgl@126.com
王宇, E-mail: yuwang@zjnu.edu.cn

