中国花鲈精子的超低温冷冻保存及酶活性检测
史应学程 顺竺俊全吴雄飞
(1. 宁波大学教育部应用海洋生物技术重点实验室, 宁波 315211; 2. 浙江海洋高效健康养殖协同创新中心, 宁波 315211; 3. 宁波市海洋与渔业研究院, 宁波 315012)
研究简报
中国花鲈精子的超低温冷冻保存及酶活性检测
史应学1, 2程 顺1, 2竺俊全1, 2吴雄飞2,3
(1. 宁波大学教育部应用海洋生物技术重点实验室, 宁波 315211; 2. 浙江海洋高效健康养殖协同创新中心, 宁波 315211; 3. 宁波市海洋与渔业研究院, 宁波 315012)
精子超低温冷冻保存技术在种质资源保存、遗传育种及苗种生产上具有重要的应用价值[1, 2]。为了提高冷冻精子的实际应用效果, 需要在提高冻精质量上进行深入研究。冻精质量的提高有赖于精子超低温冷冻保存技术参数的优化, 诸如稀释液种类、稀释比例、抗冻剂种类及浓度、降温方法及速率等技术参数均需要进行研究与优化选择。目前, 海水鱼类精子超低温冷冻保存研究已见在真鲷(Pagrus major)[3, 4]、黑鲷(Sparus macrocephalus)[5]、牙鲆(Paralichthys olivaceus)[6]及大菱鲆(Scophthalmus maximus)[7, 8]、条纹狼鲈(Dicentrarchus labrax)[9]、大黄鱼(Pseudosciaena crocea)[1, 10]、黄姑鱼(Nibea albiflora)[2]等种类中报道; 其使用的稀释液种类主要有Cortland、TS-2和HBSS等, 稀释比例一般在1∶1—1∶9; 采用的抗冻剂种类主要有 DMSO(二甲基亚砜)、EG(乙二醇)、Gly(甘油)及PG(丙二醇)等, 其适用浓度一般为 5%—20%; 采用的降温方法有程序降温仪降温法或自制简易降温装置降温法。为了评价精子的超低温冷冻保存效果, 需对冻精质量进行检测与分析, 常用检测方法有精子活力检测法、酶活性检测法、单细胞凝胶电泳(SCGE)DNA损伤检测法、流式细胞术(FCM)细胞结构损伤检测法等等, 根据实际研究条件选择应用。
中国花鲈(Lateolabrax maculatus)又名鲈鱼, 属鲈形目(Perciformes)、科(Serranidae)、花鲈属, 分布于中国、日本及朝鲜沿海。近年来, 随着中国花鲈增养殖产业的发展, 其优良种质保存、遗传育种及良种繁育研究愈益引起重视, 超低温冷冻保存的中国花鲈精子在诱导漠斑牙鲆(Paralichthys lethostigma)[11]、条斑星鲽(Verasper moseri)[12]、大菱鲆[13]等鱼类雌核发育研究方面得到了应用。以往, 中国花鲈精子超低温冷冻保存研究已见报道[14, 15],但精子的冷冻保存效果因研究者实施的冻存条件不同存在差异, 冷冻保存技术参数还有待于进一步选优, 以提高冻精质量。本研究以0.25 mL麦细管为冻存管、两步降温法研究了稀释液、稀释比例、抗冻剂种类与浓度以及降温高度对中国花鲈精子超低温冷冻保存效果的影响, 并采用酶活性测定技术检测了鲜精和优选组冻精质量, 旨在优化中国花鲈精子超低温冻存的技术参数, 为中国花鲈精子超低温冷冻保存优化工艺的建立提供参考。
1 材料与方法
1.1 材料
实验用性成熟中国花鲈雄鱼于2013年11月取自浙江省奉化市石沿育苗厂, 体长51.5—63.5 cm、体重3.0— 4.0 kg, 共10尾, 暂养于水泥池中, 供实验用。
1.2 方法
精液的采集 用促黄体素释放激素类似物和绒毛膜促性腺激素(LRH-A +HCG)对实验用鱼进行催产, 30h后采精; 用鱼夹夹住鱼, 用干毛巾擦去生殖孔周围及体表的水分, 轻压鱼腹使精液自然流出, 用洁净的注射器将精液移入离心管中, 置于冰浴上(4℃)备用。
精子活力测定 以过滤海水(水温15℃、pH 8.1、盐度 27%)为激活液(下同), 精液与激活液混合后在显微镜下观察精子活力(激活率、活动时间和寿命)。激活率为给定视野中被激活精子的数量占全部精子数量的百分比;运动时间是指精子自激活开始至 90%的精子原地颤动为止所经历的时间; 精子的寿命指精子从激活开始至 90%的精子停止运动的时间。实验重复3次。
稀释液种类对精子超低温冷冻保存效果的影响试验
分别以 HBSS、MPRS、Cortland 液为稀释液(表 1), 以10%EG为抗冻剂(抗冻剂为终浓度, 下同)配制抗冻液;将精液与抗冻液按1∶3比例混匀, 4℃平衡30min; 将平衡后的精液-抗冻液混合物分装入 0.25 mL麦细管中, 然后用两步降温法(即将盛精麦细管平放在自制简易降温装置的液氮面上7.5 cm处, 停留10min后投入液氮中)保存。12h后, 将麦细管从液氮中快速取出, 于40℃水浴中溶化后检测精子激活率。
稀释比例对精子超低温冷冻保存效果的影响试验以10%EG为抗冻剂、Cortland液为稀释液配制抗冻液, 将精液与抗冻液按1∶1、1∶2、1∶3、1∶4、1∶5、1∶7、1∶9混匀, 按前文方法冷冻保存精子及解冻与激活率检测。
抗冻剂种类及浓度对精子超低温冷冻保存效果的影响试验 以5%、10%、15%及20%四个浓度的DMSO、Gly、EG、PG为抗冻剂、Cortland液为稀释液配制抗冻液, 将精液与抗冻液按 1∶3混匀, 按前文方法冷冻保存精子及解冻与活力检测。
降温高度对精子超低温冷冻保存效果的影响试验
以10%EG为抗冻剂、Cortland液为稀释液配制抗冻液, 将精液与抗冻液按1∶3混匀, 装入0.25 mL麦细管中于4℃平衡 30min后, 分别平放在液氮面之上 2.5、5、7.5、10 及 12.5 cm处(通过控制麦细管距离液氮面的高度, 来改变冷冻过程的降温速率, 5个距离液氮面不同高度代表了5个不同的降温速率), 停留10min后投入液氮中保存。按前文方法进行冻精解冻与激活率检测。
鲜精及优选组冻精的酶活性检测 按章龙珍等[16]的方法处理鲜精和优选组(活力最优组)冻精样本(0.25 mL麦细管为冻存管、Cortland液为稀释液、1∶3为稀释比、10%EG为抗冻剂、距离液氮面7.5 cm高度降温10min后投入液氮, 保存12h后按前文方法进行解冻的冻精样本)。用购自南京建成生物工程研究所的酶活检测试剂盒测定酶活性(实验操作参照其说明书进行)。总ATP酶采用比色法测定, 酶活力单位定义为每小时每毫升样品中 ATP 酶分解ATP产生1 μmol无机磷的量为1个ATP 酶活力单位(U)。SDH(琥珀酸脱氢酶)采用比色法, 酶活力单位定义为每毫克蛋白每分钟使反应体系的吸光度降低 0.01为 1个比活性单位(U)。LDH(乳酸脱氢酶)采用比色法, 酶活力单位定义为1000 mL血清37℃与基质作用15 min, 在反应体系中产生1 μmol丙酮酸为1单位(U)。SOD(超氧化物歧化酶)采用黄嘌呤氧化酶法, 酶活力单位定义为每毫升反应液中SOD抑制率达50%时所对应的SOD量为1个SOD活力单位(U)。CAT(过氧化氢酶)采用比色法, 活力单位定义为每分钟分解1 μmol的过氧化氢的量为1个酶活力单位(U)。GR(谷胱甘肽还原酶)采用比色法, 活力单位定义为每升样品中每分钟使反应体系中底物NADPH的浓度改变1 mmol/L所需的酶量为1个酶活力单位(U)。

表1 三种精子超低温冷冻保存稀释液的组成成分Tab. 1 Composition of three extenders for sperm cryopreservation of Lateolabrax maculatus
1.3 数据分析
采用 Excel和 SPSS 17.0软件对实验数据进行处理,用单因素方差分析(One-Way ANOVA)检验各组精子活力、酶活性的差异显著性, 差异显著水平为 P<0.05。统计结果以平均值±标准差表示。
2 结果
2.1 稀释液种类对精子超低温冷冻保存效果的影响
以MPRS、HBSS及Cortland液为稀释液、10% EG为抗冻剂, 超低温冷冻保存中国花鲈精子, 12h后解冻,激活率检测结果见表2。冻精激活率Cortland组最高, 其次为MPRS组, HBSS组最低, 组间冻精激活率差异显著。

表2 稀释液种类对中国花鲈精子超低温冷冻保存效果的影响Tab. 2 Effects of extenders on activation rate during sperm cryopreservation in Lateolabrax maculatus
2.2 稀释比例对精子超低温冷冻保存效果的影响
以10%EG为抗冻剂、Cortland液为稀释液, 不同稀释比例对精子冷冻保存效果的影响(图1)。稀释比例为1∶3时冻精激活率最高, 达(87.33±2.52)%, 与鲜精相比差异不显著; 稀释比例低于或高于 1∶3, 精子激活率均明显下降, 与鲜精相比差异显著。
2.3 降温高度对精子超低温冷冻保存效果的影响
以Cortland液为稀释液、10%EG为抗冻剂, 不同降温高度超低温冷冻保存中国花鲈精子 12h后解冻, 激活率检测结果见图2。以距液氮面高度为7.5 cm的降温高度冷冻保存的精液, 解冻后激活率最高, 达(87.33±2.52)%,与鲜精相比差异不显著; 距液氮面高度小于或大于7.5 cm的降温高度, 冻精激活率与鲜精相比差异显著。
2.4 抗冻剂种类及浓度对精子超低温冷冻保存效果的影响
以Cortland液为稀释液、5%—20% DMSO、Gly、EG 及PG为抗冻剂, 超低温冷冻保存中国花鲈精子, 12h后解冻, 活力检测结果见表3。4种抗冻剂随着浓度的增加, 冻精活力都呈先上升后减低的变化趋势。E2、E3组冻精活力与鲜精相比差异不显著, 其中E2组冻精激活率、运动时间及寿命最高, 分别达(87.33±2.52)%、(15.23± 0.81)min 及(20.00±0.68)min; 其他各组冻精激活率、运动时间及寿命均显著低于鲜精。
2.5 鲜精及优选组冻精的总ATP酶、SDH、LDH及SOD、CAT、GR活性
由表4可知, 优选组冻精的总ATP酶、SDH、LDH、SOD及CAT活性与鲜精相比均有所下降, GR活性与鲜精相比有所上升, 但差异均不显著。
3 讨论
3.1 稀释液及抗冻剂对精子超低温冷冻保存效果的影响
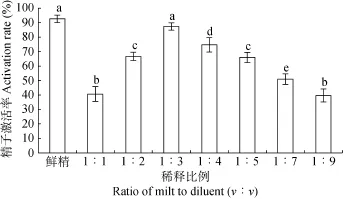
图1 稀释比例对中国花鲈精子超低温冷冻保存效果的影响Fig. 1 Effects of ratios of milt to diluent on activation rate of frozen-thawed sperm in Lateolabrax maculatus

图2 降温高度对中国花鲈精子冷冻保存效果的影响Fig. 2 Effects of cooling heights on activation rate of frozenthawed sperm in Lateolabrax maculates
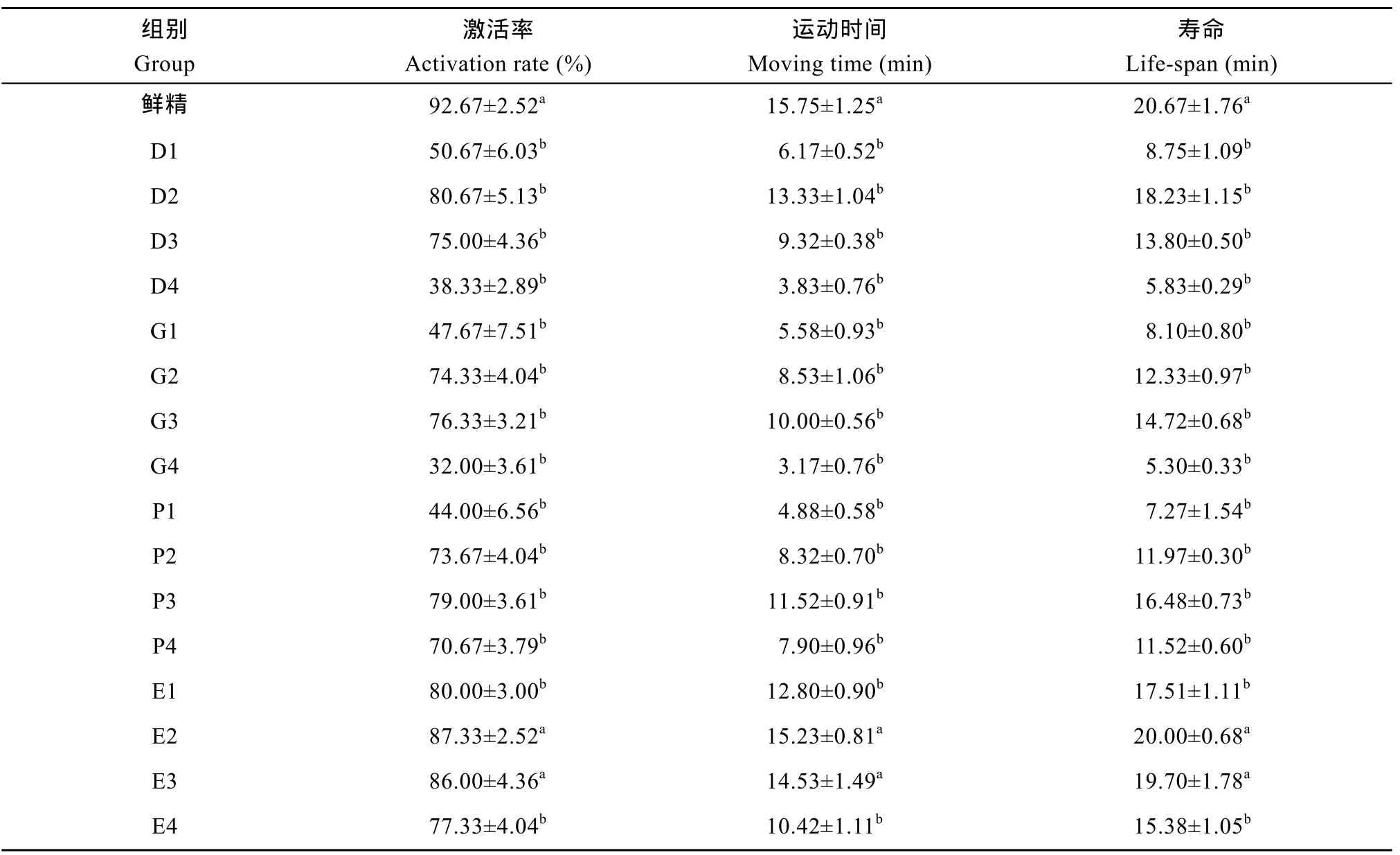
表3 抗冻剂种类及浓度对中国花鲈精子超低温冷冻保存效果的影响Tab. 3 Effects of types and concentrations of cryoprotectant on frozen-thawed sperm motility in Lateolabrax maculatus
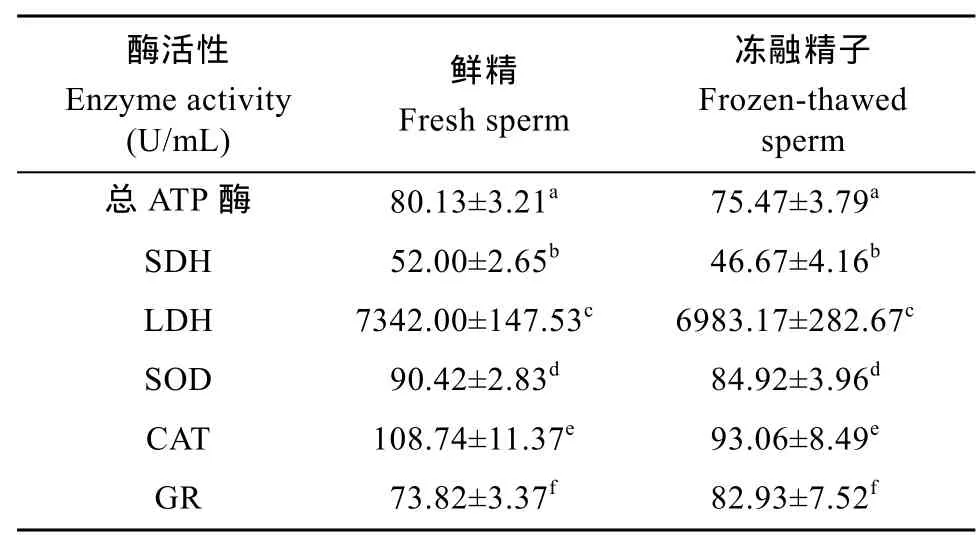
表4 鲜精及优选组冻精的总ATP酶、SDH、LDH及SOD、CAT、GR活性Tab. 4 The total ATPase, SDH, LDH and SOD, CAT, GR activities of fresh sperm and optimized frozen-thawed sperm in Lateolabrax maculatus
稀释液为精子提供一个适宜的生理环境, 延长其在体外的存活时间, 并防止精子被激活。稀释液的冷冻保存效果与其渗透压、pH及离子组成密切相关, 精子可被与精浆等渗或接近等渗的溶液抑制; 酸性溶液会降低或抑制精子运动; 高浓度K+能抑制精子活动, 而Na+、Ca2+、Mg2+能缓解或部分缓解这种抑制[17, 18]。不同种鱼类精子生理特性不同, 适宜的稀释液也不尽相同。Fauvel等[9]以MMM液为稀释液、10% DMSO为抗冻剂超低温冷冻保存条纹狼鲈精子, 冻精激活率与鲜精之间无显著差异。Chen等[7]以TS-2液为稀释液, 10%、14% DMSO为抗冻剂超低温冷冻保存大菱鲆精子, 激活率达(78.3±7.6)%和(76.6±5.8)%。Koh等[19]以FBS为稀释液, 5%DMSO为抗冻剂冷冻保存七带石斑鱼(Epinephelus septemfasciatus)精子, 激活率达(77.6±8.5)%。
本研究所选的 3种稀释液在海水鱼类精子超低温冷冻保存中较常用。如以 HBSS液为稀释液、5%—20% DMSO为抗冻剂冷冻保存的黄姑鱼精子激活率达(79.25± 3.86)%—(85.25±3.95)%[2]; 以MPRS液为稀释液、10%DMSO为抗冻剂冷冻保存的中国花鲈精子激活率达(68.3± 4.4)%[14]; 以Cortland液为稀释液、10%DMSO和10%Gly为抗冻剂冷冻保存的黑鲷和大黄鱼精子, 激活率最高分别达(92.91±1.25)%和(89.93±1.07)%[5, 10]。本研究以Cortland液为稀释液、10%EG为抗冻剂超低温冷冻保存的精子激活率较高, 达(87.33±2.52)%。分析认为, 与HBSS、MPRS液相比, Cortland液的渗透压、pH及离子环境可以更好地抑制中国花鲈精子运动, 提高冻后精子活力。因此, Cortland液适宜作为中国花鲈精子冷冻保存用稀释液。
抗冻剂的作用是在溶液中结合水分子, 发生水合作用, 使溶液的黏性增大, 从而弱化水的结晶过程, 达到保护精子的目的; 不同种鱼类精子适宜的抗冻剂种类及浓度有所不同。Zhang等[6]以12%DMSO和12%Gly为抗冻剂冷冻保存牙鲆精子, 激活率分别达(60.5±3.6)%和(79.17± 4.5)%; Chen等[7]以10%—14% DMSO为抗冻剂冷冻保存大菱鲆精子, 激活率达(76.6%±5.8)%—(78.3±7.6)%, 而以10%PG为抗冻剂时, 激活率下降为(51.7±2.9)%; 姜建湖等[1]以 5%—20% EG为抗冻剂冷冻保存大黄鱼精子, 激活率达(81.25±2.30)%—(87.50±2.52)%, 与鲜精相比无显著差异; 程顺等[10]以5%—20% Gly为抗冻剂冷冻保存大黄鱼精子, 激活率达(83.98±2.70)%—(89.93±1.07)%, 与鲜精无显著差异。本实验采用 Gly、DMSO、EG及 PG四种常用抗冻剂超低温冷冻保存中国花鲈精子, 其效果是EG>PG>DMSO>Gly, 其中以10% EG为抗冻剂时精子活力最高, 激活率、运动时间和寿命分别达(87.33±2.52)%、(15.23±0.81)min和(20.00±0.68)min, 与鲜精相比无显著差异。分析认为, EG分子量相对较小, 其渗透性比 PG、DMSO及Gly高, 能更快速地进入中国花鲈精子, 与水结合, 弱化结晶过程; 10%EG既能起到良好的抗冻保护作用, 又不会因其浓度过高而导致精子中毒。因此, 中国花鲈精子冷冻保存宜选用10% EG为抗冻剂。
精液与抗冻液的稀释比是影响精子冷冻保存效果的又一重要因素, 适宜的稀释比能使稀释液充分渗透入精子细胞。不同种鱼类精液中精子密度及其生理特性不同,适宜的稀释比也会有所不同。据报道, 大菱鲆精子的冷冻保存试验, 稀释比从1∶1升高到1∶9, 精子激活率无显著变化[7, 8]。黄姑鱼、真鲷和大黄鱼精子冷冻保存试验, 稀释比1∶3, 冻精激活率最高分别达(85.25±3.95)%、(81.0± 5.4)%和(89.93±1.07)%[2, 3, 10]。Ji等[14]以1∶1稀释比冷冻保存中国花鲈精子, 冻精激活率最高达(73.3±5.7)%。本研究的中国花鲈精子超低温冷冻保存试验, 稀释比为 1∶3时激活率达(87.33±2.52)%, 稀释比大于或小于1∶3时激活率明显下降。分析认为, 稀释比 1∶3时, 稀释液能充分渗透入中国花鲈精子, 这一稀释比适于中国花鲈精子冷冻保存。
3.2 降温高度对精子超低温冷冻保存效果的影响
简易降温装置-两步降温法是鱼类精子冷冻保存的常用方法, 它通过设置冻存管距离液氮面的高度及停留时间来控制降温速率。当距液氮面高度增加、降温减慢时,细胞外冰晶形成速度快于细胞内, 导致细胞因暴露于较高浓度环境中而脱水产生渗透休克, 而当距液氮面高度降低、降温加快时, 细胞内水分来不及渗出, 细胞因形成冰晶而刺破细胞膜和细胞器等结构, 导致细胞死亡, 所以当距液氮面的高度高于或低于适宜高度时, 冻精激活率降低。不同种鱼类精子适宜的降温高度有所不同。Koh等[19]对七带石斑鱼精子的冷冻保存试验是在距离液氮面高度2.5、5.0、7.5及10 cm处先降温至-50 , ℃ 然后投入液氮中保存, 各高度组冻精激活率无显著差异。Dreanno等[8]在距离液氮面6.5 cm高度降温15min与在2 及13 cm高度处降温相同时间冷冻保存大菱鲆精子, 其激活率分别达(81.1±3.6)%与(56.7±4.6)%及(74.7±4.9)%。程顺等[10]对大黄鱼精子的冷冻保存试验是在距离液氮面3—4 cm处降温 3—5min, 然后投入液氮中保存, 冻精激活率达(83.98±2.70)%—(89.93±1.07)%。Ji等[14]试验发现,花鲈精子在距离液氮面2、6及13 cm高度处降温10min,接着在液氮面停留5min后投入液氮中保存, 冻精激活率分别为(41.7±10.6)%、(73.3±5.7)%及(48.3±2.9)%。本研究5个不同的液氮面设置高度(2.5、5、7.5、10及12.5 cm)代表5组不同的降温速率, 其中以7.5 cm高度组冻精激活率最高, 达(87.33±2.52)%, 与鲜精无显著差异。分析认为, 在此降温高度, 细胞内冰晶的形成和渗透休克(溶液效应)可能都降到了最低限度。因此, 两步降温法冷冻保存中国花鲈精子宜选择液氮面设置高度7.5 cm。
3.3 超低温冷冻保存对精子能量代谢酶及抗氧化酶活性的影响
精子的ATP酶、SDH及LDH等能量代谢相关酶活性与精子的活力密切相关, 可作为精子质量评价的重要指标[20—25]。据研究, 长鳍篮子鱼(Siganus canaliculatus)精子和日本鳗鲡(Anguilla japonica)精子在超低温冷冻保存后总ATP酶、SDH活性显著降低, 活力明显下降[26, 27];黄鳝(Monopterus albus)精子在冷冻保存后LDH活性显著下降, 活力明显降低[28]。虹鳟(Oncorhynchus mykiss)精子在超低温冷冻保存后LDH活性显著下降, 活力明显受影响[29]。精子超低温冷冻保存后能量代谢酶活性的降低可能是因为精子冷冻过程中酶类物质结构受损, 也可能是因为精子冻融过程中的机械损伤、细胞膜结构改变, 导致精子内的酶类物质溢出。本研究, 中国花鲈精子经超低温冷冻保存后, 最优组冻精总ATP酶、SDH及LDH活性与鲜精相比下降并不明显, 冻精活力与鲜精相比也未见明显降低。这说明采用本试验的优选工艺超低温冷冻保存中国花鲈精子, 其内能量代谢酶受到了较好保护, 精子活力较高。
精子在超低温冻存过程中会产生大量的活性氧, 过量的活性氧会导致精子细胞脂质过氧化、DNA和轴丝结构损伤、活力及授精能力降低等[30—32]。SOD、CAT及GR等是精子中重要的抗氧化酶, 具有清除活性氧、保护细胞免受氧化损伤的作用, 其活性与精子活力密切相关[16, 30, 31, 33]。Maxwell等[34]研究发现, 5℃保存公羊精液一段时间后,精子激活率从>75%降到 41.2%, 而若在精液中分别添加800 U/mL的SOD或200 U/mL的CAT, 精子激活率分别为52.1%和53.6%, 添加SOD+CAT(800 U/mL+200 U/mL)混合物, 精子激活率为 55.7%。Lahnsteiner等[35]在褐鳟(Salmo trutta)精液中添加150 U/L的CAT, 4℃保存72h后精子激活率为(74.1±9.7)%, 而不添加组精子激活率为(44.0±8.7)%。长鳍篮子鱼精子、日本鳗鲡精子以及俄罗斯鲟(Acipenser gueldenstaedti)精子在超低温冷冻保存后GR活性显著上升, SOD、CAT活性显著下降, 精子活力明显降低[16, 26, 27]。本研究, 中国花鲈精子经超低温冷冻保存后, 最优组冻精与鲜精相比, GR活性上升及SOD与CAT活性下降并不明显, 冻精活力与鲜精相比也未见明显降低。这说明采用本试验的优选工艺超低温冷冻保存中国花鲈精子, 其细胞内的抗氧化酶系统受到了较好保护,多余的活性氧得到及时清除, 精子活力接近鲜精。
综上所述, 以0.25 mL麦细管为冻存管、Cortland液为稀释液、10%EG为抗冻剂、精液稀释比1∶3、两步降温法降温高度为距液氮面7.5 cm处降温10min, 超低温冷冻保存的中国花鲈精子, 其活力、酶活性与鲜精相比差异不显著, 因此, 可作为花鲈精子超低温冷冻保存适用技术参数选择之一。
[1] Jiang J H, Yan J Q, Zhu J Q, et al. Sperm cryopreservation and the cytoarchitecture damage detection of Pseudosciaena crocea [J]. Journal of Agricultural Biotechnology, 2011, 19(4): 725—733 [姜建湖, 闫家强, 竺俊全, 等. 大黄鱼精子的超低温冻存及细胞结构损伤的检测. 农业生物技术学报, 2011, 19(4): 725—733]
[2] Peng L Y, Xiao Y M, Liu Y. Effect of cryopreservation and short-term storage of hinese giant salamander sperm [J]. Acta Hydrobiologica Sinica, 2011, 35(2): 325—331 [彭亮跃, 肖亚梅, 刘筠. 低温和超低温保存对中国大鲵成熟精子的影响. 水生生物学报, 2011, 35(2): 325—331]
[3] Liu Q H, Li J, Zhang S C, et al. Flow cytometry and ultrastructure of cryopreserved red seabream (Pagrus major) sperm [J]. Theriogenology, 2007, 67(6): 1168—1174
[4] Wei P, Zhu J Q, Yan J Q, et al. Sperm cryopreservation and the DNA damage detection in Pagrosomus major [J]. Acta Hydrobiologica Sinica, 2010, 34(5): 1049—1055 [魏平, 竺俊全, 闫家强, 等. 真鲷精子的超低温冻存及 DNA损伤的检测. 水生生物学报, 2010, 34(5): 1049—1055]
[5] Ye T, Zhu J Q, Yang W X, et al. Sperm cryopreservation in Sparus macrocephalus and DNA damage detection with SCGE [J]. Zoological Research, 2009, 30(2): 151—157 [叶霆, 竺俊全, 杨万喜, 等. 黑鲷精子的超低温冻存及 DNA损伤的SCGE检测. 动物学研究, 2009, 30(2): 151—157]
[6] Zhang Y Z, Zhang S C, Liu X Z, et al. Cryopreservation of flounder (Paralichthys olivaceus) sperm with a practical methodology [J]. Theriogenology, 2003, 60(5): 989—996
[7] Chen S L, Ji X S, Yu G C, et al. Cryopreservation of sperm from turbot (Scophthalmus maximus) and application to large-scale fertilization [J]. Aquaculture, 2004, 236(1—4): 547—556
[8] Dreanno C, Suquet M, Quemener L, et al. Cryopreservation of turbot (Scophthalmus maximus) spermatozoa [J]. Thenogenology, 1997, 48(4): 589—603
[9] Fauvel C, Suquet M, Dreanno C, et al. Cryopreservation of sea bass (Dicentrarchus labrax) spermatozoa in experimental and production simulating conditions [J]. Aquatic Living Resources, 1998, 11(6): 387—394
[10] Cheng S, Yan J Q, Zhu J Q, et al. The DNA damage of Pseudosciaena crocea cryopreservated sperm used Gly as cryoprotectant [J]. Chinese Journal of Animal Science, 2013, 49(11): 34—36 [程顺, 闫家强, 竺俊全, 等. 甘油为抗冻剂超低温冷冻保存大黄鱼精子的DNA损伤. 中国畜牧杂志, 2013, 49(11): 34—36]
[11] Yang J F, Chen S L, Xu G B, et al. Gynogenetic induction in southern flounder (Paralichthys lethostigma) by cryopreserved sperm of Lateolabrax japonicas [J]. Journal of Fisheries of China, 2010, 34(8): 1174—1181 [杨景峰, 陈松林,徐亘博, 等. 花鲈冷冻精子诱导漠斑牙鲆雌核发育. 水产学报, 2010, 34(8): 1174—1181]
[12] Yang J F, Chen S L, Su P Z, et al. Study on gynogenesis induced by heterogenous sperms in barfin flounder Verasper moseri [J]. Journal of Fisheries of China, 2009, 33(3): 372—378 [杨景峰, 陈松林, 苏鹏志, 等. 异源精子诱导条斑星鲽雌核发育. 水产学报, 2009, 33(3): 372—378]
[13] Su P Z, Chen S L, Yang J F, et al. Induction of gynogenesis in Scophthalmus maximus by heterologous sperms of Lateolabrax japonicas [J]. Journal of Fishery Sciences of China, 2008, 15(5): 715—721 [苏鹏志, 陈松林, 杨景峰, 等. 异源冷冻精子诱导大菱鲆的雌核发育. 中国水产科学, 2008, 15(5): 715—721]
[14] Ji X S, Chen S L, Tian Y S, et al. Cryopreservation of sea perch (Lateolabrax japonicus) spermatozoa and feasibility for production-scale fertilization [J]. Aquaculture, 2004, 241(1—4): 517—528
[15] Hong W S, Zhang Q Y, Xu S F, et al. Physiological characteristics and cryopreservation of spermatozoa in Lateolabrax japonicas [J]. Acta Oceanologica Sinica, 1996, 18(2): 97—104 [洪万树, 张其永, 许胜发, 等. 花鲈精子生理特性及其精液超低温冷冻保存. 海洋学报, 1996, 18(2): 97—104]
[16] Zhang L Z, Jiang Q, Zhuang P, et al. Effects of cryopreservation on antioxidant activities of semen enzymes in Russian sturgeon Acipenser gueldenstaedti [J]. Journal of Dalian Fisheries University, 2009, 24(6): 504—508 [章龙珍, 江琪,庄平, 等. 超低温冷冻对俄罗斯鲟精子抗氧化酶活性的影响. 大连水产学院学报, 2009, 24(6): 504—508]
[17] Tanimoto S, Morisawa M. Roles for potassium and calcium channels in the initiation of sperm motility in rainbow trout [J]. Development, Growth & Differentiation, 1988, 30(2): 117—124
[18] Baynes S M, Scott A P, Dawson A P. Rainbow trout, Salmogairdneri Richardson, spermatozoa: effects of cations and pH on motility [J]. Journal of Fish Biology, 1981, 19(3): 259—267
[19] Koh I C C, Yokoi K, Tsuji M, et al. Cryopreservation of sperm from seven-band grouper, Epinephelus septemfasciatus [J]. Cryobiology, 2010, 61(3): 263—267
[20] Lahnsteiner F, Berger B, Weismann T, et al. Determination of semen quality of the rainbow trout, Oncorhynchus mykiss, by sperm motility, seminal plasma parameters, and spermatozoal metabolism [J]. Aquaculture, 1998, 163(1—2): 163—181
[21] Xiong C L, Huang X B, Shen J Y, et al. Relationship between levels of ATP and succinate dehydrogenase in spermatozoa in the patients with asthenospermia and sperm motility [J]. Acta Universitatis Medicinae Tongji, 1999, 28(4): 289—291 [熊承良, 黄勋彬, 沈继云, 等. 弱精子症患者精子中 ATP和琥珀酸脱氢酶的含量与精子活率的关系. 同济医科大学学报, 1999, 28(4): 289—291]
[22] McNiven M A, Gallant R K, Richardson G F. In vitro methods of assessing the viability of rainbow trout spermatozoa [J]. Theriogenology, 1992, 38(4): 679—686
[23] Gatti J L, King S M, Moss A G, et al. Outer arm dynein from trout spermatozoa. Purification, polypeptide composition, and enzymatic properties [J]. The Journal of Biological Chemistry, 1989, 264(19): 11450—11457
[24] Piasecka M, Wenda-Rozewicka L, Ogonski T. Computerized analysis of cytochemical reactions for dehydrogenases and oxygraphic studies as methods to evaluate the function of the mitochondrial sheath in rat spermatozoa [J]. Andrologia, 2001, 33(1): 1—12
[25] Deng S M, Li S G, Wen J G, et al. Determination of activity and study of localization about lactate dehydrogenase isoenzyme LDHx in infertile spermatozoa [J]. Chinese Journal of Histochemistry and Cytochemistry, 2001, 10(1): 8—13 [邓顺美, 李叔庚, 文建国, 等. 不育症精子乳酸脱氢酶同功酶LDHx活性测定及其定位研究. 中国组织化学与细胞化学杂志, 2001, 10(1): 8—13]
[26] Huang X R, Zhang L Z, Zhuang P, et al. Effects of cryopreservation on enzyme activity of Siganus canaliculatus spermatozoa [J]. Marine Sciences, 2009, 33(7): 16—22 [黄晓荣,章龙珍, 庄平, 等. 超低温冷冻对长鳍篮子鱼精子中几种酶活性的影响. 海洋科学, 2009, 33(7): 16—22]
[27] Huang X R, Zhang L Z, Zhuang P, et al. Cryopreservational effects on the spermatic enzyme’s activities of Japanese ell (Anguilla japonica) [J]. Marine Fisheries, 2008, 30(4): 297—302[黄晓荣, 章龙珍, 庄平, 等. 超低温冷冻对日本鳗鲡精子酶活性的影响. 海洋渔业, 2008, 30(4): 297—302]
[28] Yan X M, Zhang X X. Effects of cryopreseration on enzyme activity of Monopterus albus spermatozoa [J]. Acta Hydrobiologica Sinica, 2011, 35(5): 882—886 [闫秀明, 张小雪. 超低温冷冻对黄鳝精子中几种酶活性的影响. 水生生物学报, 2011, 35(5): 882—886]
[29] Babiak I, Glogowski J, Goryczko K, et al. Effect of extender composition and equilibration time on fertilization ability and enzymatic activity of rainbow spermatozoa [J]. Theriogenology, 2001, 56(1): 177—192
[30] Nair S J, Brar A S, Ahuja C S, et al. A comparative study on lipid peroxidation, activities of antioxidant enzymes and viability of cattle and buffalo bull spermatozoa during storage at refrigeration temperature [J]. Animal Reproduction Science, 2006, 96(1—2): 21—29
[31] Sikka S C, Rajasekaran M, Hellstrom W J. Role of oxidative stress and antioxidants in male infertility [J]. Journal of Andrology, 1995, 16(6): 464—468
[32] Tramer F, Rocco F, Micali F, et al. Antioxidant systems in rat epididymal spermatozoa [J]. Biology of Reproduction, 1998, 59(4): 753—758
[33] Kankofer M, Kolm G, Aurich J, et al. Activity of glutathione peroxidase, superoxide dismutase and catalase and lipid peroxidation intensity in stallion semen during storage at 5℃[J]. Theriogenology, 2005, 63(5): 1354—1365
[34] Maxwell W M C, Stojanov T. Liquid storage of ram semen in the absence or presence of some antioxidants [J]. Reproduction, Fertility and Development, 1996, 8(6): 1013—1020
[35] Lahnsteiner F, Mansour N, Plaetzer K. Antioxidant systems of brown trout (Salmo trutta f. fario) semen [J]. Animal Reproduction Science, 2010, 119(3—4): 314—321
SPERM CRYOPRESERVATION AND ENZYME ACTIVITY DETECTION IN LATEOLABRAX MACULATUS
SHI Ying-Xue1, 2, CHENG Shun1, 2, ZHU Jun-Quan1, 2and WU Xiong-Fei2, 3
(1. Key Laboratory of Applied Marine Biotechnology, Ministry of Education, Ningbo University, Ningbo 315211, China; 2. Collaborative Innovation Center for Zhejiang Marine High-efficiency and Healthy Aquaculture, Ningbo 315211, China; 3. Ningbo Academy of Oceanology and Fisheries, Ningbo 315012, China)
中国花鲈; 超低温冷冻保存; 精子; 活力; 酶活性
Lateolabrax maculatus; Cryopreservation; Spermatozoa; Motility; Enzyme activities
S961
A
1000-3207(2015)06-1241-07
10.7541/2015.162
2014-11-13;
2015-02-26
宁波市科技计划重大项目(2011C11005); 国家海洋局海洋资源生物种质资源库建设项目(12PYY001SF08-NBDX-1)资助
史应学(1988—), 男, 安徽阜阳人; 硕士研究生; 主要从事水产动物遗传育种研究。E-mail: ahsyxue@163.com
竺俊全(1964—), E-mail: zhujunquan@nbu.edu.cn

