3种方法评估肺炎克雷伯菌及鲍曼不动杆菌对替加环素的体外药敏结果分析
余 倩,胡志东,李 静,李妍淳,李 金
(天津医科大学总医院医学检验科,天津 300052)
论著
3种方法评估肺炎克雷伯菌及鲍曼不动杆菌对替加环素的体外药敏结果分析
余 倩,胡志东,李 静,李妍淳,李 金
(天津医科大学总医院医学检验科,天津 300052)
目的:比较3种药敏方法在判定菌株对替加环素不敏感结果的一致性。方法:收集Vitek 2 Compact系统测定的对替加环素不敏感菌株110株,其中肺炎克雷伯菌59株,鲍曼不动杆菌51株。纸片扩散法及MIC Test Strip(MTS)法进行复核检测对替加环素的敏感性。结果:以MTS法为参考方法,Vitek 2法检测菌株与MTS法的一致率,MTS法采用EUCAST折点优于FDA折点,并且误差率较FDA折点低。Vitek2法检测肺炎克雷伯菌对替加环素敏感性与MTS法的一致率高于纸片法,而检测鲍曼不动杆菌的一致率低于纸片法。产ESBL肺炎克雷伯菌对替加环素的耐药率高于非产ESBL肺炎克雷伯菌,Vitek 2 MIC50较MTS MIC50高一个稀释度。CRAB对替加环素的敏感率为100%(MTS法/FDA折点),CSAB的中介率为77.8%,未发现耐药株。结论:Vitek 2法与纸片法均不能作为检测肺炎克雷伯菌与鲍曼不动杆菌对替加环素敏感性的常规方法,应采用MTS法或肉汤稀释法对不敏感菌株进行复核。
替加环素;肺炎克雷伯菌;鲍曼不动杆菌;微生物敏感性实验;体外
替加环素是第一个应用于临床的新型甘氨酰环类抗生素,是米诺环素的衍生物。替加环素通过与细菌30S核糖体亚基结合,阻止蛋白质合成,抑制细菌繁殖,不受多种耐药机制的影响,能有效地治疗临床上多种复杂耐药细菌,如耐甲氧西林金黄色葡萄球菌(MRSA)、耐万古霉素肠球菌(VRE)、耐碳青霉烯肠杆菌(CRE)及泛耐药鲍曼不动杆菌(XDRAB)等。替加环素不同于氨基糖苷类、多粘菌素类药物,其剂量小肾毒性低,治疗相对安全,是治
疗效果较好的广谱抗生素。目前我国采用的美国临床和实验室标准协会(Clinical and Laboratory Standards Institute,CLSI)标准中尚无替加环素体外药敏检测的操作指南和结果判定标准,并且不同的体外实验方法对评估替加环素敏感性差异较大,而临床需要依据药敏结果确定患者的用药治疗,为此,我们探讨用3种常用方法评价、比较其体外药敏对临床的用药指导。
1 材料与方法
1.1 材料 收集2014年2月-2015年1月经Vitek 2 Compact系统测定对替加环素不敏感菌株110株,其中肺炎克雷伯菌59株,标本分离自痰标本36株、尿液12株、血液2株,其他9株;鲍曼不动杆菌51株,标本分离自痰标本37株、肺泡灌洗液8株、其他6株。剔除同一患者重复标本。
1.2 仪器和试剂 Vitek 2 Compact全自动细菌鉴定仪及配套药敏卡AST-GN16(法国梅里埃公司)、水解酪蛋白试剂(杭州天和微生物公司)、替加环素药敏纸片(15 μg)及替加环素MIC Test Strip试条(0.016~256 mg/L)(意大利Liofilchem公司)。
1.3 方法 经Vitek 2 Compact测定的对替加环素不敏感菌株再行纸片法和MTS条检测。纸片法及MTS法参照美国CLSI文件要求操作。使用新鲜配制的培养基,并以大肠埃烯菌ATCC25922和金黄色葡萄球菌ATCC25923对MH培养基进行质控,质控菌株结果在规定的范围内才能进行后续实验,并注意避光培养。
1.4 结果采用标准 由于CLSI标准中尚无替加环素体外药敏检测的操作指南和结果判定标准,因此参照美国食品药品监督局(FDA)、欧洲药敏实验委员会(EUCAST)及张冀霞推荐折点[1]对结果进行判读(表1)。将MTS法作为参考方法比较Vitek 2法、纸片扩散法与MTS方法的一致性。分类一致性(categorical agreement,CA)定义为被评估方法与MTS法药敏结果判断为一致的菌株百分比。非常重大误差(very major error,VME)定义为被评估方法将耐药误判为敏感,重大误差(major error,ME)定义为被评估方法将敏感误判为耐药;小误差(minor error,mE)定义为被评估方法将中介报告为耐药或敏感。可接受的误差范围为:CA≥90%,VME≤1.5%,ME≤3%,mE≤10%[2]。

表1 纸片法与MTS法结果判定标准Tab 1 Disk diffusion and MTS interpretive criteria
1.5 统计学方法 使用SPSS18.0软件进行统计学分析,采用χ2检验对每种方法不同结果采用标准得到的敏感、中介、耐药菌株数进行比较,并对不同方法采用同一标准得到的敏感、中介、耐药菌株数比较。
2 结果
2.1 3种方法测定不同菌株的药敏结果。
2.1.1 Vitek 2法在FDA标准下检测到肺炎克雷伯菌的耐药率71.2%,中介率28.8%,MIC50和MIC90均为8 mg/L;鲍曼不动杆菌的耐药率7.8%,中介率92.8%,MIC50和MIC90均为4 mg/L。Vitek 2法检测到肺炎克雷伯菌的耐药率较高,而鲍曼不动杆菌的中介率较高,肺炎克雷伯菌的MIC50/MIC90(8 mg/L)较鲍曼不动杆菌MIC50/MIC90(4 mg/L)高一个稀释度。
2.1.2 纸片法在检测两种菌对替加环素的敏感率时,按FDA推荐折点、EUCAST推荐折点、张冀霞推荐折点检测到肺炎克雷伯菌和鲍曼不动杆菌的敏感率分别为22%/98%、25.4%/4%、72.9%/100%。张冀霞推荐折点在检测肺炎克雷伯菌的敏感率较高(72.9%),EUCAST折点在检测鲍曼不动杆菌的敏感率最低(4%)。
2.1.3 MTS法的检测结果按FDA和EUCAST折点判定。敏感率分别为:肺炎克雷伯菌39%/17%;鲍曼不动杆菌86.3%/56.9%,两种判定折点结果的差异性较大。
2.1.4 χ2检验结果显示,同一方法不同结果判定标准的敏感性检测结果差异具有统计学意义(P<0.01),而同一标准不同方法检测肺炎克雷伯菌敏感性结果的差异不具有统计学意义(P>0.05),检测鲍曼不动杆菌,纸片法与MTS法按EUCAST判定折点,检测结果具有统计学差异(P<0.01)。
2.2 Vitek 2法、纸片法与MTS法检测结果一致性比较 见表2。
2.2.1 Vitek 2法与MTS法结果一致性比较 MTS按FDA判定标准,Vitek 2法检测肺炎克雷伯菌和鲍曼不动杆菌与MTS法的CA分别为23.7%和13.7%,一致率较低;而以EUCAST折点判定,CA分别为72.9%和27.5%,肺炎克雷伯菌的分类一致率得到了明显提高,但仍低于90%,未产生极重要误差。Vitek 2法检测细菌对替加环素的敏感性时,肺炎克雷伯菌误差率高于鲍曼不动杆菌。
2.2.2 纸片法与MTS法结果一致性比较 纸片法采用FDA折点时,菌株对替加环素的敏感性与MTS法一致率最高,误差率较低,优于EUCAST折点。
2.2.3 Vitek 2法与纸片法检测两种菌结果的比较 检测肺炎克雷伯菌时,纸片法与MTS最高的一致率不及Vitek 2与MTS法的一致率高。而检测鲍曼不动杆菌时,纸片法与MTS法的一致率明显高于Vitek 2法与MTS法的一致率。
2.3 耐药菌株对替加环素的敏感性 见表3。
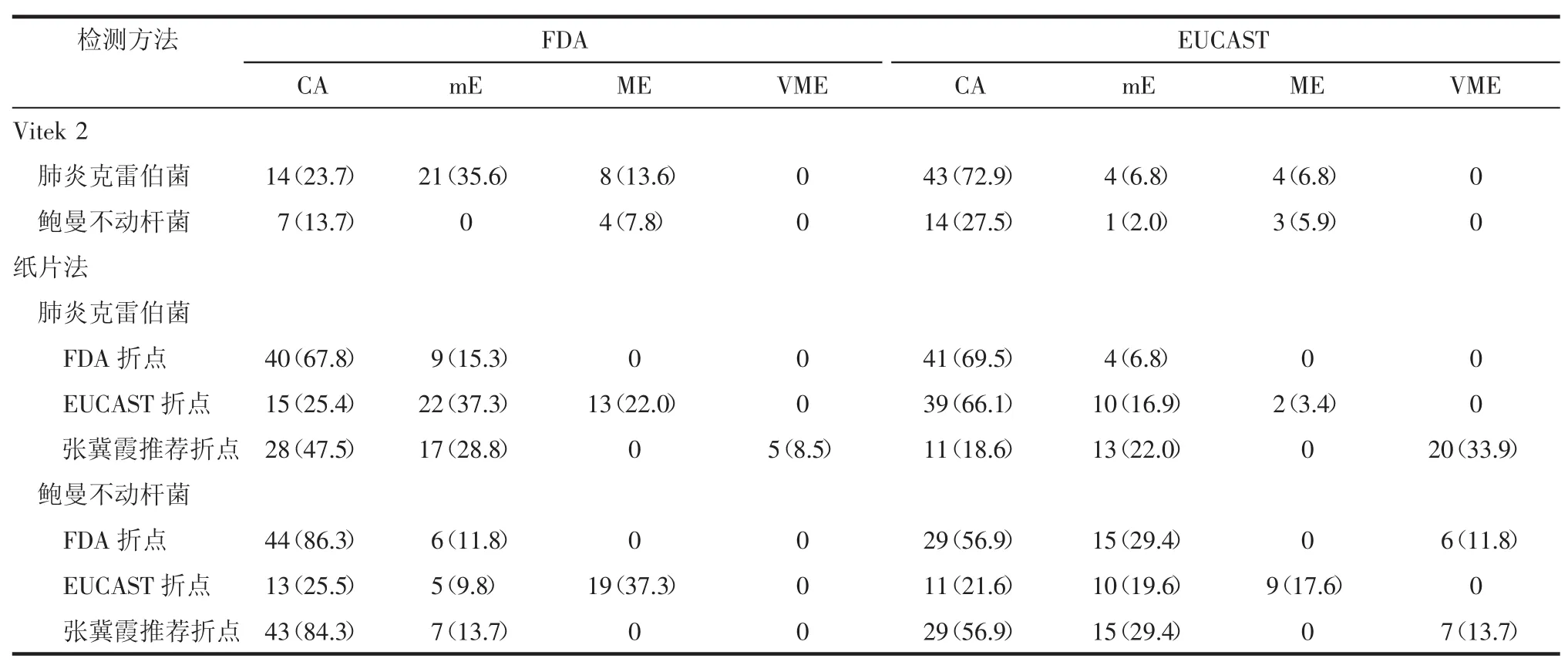
表2 Vitek 2法、纸片扩散法与MTS法检测结果比较(%)Tab 2 CA,and types of errors occurred when testing tigecycline susceptibility by Vitek2 and disk diffusion as compared to MTS(%)
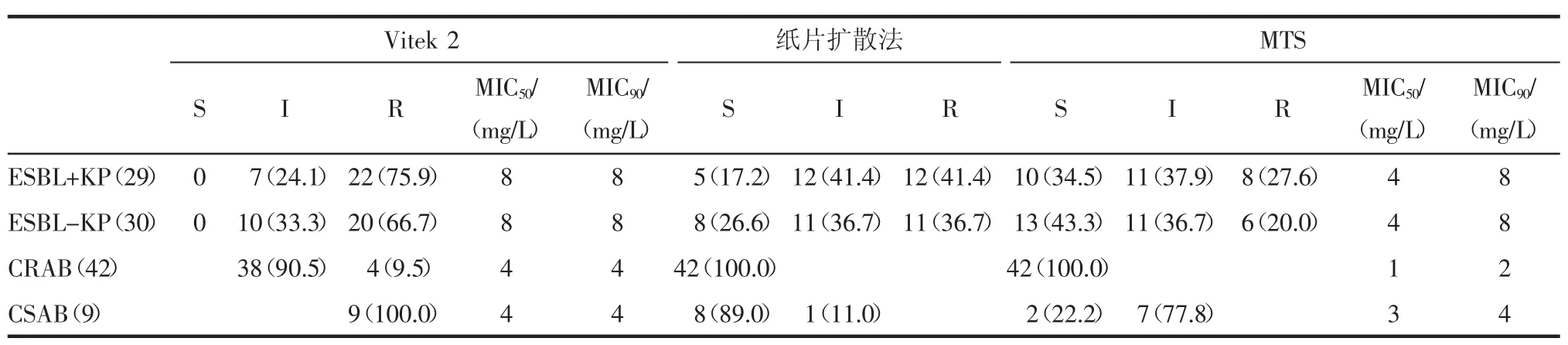
表3 3种方法在检测耐药菌株与敏感菌株的结果比较(%)Tab 3 Susceptibilities to tigecycline in resistant and sensitivity strains by three different susceptibility testing methods(%)
2.3.1 产ESBL肺炎克雷伯菌(ESBL+KP)与非产ESBL肺炎克雷伯菌(ESBL-KP)对替加环素的敏感性比较 ESBL+KP与ESBL-KP 3种方法检测结果的差异不大。ESBL+KP与ESBL-KP采用Vitek 2法和MTS法的MIC50和MIC90值一致,但ESBL+KP较ESBL-KP对替加环素的敏感率低,纸片法结果为17.2%/26.6%,MTS法结果为34.5%/43.3%。
2.3.2 碳青霉烯耐药鲍曼不动杆菌(CRAB)与敏感鲍曼不动杆菌(CSAB)对替加环素的敏感性(FDA折点) 将51株鲍曼不动杆菌按是否对碳青酶烯抗生素耐药分为42株CRAB和9株CSAB,CRAB经Vitek 2检测到有4株对替加环素耐药,而经纸片法和MTS法未检出不敏感菌株。9株CSAB经Vitek 2检测到9株中介,经MTS法复核测定其中7株中介(FDA折点),另2株为敏感菌株分别与Vitek2法相差8个和4个稀释度。
3 讨论
肺炎克雷伯菌和鲍曼不动杆菌是引起医院感染重要的致病菌,近些年由于出现了产碳青霉烯水解酶的肺炎克雷伯菌和泛耐药鲍曼不动杆菌,给治疗带来严峻挑战。替加环素是一种新上市的广谱抗生素,它能有效地治疗碳青霉烯耐药菌株及多种复杂耐药菌株,然而近些年却出现了对替加环素不敏感菌株,甚至在一些没有使用替加环素的地区也出现了耐药[3]。仪器法、纸片扩散法、E-test法、MTS法、琼脂稀释法、肉汤稀释法是替加环素体外药敏实验方法,由于仪器法、纸片扩散法的便捷、价格便宜等优点,常常作为微生物实验室的主要方法。肉汤稀释法是体外检测替加环素敏感性的金标准,常被用来作为参考方法评估其他可选择药敏方法的准确性[4]。研究显示MTS法测定替加环素MIC结果比微量肉汤稀释法低1个稀释度以上,但其与微量肉汤稀释法一致性较好[5]。王辉等[6]专家共识建议当纸片法和仪器法显示中介或耐药时,应使用肉汤稀释法或MTS法确证。因此将MTS法作为参考方法,比较Vitek 2和纸片扩散法在测定替加环素时与MTS法的一致性。
Vitek 2由于其自动化、高通量,广泛应用于微生物实验室。Vitek 2法检测肺炎克雷伯菌时与MTS法的最高一致率高于纸片法,而检测鲍曼不动杆菌时低于纸片法,与何翠娥[7]的研究结果相似。Zarkotou[8]的研究显示Vitek 2测定的替加环素MIC值较微量肉汤稀释法高1~3个稀释度,较MTS法高2~4个稀释度。从表3可以看出,Vitek 2较MTS法MIC值高1~4个稀释度,假中介及假耐药率较高,是MTS法按EUCAST折点与Vitek 2法的一致率高于FDA折点的原因。虽然Vitek 2没有产生极重要误差,但其与MTS法的一致性较差,不能用来测定肺炎克雷伯菌及鲍曼不动杆菌对替加环素的MIC值,但可在常规工作中用来测定革兰阳性菌(如MRSA、VRE)、大肠埃希菌敏感性[9-10]。
纸片法操作简便、价格便宜是基层医院检测替加环素敏感性的主要方法,结果表明纸片法参照FDA标准与MTS法的一致率高于EUCAST判定折点和张冀霞推荐折点,并且mE也较另外两种判定标准低,未产生ME及VME。但是无论采用哪种推荐折点,其CA均<90%,因此纸片法可能不适合。
替加环素是治疗多重耐药菌株的有效药物。ESBL+KP和ESBL-KP的敏感率分别为17.2%/ 26.6%(纸片法)、34.5%/43.3%(MTS法),ESBL+KP对替加环素的敏感率低于ESBL-KP,与Sader[11]研究结果一致。纸片法可能低估了对替加环素敏感性。Vitek 2不能用来作为测定CRAB的常规方法,CSAB是否可以使用Vitek 2法有待进一步研究。替加环素对碳青霉烯耐药的鲍曼不动杆菌的敏感性较好,临床可用其治疗复杂性腹腔感染、复杂性皮肤软组织感染、社区获得性细菌性肺炎。
临床上检测替加环素的体外活性的方法很多,培养基配制时间、锰的含量、易氧化使结果的准确性往往受到影响[1]。目前CLSI没有替加环素的药敏折点,并且不同的药敏方法结果差异较大,肉汤稀释法作为金标准,但操作复杂难以在全国微生物实验室全面开展,因此当纸片法和仪器法显示中介或耐药时,应使用肉汤稀释法或MTS法确证。
[1] 张冀霞,赵春江,刘文云,等.替加环素对鲍曼不动杆菌和肺炎克雷伯菌体外抗菌活性检测的影响因素和方法学评估[J].中华检验医学杂志,2013,36(7):604
[2] Clinical and Laboratory Standards Institute.M23-A3 Development of in vitro susceptibility testing criteria and quality control parameters:approved guideline[S].Wayne,PA:CLSI,2008
[3] Navon-Venezia S,Leavitt A,Carmeli Y.High tigecycline resistance in multidrug-resistant Acinetobacter baumannii[J].J Antimicrob Chemother,2007,59(4):772
[4] Pillar C M,Draghi D C,Dowzicky M J,et al.In vitro activity of tigecycline against gram-positive and gram-negative pathogens as evaluated by broth microdilution and E test[J].J Clin Microbiol, 2008,46(9):2862
[5]杜小幸,王海萍,傅鹰,等.不同药敏方法检测替加环素对鲍曼不动杆菌敏感性的比较[J].中华检验医学杂志,2013,36(7):598
[6] 王辉,俞云松,王明贵,等.替加环素体外药敏试验操作规程专家共识[J].中华检验医学杂志,2013,36(7):584
[7] 何翠娥,李妍淳,田彬,等.鲍曼不动杆菌和肺炎克雷伯菌对替加环素体外敏感性检测的方法学评估[J].中华临床感染病杂志, 2013,6(5):282
[8] Zarkotou O,Pournaras S,Altouvas G,et al.Comparative evaluation of tigecycline susceptibility testing methods for expanded-spectrum cephalosporin- and carbapenem-resistant gram-negative, pathogens[J].J Clin Microbiol,2012,50(11):3747
[9] Liu J W,Ko W C,Huang C H,et al.Agreement assessment of tigecycline susceptibilities determined by the disk diffusion and broth microdilution methods among commonly encountered resistant bacterial isolates:results from the Tigecycline In Vitro Surveillance in Taiwan(TIST)study,2008 to 2010[J].Antimicrob Agents Chemother,2012,56(3):1414
[10]Huang T D,Berhin C,Bogaerts P,et al.In vitro susceptibility of multidrug-resistant Enterobacteriaceae clinical isolates to tigecycline[J].J Antimicrob Chemother,2012,67(11):2696
[11]Sader H S,Flamm R K,Jones R N.Tigecycline activity tested against antimicrobial resistant surveillance subsets of clinical bacteria collected worldwide(2011)[J].Diagn Microbiol Infect Dis, 2013,76(2):217
(2015-06-01收稿)
Effect of Tigecycline on Klebsiella pneumoniae and Acinetobacter baumanaii by susecptibility testing in vitro
YU Qian,HU Zhi-dong,LI Jing,LI Yan-chun,LI Jin
(Department of Laboratory Medicine,General Hospital,Tianjin Medical University,Tianjin 300052,China)
Objective:To compare Klebsiella pneumoniae and Acinetobacter baumanaii in vitro susceptibility to tigecycline by three different susceptibility testing methods.Methods:Fifty nine isolates of Klebsiella pneumoniae and 51 isolates of Acinetobacter baumanaii,nonsusceptibility to tigecycline by Vitek 2 were collected from February 2014 to January 2015,and then were confirmed by disk diffusion method and MIC Test Strip(MTS).Results:Compared with MTS method which was on the basis of EUCAST interpretive criteria, the CA of Vitek 2 was higher than FDA for Klebsiella pneumoniae and Acinetobacter baumanaii,and the error was lower.Vitek 2 produced higher CA result for Klebsiella pneumoniae than disk diffusion,but the CA result for Acinetobacter baumanaii was the opposite.The resistance rate of ESBL-producing K.pneumoniae isolates was higher than non-ESBL-producing K.pneumoniae,and Vitek 2 result in MIC50in 1 dilution was higher compared with MTS.Remarkably high tigecycline susceptibility rates (100%)were found among the Carbapenem-resistant A.baumanaii by MTS method,the intermediate rate of Carbapenem-susceptible A.baumanaii to tigecycline was 77.8%,and no resistant strain to tigecycline was found.Conclusion:For routine susceptibility testing of K.pneumoniae and A.baumannii on tigecycline,the disk method and Vitek2 may not be proper because of the poor correlation of results between the MTS.
tigecycline;Klebsiella pneumoniae;Acinetobacter baumanaii;microbial sensitivity tests;in vitro
R446.5
A
1006-8147(2015)06-0510-04
余倩(1989-),女,硕士在读,研究方向:细菌耐药机制;通信作者:胡志东,E-mail:huzhidong27@163.com。

