洋河水库浮游植物组成及优势种演替规律研究
惠天翔谢 平过龙根储昭升刘明华
(1. 中国科学院水生生物研究所, 淡水生态与生物技术国家重点实验室, 东湖生态系统实验站, 武汉 430072; 2. 中国科学院大学, 北京 100049; 3. 中国环境科学研究院, 北京 100049; 4. 秦皇岛市环境保护监测站, 秦皇岛 066001)
洋河水库浮游植物组成及优势种演替规律研究
惠天翔1,2谢 平1过龙根1储昭升3刘明华4
(1. 中国科学院水生生物研究所, 淡水生态与生物技术国家重点实验室, 东湖生态系统实验站, 武汉 430072; 2. 中国科学院大学, 北京 100049; 3. 中国环境科学研究院, 北京 100049; 4. 秦皇岛市环境保护监测站, 秦皇岛 066001)
在洋河水库设置 6个采样点, 对浮游植物进行了周年研究, 并在夏季进行了每周一次的加密采样, 以揭示水华期间藻类优势种演替规律。结果表明洋河水库全年共检测到浮游植物8门41属49种, 群落季节变化与温度密切相关。春季隐藻门的啮齿隐藻(Cryptomonas erosa)为优势, 夏季初期表层水温在 25℃以下时,绿藻门的波吉卵囊藻(Oocystis borgei)占主要优势; 当表层水温升至25℃以上, 微囊藻(Microcystis spp.)迅速取代其成为绝对优势。秋季硅藻门的克洛脆杆藻(Fragiaria crotomensis)和隐藻门的啮齿隐藻(C. erosa)为优势。空间分布上水库北部浅水区域隐藻和硅藻生物量普遍高于南部; 受东南风影响, 蓝藻生物量在西洋河口S2点位最大。CCA分析表明夏季水华主体微囊藻的生物量与氮浓度正相关, 螺旋鱼腥藻在夏季仅作为第二优势种短暂出现于西洋河口处, 其出现与否受到磷营养盐的限制。
洋河水库; 浮游植物; 群落演替; 环境因子
洋河水库(39º45′-40º13′N, 119º00′-119º25′E)位于河北省抚宁县城北10 km处, 集水面积755 km2,总库容3.5×108m3, 兴利库容1.39×108m3, 邻近北戴河, 是秦皇岛市的重要备用水源地, 兼有防洪、灌溉、养殖、发电等功能(图1)。已有研究表明[1,2], 近年来其富营养化问题日益突出, 表现在水库总氮、总磷浓度大幅上升, 夏季以微囊藻为主的“水华”面积扩大、时间延长。2007年夏季更是暴发了以螺旋鱼腥藻(Anabaena spiroides)为主的蓝藻水华, 产生的异味严重影响周围环境[3]。
然而自水库1961年建成以来, 关于浮游植物的详细研究十分匮乏, 仅有的一份研究也只涉及定性分析[4], 缺乏对其时空分布及相关环境因子影响的系统研究。因此对洋河水库的浮游植物进行细致的调查研究显得尤为重要。本文在洋河水库设置6个采样点, 进行了为期一年的野外浮游植物监测, 用以研究其浮游植物组成、时间变化及空间分布特征。特别针对夏季水华发生时期提高采样频率, 以期捕捉到水华优势种演替规律及与环境因子之间的相互关系, 为洋河水库水华预防与治理提供重要的基础参数。
1 材料与方法
1.1 采样点与采样方法
全库共设置6个采样点(图1), 采样时间为2009年全年, 除去无法采样的冰封期(12月、1月、2月)。其中6至8月为每周一次采样, 其余月份为每月一次采样。所有样点均用5 L有机玻璃采水器采集混合水样。
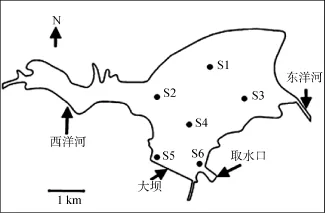
图1 洋河水库示意图及采样点设置Fig. 1 The locations of sampling stations in the Yanghe Reservoir
1.2 测定方法
现场指标中, 溶解氧(DO)采用便携式 DO仪(YSI D0200)现场测定, 水温和pH采用便携式pH仪(PHBJ-260)现场测定, 透明度(SD)采用 Secchi 透明度盘测定。总氮 (TN)、总磷(TP)、硝态氮(NO3-N)、亚硝态氮(NO2-N)、铵态氮(NH4-N) 及生化需氧量(COD)参照国标方法测定[5]。硝态氮和亚硝态氮相加得到氧化态氮(NOX-N)。以上数据由秦皇岛市水质监测站提供。叶绿素a (Chl.a)经Whatman GF/C 过滤后用90%丙酮提取,然后通过分光光度计测定[6]。
用于浮游植物鉴定的水样(1 L)用酸化的鲁哥试剂进行现场固定[7]。样品带回实验室之后, 通过静止沉淀48h浓缩至50 mL。将浓缩样品进行充分摇匀之后, 取0.1 mL放置于计数板中, 用奥林巴斯显微镜(BX50, Olympus, Tokyo, Japan)进行观察鉴定和计数。群体微囊藻先经超声波破碎仪(JY88-II, Scientiz,浙江宁波) 分离成单细胞, 再进行计数。浮游植物种类鉴定参照文献[8, 9], 生物量由体积按 1∶1换算得到[9]。
1.3 数据分析
One-way ANOVA使用SPSS 20进行分析。典范对应分析(CCA)使用通用软件 CANOCO 4.5, 生成的数据文件应用CANODRAW 4.1 作图[10]。分析前,环境变量除pH外均进行对数转换。
2 结果
2.1 水体理化参数
表1显示了洋河水库2009年采样期间各点位水体物理化学指标的均值及变化范围。透明度最大值(6.8 m)出现在11月, 最小值(0.7 m)出现在6月; 水深在水库北部(S1、S2、S3)明显低于南部(S4、S5、S6), 叶绿素a含量则呈现相反趋势; 表层水温在0℃至 26.9℃之间变化; 溶解氧、生化需氧量、氧化态氮及 pH在各点位之间无明显差异; 铵态氮浓度则是水库南部略高于北部; 水库全年总磷平均浓度在西洋河口处的 S2点位明显高于其他点位, 最大值(0.46 mg/L)出现在 10月份; 总氮浓度的最大值(6.57 mg/L)同样出现在10月份, 但在全年平均值上各点位差异不大。
2.2 浮游植物组成及时空变化
种类组成分析 采样期间, 洋河水库共检测到浮游植物8门41属49种, 其中绿藻门种类最多,有21种, 硅藻门11种, 蓝藻门6种, 裸藻门3种, 甲藻门3种, 隐藻门2种, 金藻门2种, 定鞭藻门1种。根据浮游植物功能分类法和对优势种的定义(某种类占到总量的5%以上)[11], 筛选出6种优势藻: 惠氏微囊藻(Microcystis wesenbergii)、铜绿微囊藻(Microcystis aeruginosa)、啮噬隐藻(Cryptomonas erosa)、克洛脆杆藻(Fragilaria crotomensis)、波吉卵囊藻(Oocystis borgei)、飞燕角甲藻(Ceratium hirundinella)。
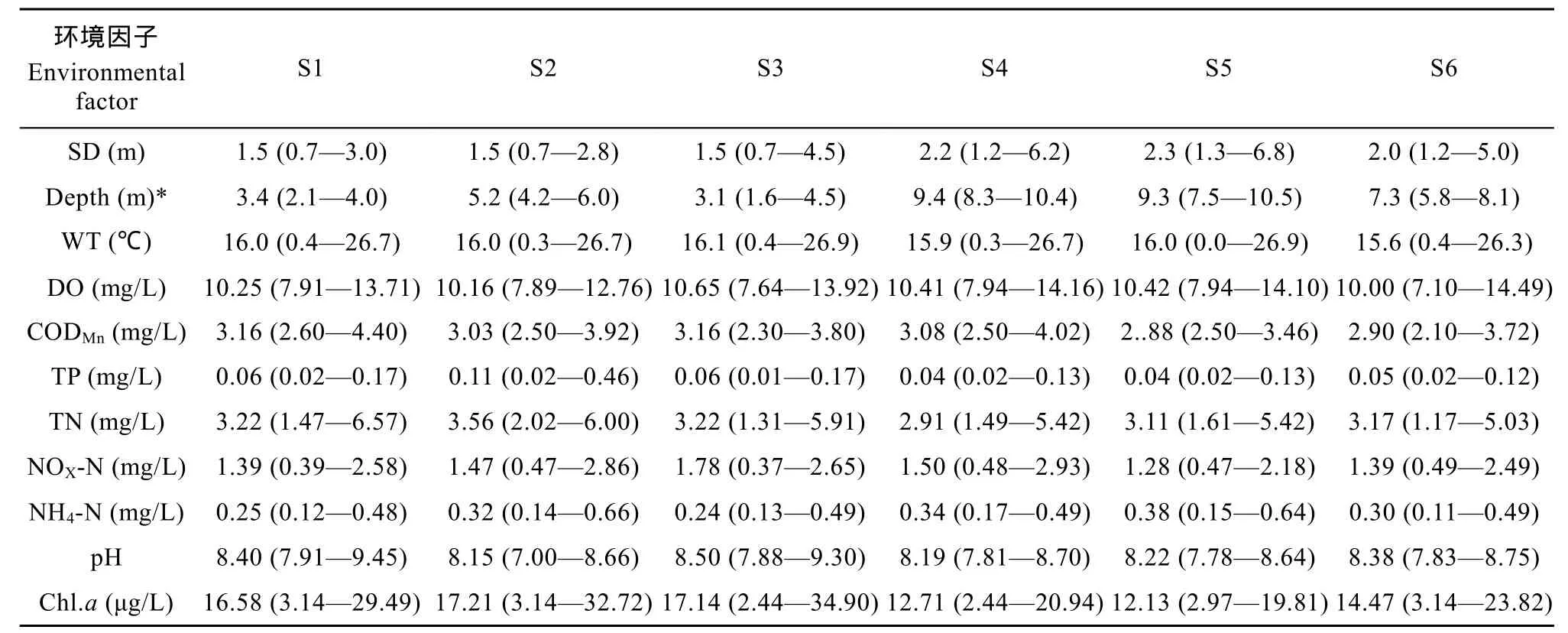
表1 研究期间(2009年3—11月)洋河水库各点位环境因子Tab. 1 Monthly average of environmental factors (mean and range) during the study period (March 2009—November 2009) in the Yanghe Reservoir
浮游植物时空分布分析 从时间分布上看,洋河水库浮游植物总量随时间的波动起伏较大, 春季及秋末浮游植物总量偏低, 最低值(0.97 mg/L)发生在3月和11月; 相反夏季浮游植物含量偏高, 最高值(15.16 mg/L)发生在8月份(图2)。其中春季及秋季的10、11两月主要由隐藻门和硅藻门组成, 分别占到总生物量的 43.7%和28.3%。夏季6月份绿藻门(47.5%)含量最高, 7、8、9三月则以蓝藻门(61.2%)为主。裸藻门、金藻门、定鞭藻门的生物量在所有样品中含量极低, 故未在图中显示。从空间分布上看, 除甲藻门外, 洋河水库北部各门浮游植物生物量普遍高于南部(图3)。其中蓝藻门在西洋河口S2点位处含量最高。
2.3 CCA分析
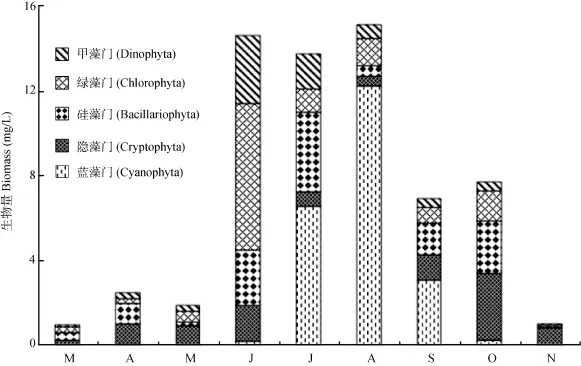
图2 洋河水库浮游植物季节变化Fig. 2 Seasonal variation of phytoplankton in the Yanghe Reservoir
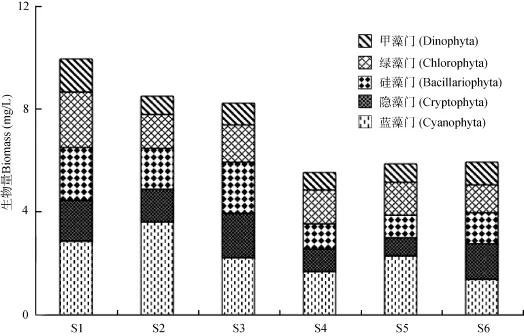
图3 浮游植物空间分布Fig. 3 Spatial variation of phytoplankton in the Yanghe Reservoir
以浮游植物优势种为响应变量, 以环境因子为解释变量, 用 CANOCO 4.5 进行典型对应分析(CCA), 结果如表2和图4所示。由于微囊藻定量为打散群体后计数, 故CCA分析中微囊藻以属来计。分析结果表明, 环境因子与浮游植物优势种的相关性依次为氧化态氮(NOX-N)、水温(WT)、总氮(TN)、生化需氧量(COD)、溶解氧(DO)、铵态氮(NH4-N)、总磷(TP)、透明度(SD)。其中氧化态氮与第一轴明显负相关(–0.89), 水温与第二轴负相关(–0.59)。这两个排序轴对物种数据总变量的贡献达到 54.2%,解释了浮游植物-环境因子关系的95.5%。微囊藻占据了第三象限, 与氧化态氮(NOX-N)、水温(WT)、生化需氧量(COD)正相关。
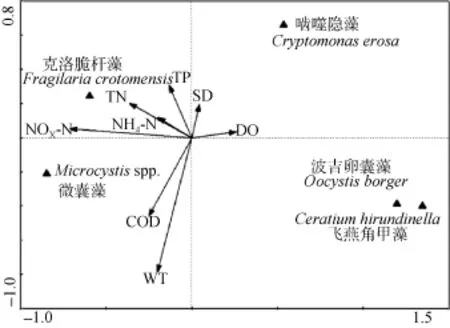
图4 洋河水库浮游植物优势种类与环境因子的分析排序图Fig. 4 Species–environmental variable biplot of canonical correspondence analysis (CCA). The angles represent dominant species and the arrows represent environmental variables. The parameters of CCA appear in Tab. 3
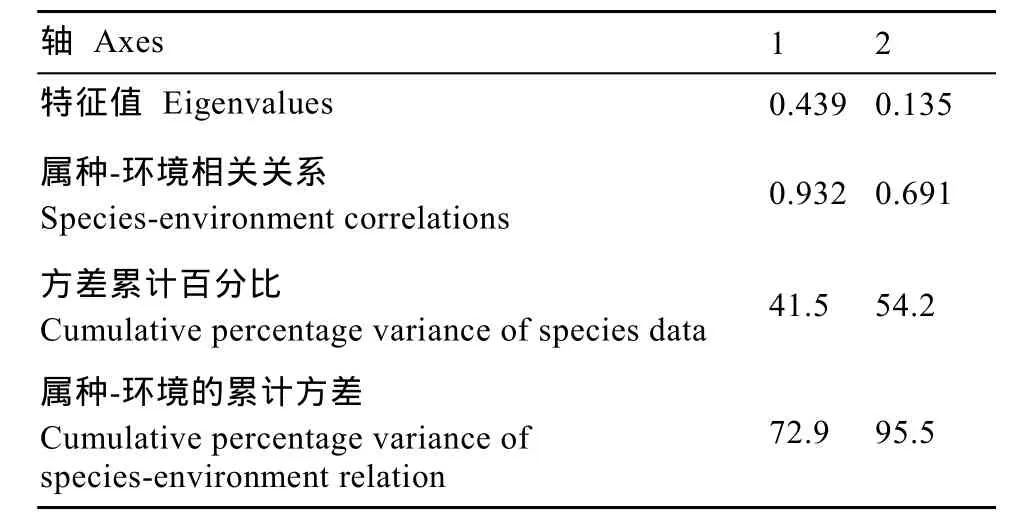
表2 CCA分析统计信息Tab. 2 Eigenvalues for CCA axes and correlation coefficients between environmental factors and CCA ordination axes
2.4 夏季优势种演替及相关环境因子
夏季浮游植物主要优势藻类演替过程及温度、总氮和总磷的周变化情况如图5所示。在夏季初期的6月份, 表层水体温度始终维持在 25℃以下, 绿藻门的波吉卵囊藻(Oocystis borgei)占主要优势, 生物量及在浮游植物总量中所占比例同时在6月17日达到全年最大值(6.74 mg/L、36.7%)。 从6月底开始, 表层水温升至 25℃以上, 微囊藻迅速取代卵囊藻成为新的优势种并持续至 8月底, 并在 8月 17日达到最大值(13.32 mg/L, 80%)。总氮在整个夏季都处于较高浓度(>2 mg/L), 总磷则在夏季的大部分时间内维持在相对低的浓度(<0.05 mg/L), 最大值出现在 7月 29日(0.107 mg/L)。螺旋鱼腥藻在2009年夏季并未出现大规模的爆发, 仅在8月份作为除微囊藻外的第二优势种, 短暂出现在西洋河口S2号点位。
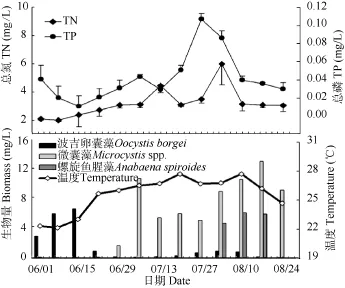
图5 夏季加密采样期间总氮、总磷、温度以及优势藻种的周变化Fig. 5 Weekly variations of TN, TP, water temperature and dominant species from June to August. Microcystis spp.: including Microcystis wesenbergii and M. aeruginosa
3 讨论
3.1 洋河水库浮游植物时空分布及影响因子分析
洋河水库曾是秦皇岛市的重要饮用水源地, 邻近北戴河区。近年来由于频发的蓝藻水华污染事件,被迫改为备用水源地。很多研究报道将水华现象的频发归咎于水库水体富营养化的加剧, 特别是西洋河上游众多的淀粉加工厂所排放的废水向水库输入了大量的氮磷营养盐[12]。但对于产生水华的主体,浮游植物缺乏长期、系统的研究。本文研究结果表明洋河水库浮游植物的季节变化与温度密切相关,空间分布上水库北部浅水区域浮游植物生物量普遍高于南部。夏季水华主体微囊藻的生物量与氮浓度正相关, 螺旋鱼腥藻的出现与否则主要受到磷营养盐的影响。
洋河水库浮游植物的空间分布受到洋河水库地理格局及风场影响。洋河水库的地理格局决定了水库北部水浅, 南部水深(表1)。属于功能类群P的硅藻门优势种克洛脆杆藻(Fragiaria crotomensis), 其最适生长环境是在2—3 m水深的持续混合水体中[11],因此位于浅水区域的 S1、S2、S3的硅藻门生物含量明显高于位于深水区域的其他三个点位。同样,属于功能类群 Y的隐藻门优势种啮噬隐藻(Cryptomonas erosa), 因耐受低光照条件[11]而更适应于透明度低的浅水区域(图3)。具有伪空泡的蓝藻,特别是微囊藻在夏季浮游植物中占据了绝对优势,其水平迁移受到了风场的直接影响[13], 洋河水库夏季东南风风频明显大于西北风[14], 因此蓝藻生物量在位于水库西北方向的S2点位最大。
不同的浮游植物有着不同的最适生长温度。室内研究表明, 在相同的营养调节下, 绿藻在中等温度条件下占优势, 蓝藻则趋向更高的水温条件[15]。围隔实验证实当水温为 26℃时, 最适宜于微囊藻的聚集、上浮而形成水华[16]。洋河水库夏季最初水温低于 25℃时, 绿藻门的波吉卵囊藻 (Oocystis borgei)为优势藻种, 微囊藻则在水温超过25℃后出现并迅速成为优势藻(图5)。CCA分析表明其生物量与氮营养盐, 特别是氧化态氮正相关(图4)。从洋河水库夏季水体中分离出的微囊藻进行的室内实验也证实, 其生长显著受到了氮营养盐的影响, 而与磷关系不大[17]。洋河水库整个夏季水体总磷平均值为0.04 mg/L, 含量充足, 无法成为微囊藻生长的限制因子。
洋河水库在2007年6月底暴发了以螺旋鱼腥藻(Anabaena spiroides)为优势种的水华[3], 而在 2009年夏季鱼腥藻并没有出现, 仅在磷突然升高后(0.107 mg/L)出现在西洋河口(图 5), 并且西洋河口点位全年总磷含量明显高于其他点位(表1)。微囊藻具有较高的最大磷吸收速率[18], 特别是在磷充足条件下对其过量吸收能力明显高于鱼腥藻[19]; 而在共培养条件下, 磷含量高时螺旋鱼腥藻生长占优势,反之微囊藻占优势[20]。洋河水库2009年水体总氮含量偏高, 夏季浓度更是始终保持在2 mg/L以上, 磷也并非处于限制浓度, 因此无固氮能力的微囊藻处于绝对优势地位。而磷浓度在局部区域的突然升高使得原本被竞争压制的鱼腥藻得以获得短暂的快速增殖。
形成水华的蓝藻种类很多, 并且有固氮和非固氮蓝藻之分, 同一水体中的不同年份, 甚至不同月份中所形成水华的蓝藻种类都有可能不同[21,22]。如中国太湖自 1988年起以微囊藻为主的蓝藻水华在夏季频繁爆发, 其中仅于1993、1994年的6月出现鱼腥藻水华, 之后再未出现[13]; 洱海自1996年起出现鱼腥藻水华, 期间也伴随有微囊藻主导的水华时期, 2006年7月—9月发生大面积螺旋鱼腥藻水华[23];巢湖在 2003年春末夏初出现微囊藻与鱼腥藻为主的水华[24]; 韩国的Daecheong湖在1999年夏季也发生微囊藻与鱼腥藻共同主导的蓝藻水华[25]; 位于巴西的Monjolinho水库在2004年10月出现了以鱼腥藻为优势种的水华[26]。洋河水库在2007年夏季发生严重的螺旋鱼腥藻水华, 微囊藻也有出现, 含量相对低[3]。在本研究中2009年夏季微囊藻为绝对优势,鱼腥藻短期在西洋河口附近暴发。
3.2 诱发洋河水库夏季优势种演替的环境因子探讨
关于不同蓝藻种类之间的竞争多存在于室内实验中, 对野外发生的蓝藻优势种的竞争演替情况多为描述性的总结, 缺乏有效的分析。本文综合了一些由微囊藻或鱼腥藻或两者共同主导的水华情况,针对温度、总氮、总磷以及氮磷比来探讨环境因子在微囊藻和鱼腥藻竞争水华优势种时起到的作用(表3)。
温度 Hammer[21]对23个湖泊的水华演替规律总结得出如下结论: 受温度影响, 夏季水华出现顺序依次是鱼腥藻, 微囊藻, 束丝藻。Kasumigaura湖夏初蓝藻优势种为鱼腥藻, 随后优势种转变为微囊藻[22]。室内实验中洱海鱼腥藻在25℃下最适宜生长, 30℃下生长受抑制, 35℃下死亡[27]。在室内实验中, 太湖微囊藻的最适生长温度为(30—35)℃[28]。从表3中我们也可以看出温度对于微囊藻和鱼腥藻的竞争起先决作用, 当温度高于 25℃, 无论低氮磷比(如太湖)或高氮磷比(如 2009年洋河水库), 微囊藻都能够竞争胜出; 而鱼腥藻想要竞争超越微囊藻或与之共同主导夏季水华, 需要水温在25℃以下。
磷 尽管鱼腥藻的固氮机制主要由低浓度的无机氮激发, 但也依赖于可靠的磷等其他条件[29],静息孢子的形成受到温度降低的影响, 以及一定程度的磷[30]。水中沉积物不仅保证了鱼腥藻的越冬,还为其萌发与生长提供营养, 使其对于水体中的营养盐并不敏感[31]。微囊藻对磷有更好的吸收, 存储能力[18,32]。在室内实验中, 磷充足时, 微囊藻对磷过量吸收的能力明显高于鱼腥藻[19]。换言之, 在低磷浓度情况下, 微囊藻和鱼腥藻有着各自的优势以保持正常生长, 但共同存在时, 微囊藻对磷的竞争性吸收可能会抑制鱼腥藻的生长。而在高磷浓度情况下, 如表 3中 Daecheong湖在磷浓度平均0.231 mg/L和图 2—图 5中显示的洋河水库环境中磷含量猛增时, 这种竞争性抑制消失, 鱼腥藻才能够得以生长。又如1996—1997年太湖总磷浓度达到最大, 此时微囊藻也不再是最优势种[13]。
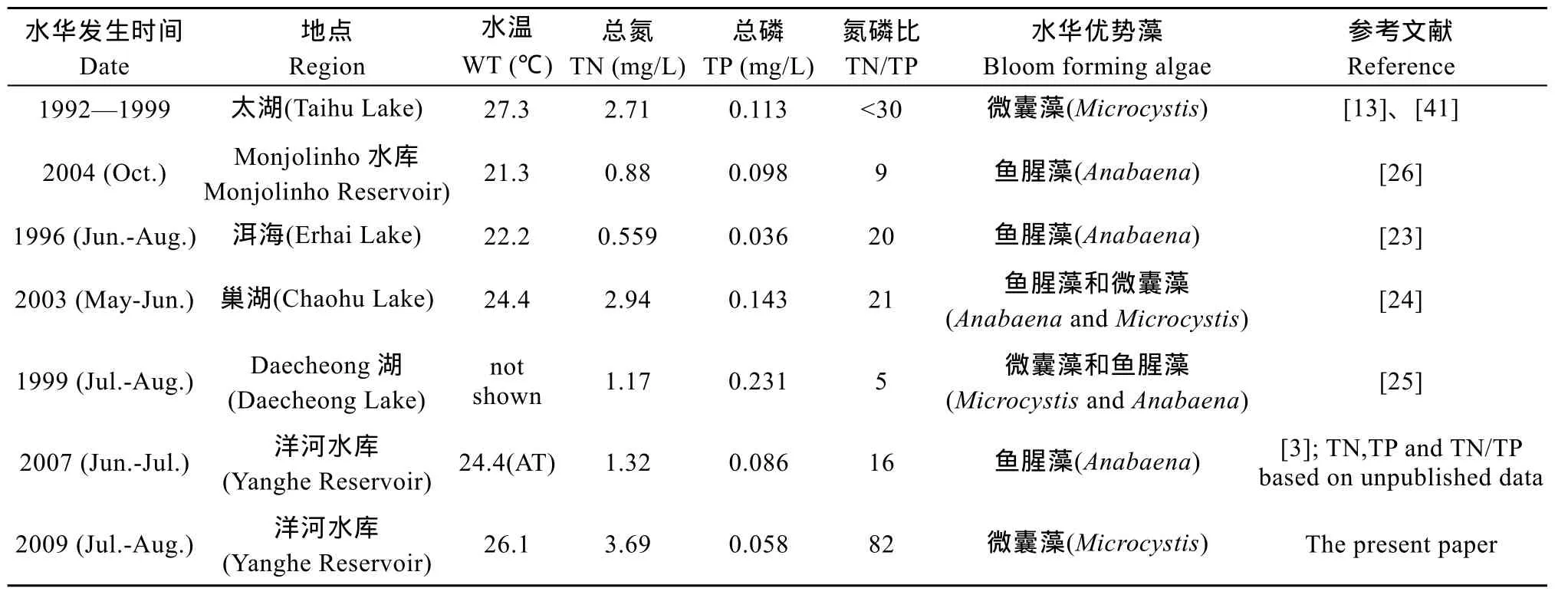
表3 形成微囊藻或鱼腥藻水华的不同水体中温度及营养盐对比Tab. 3 Comparison of water temperature and nutritions among different lakes with phytoplankton bloom formed by Microcystis or Anabaena
氮 原位添加氮磷实验, 证明氮限制是影响Microcystis aeruginosa生长的主要因素[33]。室内实验证明洋河水库微囊藻氮浓度升高时, 生长速率明显增加, 而鱼腥藻生长速率基本未变[17]。微囊藻对于氮浓度变化敏感, 从表 3中可以看到, 在磷浓度相近的情况下, 氮含量低的洱海为鱼腥藻水华, 氮含量高的洋河水库为微囊藻水华。所有拥有微囊藻作为优势种或优势种之一的水体, 除了 Daecheong湖(总磷含量超高), 总氮含量都在2 mg/L以上。
氮磷比 Smith等[34]提出氮磷比 22∶1是区分固氮蓝藻占优的湖泊和非固氮蓝藻占优的湖泊的临界值, 但是非固氮蓝藻比如微囊藻在低 TN∶TP条件下, 仍能形成种群优势[35]。而在更高的TN∶TP的情况下, 也能形成微囊藻水华, 较低的 TN∶TP并不是微囊藻水华形成的条件, 而是结果[36]。Teubner等[37]指出, 氮磷比达到某一临界值的时机对藻类优势种的影响同样重要。比如初始高浓度的微囊藻接种量会对鱼腥藻的生长产生抑制作用[38]。Nalewajko 和 Murphy[39]在室内实验中得到的结果是微囊藻生长最适氮磷比为 100, 鱼腥藻则在 10— 1000内没有太大变化, 并在低氮磷比条件下生长速率大于微囊藻。
在表3中, 鱼腥藻在与微囊藻的竞争中不被抑制的情况都是在低氮磷比条件下。表中太湖氮磷比虽然在 30以下, 但实际氮磷浓度都高(氮>2 mg/L,磷>0.1 mg/L), 且温度在 25℃以上, 因此优势种始终是微囊藻。而在低氮条件下微囊藻的生长会受到抑制, 鱼腥藻可能形成优势(Monjolinho湖和巢湖)。由于氮在生态系统中的循环比磷快, 所以高磷条件下很少出现氮很低的情况, 因此微囊藻并不会受到抑制, 此时微囊藻与鱼腥藻共存, 二者的生长竞争情况就受到其他因素的影响, 比如洋河水库2009年夏季总磷出现了一次突然升高, 导致氮磷比降至 33, 鱼腥藻随之爆发, 但之前微囊藻一直处于最优势地位, 高浓度的微囊藻抑制了鱼腥藻的生长[38]。
4 总结
通过对比洋河水库2007与2009年的优势种与温度, 氮磷等差异, 以及其他存在微囊藻和鱼腥藻作为优势种竞争演替的水体, 本文推断出: (1)温度是影响微囊藻与鱼腥藻竞争生长的首要因素, 微囊藻偏向于较高温度(>25℃), 鱼腥藻偏向于较低温度(≤25℃); (2)单独存在时, 磷并非微囊藻和鱼腥藻的限制因子, 但共存时微囊藻对磷的有力竞争使得需要一定磷浓度维持生存的鱼腥藻受到竞争抑制; (3)氮对于微囊藻的限制作用明显, 因此鱼腥藻可能在低氮条件下竞争胜出; (4)鱼腥藻的生长情况符合关于蓝藻的氮磷比假说, 即低氮磷比条件下适宜生长, 但微囊藻在低氮磷比或高氮磷比条件下都可以存在, 原因在于低磷无法限制其生长, 而在高磷条件下, 水体中氮含量普遍不低。
因此 2007年洋河水库鱼腥藻水华的发生是由于在适宜鱼腥藻生长的温度时期(≤25℃)水体中氮磷比处于低水平(16), 低氮高磷且没有高浓度微囊藻抑制的条件完全符合螺旋鱼腥藻爆发的所有条件。为避免再次发生严重的异味事件, 必须限制水库磷营养盐的输入, 如限制上游淀粉加工厂排污,人工混合坝前水体[40]等。特别需要注意在夏季初期水库上游遭遇暴雨径流时, 必须开闸放水快速排放上游水体携带的大量磷营养盐, 避免触发鱼腥藻暴发的条件。
致谢:
感谢中国环境科学研究院湖泊基地的各位老师和同学, 特别感谢郭伟峰和张玉宝在采样和样品处理过程中给予的帮助。
[1] Li F B, Du Y X, Li Z L. Discussion of algae growth experiment in Yanghe Reservoir [J]. Water Sciences and Engineering Technology, 2001, (5): 26—27 [李凤彬, 杜迎新, 李仲礼. 洋河水库藻类增长实验分析. 水科学与工程技术, 2001, (5): 26—27]
[2] Li W Q, Cai J B, Pang Y, et al. Eutrophication assessment of Yanghe Reservoir and its control measures [J]. Water Resources Protection, 2007, 23(2): 16—19 [李文奇, 蔡金傍,逄勇, 等. 洋河水库富营养化评价及防治对策. 水资源保护, 2007, 23(2): 16—19]
[3] Li Z, Yu J, Yang M, et al. Cyanobacterial population and harmful metabolites dynamics during a bloom in Yanghe Reservoir, North China [J]. Harmful Algae, 2010, 9(5): 481—488
[4] Li F B, Dai L. The eutrophic situation and management in Yanghe Reservoir [A]. In: Han B P, Shi Q C, Chen W X (Eds.), Reservoir Ecology and Water Quality Management in China [C]. Beijing: Science Press. 2006, 168—184 [李凤彬,戴礼. 洋河水库富营养化现状与管理对策.见: 韩博平, 石秋池, 陈文祥. 中国水库生态学与水质管理研究. 北京:科学出版社. 2006, 168—184]
[5] State Environmental Protection Administration, the Monitor and Analysis Methods of Water and Wastewater Editorial Committee. The Monitor and Analysis Methods of Water and Wastewater [M]. Beijing: Chinese Environmental Science Press. 2002, 88—284 [国家环境保护总局, 水和废水监测分析方法编委会. 水和废水监测分析方法(第四版).北京: 中国环境科学出版社. 2002, 88—284]
[6] Lorenzen C J. Determination of chlorophyll and phaeopigments: spectrophotometric equations [J]. Limnology and Oceanograohy, 1967, 12: 343—346
[7] Parsons R T, Maita Y, Lalli C M. A Manual of Chemical and Biological Methods for Seawater Analysis [M]. Oxford: Pergomon Press. 1984, 94—97
[8] Hu H J, Wei X Y. The Freshwater Algae of China-Systematics, Taxonomy and Ecology [M]. Beijing: Science Press. 2006, 23—903 [胡鸿钧, 魏印心. 中国淡水藻类—系统、分类及生态. 北京: 科学出版社. 2006, 23—903]
[9] Zhang Z S, Huang X F. Research Methods of Freshwater Algae [M]. Beijing: Science Press. 1991, 23—168 [章宗涉,黄祥飞. 淡水浮游生物研究方法. 北京: 科学出版社. 1991, 23—168]
[10] Terbraak C J F, Smilauer P. CANOCO Reference Manual and User’s Guide to Canoco for Windows: Software for Canonical Community Ordination (Version 4) [M]. Ithaca, NY, USA: Microcomputer Power Press. 1998
[11] Reynolds C S, Huszar V, Kruk C, et al. Towards a functional classification of the freshwater phytoplankton [J]. Journal of Plankton Research, 2002, 24(5): 417—428
[12] Li F B. Discussion of the eutrophic situation and strategy in Yanghe Reservoir [J]. Water & Wastewater Engineering, 2003, 29(8): 17—19 [李凤彬. 洋河水库富营养化的现状和对策探讨. 给水排水, 2003, 29(8): 17—19]
[13] Chen Y W, Qin B Q, Teubner K, et al. Long-term dynamics of phytoplankton assemblages: Microcystis-domination in Lake Taihu, a large shallow lake in China [J]. Journal of Plankton Research, 2003, 25(1): 445—453
[14] Li Y, Wu X Y, Chu Z S, et al. Spatial distribution characteristics of Microcystis and influencing factors in Yanghe Reservoir [J]. Research of Environmental Sciences, 2012, 25(5): 1—6 [李芸, 吴祥云, 储昭升, 等. 洋河水库微囊藻空间分布特征及其影响因素分析. 环境科学研究, 2012, 25(5): 1—6]
[15] Tilman D, Kiesling R. Freshwater algal ecology: taxonomic tradeoffs in the temperature dependence of nutrient competitive abilities [A]. In: Klug M J, Reddy C A (Eds.), Current Perspective in Microbial Ecology, Proceedings of the 3rd International Symposium on Microbial Ecology [C]. Washington, D.C. (USA): American Society for Microbiology Press. 1984, 314—319
[16] Hua J B, Zong Z X. Experimental research on formation of algae bloom in Yanghe Reservoir [J]. Acta Scientiarum Naturalium Universitatis Pekinensis, 2010, 30(4): 476—484 [华锦彪, 宗志祥. 洋河水库“水华”发生的实验研究. 北京大学学报(自然科学版), 2010, 30(4): 476—484]
[17] Li H, Xu Q J, Chu Z S, et al. Effects of different forms of nitrogen on the growth of Anabaena sp. and Microcystis sp. from Yanghe Reservoir [J]. Research of Environmental Sciences, 2010, 23(12): 1—5 [李涵, 许秋瑾, 储昭升, 等.不同形态氮对洋河水库螺旋鱼腥藻和惠氏微囊藻生长的影响. 环境科学研究, 2010, 23(12): 1—5]
[18] Baldia S F, Evangelista A D, Aralar E V, et al. Nitrogen and phosphorus utilization in the cyanobacterium Microcystis aeruginosa isolated from Laguna de Bay, Philippines [J]. Journal of Applied Phycology, 2007, 19(6): 607—613
[19] Tan X, Shen H, Song L R. Comparative studies on physiological responses at phosphorus stress of three waterbloom-forming cyanobacteria [J]. Acta Hydrobiologica Sinica, 2007, 31(5): 693—699 [谭香, 沈红, 宋立荣. 三种水华蓝藻对不同磷浓度生理响应的比较研究. 水生生物学报, 2007, 31(5): 693—699]
[20] Gu Q H, Zhao L, Tan X. Studies on competition predominance of Microcystis aeruginosa, Anabaena spiroides and Aphanizomeno flos-aquae [J]. Journal of Anhui Agricultural Sciences, 2007, 35(7): 1990—1991, 2031 [顾启华, 赵林, 谭欣. 铜绿微囊藻、螺旋鱼腥藻和水华束丝藻竞争优势的研究. 安徽农业科学, 2007, 35(7): 1990—1991, 2031]
[21] Hammer U T. The succession of “bloom” species of blue-green algae and some causal factors [J]. Verhandlungen des Internationalen Verein Limnologie, 1964, 15: 829—836
[22] Ohkubo N, Yagi O, Okada M. Studies on the succession of blue-green-algae, Microcystis, Anabaena, Oscillatoria and Phormidium in lake Kasumigaura [J]. Environmental Technology, 1993, 14(5): 433—442
[23] Wang Y. Study on the group of Cyanophyta and the cause of alga bloom in Erhai lake in summer and autumn [J]. Journal of Dali University, 2008, 7(12): 39—42 [王芸. 洱海夏秋季蓝藻种群动态变化及水华成因分析. 大理学院学报, 2008, 7(12): 39—42]
[24] Deng D G, Xie P, Zhou Q, et al. Studies on temporal and spatial variations of phytoplankton in Lake Chaohu [J]. Journal of Integrative Plant Biology, 2007, 49(4): 409—418
[25] Ahn C Y, Chung A S, Oh H M. Rainfall, phycocyanin, and N : P ratios related to cyanobacterial blooms in a Korean large reservoir [J]. Hydrobiologia, 2002, 474(1—3): 117—124
[26] Sotero-Santos R B, Carvalho E G, Dellamano-Oliveira M J, et al. Occurrence and toxicity of an Anabaena bloom in a tropical reservoir (Southeast Brazil) [J]. Harmful Algae, 2008, 7(5): 590—598
[27] Pan X, Chang F, Kang L, et al. Morphological characteristics and phylogenetic relationship of Anabaena species from Lakes Dianchi and Erhai, China [J]. Hydrobiologia, 2008, 614(1): 353—362
[28] Chen Y W, Gao X Y. Study on variations in spatial and temporal distribution of Microcystis in Northwest Taihu. Lake and its relations with light and temperature [A]. In: Cai Q M (Eds.), Ecology of Taihu Lake [C]. Beijing: China Meteorological Press. 1998, 142—148
[29] Peter M V, Ken C, Cory C, et al. Towards an ecological understanding of biological nitrogen fixation [J]. Biogeochemistry, 2002, 57—58(1): 1—45
[30] Kravchuk E S, Ivanova E A, Gladyshev M I. Seasonal dynamics of akinetes of Anabaena flos-aquae in bottom sediments and water column of small Siberian reservoir [J]. Aquatic Ecology, 2006, 40(3): 325—336
[31] Hellweger F L, Kravchuk E S, Novotny V, et al. Agent-based modeling of the complex life cycle of a cyanobacterium (Anabaena) in a shallow reservoir [J]. Limnology and Oceanography, 2008, 53(4): 1227—1241
[32] Jutta P, Suzanne H, Marieke E, et al. Competition for nutrients and light: stable coexistence, alternative stable states, or competitive exclusion [J]? Ecological Monographs, 2006, 76(1): 57—72
[33] Moisander P H, Ochiai M, Lincoff A. Nutrient limitation of Microcystis aeruginosa in northern California Klamath River reservoirs [J]. Harmful Algae, 2009, 8(6): 889—897
[34] Smith V H, BiermanVictor J Jr, Jones B L, et al. Historical trends in the Lake Okeechobee ecosystem IV. Nitrogen: phosphorus ratios, cyanobacterial dominance, and nitrogen fixation potential [J]. Archiv für Hydrobiologie, Supplementband, 1995, 107(1): 71—88
[35] González Sagrario M A, Jeppesen E, Gomà J, et al. Does high nitrogen loading prevent clear-water conditions in shallow lakes at moderately high phosphorus concentrations [J]? Freshwater Biology, 50(1): 27—41
[36] Xie L Q, Xie P, Li S X, et al. The low TN : TP ratio, a cause or a result of Microcystis blooms [J]? Water Research, 2003, 37(9): 2073—2080
[37] Teubner K, Feyerabend R, Henning M, et al. Alternative blooming of Aphanizomenon flos-aquae or Planktothrix agardhii induced by the timing of the critical nitrogen: phosphorus ratio in hypertrophic riverine lakes [J]. Arch Hydrobiol, Spec Issues Advanc Limnol, 1999, 54: 325—344
[38] Lam C W Y, Silvester W B. Growth interactions among blue-green (Anabaena Oscillarioides, Microcystis aeruginosa) and green (Chlorella sp.) algae [J]. Hydrobiologia, 1979, 63(2): 135—143
[39] Nalewajko C, Murphy T P. Effects of temperature, and availability of nitrogen and phosphorus on the abundance of Anabaena and Microcystis in Lake Biwa, Japan: an experimental approach [J]. Limnology, 2001, 2(1): 45—48
[40] Burford M A, O'Donohue M J. A comparison of phytoplankton community assemblages in artificially and naturally mixed subtropical water reservoirs [J]. Freshwater Biology, 2006, 51(5): 973—982
[41] Liu X, Lu X H, Chen Y W. The effects of temperature and nutrient ratios on Microcystis blooms in Lake Taihu, China: An 11-year investigation [J]. Harmful Algae, 2011, 10(3): 337—343
STUDY ON PHYTOPLANKTON COMMUNITY AND THE SUCCESSION OF DOMINANT SPECIES IN THE YANGHE RESERVOIR
HUI Tian-Xiang1,2, XIE Ping1, GUO Long-Gen1, CHU Zhao-Sheng3and LIU Ming-Hua4
(1. Donghu Experimental Station of Lake Ecosystems, State Key Laboratory of Freshwater Ecology and Biotechnology, Institute of Hydrobiology, Chinese Academy of Sciences, Wuhan 430072, China; 2. University of Chinese Academy of Sciences, Beijing 100049, China; 3. Chinese Research Academy of Environmental Sciences, Beijing 100049, China; 4. Qinhuangdao Environmental Monitoring Station, Qinhuangdao 066001, China)
The Yanghe Reservoir is an important drinking water source for Qinhuangdao City. In recent years, severe blooms of cyanobacteria in this reservoir have become a growing threat to the water safety. To study the temporal and spatial patterns of the phytoplankton growth in Yanghe Reservoir, we continuously collected water samples from six sites throughout one year with a higher sampling frequency during the summer. We identified 49 phytoplankton species that belonged to 41 genera and 8 phyla. The seasonal variation of community structure was closely related to the temperature. Cryptomonas erosa of Cryptophyta was the dominant species in the spring. Oocystis borgei of Chlorophyta was the dominant species in the early summer when the temperature of surface water was below 25℃. Microcystis spp. of Cyanophyta later became dominant when the water temperature rose above 25℃. Fragiaria crotomensis of Bacillariophyta and C. erosa were the dominant species in the autumn. The total biomass of both Cryptophyta and Diatom in the north part of the reservoir was higher than that in the south part. Due to the impact of southeast wind, the biomass of cyanobacteria in the west river mouth (S2) was the highest. CCA analysis showed positive correlation between the biomass of Microcystis spp. and the nitrogen level. Anabaena spiroides was only found in west river mouth and was short-lived. The appearance of Anabaena spiroides could depend on the phosphorus level.
Yanghe Reservoir; Phytoplankton; Community succession; Environmental factors
Q145+.2
A
1000-3207(2015)03-0524-09
10.7541/2015.69
2014-05-06;
2014-11-11
环保部重要公益性行业科研专项“洋河水库异味物质产生机制与监控系统研究”资助
惠天翔(1986—), 男, 安徽人; 博士; 主要从事淡水浮游植物生理生态学研究。E-mail: huitianxiang@126.com
谢平, E-mail: xieping@ihb.ac.cn

