不同外源激素对紫斑牡丹愈伤组织诱导的影响
张健欣,唐红
(甘肃农业大学林学院,甘肃 兰州 730070)
不同外源激素对紫斑牡丹愈伤组织诱导的影响
张健欣,唐红
(甘肃农业大学林学院,甘肃 兰州730070)
摘要:试验以‘美髯公’‘粉荷’‘粉冠彩带’3个紫斑牡丹品种的叶片和叶柄为材料,研究不同处理时间0.1% HgCl2处理牡丹对叶片、叶柄污染率、褐化率、存活率及死亡率的影响.并研究了6-BA和NAA组合,2,4-D和NAA组合以及2,4-D和6-BA组合分别对紫斑牡丹叶片和叶柄愈伤组织诱导、增殖以及再分化的影响.结果表明:(1)用0.1% HgCl2进行消毒处理,叶片和叶柄的最佳消毒时间分别为6、8 min.(2)3个品种的牡丹叶片在6-BA(2.0 mg/L)/NAA(0.3 mg/L)处理下的愈伤组织诱导率均为最高,叶柄在6-BA(2.0 mg/L)/NAA(0.4 mg/L)处理下的愈伤组织诱导率均为最高;‘粉冠彩带’叶片和叶柄的愈伤组织诱导率显著高于其他两个品种;同一品种之间叶柄的愈伤组织诱导率明显高于叶片的诱导率.(3)2,4-D(0.5 mg/L)/ NAA(1.5 mg/L)组合处理中,叶片和叶柄愈伤增殖率均达到最高,且NAA质量浓度越高愈伤组织质地越好.(4)2,4-D(0.2 mg/L)/6-BA(4 mg/L)处理愈伤组织再分化过程中发现有少数透明状的胚状体.
关键词:紫斑牡丹;叶片;叶柄;愈伤组织;
第一作者:张健欣(1989-),女,硕士研究生,主要从事园林观赏植物遗传育种研究.E-mail:chenyo258@126.com
紫斑牡丹(Paeoniarockii)属于芍药科芍药属牡丹组,花大色美,因其花瓣基部有明显的紫斑而得名.紫斑牡丹集中栽培分布于甘肃省兰州市、临夏以及临洮等地区,是仅次于中原牡丹的第二大品种群.紫斑牡丹除了有很高的观赏价值外还有较高的药用价值和油用价值[1],且资源需求量大,但繁殖困难.近年来紫斑牡丹组培等快速繁殖的方法成为研究热点,相关研究在国内外已有少数报道[2-13],但由于外植体褐化严重以及组培苗生根困难,市场上尚未有成功的组培苗出售,而使紫斑牡丹组织培养成为目前研究的难点.因愈伤组织生长具有繁殖速度快、数量多、再生率高较外植体培养污染率低等优点使得愈伤组织培养成为紫斑牡丹组织培养研究中的一个重点.为了进一步降低紫斑牡丹诱导过程中的褐化率、污染率,提高其诱导率,本试验以紫斑牡丹营养器官(叶片、叶柄)为材料,研究不同激素配比对其愈伤组织诱导、增殖以及分化的影响,以期为以后紫斑牡丹愈伤组织诱导分化研究提供科学依据.
1材料与方法
1.1供试材料
试验材料于2013年4月采自甘肃省兰州市榆中县和平牡丹园.选择‘美髯公’‘粉荷’‘粉冠彩’带3个品种的紫斑牡丹,采摘一年生嫩枝上健壮、无病害且长势良好的叶片和叶柄.采摘后置于4 ℃的冰箱中储藏备用.
1.2培养基和培养条件
本试验中均以MS为基本培养基(pH5.6、蔗糖30 g/L、琼脂5 g/L、LH 500 mg/L、PVP 0.1 g/L).培养箱光照强度为(2 000±100)lx,光照时间为16 h光照/8 h黑暗,温度(20±3)℃,空气相对湿度为(70±5)%.
1.3试验方法
1.3.1外植体处理及HgCl2消毒比对将采摘的叶片和叶柄用细毛刷洗干净后在流水下冲洗2 h,用蒸馏水冲洗5次后置于超净工作台上,用75%酒精将材料浸泡15 s后用无菌水迅速冲洗3次.从3个品种牡丹中选取等量的叶片和叶柄混合,用0.1% HgCl2进行2、4、6、8、10、12 min的消毒处理,用无菌水冲洗5次.将处理过的叶片沿主叶脉切成约0.5 cm2的方块、叶柄切成约1 cm的条块,并刻划伤口,接种到MS培养基中.每处理各接种30块,重复3次.将接种后的材料置于上述条件培养箱中.10 d后统计污染率、褐化率、存活率及死亡率.
1.3.2启动培养将材料进行消毒处理后,每个品种的叶片和叶柄分别接种300块,置于上述条件箱中暗培养(用锡纸包裹遮光).7 d后选择生长良好的叶片和叶柄转接至愈伤组织诱导培养基中,以缓解外植体的褐化.
1.3.3愈伤组织诱导培养MS基本培养基加入6-BA(2.0 mg/L)和不同质量浓度的NAA (0.1、0.2、0.3、0.4、0.5 mg/L).选择启动培养中无污染、生长良好的叶片、叶柄,转接至诱导培养基中,每处理接30个,重复3次,置于培养箱中进行诱导比对试验.每天上午10∶00观察统计,40 d后统计愈伤组织诱导率.
1.3.4愈伤组织增殖培养MS基本培养基中加入0.5 mg/L的2,4-D和不同质量浓度的NAA(0.5、1.0和1.5 mg/L).选择诱导比对试验中诱导率最高并且生长最良好的品种:‘粉冠彩带’进行愈伤组织增殖生长比对试验.选取叶片和叶柄中被诱导生长良好的愈伤组织切割成0.5 cm2左右的块状,转至增殖培养基中.每处理接20个,重复3次,置于培养箱中.每天上午10∶00观察,30 d后统计愈伤组织增殖情况.
1.3.5愈伤组织分化培养MS基本培养基中加入不同质量浓度的2,4-D(0.2、0.4 mg/L)和不同质量浓度的6-BA(4.0、6.0 mg/L).因增殖培养中叶柄愈伤组织质地优于叶片,故选取叶柄愈伤组织为材料进行后续试验.将增殖培养基中生长良好的叶柄愈伤组织转至分化培养基中,每处理接10个,重复3次,置于培养箱培养.每天10∶00观察并记录愈伤组织生分化情况,40 d后统计愈伤组织分化率.
1.4评价指标与数据分析
本试验数据评价指标有污染率、褐化率、存活率、死亡率、愈伤组织诱导率以及愈伤组织增殖率.用Excel和SPSS 19.0统计分析软件对数据进行相应的分析,用Duncan多重比较法进行差异显著性检测.
2结果与分析
2.1不同消毒时间对外植体生长的影响
由表1、2可知,不同消毒时间处理均在一定程度上影响叶片和叶柄的污染率、褐化率、存活率以及死亡率.随着消毒时间的延长,叶片的污染率逐渐降低,6 min后污染率均为零,与2、4 min的差异性显著(P<0.05);叶柄的污染率随着消毒时间的延长逐渐降低, 8 min与10、12 min的差异不显著,与2、
4 min和6 min的差异极显著(P<0.01).叶片褐化率随着时间的延长呈先降低后增大的趋势,在6 min时达到最低(50%),与其他处理间的差异极显著(P<0.01);叶柄褐化率随着时间的延长先降低后增大,2~6 min褐化率降低,8~12 min褐化率升高.叶片存活率随消毒时间延长逐渐降低,处理 6 min(82.22%)以后开始急剧下降,与8、10 min和12 min的差异极显著(P<0.01),与4 min的差异不显著;存活率随消毒时间的延长先升高后降低,8 min与2、4 和6 min的差异极显著(P<0.01).叶片死亡率随时间延长逐渐升高,处理6 min(17.78%)以后开始急剧升高,与8、10和12 min的差异极显著(P<0.01),与2、4 min的差异显著(P<0.05);叶柄死亡率随时间延长呈降低趋势, 处理8 min与10、12 min的差异显著(P<0.05).
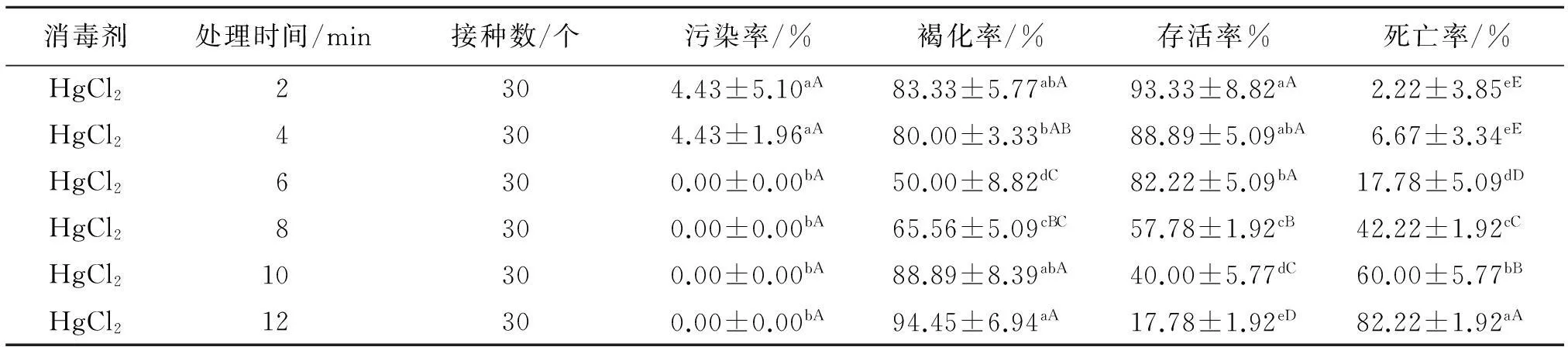
表1 不同消毒时间对紫斑牡丹叶片生长的影响
表中同列数据肩标不同小写字母表示差异显著(P<0.05),不同大写字母表示差异极显著(P<0.01).
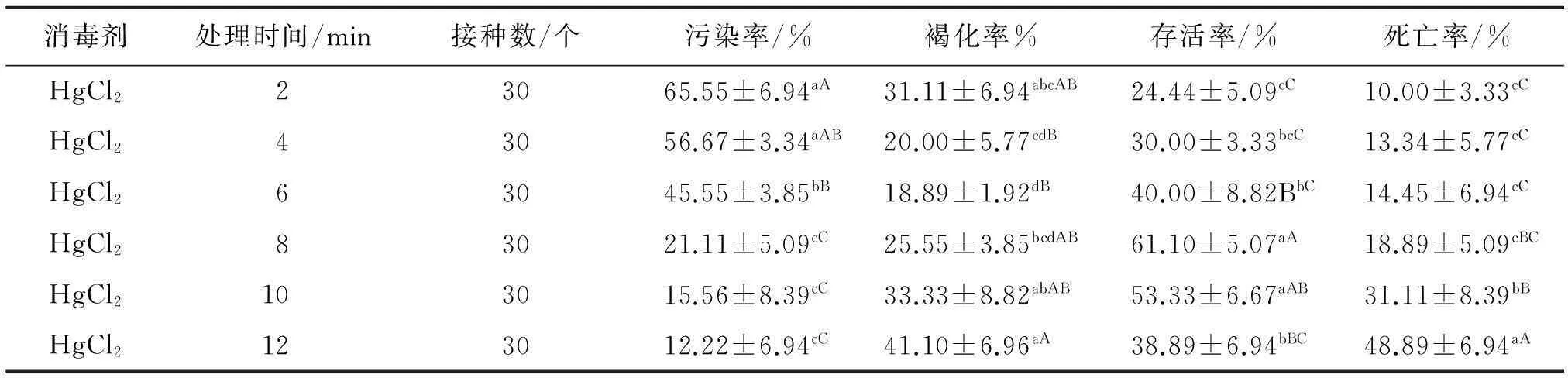
表2 不同消毒时间对紫斑牡丹叶柄生长的影响
表中同列数据肩标不同小写字母表示差异显著(P<0.05),不同大写字母表示差异极显著(P<0.01).
2.26-BA与不同质量浓度 NAA配比对紫斑牡丹不同品种离体叶片、叶柄愈伤组织诱导的影响
由表3、4可知,紫斑牡丹不同品种间,‘粉冠彩带’叶片和叶柄的愈伤诱导率都最高,分别为60.00%、84.44%.3个品种的叶片愈伤诱导率都在0.3 mg/L NAA处理下最高,与其他处理的差异显著(P<0.05)且生长表现良好;在0.1、0.5 mg/L NAA处理下诱导率较低,且所有品种中0.5 mg/L NAA处理与其他处理间差异极显著(P<0.01).在0.4 mg/L NAA处理下3个品种的叶柄愈伤诱导率都最高,且在‘美髯公’与‘粉荷’两个品种中0.4 mg/L NAA处理与其他处理间差异极显著(P<0.01),愈伤组织生长良好,纵向切口处绿色团状愈伤组织较多;在0.1、0.2 mg/L NAA处理下诱导率相对较低,且所有品种中0.1 mg/L NAA处理与其他处理间差异显著(P<0.05),愈伤组织质地较差,大多呈淡黄色或黄褐色颗粒状.由配比结果可知,在6-BA(2.0 mg/L)质量浓度不变的情况下,随着培养基中NAA质量浓度的升高,叶片和叶柄的愈伤诱导率随之增大,增加到一定程度后愈伤诱导率又随着NAA质量浓度的增大而降低.
分别选取3个品种中叶片和叶柄的最高诱导率进行比较,如图1所示, 3个品种愈伤组织诱导率大小为:‘粉冠彩带’>‘美髯公’>‘粉荷’,差异性极显著(P<0.01),且叶柄愈伤组织的诱导率明显大于叶片愈伤组织的诱导率.以上分析说明,不同品种、不同外植体和不同质量浓度激素配比均可在一定程度上影响紫斑牡丹愈伤组织诱导率.
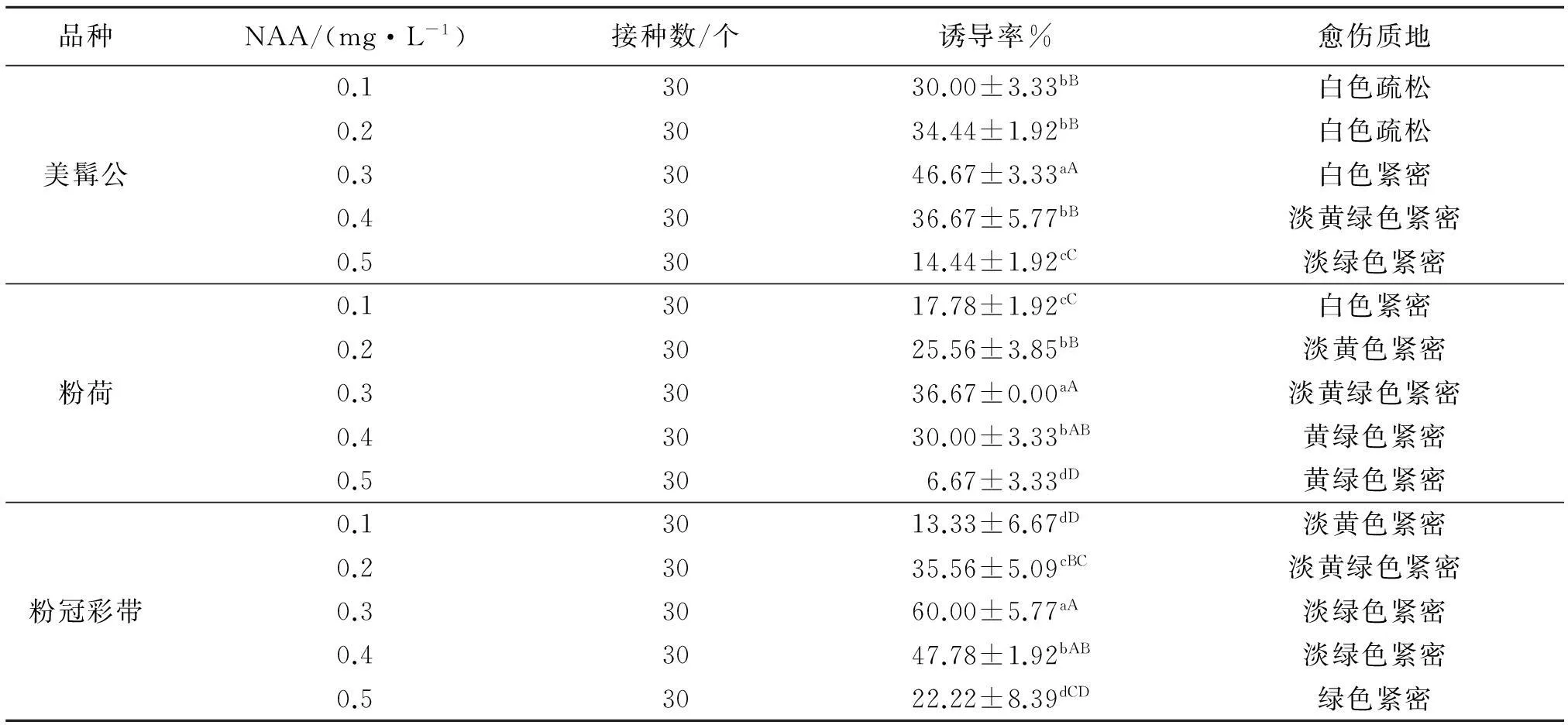
表3 6-BA和不同质量浓度NAA配比对紫斑牡丹不同品种离体叶片愈伤组织诱导的影响
表中同列数据肩标不同小写字母表示差异显著(P<0.05),不同大写字母表示差异极显著(P<0.01).

表4 6-BA和不同质量浓度NAA配比对紫斑牡丹不同品种离体叶柄愈伤组织诱导的影响
表中同列数据肩标不同小写字母表示差异显著(P<0.05),不同大写字母表示差异极显著(P<0.01).

图1 不同品种及不同外植体对愈伤诱导率的影响Fig.1 Effects of different variety and explant oncallus induction rate
2.32,4-D和不同质量浓度NAA配比对愈伤组织增殖的影响
由表5可知,2,4-D和不同质量浓度NAA配比对叶片和叶柄愈伤组织增殖率影响明显.1.5 mg/L NAA处理的叶片增殖率(86.67%)显著高于0.5 mg/L NAA处理(P<0.05);1.5 mg/L NAA处理叶柄的增值率最高(98.33%),于其他处理间差异极显著(P<0.01).在2,4-D(0.5 mg/L)质量浓度不变的情况下,随着NAA质量浓度的增大,叶片和叶柄的愈伤组织增殖率相应升高,颜色由白色逐渐变为淡绿色,质地由疏松状变为紧密状.当NAA质量浓度达到1.5 mg/L时,叶片和叶柄愈伤组织增殖率均最高且愈伤组织质地较好,生长旺盛.
2.4不同细胞分裂素和生长素配比对愈伤组织分化的影响
分化培养中愈伤组织的生长状况,接种48d表中同列数据肩标不同小写字母表示差异显著(P<0.05),不同大写字母表示差异极显著(P<0.01).后,只有极少数愈伤组织在2,4-D(0.2 mg/L)/6-BA(4 mg/L)处理中分化出透明状、淡绿色的胚状体,分化率不到10%,且在其他3种处理中均未观察到分化现象.在分化培养基中,大部分愈伤组织褐化死亡,只有个别组织块边缘生长出新的愈伤组织,分化困难.

表5 2,4-D和不同质量浓度NAA配比对愈伤组织增殖的影响

A:叶片褐化程度;B:叶柄褐化程度;C:叶片在MS+6-BA2.0 mg/L+NAA0.4 mg/L+LH 500 mg/L+PVP0.1 g/L诱导的愈伤组织;D:叶柄在MS+6-BA2.0 mg/L+NAA0.3 mg/L+LH500 mg/L+PVP 0.1 g/L诱导的愈伤组织;E:叶片愈伤组织在MS+2,4-D0.5 mg/L+NAA1.5 mg/L+CH500 mg/L+PVP 0.1 g/L中的增殖;F:叶柄愈伤组织在MS+2,4-D0.5 mg/L+NAA1.5 mg/L+CH500 mg/L+ PVP0.1 g/L中的增殖.图2 紫斑牡丹愈伤组织诱导及增殖Fig.2 Callus induction and proliferation of Paeonia rockii
3讨论与结论
3.1外植体的消毒处理
在植物组织培养中,直接以野外生长的材料作为外植体进行组织培养的过程中常因野外材料携带大量病菌导致培养过程中污染率较高.选择适当的消毒剂及消毒时间成为有效控制污染,促进组织培养成功的首要环节.不同消毒时间对外植体的影响不同,时间过短会因为消毒不彻底而造成组织污染,时间过长则会对外植体造成损伤使得死亡率增高.所以选择适宜的处理时间,尽量减少材料的损伤和死亡成为紫斑牡丹不同外植体组织培养的首要任务.
本试验以紫斑牡丹叶片和叶柄为外植体,用0.1% HgCl2对材料进行不同消毒时间处理,结果表明,不同消毒时间处理对不同外植体培养造成不同影响,叶片和叶柄理想消毒时间分别为6 min和8 min,这与王军娥等[14]对牡丹叶片以及叶柄最佳消毒时间的研究结果不太一致,这可能是因为紫斑牡丹本身抗逆性较强对HgCl2的耐受力较中原牡丹强,也有可能是因为选取材料所处生长发育阶段不同使外植体的污染率、褐化率、存活率和死亡率存在着明显差异.
3.2不同激素配比对不同品种及组织器官愈伤组织诱导率的影响
愈伤组织是组织培养过程中在人工培养基上由外植体延伸出来的一团无序的薄壁细胞,是一群原始的未分化的细胞,可以在一定培养基和培养条件下诱导分化形成胚或直接形成小植株[15].愈伤组织生长具有繁殖速度快、数量多、再生率高较外植体培养污染率低等优点.之前研究表明各种激素对牡丹愈伤组织诱导的影响不同,而且不同品种和不同组织器官愈伤组织诱导对激素的要求存在较大差异.陈笑蕾[16]、王琼[17]、李艳敏[18]以及陈怡平等[5]的研究中表明NAA、6-BA和2,4-D能有效地诱导牡丹愈伤组织.在紫斑牡丹愈伤组织诱导的研究中发现,组织脱分化对 NAA的质量浓度变化比 6-BA的变化敏感,且NAA质量浓度稍高于6-BA质量浓度是比较理想的配方.本试验参考前人的研究结果,以紫斑牡丹3个不同品种的叶片和叶柄组织为材料,研究在6-BA质量浓度不变(2.0 mg/L)的情况下,添加较低质量浓度的NAA对愈伤组织诱导率的影响.结果表明,不同质量浓度的NAA对叶片、叶柄诱导率的影响不同.3个品种叶片的最佳诱导质量浓度都为0.3 mg/L,叶柄的最佳诱导质量浓度为0.4 mg/L,这与陈怡平得出的6-BA(1.5 mg/L)/NAA(2.0 mg/L)处理下诱导率最高的结果不同,主要可能是因为选取的组织器官内源激素水平不同所致[19].另外,在试验中发现,NAA不仅能够促进愈伤组织形成,而且对愈伤组织的质地也有影响.结果表明,随NAA质量浓度的升高,愈伤组织的颜色逐渐加深.这说明在一定范围内,NAA质量浓度越高愈伤组织的质地越好[20].另外对不同品种及不同组织器官最佳诱导率进行比较发现不同品种间诱导率存在明显差异,‘粉冠彩带’的叶片和叶柄愈伤组织诱导率均最高且显著高于其他品种;同一品种叶柄的愈伤诱导率高于叶片,与前人的研究结果基本一致.
3.3不同激素配比处理对愈伤组织增殖率的影响
为了从愈伤组织中诱导出分化苗,首先要保证有足够数量的愈伤组织,所以愈伤组织的增殖培养是十分必要的.王琼[17]在对‘凤丹’幼胚愈伤组织进行增殖试验中发现KT和6-BA对牡丹愈伤组织增殖有很大影响.为了研究其他激素对紫斑牡丹愈伤组织增殖是否也有促进作用,本试验研究了0.5 mg/L的2,4-D和不同质量浓度NAA组合对紫斑牡丹愈伤组织增值率的影响.结果表明,1.5 mg/L NAA处理中,叶片和叶柄的愈伤组织增殖率均最高.另外随着NAA质量浓度的升高,愈伤组织的质地由疏松状到紧密状、颜色由浅至深.说明在一定范围内高质量浓度(1.5 mg/L)的NAA有利于叶片和叶柄愈伤组织的增殖.在以后的试验中,更高质量浓度NAA处理对紫斑牡丹叶片和叶柄愈伤组织增殖的影响还有待进一步研究.
3.4不同激素种类和质量浓度组合对愈伤组织再分化的影响
愈伤组织再分化形成芽一直是牡丹组织培养技术中的难点之一,陈笑蕾[16]对牡丹愈伤组织进行了增殖分化培养,结果很不理想,没有分化出苗,愈伤组织在培养一段时间后褐化死亡;Beruto等[10]把牡丹花丝和花瓣接种在含有生长剂组合2ip+PIC或TDZ+2,4-D的培养基中,发现TDZ能够促进花瓣上的愈伤组织分化出不定芽.本试验用不同质量浓度 6-BA和不同质量浓度2,4-D组合进行愈伤组织分化的研究中发现2,4-D(0.2 mg/L)/6-BA(4 mg/L)处理中有少数透明状的胚状体,但因后期酚类物质大量产生,抑制组织再分化,最终导致胚状体死亡.紫斑牡丹愈伤组织诱导以及增殖已经成功,但诱导紫斑牡丹愈伤组织再分化的途径远未成熟,且紫斑牡丹属于系统进化中原始类群,组织培养再分化就越困难.因此,探索紫斑牡丹愈伤组织分化以及成苗的新途径及方法是今后努力的方向.
综上所述,在本试验中,用0.1%HgCl2对紫斑牡丹进行消毒处理,叶片和叶柄最佳消毒时间分别为6 min和8 min.6-BA(2.0 mg/L)/NAA(0.3 mg/L)处理在3个品种中叶片的愈伤组织诱导率均为最高,6-BA(2.0 mg/L)/NAA(0.4 mg/L)处理在3个品种中的叶柄的愈伤组织诱导率均为最高;‘粉冠彩带’叶片和叶柄的愈伤组织诱导率显著高于其他两个品种;同一品种叶柄的愈伤组织诱导率明显高于叶片的诱导率;在一定范围内NAA质量浓度越高愈伤组织的质地越好.2,4-D(0.5 mg/L)/ NAA(1.5 mg/L)组合处理中,叶片和叶柄愈伤增殖率均达到最高.2,4-D(0.2 mg/L)/6-BA(4 mg/L)处理诱导愈伤组织在分化过程中发现有少数透明状的胚状体.
参考文献
[1]陈慧玲,杨彦伶,张新叶,等.油用牡丹研究进展[J].湖北林业科技,2013,42(5):41-44
[2]周仁超,姚崇怀.紫斑牡丹胚培养与植株再生[J].亚热带植物科学,2001(3):58-60
[3]曹小勇.濒危植物紫斑牡丹胚离体培养[J].氨基酸和生物资源,2003,25(2):35-36
[4]陈怡平,廉永善,王勋陵.紫斑牡丹休眠地下芽在组织培养条件下的发育研究[J].西北植物学报,2003,23(2):314-317
[5]陈怡平,丁兰,赵敏桂.用紫斑牡丹不同外植体诱导愈伤组织的研究[J].西北师范大学学报:自然科学版,2001,37(3):66-69
[6]周秀梅,成仿云,钟原,等.紫斑牡丹 '书生捧墨' 的体胚诱导与发生[J].北京林业大学学报,2009,31(2):151-154
[7]钟原.紫斑牡丹分生结节的诱导与培养[D].北京:北京林业大学,2011
[8]成仿云.紫斑牡丹花粉发育的细胞形态学研究[J].园艺学报,1998,25(4):367-373
[9]成仿云,李嘉珏,陈德忠.中国野生牡丹自然繁殖特性研究[J].园艺学报,1997,24(2):180-184
[10]Beruto M,Curir P.Invitroculture of tree peony through axillary budding[C].Berlin:Springer-Verlag,2007
[11]Beruto M,Lanteri L,Portogallo C.Micro-propagation of tree Peony (Paeoniasuffruticosa)[J].Plant Cell Tissue and Organ Culture,2004,79(2):249-255
[12]Wu S H,Wu D G,Chen Y W.Chemical constituents and bioactivities of plants from the Genus Paeonia[J].Chemistry & Biodiversity,2010,7(1):90-104
[13]安阿莉,苏小玲,陈佰鸿,等.紫斑牡丹胚培养研究[J].甘肃农业大学学报,2009,44(6):63-68
[14]王军娥,巩振辉,李新凤.牡丹愈伤组织诱导与分化技术的优化研究[J].西北农业学报,2008,17(5):282-286
[15]徐海荣,徐吉军,常绪源,等.中国茶事大典[M].北京:华夏出版社,2000
[16]陈笑蕾.牡丹组织培养的初步研究[D].郑州:河南农业大学,2005
[17]王琼.牡丹组织培养与快速繁殖[D].郑州:河南师范大学,2007
[18]李艳敏.三种牡丹品种组织培养技术的研究[D].北京:北京林业大学,2004
[19]谢从华,柳俊.植物细胞工程[M].北京:高等教育出版社,2004
[20]韩婷婷,孙周平.矮丛蓝莓叶片的愈伤组织诱导及植株再生[J].西北植物学报,2010,30(3):615-620
(责任编辑赵晓倩)
Effects of different hormone combinations on callus
induction ofPaeoniarockii
ZHANG Jian-xin,TANG Hong
(College of Forestry,Gansu Agricultural University,Lanzhou 730070,China)
Abstract:Takinginvitroleaves and leafstalks ofPaeoniarockiias study materials,the effects of treating with 0.1% HgCl2in different time on the pollution rate,browning rate,survival rate and mortality of leaves and petioles were studied.In addition,the effects of 6-BA and NAA,2,4-D and NAA as well as 2,4-D and 6-BA combinations on callus induction,proliferation and re-differentiation of leaves and petioles ofPaeoniarockiiwere also researched.The results showed that: (1) Using 0.1% HgCl2for disinfection treatment,the best sterilization time for leaves and petioles were 6,8 min respectively.(2) Under the treatment of 6-BA (2.0 mg/L)/NAA (0.3 mg/L),the callus induction rates of leaves from three cultivars were all the highest.Under the treatment of 6-BA (2.0 mg/L)/NAA (0.4 mg/L),the callus induction rates of petioles from three cultivars were all the highest.The callus induction rates of leaves and petioles of ‘Fen Guan Cai Dai’ were both significantly higher than that of other two cultivars.For the same cultivar,callus induction rate of petiole was significantly higher than that of leaf.(3) Under the treatment of 2,4-D (0.5 mg/L)/NAA (1.5 mg/L),callus proliferation rates of leaves and petioles reached to the highest,and the callus texture getting better with the increasing of the NAA concentration.(4)A few transparent embryoid were found in the process of callus re-differentiation under the treatment of 2,4-d (0.2 mg/L)/6-BA(4 mg/L).
Key words:Paeoniarockii;leaf;petiole;callus
收稿日期:2014-10-29;修回日期:2014-12-25
基金项目:甘肃紫斑牡丹无性繁殖关键技术研究(GAU-QNDS-201202);甘肃农业大学青年导师基金.
通信作者:唐红,女,博士,副教授,硕士生导师,主要从事园林观赏植物遗传育种研究.E-mail:gsth@21cn.com
中图分类号:S 685.11
文献标志码:A
文章编号:1003-4315(2015)06-0074-07

