不同菌种对猪用发酵床的应用效果
魏平,滚双宝,张强龙,赵芳芳
(甘肃农业大学动物科学技术学院,甘肃 兰州 730070)
不同菌种对猪用发酵床的应用效果
魏平,滚双宝,张强龙,赵芳芳
(甘肃农业大学动物科学技术学院,甘肃 兰州730070)
摘要:为筛选适宜于在西北地区推广发酵床养猪的菌种,试验以稻壳、锯末、玉米秸秆和玉米芯为原料,通过添加当地土著菌种、实验室保存的纤维素分解菌群和商业发酵菌种,研究不同菌种对发酵床效果的影响.试验共设了7个处理组合,分别为:100%土著菌种(A1)、100%纤维素分解菌群(A2)、100%商业发酵菌种(A3)、30%土著菌种+70%纤维素分解菌群(B1)、70%土著菌种+30%纤维素分解菌群(B2)、50%土著菌种+50%纤维素分解菌群(B3)、不添加任何发酵菌种的对照组(CK).结果表明:整个试验过程中,B2组发酵床30 cm处平均温度最高为(37.66±1.32)℃,与其他组差异显著(P<0.05),其中,在前5期,B2组与A3组差异不显著(P>0.05);各试验组的pH值都处在7.0~8.5,均在适宜微生物生长的范围内,其中B2组pH值显著低于同期其他组(P<0.05),说明添加微生物菌剂能降低垫料的pH值,对猪粪中NH3的挥发有一定抑制作用;C/N在整个试验过程中,均呈现持续下降的趋势,其中,A1、B2和B3组下降趋势明显大于其他组(P<0.05);各试验组粗纤维在11~35 d降解速率最大,42 d后A2和B2组粗纤维的总降解率分别为44.38%和45.08%,显著高于CK组(P<0.05).综合评价,70%土著菌种+30%纤维素分解菌群组发酵效果相对较好.
关键词:发酵床;复合菌剂;温度;猪粪
第一作者:魏平(1986-),男,硕士研究生,研究方向为动物遗传育种与繁殖.E-mail:1064643796@qq.com
随着我国养猪向集约化、规模化发展,猪场污染物已对环境造成了威胁.因此,对养猪场废弃物污染的防治和粪污无害化处理已迫在眉睫.发酵床养猪是利用高效有益菌种与垫料构建生猪生长的发酵床基质,通过床体中功能菌的新陈代谢消耗垫料中的纤维素、半纤维素等大分子物质,同时分解生猪排泄的粪尿,从而实现对周围环境零排放的一种生态养猪方法,可有效解决环境污染问题[1].但随着该技术的深入推广,也出现了一系列问题,例如:如何降低发酵垫料成本以及针对本地资源进行发酵菌种研发等.微生物是发酵床垫料中最关键、最活跃的成分,起作用的生物群落结构十分复杂,包含了大量不同种类的细菌、放线菌和真菌等,且还在不断的变化中[2].在堆肥化过程中,单一添加的微生物,无论其活性有多高,都不及复合微生物菌群的共同作用[3].近年来,国内学者围绕发酵床微生物复合菌剂开展了大量研究工作,有报道称,土著微生物菌群不一定适应发酵床的高温环境,微生物的活性、降解猪粪尿的能力不一定强,发生死床的概率会高[4].王卫平等[5]和张邑帆等[6]的研究,均是在单一菌种基础上按一定比例组合而成的复合菌剂,其在发酵床中的应用效果相对较好,但分离某种单一菌种较为繁琐且易染杂菌.目前有关微生物复合菌剂的研究报道中,对几种未知混合微生物菌种按一定比例再次配合而成的多种复杂微生物群体间的相互作用及应用效果的研究相对较少.因此,为进一步促使发酵床养猪朝着更本地化的方向发展,开发适用于当地的发酵床菌种很有必要.本试验采用了3种不同菌种(土著菌种、纤维素分解菌群和商业菌种),评价其对发酵床温度、pH、C/N以及粗纤维等方面的影响,以期对发酵床菌种开发及筛选提供指导,为本地区更好地推广发酵床养猪提供科学依据.
1材料与方法
1.1试验材料
1.1.1垫料及来源发酵原料为稻壳、锯末、玉米秸秆和玉米芯,来自甘肃省定西市,鲜猪粪为50 kg育肥猪的当天粪便,来自兰州某养殖场.
1.1.2菌种及营养液土著菌种是由多种有益微生物组成的活性强的优势菌群,成分非常复杂,主要包括固定碳素的光合细菌、抑制病害的放线菌、分解糖类的酵母菌、耐高温的芽孢杆菌以及在厌氧状态下能够有效分解有机物质的乳酸菌等多种微生物组成的群落.在兰州当地落叶丰富、腐殖质较多的区域采集,将八成熟米饭捏成团状,装入木盒,用宣纸封好,用树叶和腐殖质土将其埋好,放置7 d左右,米团上长满白色菌丝,立即将稀软的米团与红糖以3∶1的比例混合均匀,装入瓷坛,用宣纸封口,经6 d左右转化为浆状,形成土著发酵菌原菌.菌种不经纯化,室温条件下,将原菌与小麦麸皮混合均匀,喷洒稀释后的营养液,保持含水量在60%左右,2~3 d后表面会长满白色的菌丝,即为发酵床用土著菌种.扩繁后的菌种只需阴干即可,一般要求3个月左右使用完,最好现配现用;纤维素分解菌为课题组前期分离培养并在实验室保存的菌种;商业菌种购自苏柯汉(潍坊)生物工程有限公司,是一种新型的微生态活性菌剂,由芽孢杆菌、乳酸菌群、酵母菌群、放线菌群、丝状菌群等十几种微生物组成.同一般生物制剂相比,它具有发酵稳定、升温迅速、除臭效果好、安全可靠的特点,适用于以发酵床自然生态养猪为主的养殖业生产.参照黎朝燕[7]的方法,营养液以苹果、芹菜、红糖、大蒜、啤酒、淘米水和牛奶为原料,将不同原料按一定比例配合,经腌渍、发酵制成5种营养液,并等体积混合,用水500倍稀释备用.
1.2试验设计
试验采用单因子随机试验设计,每组7 d为1期,共7期,总计49 d,各处理发酵床垫料均以“20%锯末+20%稻壳+30%玉米秸秆+30%玉米芯”为载体,共设7个处理, 每个处理3个重复,试验设计方案见表1.

表1 试验处理设计方案
1.3发酵床制作
依据试验设计,商业菌种的添加参考其用法及用量,其余各组除CK外均添加菌种总量1 kg.将相同的锯末、稻壳、玉米秸秆和玉米芯按20%、20%、30%和30%的比例混合,并与菌种搅拌均匀,喷洒经1∶500稀释后的混合营养液于A1、A2、B1、B2和B3组,并保持含水率在55%~60%,之后加入到塑料圆桶中(直径60 cm,深90 cm)至70 cm厚度.将制作好的模拟发酵床,按照前期发酵的要求,每天早晨9∶00在中间30 cm深处测温,温度均呈现上升趋势,除CK组外,其他组上升至45 ℃左右,继而下降并稳定维持在40 ℃以上,每个桶每次添加猪粪2 kg(猪粪添加量按照饲养密度1.5 m2/头、排粪量1.5 kg/(d·头)计算[7],根据圆桶实际面积,每次添加7 d的猪粪量),共添加7次.
1.4样品的采集与测试分析
发酵床每天监测5个点的温度,监测时间为早晨9∶00,监测点深度为30 cm,在发酵的第1、8、15、22、29、36、43天进行取样,采用四分法采样,每个试验期取样3次,每次取3个平行,样品混合均匀,保留1 kg,待检.测定样品的pH值、有机质、粗纤维、无机氮、铵态氮和碳氮比(C/N)指标.
铵态氮采用靛酚蓝分光光度法测定[8];全氮采用凯氏定氮法测定[8];有机质采用重铬酸钾稀释法测定[9];pH:参考土壤pH值的测定方法[9];粗纤维含量的测定:按照GB/T 6434-1994.
1.5发酵床的日常管理
为防止发酵床垫料板结,控制发酵床的含水率在60%左右,并且每周将发酵床深度至少30 cm的垫料均匀翻动1次.
1.6数据处理
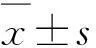
2结果与分析
2.1不同菌种对发酵床30 cm处温度的影响
从表2可以看出,CK组1~7期发酵床30 cm处温度均显著低于其他6个组(P<0.05).其他组在不同期温度存在差异,其中,在1、2、3和4期,B2组温度均最高,分别为(40.57±0.91)℃、(38.27±1.26)℃、(37.66±0.65)℃、(40.20±0.96)℃,显著高于A1、A2、B1、B3和CK组(P<0.05),与A3组之间差异不显著(P>0.05);第5期,A3组温度最高为(37.52±1.25)℃,与A2组差异显著(P<0.05),第6期,B2组温度最高为(33.03±1.05)℃,与其他组差异显著(P<0.05),第7期,B3组温度最高为(36.30±3.10)℃,与B2组差异不显著(P>0.05),从平均温度来看,A1、A3、B2和B3组温度显著高于A2组(P<0.05),且A1、A3、B2和B3组1~7期温度均保持在30 ℃以上.综合评价,A1、A3和B2组的内部温度较高,发酵效果较好,但A3组在发酵后期温度下降趋势较大.
2.2不同菌种对粗纤维的影响
根据表3可知,CK组粗纤维含量在每次测定中均最高,与其他组差异显著(P<0.05).其中,第1期,B2组粗纤维含量最低为(49.29±2.33)%,与A2、B1和B3组差异显著(P<0.05),与A1和A3组差异不显著(P>0.05);第2期,B2组粗纤维最低为(48.20±2.68)%,与A1、A2和B3组差异显著(P<0.05),与A3和B1组差异不显著;第3和4期,B2组的粗纤维最低分别为(44.74±1.48)%、(35.01±2.72)%,与A1、A2和A3组差异显著(P<0.05),与B3组差异不显著;第5和6期,A2组粗纤维含量最低,分别为(32.60±1.58)%、(29.34±1.81)%,与A1、B1和B3组差异显著(P<0.05),与A3和B2组差异不显著;第7期,B2组粗纤维最低(28.90±1.31)%,与A1、A2、A3和B3组差异显著(P<0.05),与B1组差异不显著(P>0.05).总体可以看出,B2组处理的发酵效果较好,在各个试验段的纤维素含量均最低,下降趋势稳定.
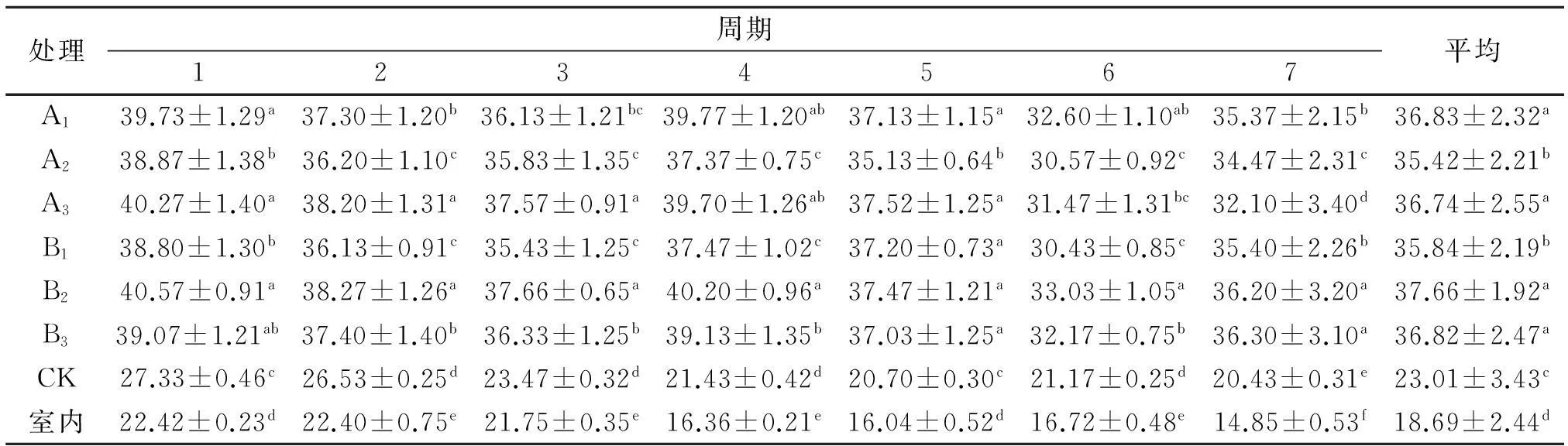
表2 发酵床30 cm处温度
同列数据肩标不同小写字母表示差异显著(P<0.05).
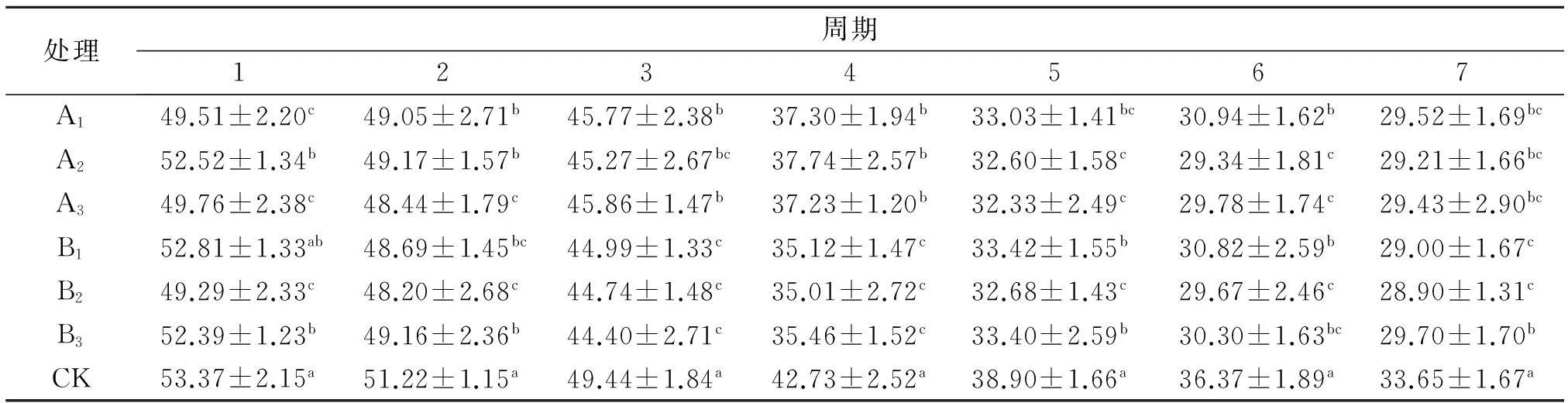
表3 不同菌种对粗纤维的影响
同列数据肩标不同小写字母表示差异显著(P<0.05).
2.3不同菌种对pH的影响
通过方差分析可知,第1期,B2组pH最低为(7.37±0.51),与A1、A2和CK组差异显著(P<0.05),与A3和B3组差异不显著(P>0.05);第2期,B2组的pH值最低为(8.17±0.56),显著低于CK组(P<0.05),与A3和B1组差异不显著(P>0.05);第3期,各试验组之间的pH差异不显著(P>0.05);第4期,B2组的pH值最低为(7.74±0.21),与A1、A2、B3和CK组差异显著(P<0.05),与A3和B1组差异不显著;第5、6和7期,B2组的pH值均最低,分别为(7.43±0.37)、(7.13±0.48)、(7.05±0.37),显著低于对照组(P<0.05).在整个试验过程中,B2组pH值均最低,说明添加70%土著菌种+30%纤维素分解菌群能显著降低垫料的pH值,对猪粪中NH3的挥发有一定抑制作用.
2.4不同菌种对铵态氮的影响
由表5可以看出,第1期,B2组铵态氮最高为(29.46±1.25)mg/kg,与A2、A3、B1、B3和CK组差异显著(P<0.05),与A1组差异不显著;第2、3、4和5期,B1组铵态氮最低,分别为(39.32±1.24)mg/kg、(38.72±1.19)mg/kg、(39.44±0.93)mg/kg、(37.30±2.26)mg/kg,与A1、A2、B3和CK组差异显著(P<0.05),与B2组差异不显著;第6期,B2组的铵态氮最低为(34.51±1.23)mg/kg,与A3、B1、B3和CK组差异显著(P<0.05),与A1和A2组差异不显著;第7期,A1组最低为(29.07±1.26) mg/kg,与A2、A3和CK组差异显著,与B2和B3组差异不显著(P>0.05).

表4 不同菌种对pH的影响
同列数据肩标不同小写字母表示差异显著(P<0.05).

表5 不同菌种对铵态氮的影响
同列数据肩标不同小写字母表示差异显著(P<0.05).
2.5不同菌种对C/N的影响
从方差分析可知,CK组在各个试验期C/N均显著高于其他组(P<0.05)(表6).其中,第1和2期B1组最低,分别为(43.33±1.46)、(35.75±0.87),与A1、A2、B2和B3组的差异显著(P<0.05);第3期,B2组C/N最低(30.39±1.55),与A1、A3和CK组差异显著(P<0.05),与A2、B1和B3组差异不显著;第4和5期,B2组C/N最低,分别为(27.10±0.92)、(26.89±0.46),与A3、B1和B3组差异显著(P<0.05),与A1和A2组差异不显著(P>0.05);第6期,B2组最低为(24.17±1.53),与A2、A3和B3组差异显著(P<0.05),与A1和B1组差异不显著(P>0.05);第7期,B2组最低为(21.24±0.46),与其他组差异显著(P<0.05).总体看来,B2组发酵效果相对较好,碳氮比下降稳定,且最终C/N最低.
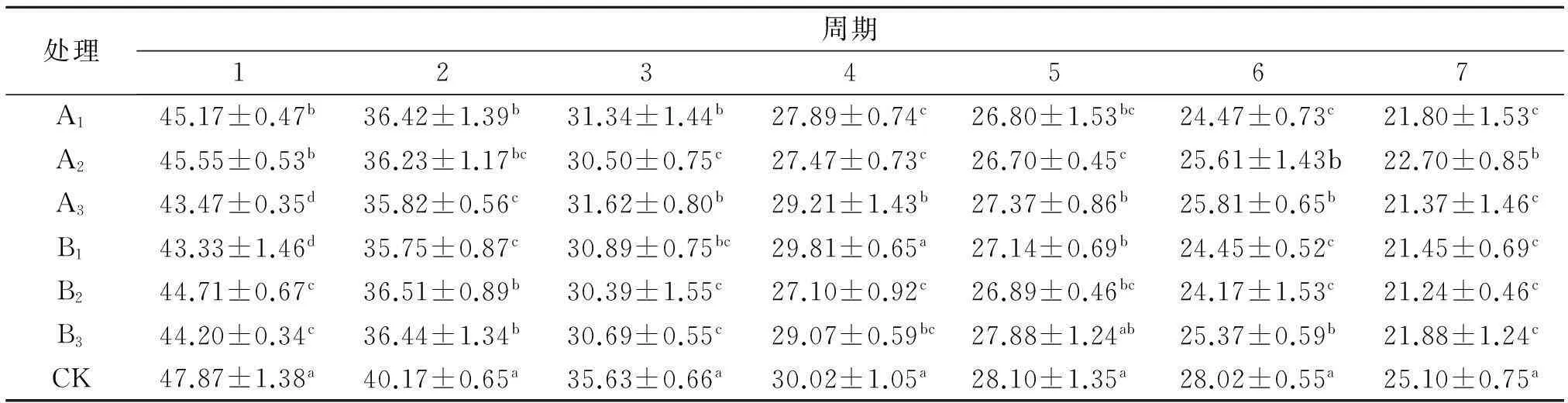
表6 不同菌种对C/N的影响
同列数据肩标不同小写字母表示差异显著(P<0.05).
3讨论
1)核心温度是衡量发酵效率的一个重要指标,其稳定维持是保证高效发酵的前提[10].在本试验条件下,添加微生物菌剂对发酵床30 cm处的温度影响显著(P<0.05).在前5期,A1、A3和B2组温度维持相对较高且稳定,可能与发酵菌种的种类有关,而在第6期时,A3组温度降到30 ℃左右,显著低于B2组(P<0.05),可能与好氧微生物发酵减弱有关,也可能与菌种的来源有关.与栾炳志等[10]的研究类同,整个试验过程中,试验组大体经历了“升温期一高温期一降温期”3个阶段,可能是刚加入猪粪时,微生物得到了充分营养,开始大量繁殖,自身代谢旺盛,产生大量热,使垫料温度迅速上升,但随着营养物质逐渐被消耗完全,微生物得不到可利用物质,代谢减弱,数量也逐渐减少,整个垫料的温度开始下降.因此,在生产实践中,可以对发酵过程进行适当的调控,根据温度的变化规律添加营养液,使其维持高效发酵.
2)发酵床周期长短的根本原因在于其垫料的组成成分,而垫料一般由木屑和稻壳组成,木质素含量高,降解较为困难[11].研究表明,在整个试验过程中,各试验组粗纤维的降解率呈先上升后下降的趋势,粗纤维的降解速度在11~35 d最快,42 d后A2、B2组粗纤维的总降解率分别为44.38%和45.08%,比CK组高7.44%和8.14%.由此可知,添加纤维素分解菌群能明显提高粗纤维的降解,进而促进发酵的持续进行.A1和A2组粗纤维的含量比混合组B系列高,而B2组发酵桶内粗纤维的含量相对较低且下降趋势稳定,可能与微生物菌种间的相互协同作用有关.
3)pH是影响微生物生长的重要因素之一,过高或低pH会影响发酵,只有在适当的pH下微生物才能正常生长,发酵床功能菌群的发酵一般需要弱碱性环境,pH为7.5左右最为适宜[12-13].本试验结果表明,各试验组pH起初保持上升的趋势,且各组之间差异不显著(P>0.05),这与张莉等[14]的研究结果一致,由此可知,在发酵的初始阶段,垫料中的有机物质逐渐发生降解,特别是蛋白质的水解,引起氨的浓度增加,导致pH升高,这个过程是无机氮代谢影响的缘故.各试验组的pH始终比CK组低,其中,B2组pH最低,显著低于CK组(P<0.05),说明通过添加微生物,将有机物降解为铵态氮,并以铵态氮的形式存在于垫料中,降低了整个环境的pH,有利于减少NH3的挥发.但是试验发现,B2组pH在前期较低,却上升快,且试验组和对照组pH达到的最高值相近,其原因有待与进一步研究.
4)铵态氮含量可以反映发酵过程中通气状况和微生物分解利用氮的情况[15].试验结果表明,铵态氮前期快速上升,可能是微生物的氨化和有机氮的矿化导致增加可溶性铵态氮[16],到达顶峰后,随着NH3的挥发和微生物的固氮作用,铵态氮含量不断下降.在整个试验过程中铵态氮含量以B2组最低,显著低于其他组(P<0.05),说明添加70%土著菌种+30%纤维素分解菌在促进有机态氮分解转化的同时显著加快了氮素的生物固定与硝化,氮的损失较其他组要少.研究表明,发酵42 d后,各试验组铵态氮含量显著低于CK组(P<0.05),说明微生物菌剂可加速有机物降解,有利于促进发酵的进一步进行.
5)微生物的生存和繁殖需要一定的营养源,主要来源于垫料和猪粪尿中易分解的有机物,因此碳和氮的含量决定了微生物的生存和繁殖效率[17].发酵床垫料中的C/N是影响基质发酵效果的重要因素,合适的C/N为发酵床功能菌群的生长提供最均衡的营养条件,保证粪便快速发酵分解[18].董晓宇等[19]对玉米秸基质发酵效果的研究结果表明,碳氮比愈小,发酵高温出现的时间相对愈早,持续的时间也较长,发酵基质的pH愈高.在整个试验过程中,随着发酵的进行,C/N保持下降的趋势,到42 d时,还保持在20以上,说明各试验组发酵效果较好,而B2组C/N显著低于A1、A2、A3、B1和B3组,说明碳氮比低了微生物活动频繁,温度高,这与董晓宇等[19]的结果一致.
4结论
本试验通过对7个处理的温度、粗纤维、pH、C/N和铵态氮等指标进行分析,结果显示B2组发酵的温度相对较高、pH适宜、C/N调整较好、发酵后营养养分含量高,整体发酵效果最为理想.因此,在本试验条件下,初步确定70%土著菌种+30%的纤维素分解菌群的组合应用于发酵床效果较好.由于试验只是在模拟条件下进行的,所得结果将有待于进一步在生产中验证.
参考文献
[1]盛清凯,武英,王成,等.发酵床养猪技术的优势与推广中存在的问题[J].猪业科学,2008(3):80-81
[2]张庆宁,胡明,朱荣生,等.生态养猪模式中发酵床优势细菌的微生物学性质及其应用研究[J].山东农业科学,2009(4):99-105
[3]Tam N F Y,Vrijmoed L L P.Effects of commercial bacterial production nutrient transformations of pig manure in a pig-on-litter system[J].Water Manage Res,1990,8(5):363-373
[4]施光发,甘友保,朱冠元,等.土壤微生物发酵养猪技术[J].畜牧与兽医,2006,38(3):59
[5]王卫平,汪开英,薛智勇,等.不同微生物菌剂处理对猪粪堆肥中氨挥发的影响[J].应用生态学报,2005,16(4)∶693-697
[6]张邑帆,卢茵,黄微,等.发酵床垫料复合菌剂优化组合的研究[J].现代畜牧兽医,2012(2):51-54
[7]黎朝燕.土著微生物发酵床的制作研究[J].畜牧市场,2010(8):39-41
[8]鲁如坤.土壤农业化学分析方法[M].北京:中国农业科技出版社,2000
[9]中国土壤学会农业化学专业委员会.土壤农业化学常规分析方法[M].北京:科学出版社,1983:86-92
[10]栾炳志,焦洪超,林海,等.发酵床养猪垫料基础参数研究[C].2010年家畜环境与生态学术研讨会,通辽:中国畜牧兽医学会,畜环境卫生学会,2010
[11]秦竹,周忠凯,顾洪如,等.发酵床生猪养殖中菌种与垫料的研究进展[J].安徽农业科学,2012,40(30):14771-14774
[12]He X T,Terry J L.Physical and chemical characteristics of selected U.S.municipal solid waste composts[J].Journal of Environment Quality,1995,24:543-552
[13]Fang Y M.Research of complex microbial community and application in composting[D].Shanghai:Shanghai Normal University,2011
[14]张莉,吴松成,李卿,等.发酵床养猪微生物降解系统的研究[J].中兽医医药杂志,2011(5):10-13
[15]黄国锋,钟流举,张振钿,等.猪粪堆肥化处理过程中的氮素转变及腐熟度研究[J].应用生态学报,2002,13(11):1459-1462
[16]段淇斌,冯强,姬永莲,等.生物发酵床对育肥猪舍氨气和硫化氢浓度季节动态的影响[J].甘肃农业大学学报,2011,46(3):13-15
[17]Zhu N.Effect of low initial C/N ratio on aerobic composting of swine manure with ric straw[J].Bio resource Technol,2007,98(1):9-13
[18]秦莉,沈玉君,李国学,等.不同C/N对堆肥腐熟度和含氮气体排放变化的影响[J].农业环境科学学报,2009,28(12):2668-2673
[19]董晓宇,孙守如,杨秋生,等.碳氮比和氮源配比对玉米秸基质发酵效果的影响[J].河南农业大学学报,2008,42(2):167-169
(责任编辑赵晓倩)
Effects of different compound bacterial agents
on fermentation bed of swine
WEI Ping,GUN Shuang-bao,ZHANG Qiang-long,ZHAO Fang-fang
(College of Animal Science and Technology,Gansu Agricultural University,Lanzhou 730070,China)
Abstract:In order to select suitable strains for fermentation bed of pig raising in northwest areas of China,rice husk,sawdust,corn stalk and corn cob were taken as raw materials,and added with local indigenous bacteria,cellulose decomposing bacteria preserved in laboratory and commercial fermentation strains,respectively,thus the effects of different inoculants on the fermentation bed were studied.Seven treatments were set as follows,100% indigenous bacteria (A1),100% cellulose decomposition microbes (A2),100% commercial fermentation strains (A3),30% indigenous strains+70% cellulose decomposition microbes (B1),70% indigenous strains+30% cellulose decomposition microbes (B2),50% indigenous strains+50% cellulose decomposition microbes (B3),no adding as control group (CK).The results showed that the in the whole test process,the average temperature at 30cm of fermentation bed of B2group was the highest (37.66 ±1.32) ℃,and was significantly different with that of other groups (P<0.05),but which was not significantly different between B2and A3group in the first five cycles (P>0.05).The pH values of each group were between 7.0~8.5,all within the suitable scope for microbial growth,the pH value of B2group was significantly lower than that of other groups in the same period (P<0.05),this showed that adding microbial agents could reduce the pH value of bed,and had a certain inhibitory effect on NH3 volatilization of pig manure.In the whole test process,C/N presented the declining trends,which of A1,B2and B3group were much obviously than that of other groups (P<0.05).The degradation rate of crude fiber of each group was the highest during 11~35 d,after 42 days,the total crude fiber degradation rate of A2and B2group were 44.38% and 45.08%,and were both significantly higher than that of control group (P<0.05).Comprehensive evaluation results showed that 70% indigenous strains+30% cellulose decomposition microbes (B2) had better fermentation effect than other treatments.
Key words:fermentation bed;compound bacterial agent; temperature; pig manure
收稿日期:2014-10-17;修回日期:2014-11-14
基金项目:国家科技支撑计划项目(2012BAD14B10);甘肃省科技创新项目(GNCX-2009-13,GNCX-2012-45) ;兰州市人才创新创业科技计划项目(2014-RC-83).
通信作者:滚双宝,男,博士,教授,研究方向为动物遗传育种与繁殖.E-mail:gunsb@gsau.edu.cn
中图分类号:S 828
文献标志码:A
文章编号:1003-4315(2015)06-0018-07

