钝化NF-κB的活化对免疫性肝损伤大鼠CYP2E1的影响
贾金雪,秦金东,李学峰,康晓琳,高洪波,薛永志
(包头医学院药理学教研室,内蒙古包头 014060)
钝化NF-κB的活化对免疫性肝损伤大鼠CYP2E1的影响
贾金雪,秦金东,李学峰,康晓琳,高洪波,薛永志
(包头医学院药理学教研室,内蒙古包头 014060)
中国图书分类号:R-332;R322.47;R345.99;R575.02;R593.02;R977.3;R977.6
摘要:目的 研究核转录因子-κB(nuclear factor kappa B,NF-κB)在免疫性肝损伤大鼠模型中的作用及对细胞色素P450总含量,亚型2E1(cytochrome P450 2E1,CYP2E1)表达、代谢活力的影响。方法 采用尾静脉注射BCG(125 mg ·kg-1)14d制备免疫性肝损伤大鼠模型。采用双光束紫外可见分光光度法测定肝匀浆中CYP450总含量,通过肝脏组织HE染色和血清中ALT和AST水平测定观察大鼠肝损伤情况。采用Western blot方法检测大鼠肝组织中CYP2E1蛋白表达;通过HPLC法检测CYP2E1的探针药物氯唑沙宗的血浆药物浓度,从而反映特异性代谢酶CYP2E1的代谢活力。结果 大鼠尾静脉注射BCG 14 d后,可引起肝组织炎性细胞浸润,肝重、脾重增加,血清转氨酶ALT及AST水平明显升高,CYP450总含量降低,CYP2E1表达和代谢活力明显降低。采用吡咯烷二硫氨基甲酸(PDTC)钝化NF-κB活化,可抑制CYP450总含量的降低,减缓CYP2E1蛋白表达和代谢活力的下调。结论 免疫损伤刺激明显下调CYP2E1,钝化NF-κB活化可明显抑制免疫性肝损伤大鼠肝组织中CYP2E1的下调,NF-κB可能参与CYP2E1下调机制。
关键词:肝损伤;核转录因子-κB;吡咯烷二硫氨基甲酸;细胞色素P450 2E1;大鼠;细胞色素P450;卡介苗
网络出版时间:2015-7-22 10:42 网络出版地址:http://www.cnki.net/kcms/detail/34.1086.R.20150727.0901.013.html
病毒感染导致的免疫性肝损伤和致癌物质导致的DNA突变是肝细胞癌发生的重要机制[1]。细胞色素P450 2E1(cytochrome P450 2E1,CYP2E1)是主要在肝脏表达的细胞色素P450酶重要的亚型,通过氧化前致癌物质转化为致癌物质,促进肝癌的形成。有研究发现[2],肝炎以及肝癌发病过程中CYP2E1下调,参与病理过程。以往关于CYP2E1的研究主要集中在酒精性肝损伤过程中氧化应激损伤[3-4],但在病毒性肝炎、肝硬化、肝细胞癌等免疫性肝损伤过程中的作用和下调机制尚未清楚。NF-κB是调节炎症和免疫反应及细胞存活的重要因子[5],也涉及细胞转化和肿瘤形成。炎症和组织损伤过程中,NF-κB激活,调控大量下游炎性细胞因子,可能参与损伤过程。吡咯烷二硫氨基甲酸(PDTC)可以通过抑制IκB的磷酸化从而发挥抑制NF-κB的作用[6],因此可以阻止NF-κB向核内移位,减少下游细胞因子的表达。本研究以尾静脉注射BCG制备大鼠免疫性肝损伤模型,观察CYP2E1的代谢活性、蛋白表达有何变化,采用PDTC抑制NF-κB活化,观察对CYP2E1氧化代谢活力和肝功能的影响,深入探讨NF-κB在免疫性肝损伤中的作用及其作用环节,为免疫性肝损伤药物治疗提供新的靶点和思路。
1 材料与方法
1.1实验动物与主要试剂 清洁级♂SD大鼠,内蒙古大学动物实验中心提供,体质量(250±20)g,动物许可证号SCXK(蒙)2005-0001。BCG冻干粉(每支60 mg,1 g·L-1),购自中国食品药品检定研究院,批号:2013-01。PDTC,美国Sigma公司,批号:851002。组织蛋白提取试剂盒、BCA蛋白定量试剂盒、SDS-PAGE凝胶制备试剂盒、CYP2E1兔抗大鼠多克隆抗体、β-actin鼠多克隆抗体,均购自武汉博士德生物工程有限公司。
1.2主要仪器 高效液相色谱仪,Thermo Finnigon公司生产;DF-D型恒压恒流电泳仪,北京市六一仪器厂;DYY-TB型转移电泳仪,北京市六一仪器厂;Sartorius分析天平,北京塞多利斯仪器有限公司;形态分析系统,江苏省捷达科技发展有限公司;7600-020型自动生化分析仪,日本;UV765型紫外分光光度计,上海精密科学仪器有限公司。
1.3动物分组及免疫性肝损伤动物模型的制备SD大鼠60只,适应性饲养2周,称重、编号后,按随机数字表分为Control、BCG、BCG+PDTC(50 mg· kg-1)、BCG+PDTC(100 mg·kg-1)、BCG+PDTC (200 mg·kg-1)组,每组12只。BCG、BCG+PDTC(小、中、大)组尾静脉注射BCG 125 mg·kg-114 d制备免疫性肝损伤大鼠模型,Control组尾静脉注射等体积NS。采用NF-κB特异性抑制剂对BCG+PDTC(小、中、大)组进行干预(d 11、12、13的16时腹腔注射PDTC各1次,剂量分别为50、100、200 mg ·kg-1)。d 14用于HPLC方法测定CYP2E1代谢活力实验,随后将大鼠颈椎脱臼处死,迅速剖取肝脏、脾脏,称重。将部分肝组织浸泡于事先配好的甲醛酒精(甲醛∶酒精=1∶9)固定液中,做石蜡包埋切片,常规HE染色。称取部分肝组织用于CYP450总含量测定,另称取部分肝组织冻存用于Western blot检测。
1.4高效液相色谱法(HPLC)测定大鼠CYP 2E1代谢活性 实验d 14,Control、BCG、BCG+PDTC (100 mg·kg-1)3组大鼠单次ig氯唑沙宗50 mg· kg-1,分别于给药后0.5、1、1.5、2、3、4、6 h从眼内眦静脉丛采血,每次采血0.2 mL于肝素化试管中,3 000 r·min-1离心5 min,取血浆,保存在-20℃冰箱后待测。根据文献[3]方法,测定血浆中CYP2E1探针药物氯唑沙宗浓度的经时变化。用药物代谢动力学软件3P97对血药浓度数据进行拟合,得出AUC、T1/2、Cmax、Tmax、Ke等各项药代参数。通过测定血浆中探针药物氯唑沙宗药-时曲线及药代动力学参数的变化,检测CYP2E1代谢活性。
1.5大鼠肝组织匀浆中CYP450全酶含量的测定BCG刺激2周后(d 14晨),各组动物均取定量12只肝脏制备肝匀浆样本,按1∶4比例向肝组织匀浆样本中加入预冷的0.15 mol·L-1Tris-HCl缓冲液,通入CO气体2 min,联二亚硫酸钠还原样本后,用紫外分光光度计测定490 nm、450 nm处光密度差值。采用BCA法测定肝匀浆样本中蛋白的含量,以牛血清白蛋白作标准曲线,计算每mg蛋白中CYP450全酶含量。
1.6肝组织CYP2E1免疫印迹分析(Western blot) 肝组织称重后,匀浆制备蛋白抽提物,用BCA法作蛋白定量,SDS-PAGE电泳,将蛋白质转移到硝酸纤维素膜上,放入0.02 mol·L-1TBS缓冲液配制的5%脱脂奶粉和1%的BSA混合的封闭液内,摇床摇动,室温封闭2 h,漂洗,CYP2E1兔多克隆抗体、β-actin鼠多克隆抗体杂交,加二抗,显色,X线片曝光,用紫外透视成像系统对X线片进行光密度分析。
1.7血清肝功能谷丙转氨酶(ALT)、谷草转氨酶(AST)检测 实验d 14,取上述各组大鼠眶静脉丛取血,静置30 min,3 500 r·min-1离心5 min分离血清,使用自动生化分析仪测定。
2 结果
2.1PDTC对BCG诱导的免疫性肝损伤大鼠肝脏病理组织学、肝重/体重、脾重/体重、血清转氨酶含量的影响 尾静脉注射BCG 5~7 d后,大鼠攻击性增强,激惹易怒,相互撕打,啮咬;2周后,光镜下观察到肝实质及汇管区周围有大量单核细胞及淋巴细胞浸润,形成大小不等且弥漫性分布的大量肉芽肿团块为特征的免疫性肝损伤,见Fig 1B;肝脏、脾脏重量明显增大(P<0.05);血清AST、ALT均升高(P <0.01)。给予PDTC进行干预,炎性细胞浸润团块减少,见Fig 1C;可降低肝脏、脾脏重量的增加(P<0.05);降低AST、ALT的升高(P<0.05),见Tab 1。
Tab 1 Effect of PDTC on liver and spleen weight relative to body weight ratio(%),serum levels of ALT and AST in BCG induced hepatic injury rats in vivo(±s,n=12)
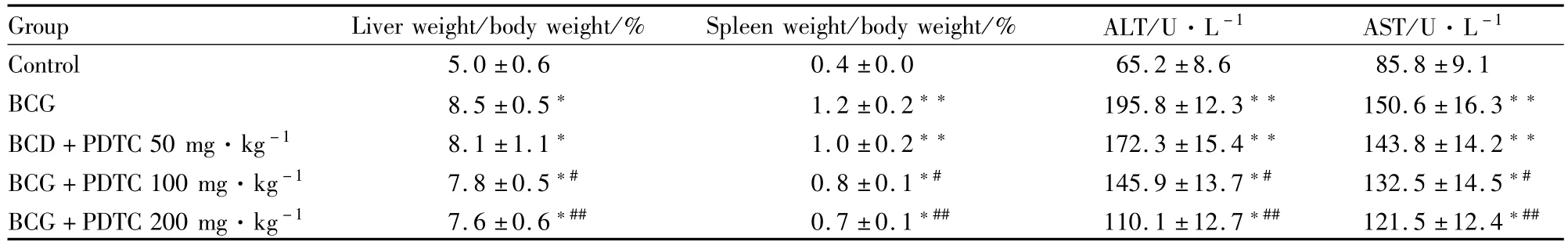
Tab 1 Effect of PDTC on liver and spleen weight relative to body weight ratio(%),serum levels of ALT and AST in BCG induced hepatic injury rats in vivo(±s,n=12)
*P<0.05,**P<0.01 vs control;#P<0.05,##P<0.01 vs BCG
Group Liver weight/body weight/% Spleen weight/body weight/% ALT/U·L-1 AST/U·L-1Control 5.0±0.6 0.4±0.0 65.2±8.6 85.8±9.1 BCG 8.5±0.5* 1.2±0.2** 195.8±12.3** 150.6±16.3**BCD+PDTC 50 mg·kg-1 8.1±1.1* 1.0±0.2** 172.3±15.4** 143.8±14.2**BCG+PDTC 100 mg·kg-1 7.8±0.5*# 0.8±0.1*# 145.9±13.7*# 132.5±14.5*#BCG+PDTC 200 mg·kg-1 7.6±0.6*## 0.7±0.1*## 110.1±12.7*## 121.5±12.4*##
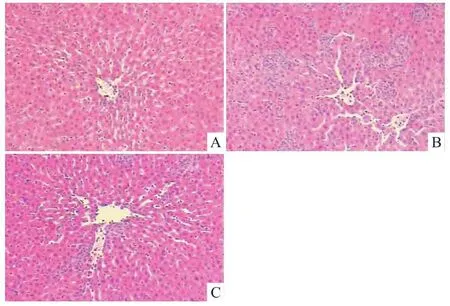
Fig 1 Pathological features in liver(HE×200)
2.2PDTC对BCG免疫刺激的大鼠肝匀浆样本中CYP450总含量的影响 与空白对照组相比,尾静脉注射BCG 14 d后,肝脏CYP450全酶含量明显减少(P<0.01)。在BCG刺激的基础上给予PDTC进行干预,则可剂量依赖性地减缓肝脏CYP450全酶含量减少,见Tab 2。
Tab 2 Effect of PDTC on CYP450 total content in BCG stimulated rats in homogenate sample(±s,n=12)
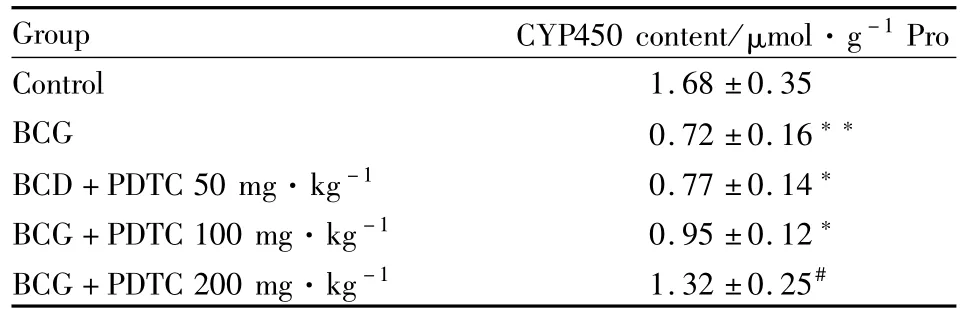
Tab 2 Effect of PDTC on CYP450 total content in BCG stimulated rats in homogenate sample(±s,n=12)
*P<0.05,**P<0.01 vs control;#P<0.05 vs BCG
Group CYP450 content/μmol·g-1Pro Control 1.68±0.35 BCG 0.72±0.16**BCD+PDTC 50 mg·kg-1 0.77±0.14*BCG+PDTC 100 mg·kg-1 0.95±0.12*BCG+PDTC 200 mg·kg-1 1.32±0.25#
2.3各组大鼠CYP2E1代谢活力的变化 Control、BCG、BCG+PDTC(100 mg·kg-1)3组大鼠经口单次给予经CYP2E1代谢的探针药物氯唑沙宗(50 mg ·kg-1),经HPLC测得大鼠血浆中氯唑沙宗血药浓度的经时变化,BCG组各个时间点血药浓度均高于Control组,BCG+PDTC组0.5、1 h时间点血药浓度低于BCG组(P<0.05),见Fig 2。经3P97药代动力学软件计算各药代动力学参数,进行房室拟合,符合一室模型。3组表观分布容积V(c)相近,BCG组Ke、Tmax、CL均小于Control组,Cmax、AUC、T1/2均高于Control组(P<0.05)。BCG+PDTC组CL高于BCG组,Cmax、AUC均低于BCG组(P<0.05),如Tab 3所示。
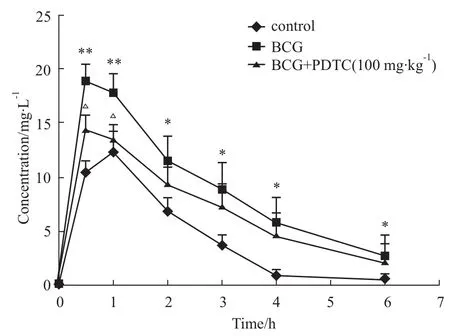
Fig 2 Plasma chlorzoxazone levels in all groups
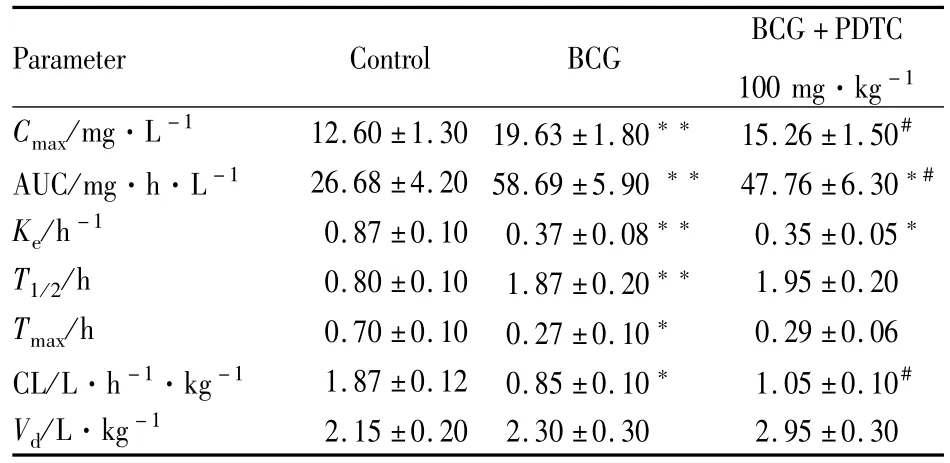
Tab 3 Plasma chlorzoxazone pharmacokinetic levels in all groups
2.4各组大鼠CYP2E1表达的变化 Western blot结果可见,内参β-actin各条带密度均一,提示蛋白定量基本准确,各组蛋白上样量基本一致。在Con-trol组肝脏组织中有CYP2E1的基础表达,BCG组中CYP2E1表达明显减少,给予PDTC干预,可使CYP2E1表达恢复,见Fig 3。
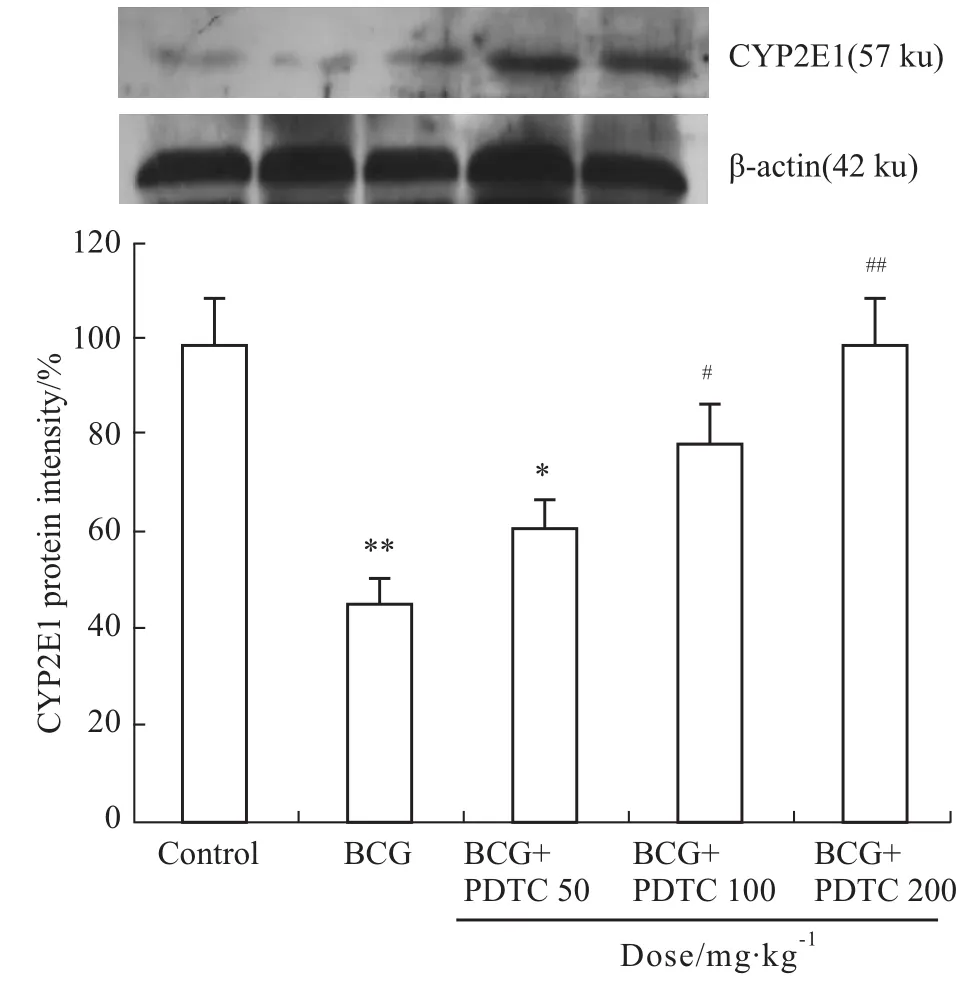
Fig 3 CYP2E1 expression in all groups
3 讨论
免疫性肝损伤是因免疫应答所导致的,免疫应答在清除病毒的同时,肝细胞也受到损伤,是病毒性肝炎、肝硬化最终发展为肝细胞癌的重要发病机制之一[6]。经尾静脉注射BCG 2周后,观察到肝实质及汇管区周围大量炎性细胞浸润、肝脾肿大及肝功受损,表明免疫性肝损伤大鼠模型成功建立,与人类病毒性肝炎的病理及血生化改变颇为一致。
本实验观察到,BCG免疫损伤刺激导致大鼠肝脏CYP450酶总含量降低,给予工具药抑制NF-κB激活,可减缓肝药酶全酶的含量降低。本研究结果进一步显示,免疫损伤过程中,占CYP450酶系7%左右的CYP2E1表达和代谢活力下调,钝化NF-κB激活可抑制其下调,推测CYP2E1的下调可能与NF-κB调节有关。BCG免疫刺激可激活肝内的巨噬细胞(Kupffer细胞,KC),诱生大量内源性的炎性细胞因子导致免疫性肝损伤,上述炎性细胞因子,可诱导肝实质细胞或肝KC表达iNOS,继而生成大量NO。NO作用于CYP2E1的铁蛋白中心,使CYP2E1破坏增加,使其下调[5,7]。NF-κB能与许多细胞因子和炎性介质的基因启动子区域的固定核苷酸序列结合,启动转录因子,在机体免疫应答、炎症反应方面发挥重要作用。免疫性肝损伤的诱因很多[8],最常见的是乙型肝炎病毒(hepatitis B virus,HBV)感染肝细胞后发生肝细胞病变后,KC可以被细胞变性、坏死释放的脂质过氧化物、细胞因子等炎性介质激活而分泌大量的细胞因子、趋化因子等促炎介质,如TNF-α、IL-1、IL-6、IL-8、NO、iNOS及活性氧等激活,趋化中性粒细胞和淋巴细胞浸润,这些物质可启动或加剧肝脏炎症反应。当细胞受到外界刺激时,IκB发生磷酸化并降解,NF-κB移位进入胞核内,与相关基因的κB位点发生特异性结合,发挥其转录活性。
本室以往研究表明,免疫损伤性刺激导致iNOS大量诱生,NO合成增加。活性氧(ROS)可能是所有刺激物激活NF-κB共同机制和LPS诱导细胞信号系统的核心,ROS增殖能减少巯基来增加细胞被氧化比例,调节NF-κB激活,NF-κB可以增加氧化信号通路的敏感性,导致基因产物的增多[9-10]。iN-OS既是NF-κB的激活物,同时,又受到NF-κB的调控,抑制NF-κB的活化可以减少NO的诱生,减缓CYP2E1的下调。有关免疫性肝损伤过程中CYP2E1代谢活力的调控是否经由NF-κB转录调控,可否通过转录调控代谢酶活力干预损伤过程有待进一步深入研究。
(致谢:本研究在包头医学院生物医学中心药物代谢研究室和药理学教研室完成,得到国家自然科学基金项目等资助,在此表示感谢!)
参考文献:
[1] 邓丽娟,李湛军,罗 楹,等.Caspase抑制剂F1013对刀豆蛋白A诱导小鼠急性肝损伤的治疗作用[J].中国药理学通报,2012,28(1):136-9.
[1] Deng L J,Li Z J,Luo Y,et al.Therapeutical effect of thecaspase selectiveinhibiter F1013 on ConA-induced acute hepatic injuryin mice[J].Chin Pharmacol Bull,2012,28(1):136-9.
[2] 陈方军,李 俊.细胞色素P4502E1在依达拉奉减轻免疫性肝损伤氧化应激中的作用[J].中国药理学通报,2013,29(2):216-20.
[2] Chen F J,Li J.Role of cytochrome P450 2E1 in edaravone easing oxidative stress inimmune liver injury[J].Chin Pharmacol Bull,2013,29(2):216-20.
[3] 潘苏华,刘平平,刘亚锋,等.复方银杏叶制剂对酒精性肝损伤的防护作用及机制[J].中国药理学与毒理学杂志,2012,26 (1):41-6.
[3] Pan S H,Liu P P,Liu Y F,et al.Protective effect of compound Ginkgo biloba on alcohol-induced liver injury and its mechanism [J].Chin J Pharmacol Toxicol,2012,26(1):41-6.
[4] 田维毅,王庆学,王文佳,等.葛根散对急性酒精性肝损伤小鼠肝微粒体CYP450含量及CYP2E1活性的影响[J].中国实验方剂学杂志,2012,18(4):183-6.
[4] Tian W Y,Wang Q X,Wang W J,et al.Effect of gegen powder on CYP450 content of liver microsomal and activity of CYP2E1 in mice acute alcohol-induced liver injury[J].Chin J Exp Tradit Med Formul,2012,18(4):183-6.
[5] Lee H J,Jeong Y J,Lee T S,et al.Moringa fruit inhibits LPS-in-duced NO/iNOS expression through suppressing the NF-κ B acti-vation in RAW264.7 cells[J].Am J Chin Med,2013,41(5):1109-23.
[6] Li X N,Su J,Zhao L,et al.The p38 MAPK inhibitor JLU1124 in-hibits the inflammatory response induced by lipopolysaccharide through the MAPK-NF-κB pathway in RAW264.7 macrophages [J].Int Immunopharmacol,2013,17,(3):785-92.
[7] Lin X,Huang R,Zhang S,et al.Methyl helicterate protects a-gainst CCl4-induced liver injury in rats by inhibiting oxidative stress,NF-κB activation,Fas/FasL pathway and cytochrome P450 2E1 level[J].Food Chem Toxicol,2012,50(10):3413-20.
◇消息◇
[8] Lim K H,Kim K H,Choi S I,et al.RPS3a over-expressed in HBV-associated hepatocellular carcinoma enhances the HBx-in-duced NF-κB signaling via its novel chaperoning function[J].PLoS One,2011,6(8):e22258.
[9] Zordoky B N,El-Kadi A O.Role of NF-κB in the regulation of cy-tochrome P450 enzymes[J].Current Drug Metab,2009,10(2):164-78.
[10]Ghose R,Omoluabi O,Gandhi A,et al.Role of high-fat diet in regulation of gene expression of drug metabolizing enzymes and transporters[J].Life Sci,2011,89(1-2):57-64.
Effect of blunting NF kappa B activation on CYP2E1 in immunological liver injury rats
JIA Jin-xue,QIN Jin-dong,LI Xue-feng,KANG Xiao-lin,GAO Hong-bo,XUE Yong-zhi
(Dept of Pharmacology,Baotou Medical College,Baotou Inner Mongolia 014060,China)
Abstract:Aim To determine the function of nuclear factor-κB(NF-κB)in immunological liver injury of rat model and its effect on CYP2E1 expression,content and metabolic activity.Methods The immunological liver injury rat model was prepared by injection of Ba-cillus Calmette Guérin(BCG,125 mg·kg-1)for 14 days.The hepatic tissue injury was revealed by hema-toxylin and eosin(HE)method and serum concentra-tion of alanine aminotransferase(ALT),aspartate ami-notransferase(AST)respectively.CYP450 total con-tent in hepatic homogenate was determined by spectro-photography.The expression of CYP2E1 protein was detected by Western blot analysis.The enzyme kinetics of CYP2E1 probe drug chlorzoxazone was evaluated by high-performance liquid chromatography(HPLC)as-say.Results The results showed that BCG-pretreat- ment(125 mg·kg-1)significantly increased the weight of liver and spleen,serum levels of ALT and AST(P<0.01),and decreased CYP2E1 expression,content and metabolic activity(P<0.05).Adminis-tration of ammoniumpyrrolidine dithiocarbamate (PDTC)(50,100,200 mg·kg-1)reversed the a-bove hepatic injury stimulated by BCG in vivo.Moreo-ver,PDTC dose-dependently inhibited the down regu-lation of CYP2E1(P<0.05).Conclusion Passiva-tion of NF-κB can inhibit the down regulation of CYP2E1 in liver tissue of immunological liver injury rats;NF-κB may be involved in CYP2E1 down-regula-tion.
Key words:liver injury;NF-κB;PDTC;CYP2E1;rat;cytochrome P450;Bacillus Calmette-Guerin
作者简介:贾金雪(1991-),女,硕士生,研究方向:药物代谢与肝脏分子药理学,E-mail:sxk7008@163.com;薛永志(1968-),男,硕士,教授,硕士生导师,研究方向:药物代谢与肝脏分子药理学,通讯作者,E-mail:xyzhxyzh68@sohu.com
基金项目:国家自然科学基金资助项目(No 30760289,81460567);内蒙古自然科学基金资助项目(No 2009MS1104,2014MS0813);内蒙古教育厅资助项目(No NJ03148,NJZY13244);内蒙古卫生厅项目(No 201302099)
收稿日期:2015-04-07,修回日期:2015-05-08
文献标志码:A
文章编号:1001-1978(2015)08-1076-05
doi:10.3969/j.issn.1001-1978.2015.08.010