氧自由基在急性单核细胞白血病发病中的作用
白改改,路晨阳,申秋菊,蒙 珊,惠凌云,苏 丹,张王刚,周芙玲
(西安交通大学医学部:1.第二附属医院血液内科,陕西西安 710004;2.第一附属医院检验科,陕西西安 710061)
急性髓系白血病是恶性程度高且很难治愈的恶性血液系统肿瘤。急性单核细胞白血病(acute monocytic leukemia,FAB分型,M5)是其中的一个重要亚型,近年来发病率逐渐升高,且病情进展迅速,常规化疗缓解后极易复发,长期生存率低[1]。因此,急性单核细胞白血病复发的机制研究显得十分重要。前期研究表明,氧自由基(reactive oxide species,ROS)参与急性白血病的发病[2-4]。本课题旨在深入研究ROS参与白血病发病的机制,为研究抗氧化剂在急性单核细胞白血病治疗中的作用提供实验依据。
1 材料与方法
1.1 实验材料 淋巴细胞分离液购自天津灏洋生物制品有限责任公司;MDA测定试剂盒、SOD测定试剂盒、LDH测定试剂盒、T-AOC测定试剂盒均购自南京建成生物工程研究所;ROS(活性氧检测试剂盒)购自普利莱基因技术有限公司;人8-OHdG Elisa试剂盒购自河北博海生物有限公司;戊二醛购自上海SCRC国药集团。
1.2 样品制备 M5患者选自2010年5月至2011年5月西安交通大学医学部第二附属医院血液科住院确诊的急性单核细胞性白血病患者76例,均在本院血液病实验室经FAB形态学、免疫学、细胞遗传学的MIC分型确诊,符合造血组织肿瘤新WHO分型标准。76例M5患者,其中男性46例,女性30例;原发组27例,复发组23例,化疗后完全缓解组26例;年龄从8~84岁,中位年龄是37岁。健康对照组24例,男17例,女7例,年龄18~79岁,中位年龄51岁。所有病例均排除心脏、肝脏、肾脏疾病。各组性别、年龄等条件无统计学差异(P<0.05)。抽取患者外周血5mL,肝素抗凝,分离血浆,分离单个核细胞,检测细胞内活性氧的水平,25mL/L戊二醛固定细胞,制备标本,透射电镜下观察细胞超微结构。
1.3 流式细胞仪检测M5患者外周血单个核细胞内活性氧的水平 实验分组同1.2。用流式细胞仪检测细胞内活性氧的水平:按照1∶1 000用无血清培养液稀释DCFH-DA,使终浓度为10μmol/L。将收集后的细胞悬浮于稀释好的DCFH-DA中,使细胞的密度为106~2×107/mL,37℃细胞培养箱内孵育20min,用无血清细胞培养液,洗涤细胞3次,4℃离心细胞,PBS冲洗1次,上机检测。将流式细胞仪的激发波长设置于488nm,发射波长525nm条件下,获取1000个细胞,检测细胞内的荧光,即特异性探针DCFDA平均荧光的强度。在荧光显微镜下观察活性氧特异性荧光探针DCFDA发出的光。根据不同组别的荧光强度,分析数据,制作图表。荧光指数(fluorescene index,FI)的计算公式为:FI=(实验样品的平均荧光强度-阴性对照组的平均荧光强度)/对照样品的平均荧光强度。
1.4 检测M5患者外周血血浆中抗氧化酶活性、氧化损伤产物的含量 从-80℃冰箱中取出血浆标本,在室温下平衡30min。通过羟胺法检测血浆中超氧化物歧化酶(superoxide dismutase,SOD)含量;比色法检测血浆中总抗氧化能力(total antioxidant capacity,T-AOC)、乳酸脱氢酶(lactate dehydrogenase,LDH)含量;硫代巴比妥酸(thiobarbituric acid,TBA)法检测血浆中丙二醛(malondialdehyde,MDA)含量,ELISA法检测血浆中8-羟化脱氧鸟苷(8-hydroxy-2′-deoxyguanine,8-OHdG)的水平,以上相同实验重复3次。
1.5 透射电镜观察M5患者外周血单个核细胞线粒体的超微结构 25mL/L戊二醛固定液4℃固定细胞,0.1 mol/L磷酸缓冲液浸洗,10g/L四氧化锇固定液固定,0.1mol/L磷酸缓冲液浸洗,乙醇梯度脱水,环氧树脂Epon812浸透、包埋,聚合后作半超薄切片1~2μm,美兰染色后光学显微镜下定位,超薄切片机进行超薄切片50~70nm,醋酸铀、柠檬酸铅染色,最后在日本日立H-7650透射式电子显微镜下观察、拍照。
1.6 统计学处理 采用SPSS 18.0软件进行统计分析,所有实验结果用均数±标准差(±s)表示,原始数据方差齐时采用单因素方差分析,组间比较用t检验;组间方差不齐时用H检验,组间比较采用U检验。P<0.05作为显著性检验的标准。
2 结 果
2.1 细胞内活性氧的检测结果 流式细胞仪检测发现,原发组及复发组细胞内活性氧的含量明显高于正常对照组(P<0.05),化疗缓解组细胞内活性氧的含量与正常对照组相比无统计学意义(图1)。
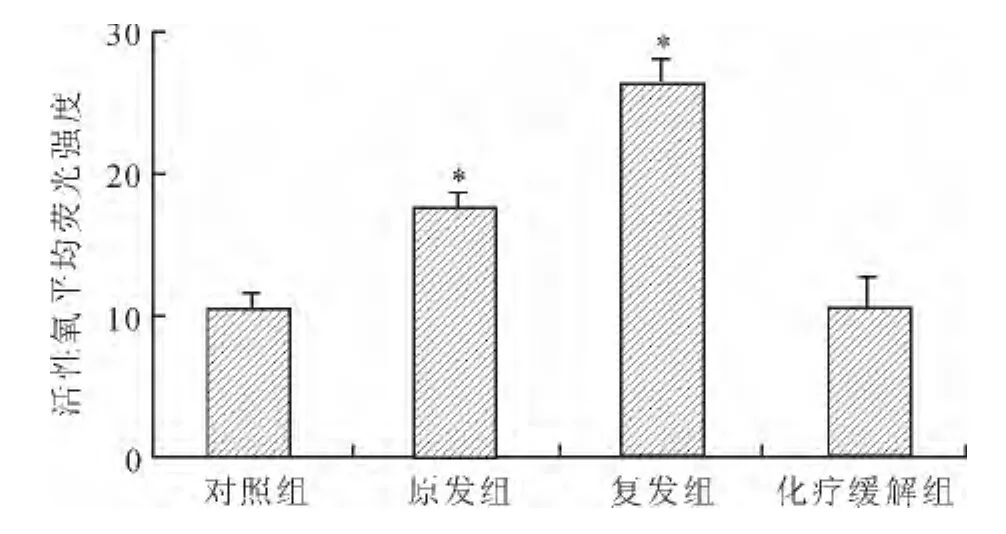
图1 各组细胞内活性氧含量的比较Fig.1 Comparison of intracellular ROS levels in different groups(±s)
2.2 M5患者血浆酶活性水平的变化 与对照组相比,原发组M5患者血浆中抗氧化物酶T-AOC、SOD活性减低(P<0.05),化疗缓解组其活性升高,而复发组其活性再次降低(P<0.05);原发组M5患者血浆中氧化损伤产物LDH、MDA、8-OHdG含量高(P<0.05),化疗缓解组其含量下降,而复发组其含量明显升高(P<0.05)。提示抗氧化酶含量与病情负相关,氧化损伤产物含量与病情正相关(表1)。
表1 急性单核细胞白血病患者外周血的氧化应激水平Tab.1 Peripheral blood level of oxidative stress in patients with acute mononuclear leukemia(±s)

表1 急性单核细胞白血病患者外周血的氧化应激水平Tab.1 Peripheral blood level of oxidative stress in patients with acute mononuclear leukemia(±s)
aP<0.05,原发vs.对照;b P<0.05,复发vs.对照;c P<0.05,缓解vs.对照;d P<0.05,原发vs.复发。
组别 T-AOC(u/mL) SOD(u/mL) LDH(u/L) MDA(nmol/mL) 8-OHdG(ng/L)原发组 7.86±6.24ad 78.59±11.33ad 537.71±160.33ad 10.47±0.54ad 122.71±79.21ad复发组 3.64±1.35bd 56.60±13.29bd 683.43±194.55bd 10.99±0.62bd 147.82±126.27bd化疗缓解组 8.89±5.70 89.15±7.15 265.26±97.42 9.59±0.53c 107.93±87.91c对照组 9.10±6.79 94.14±16.26 155.41±31.03 6.15±1.42 88.99±34.20 F 4.29 20.58 0.79 65.58 2.95 P 0.02 0.00 0.38 0.00 0.04
2.3 M5原发组、复发组患者外周血单个核细胞线粒体结构的变化 原发组M5患者外周血可见大量白血病原始单核细胞,细胞核大小不等,呈圆或椭圆形,胞核大、圆形、类圆形,核染色质纤细,部分凝集。线粒体轻度肿胀,嵴间隙增宽(图2A、图2B)。复发组M5患者外周血可见大量白血病原始单核细胞,呈圆或椭圆形,细胞核大小不等,圆形、类圆形,呈高度不规则性,核间常见核桥和核袋,核仁明显,染色质凝集明显。线粒体肿胀,可见空泡形成,嵴排列紊乱(图2C、图2D)。

图2 M5患者原发组(A、B)、复发组(C、D)外周血单个核细胞线粒体的超微结构Fig.2 Mitochondrial ultrastructure of peripheral blood mononuclear cells of acute mononuclear leukemia patients in primary group(A,B)and relapse group(C,D)(×20 000)
3 讨 论
活性氧是正常细胞在呼吸代谢过程中产生的代谢产物,其包括氧自由基、过氧化氢(H2O2)等活性物质,主要产生于线粒体。线粒体在细胞代谢活动中起着重要的作用,活性氧作为细胞内的一种信使分子,可以通过激活NF-κB、AP-1等转录因子及相应的基因表达来调节细胞的分裂和生长,从而导致癌症的发生和进展。已有研究表明,肿瘤的发生发展与机体内的ROS水平及其代谢产物有关,氧化应激与白血病的发病及无效治疗有关[5]。
在正常情况下,机体内的自由基总是处于不断产生和不断消除的动态平衡中,基于体内存在一套有效的抗氧化防御系统可以清除氧自由基及其代谢产物。本组研究结果提示M5患者体内ROS增加,这与前期文献结果一致。T-AOC是反映机体抗氧化防御系统对抗ROS对细胞损伤能力的重要指标。SOD是生物体内重要的抗氧化酶,主要作用是维持内环境ROS的动态平衡,清除过量的ROS。SOD主要存在于胞质和线粒体基质中,能够清除过多的O2-·,保护生物膜及细胞大分子结构的功能,与抑癌过程密切相关。在急性淋巴细胞白血病、慢性淋巴细胞性白血病患者体内存在氧化应激,抗氧化酶SOD和CAT活性减低,而氧化损伤产物 MDA、8-OHdG水平升高[6-7]。本实验采用流式细胞仪检测原发、复发、化疗缓解后M5患者外周血单个核细胞中活性氧的水平、羟胺法及比色法检测原发、复发、化疗缓解后M5患者血浆中抗氧化酶水平,可以得知原发组及复发组患者细胞内活性氧水平明显高于正常对照组(P<0.05),化疗后缓解组患者细胞内活性氧水平与对照组相比无统计学意义;原发组抗氧化酶SOD、TAOC活性减低,化疗缓解组活性升高,但仍低于正常对照组,而复发组活性明显下降。本研究表明,M5患者细胞内产生大量ROS,随着细胞内ROS含量的升高,氧化能力增强,细胞内抗氧化酶清除过量ROS,消耗了抗氧化酶,机体的抗氧化防御能力减弱,而化疗缓解患者体内抗氧化酶活性相比原发组、复发组升高,但仍低于正常对照组,表明血浆中抗氧化酶的活性与病情有关。
LDH广泛存在于人体各组织的细胞质中,是糖代谢的重要酶系之一,正常位于细胞质内,当细胞损害时,才释放出来,释放量与细胞受损程度呈正相关,恶性细胞代谢旺盛,LDH应激升高。白血病细胞具有恶性细胞的特性,一般认为急性白血病患者体内LDH升高是由于正常组织恶变后,肿瘤细胞中基因调控障碍导致LDH合成增加,又通过细胞损伤等一些机制使肿瘤细胞内LDH释放增多,故血清中LDH相应增多,通过检测细胞内LDH的释放可以评估肿瘤细胞和白血病细胞系的细胞毒性[8]。MDA是脂质过氧化反应的主要最终产物,具有生物毒性,可进攻蛋白质氨基酸,导致蛋白质分子内和分子间交联,使细胞骨架蛋白结构和功能发生改变。因此,MDA含量增多反映了脂质过氧化损伤增强,间接反映了ROS攻击机体的严重程度。8-OHdG是ROS攻击mtDNA的主要产物、是目前最常用最可靠的mtDNA损伤的生物标志物,且具有强的致突变能力,与肿瘤的发生发展有着密切的关系,可以评估体内氧化损伤和修复能力及氧化应激与mtDNA损伤的相互关系[9-10]。本实验结果表明,M5原发组患者血浆中氧化损伤产物 MDA、8-OhdG、LDH含量升高,化疗缓解组含量下降,而复发组含量明显升高,这提示原发组、复发组ROS含量增加,脂质过氧化损伤增强,mtDNA氧化损伤,细胞受到损伤,其代谢产物增加。表明氧化损伤产物含量的变化与病情的轻重程度相一致。因此,血浆中氧化损伤产物含量变化可以作为白血病病情严重程度及疗效的一项辅助指标。
线粒体是细胞内重要的细胞器,其数量及形态在细胞的不同阶段及外界环境刺激下不断变化。肿瘤细胞增殖失控和代谢功能障碍共同激活致癌信号刺激线粒体产生大量的ROS,进一步刺激周围正常组织向肿瘤细胞恶性转化及远地转移[11-12]。已有研究表明,在急性髓性白血病中线粒体是细胞能量代谢水平及细胞凋亡的重要细胞器,进而影响细胞增殖和分化[13]。本实验采用透射电镜观察M5患者外周血单个核细胞内线粒体的结构变化,发现原发组M5线粒体轻度异常,而复发组M5线粒体肿胀畸形,嵴排列紊乱,考虑M5细胞中线粒体结构的改变是ROS相关线粒体损伤,是白血病复发的证据之一。
综上所述,ROS平衡改变很可能是M5发生和复发的重要机制。M5患者体内存在过高的氧化应激,抗氧化酶消耗,氧化损伤产物增加,线粒体结构发生改变,相应检测可作为M5发病及复发的重要指标。此研究结果亦提示抗氧化酶活性变化与病情严重程度呈负相关,为进一步研究抗氧化剂在急性单核细胞白血病防治中应用提供了理论依据。
[1]DARMON M,AZOULAY E.Prognosis of acute monocytic leukemia(French-American-British classification M5)[J].Clin Oncol,2005,23(6):1327-1328.
[2]NIEBOROWSKA-SKORSKA M,KOPINSKI PK,RAY R,et al.Rac2-MRC-cIII-generated ROS cause genomic instability in chronic myeloid leukemia stem cells and primitive progenitors[J].Blood,2012,119(18):4253-4263.
[3]ZHOU F,SHEN Q,CLARET FX.Novel roles of reactive oxygen species in the pathogenesis of acute myeloid leukemia[J].J Leukoc Biol,2013,94(3):423-429.
[4]ZHOU FL,ZHANG WG,WEI YC,et al.Involvement of oxidative stress in the relapse of acute myeloid leukemia[J].J Biol Chem,2010,285(20):15010-15015.
[5]SARMENTO-RIBEIRO AB,PROENCA MT,SOUSA I,et al.A possible role for oxidation stress in lymphoid leukaemi as and therapeutic failure[J].Leuk Res,2012,36(8):1041-1048.
[6]OLTRA AM,CARBONELL F,TORMOS C,et al.Antioxidant enzyme activities and the production of MDA and 8-oxodG in chronic lymphocytic leukemia[J].Free Radic Biol Med,2001,30(11):1286-1292.
[7]BATTISTI V,MADERS LD,BAQATINI MD,at al.Measurement of oxidative stress and antioxidant status in acute lymphoblastic leukemia patients[J].Clin Biochem,2008,41(7-8):511-518.
[8]KIM DY,LEE JH,LEE JH,et al.Significance of fibrinogen,D-dimer,and LDH levels in predicting the risk of bleeding in patients with acute promyelocytic leukemia[J].Leuk Res,2011,35(2):152-158.
[9]COLLADO R,OLIVER I,TORMOS C,et al.Early ROS-mediated DNA damage and oxidative stress biomarkers in monoclonal B lymphocytosis[J].Cancer Lett,2012,317(2):144-149.
[10]YANG Y,TIAN Y,YAN C,et al.Determinants of urinary 8-hydroxy-2'-deoxyguanosine in Chinese children with acute leukemia[J].Environ Toxicol,2009,24(5):446-452.
[11]KULAWIEC M,OWENS KM,SINGH KK.Cancer cell mitochondria confer apoptosis resistance and promote metastasis[J].Cancer Biol Ther,2009,8(14):1378-1385.
[12]ISHIKAWA K,TAKENAGA K,AKIMOTO M,et al.ROS-generating mitochondrial DNA mutations can regulate tumor cell metastasis[J].Science,2008,320(5876):661-664.
[13]BASAK NP,BANERIEE S.Mitochondrial dependency in progression of acute myeloid leukemia[J].Mitochondrion,2015,21:41-48.

