慢性阻塞性肺疾病合并肺癌临床特征及新理念
慢性阻塞性肺疾病合并肺癌临床特征及新理念
Clinical characteristics of and new ideas
lung cancer from chronic obstructive
pulmonary disease
任成山1白莉2钱桂生2
作者单位: 400037 重庆,《中华肺部疾病杂志(电子版)》编辑部1
400037 重庆,第三军医大学新桥医院消化内科1、呼吸内科2
【关键词】肺疾病,慢性阻塞性;支气管肺癌;干细胞,癌症,定向,肺;炎症微环境;信号转导和转录激活因子;临床特征
慢性阻塞性肺疾病(chronic obstructive pulmonary disease, COPD)是一种全身性的疾病,以不可逆的持续气流受限为主要临床特征,患病人数多,社会经济负担沉重,病死率高[1]。且COPD是肺癌发生发展的独立首位危险因素之一[2-3]。COPD是呼吸系统最常见的慢性炎症性疾病(chronic inflammation disease),在临床上也经常见到COPD合并肺癌的患者,以及大量的文献报道[2,4-16]。长期以来学者们将COPD和肺癌作为两个独立的疾病分别进行研究,但近年来一系列研究认为吸烟COPD患者肺癌发生率是吸烟非COPD患者的4~5倍,组织损伤修复过程中,细胞在炎症微环境(inflammatory microenivironment)中发生癌变,细胞损伤可诱导性坏死细胞死亡和组织完整性缺失等一些新理念。由于COPD和肺癌的临床症状相似,COPD患者容易忽略对肺癌的筛查,因此COPD患者诊断肺癌时往往已是晚期,并且COPD患者心肺功能差,因此对COPD合并肺癌的治疗非常困难。炎症介质能促进细支气管肺泡干细胞(bronchioalveolar stem cells, BASCs)的生长,核转录因子(nuclear factor kappa, NF-κB)的活化作用,信号转导和转录激活因子3(signal transducer and activator of transcription 3, STAT3)在COPD和肺癌的发病机制中起着至关重要的作用[17]。但COPD和肺癌共同的发病机制仍然不清楚。因此,为了改善此类患者的临床疗效及预后,必须深入探讨COPD引发的肺癌发生发展机制及临床特征。
一、COPD与肺癌的流行病学
近年来,流行病学调查研究显示,我国40岁以上人群中COPD发生率高达8.2%,由此估计我国大约有4300万例COPD患者[1,18]。目前,全球COPD患病率为4%~20%,且COPD是第四位常见的致死原因(300万例/年),在世界范围内超过两亿人患COPD,预计到2020年COPD将上升为第三位常见的致死原因[19]。肺癌在世界范围内是第七位常见的致死原因(150万例/年)[20]。有研究报道,如果吸烟和固体燃料的使用无明显改变,预计我国2003年至2033年间将有6500万例死于COPD和1800万例死于肺癌[1,21]。一项对2507例COPD患者进行5年的随访调查,平均随访60个月(30~90个月),结果显示,其中215例由COPD发展为肺癌,每1000例/年COPD患者中有16.7例发展为肺癌(发生率为1.67%),显著高于同期吸烟者的肺癌发生率(0.10~0.15)[22]。50%~80%的患者被诊断为肺癌前就已经患有COPD,且8%~50%的肺癌患者合并COPD[23]。上述研究显示COPD引发肺癌的年发生率在0.8%~1.7%之间[22-24]。
COPD的严重程度可影响肺癌的发生率,有学者持续跟踪5402例COPD患者22年,收集并分析他们的临床资料,数据显示气流阻塞与肺癌发生率呈正相关[25]。用多变量比例风险模型研究分析,与正常肺功能相比(HR2.8,95%;CI1.8~4.4)轻度的COPD引发肺癌的风险相对较高(HR1.4,95%;CI0.8~2.6),中度或重度COPD引发肺癌的风险明显更高。Calabro等[26]报道FEV1比正常值少10%的COPD 患者,将会增加肺癌的风险。仅有15%~20%的吸烟者一生中会患COPD和/或肺癌,但个体间对这些疾病的敏感度是不同的。有研究报道COPD的遗传及流行病学,对于那些直系亲属患有COPD或肺癌患者会增加气流受限的风险。一些直系亲属患有早发型肺癌家族史的吸烟者与没有家族史的相比有更高患肺癌的风险,可能易感基因的存在与这些疾病相关[27]。
近30年来研究报道显示,许多国家肺癌的发生率和病死率均显著升高。目前我国肺癌发生率接近发达国家水平,肺癌发生率的增加与人口老龄化、城市工业化、农村城市化、环境污染化以及生活方式不良化密切相关。第三军医大学新桥医院2008年1月至2012年12月5年间收治COPD合并肺癌患者122例,其中男116例(95.1%),女6例(4.9%);年龄49~82岁,平均年龄(64.1±7.2)岁,组织类型:鳞癌60例(49.2%)、腺癌38例(31.1%)、小细胞和其他类型肺癌24例(19.7%)[2]。
二、COPD与吸烟和肺癌的关系
目前,公认吸烟包括被动吸烟是导致COPD和/或肺癌的重要危险因素之一,约有30%吸烟者发生COPD,15%吸烟者发生肺癌,仅有10%的COPD或肺癌患者无明确吸烟史[16,28-30]。香烟烟雾中含有多种化学成分和致癌物质,主要有活性氧(reactive oxygen species,ROS),它是直接引发COPD和肺癌的生物学物质。烟草中特有亚硝胺4-(甲基亚硝胺)-1-(3-吡啶)-1-丁酮[4-(methylnitrosamino)-1-(3-pyridyl)-1-butanone, NNK]的致癌作用在不同患者中随着烟雾暴露量的增加而不同[31]。这些物质作用于呼吸道上皮细胞导致发育不良、化生和腺瘤样增生,最终损伤DNA而引发细胞恶变。吸烟还可以促进气道黏液细胞的外分泌功能,损伤并降低气道纤毛细胞清除能力,使细菌易定植于气道,导致呼吸道感染和肺组织反复损伤与修复,这也是COPD和肺癌发病的共同病理基础。虽然有COPD或肺癌患者从不吸烟,但是吸烟是导致COPD或肺癌的主要因素之一,我们试图提出以下设想:吸烟→COPD→肺癌发生发展三部曲之规律。
烟草中尼古丁等有害物质刺激支气管气道上皮细胞、平滑肌细胞、中性粒细胞、巨噬细胞及多种基质细胞(stromal cells),这些细胞在肺内聚集、活化,过度分泌基质金属蛋白酶(matrix metalloproteinases)、蛋白水解酶(proteolytic enzyme)及氧自由基(oxygen free radical)等降解肺泡壁的层黏连蛋白(laminin)、纤维黏连蛋白(fibronectin)、弹性纤维(elastic fiber)和胶原纤维(collagen fibers)等基质成分,破坏肺泡和组织结构,进而导致肺组织失去弹力,肺泡弹性能力降低,肺泡腔扩大,并参与COPD的发生和发展。烟草中主要含有亚硝胺、环芳烃、苯并芘、焦油等致癌物质。烟草中这些有害物质不仅可导致COPD的发生而且可促使支气管上皮细胞腺瘤样增生发生恶变,而引发肺癌[32-33]。我院报道的COPD合并肺癌122例患者中,有吸烟史者107例(91.0%),吸烟指数(910.8±457.7/年支),单纯肺癌组吸烟指数(764.7±383.3/年支),两组比较有统计学意义(P<0.05)[2]。
肺癌患者中大约80%有吸烟史,但是长期吸烟史的人群中只有7%~10%会发生肺癌[34-35];所以吸烟并非是导致肺癌发生的唯一危险因子。流行病学调查研究比较表明,校正年龄等因素后,女性不吸烟者肺癌发生率高于男性不吸烟者,表明不吸烟者的女性肺癌敏感性较高或者更多的暴露于烟草烟雾以外的致癌物。不吸烟者发生表皮生长因子受体(epidermal growth factor,EGFR)突变较常见,而K-ras突变、p53异位突变和p16启动子高度甲基化的现象在吸烟者中更常见。不吸烟者体内存在重要的亚单位,与吸烟者体内肿瘤的病源论、生物学以及治疗反应等均不相同。将这些差异考虑在内可更好地对吸烟者和不吸烟者有效的进行癌症预防、早期检测并进行个体化治疗[28]。
三、COPD与肺癌的分子生物学关系
COPD的生物学特性包括强烈的免疫反应(immune response)、细胞外基质退化(degradation of extracellular matrix)、无效组织修复(ineffective tissue repair)、细胞凋亡增强(increased apoptosis)、血管再生受限(limited angiogenesis)等。肺癌的特征是DNA损伤(DNA damage)、无效DNA被修复(ineffective DNA repair)、持续的血管再生(sustained angiogenesis)、遗传不稳定(genetic instability)、细胞复制受限(limited cell replication)、细胞凋亡逃避(angiogenesis evasion)和癌病变组织浸润(tissue invasion)等[36]。
由COPD引发肺癌可能致癌的通路已经指出:①由吸烟造成的黏膜纤毛功能障碍导致有毒物质在呼吸道内堆积;②氧化剂和抗氧化剂之间失调,导致自由基损害DNA;③基因突变和遗传多态性可能影响肺癌的发展速度;④慢性炎症可能导致持续的有丝分裂和增加将自发DNA损坏转变为DNA突变的可能性[33]。许多参与者的易感基因与这些进程有关,它们包括环氧合酶-2(cycloox ygenase-2, COX-2)、NF-κB、白细胞介素-1β(interleukin-1β, IL-1β)、IL-6、STAT3、弹性蛋白酶、IL-8和炎症环境中的巨噬细胞移动抑制因子(macrophage inhibition factor, MIF),Kras中的基因突变和多态遗传、p53、p16、外周血淋巴细胞谷胱苷肽转硫酶基因(glutathione S-transferase mu 1, GSTM1)、相互作用蛋白(human hedgehog interacting protein, HHIP)、CYP2A6、nAChR和GYPA等[37-38]。
尽管突变或间变性淋巴瘤激酶(echinoderm microtuble-associated protein-like4-anaplastic lymphoma
kinase, EML4-ALK)的肺腺癌分别对EGFR抑制剂和淋巴瘤激酶抑制剂都有反应,但COPD合并肺癌患者EGFR突变和ALK重排发生率很低。近年来,研究报道几个可能的驱动突变致癌基因在鳞状细胞癌(squamous cell carcinoma)中被修饰,包括成纤维细胞生长因子1型受体(fibroblast growth factor receptor, FGFR1)、磷酸酶基因10(phosphatase and tensin homolog, PTEN10)和CDKN2A基因(p16)。有学者证实鳞状细胞癌组织中的FGFR1会被放大[39]。由于这些潜在强大的驱动突变致癌基因还没有新的抑制方法;因此,必须进一步研究适合的分子靶向治疗的方案。炎症微环境下启动STAT3与NF-κB的致癌作用[40],见图1。
四、COPD引发肺癌与干细胞的关系
慢性炎症被证明在许多器官中会诱发癌症。例如由丙型肝炎病毒感染导致的慢性肝炎会促进肝细胞癌的发生,幽门螺杆菌(Helicobacterpylori)感染引起的胃炎能引发胃癌,溃疡性结肠炎会导致结肠癌,石棉肺(asbestosis)与恶性间皮细胞瘤(malignant mesothelioma)有关,COPD或间质性肺炎(interstitial pneumonia)能增加癌症的发生。在组织损伤和修复过程中,细胞在炎症微环境中会发生癌变。细胞损伤会诱发两个病理过程:坏死性细胞死亡和组织完整性缺失。静态的正常干细胞或分化型祖细胞(progenitor cells)被用来修复受损组织。然而,在慢性炎症环境中,因为炎症反应产生炎症介质是潜在的基因毒性,所以细胞的损伤修复过程是一个致癌的过程。在炎症微环境中的炎症介质被认为能促进BASCs在癌变前发生突变,增殖并抵抗细胞凋亡和血管再生,产生肿瘤浸润、转移和免疫抑制因子(immunosuppressive factos)的分泌物[41-42]。一些研究表明,在发生肿瘤的肺内存在定向干细胞并起着重要作用[43]。现已证明在每一层上皮隔层中存在成熟干细胞(adult stem cells),这是由于肺干细胞(lung stem cells)中的定向干细胞在炎症微环境中的转化和发展。
代表可能的肺定向干细胞表型的干细胞中的定向干细胞(committed stem cells, CSCs)表面标志物及其特性在非小细胞肺癌(non-small cell lung cancer, NSCLC)和小细胞肺癌中(small cell lung cancer, SCLC)被鉴别出来:在NSCLC中鉴别出了侧群细胞(side population, SP)、CD133、乙醛脱氢酶(aldehyde dehydrogenase, ALDH)、CD166和细胞核内连环蛋白β(nuclear β-catenin),在SCLC中观察到了SP和CD133[44]。肺癌患者病因治疗后,CSCs可能造成肿瘤复发,因此对这类患者可能会主张采用分子靶向治疗法来进行维持治疗。COPD引发肺癌的作用机制[37],见图2。
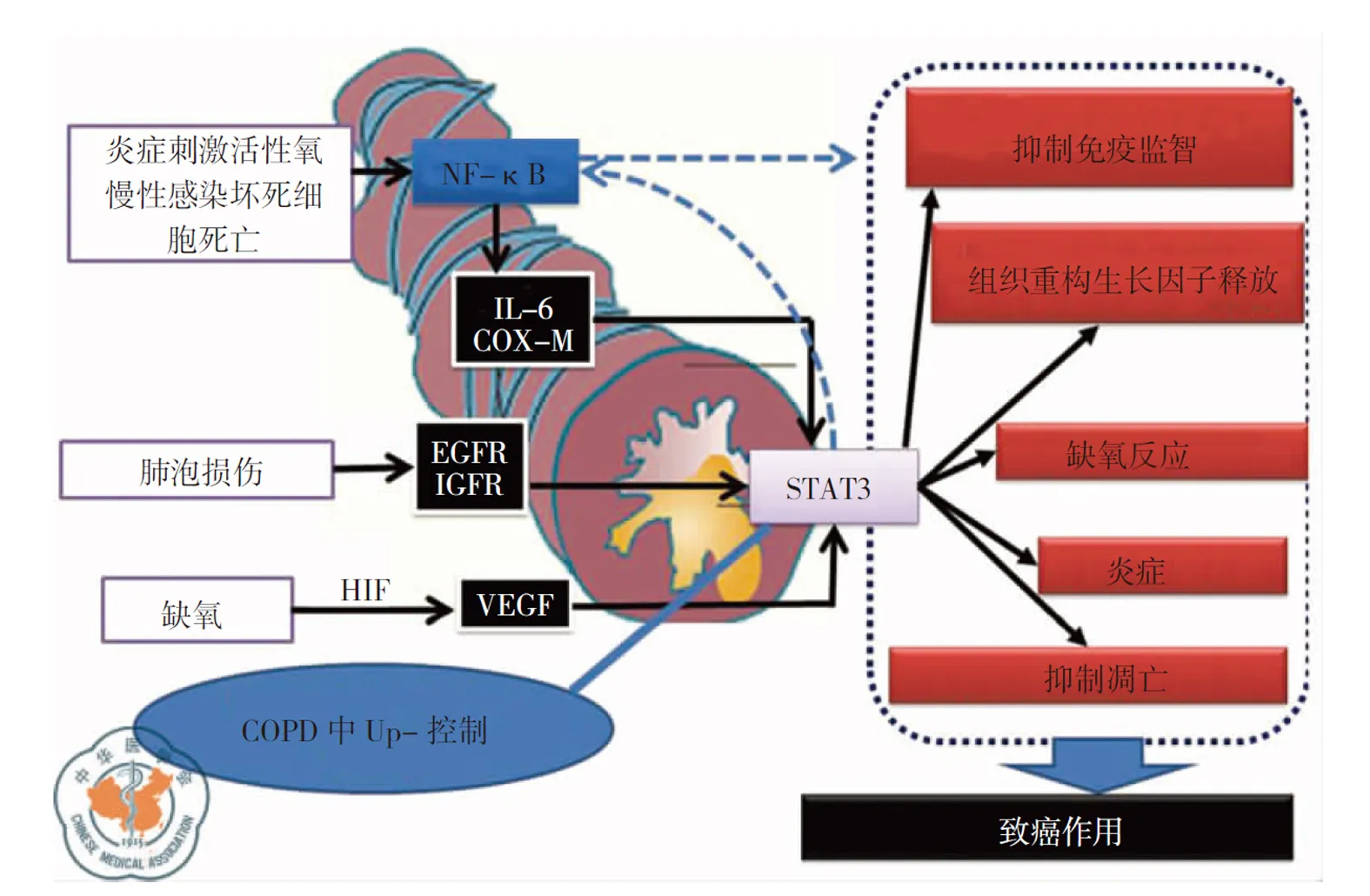
注:NF-κB: 核转录因子;IL-6:白细胞介素-6;COX-M: 环氧合酶;EGFR: 表皮生长因子受体;IGFR: 胰岛素样生
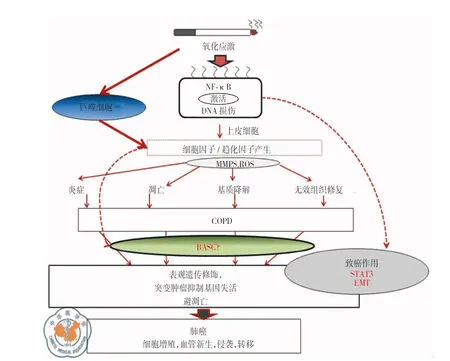
注:NF-κB: 核转录因子;DNA: 脱氧核糖核酸;MMPS: 基质金属蛋白酶;ROS:活性氧;COPD: 慢性阻塞性
五、COPD与肺癌预后的转录因子
虽然香烟烟雾中的ROS会导致COPD进而增加肺癌的发生风险。除此之外,细胞炎性因子(inflammatory cytokine)或炎症趋化因子(inflammatory chemokine)产生的活化作用和癌细胞中基因突变能促进肺癌的发生发展。许多转录因子和肺干细胞一样,在炎症微环境中起关键作用[17,45]。近来,有人报道称STAT3和NF-κB的活化作用,以及它们之间的相互作用在恶性肿瘤细胞及炎症微环境中,特别是在浸润型肿瘤(infiltrate tumor)的炎性细胞和免疫细胞之间的信号控制中起着重要作用[46-47]。在免疫细胞中,NF-κB和STAT3通过旁分泌促炎细胞因子(pro-inflammatory cytokines)通路调节其致癌效应,以其进一步调控NF-κB活性。NF-κB和STAT3也对上皮-间质细胞转化(epithelial-mesenchymal transition,EMT)有促进作用。在炎症微环境中,恶性肿瘤细胞的发展过程是从上皮细胞样形态(epithelial-like state)到成纤维细胞样状(fibroblaste-like state)的过程,进而发生肿瘤浸润和转移。在COPD和肿瘤中都存在细胞间的信号传导通路,包括三磷酸腺苷酶(adenosine triphosphatase, GTPase)信号传导通路和信号传导分子PI3K、NF-κB和STAT3。在促进EMT和胚胎中的信号通路合成物有关的炎症修复过程中这些信号通路有可能被激活[48]。
六、展望
虽然COPD和COPD引发肺癌的共同发病机制非常复杂,但主要是吸烟烟雾刺激、慢性炎症、炎症和炎症介质、炎症微环境(inflammatory microenvironment)、免疫紊乱(immune dysfunction)、细胞凋亡、细胞外基质退化、血管再生受限、DNA被破坏、NF-κB活化、STAT3等;还有α1-抗胰蛋白酶缺乏(α1-antitrypsin,α1-AT)、氧化应激(oxidative stress)、细胞生物学、肿瘤微环境(tumor microenvironment)、肿瘤免疫学(tumor immunology)、肿瘤分子生物学(oncomolecularbiology)、肺癌基因组学(lung cancer genomics)、癌症驱动因子(drive factor of cancer)、BRAF驱动因子、KRAS驱动基因、程序性死亡蛋白-1(programmed death-1, PD-1)和程序性死亡蛋白-L1(programmed death-L1, PD-L1)同样是COPD和并发肺癌的主要因素。 近来,肺癌的分子靶向治疗药物的发展有望极大延长抑制细胞毒T淋巴细胞相关蛋白-4(cytotoxic T-ly mphocyte antigen-4, CTLA-4)、PD-1/PL-L1等免疫疗法,并且已经产生了显著的临床作用[49]。为了改善肺癌患者的疗效和预后,必须战胜COPD以及由COPD引发的肺癌[50]。进一步从根源上研究和阐明COPD和肺癌的共同发病机制是至关重要的,这对肺癌预防、筛查及早期治疗有重要的临床意义。
参考文献
1任成山, 钱桂生. 慢性阻塞性肺疾病发病机制研究现状与展望[J/CD]. 中华肺部疾病杂志:电子版,2009, 2(2):104-115.
2廖晨, 余祖滨, 张萍, 等. 慢性阻塞性肺疾病合并肺癌122例临床特征分析[J/CD]. 中华肺部疾病杂志:电子版,2015, 8(1):30-34.
3Young RP, Hopkins RJ, Christmas T, et al. COPD prevalence is increased in lung cancer, independent of age, sex and smoking history[J]. Eur Respiratory J, 2009, 34(2): 380-386.
4Kiri VA, Soriano J, Visick G, et al. Recent trends in lung cancer and its association with COPD: an analysis usig the UK GP Research Database[J]. Prim Care RespirJ, 2010, 19(1):57-61.
5Yamada Y, Sekine Y, Suzuki H, et al. Trends of bacterial colonisation
and the risk of postoperative pneumonia in lug cancer patients with chronic obstrucive pulmonary disease[J]. Eur J Cardiothorac Surg, 2010, 37: 752-757.
6Raviv S, Hawkins KA, DeCamp MM Jr, et al. Lung cancer in chronic
obstructive pulmonary disease:enhancing surgical options and outcomes[J]. Am J Respir Crit Care Med, 2011, 183(9): 1138-1146.
7Sundar IK, Mullapudi N, Yao H, et al. Lung cancer and its association
with chronic obstructive pulmonary disease: update on nexus of epigenetics[J]. Cur Opin Pulm Med, 2011, 17(4): 279-285.
8Caremori G, Casolari P, Casolari P, et al. Mecha-nisms involved in lung cancer development in COPD[J] . The International Journal of Bichemistry &cell Biology, 2011, 43(7): 1030-1044.
9Rooney C, Sethi T. The epithelial cell and lung cancer: the link between chronic obstructive pulmonary diseases and lung cancer[J]. Respiration, 2011, 81(2): 89-104.
10Young RP, Hopkins RJ. How the genetics of lung cancer may overlap
with CIPD[J]. Respirlolgy, 2011, 16(7): 1047-1055.
11Zuiueta JJ, Wisnivesky JP, Henschke CI, et al. Emphysema scores predict death from COPD and lung cancer[J]. Chest, 2012, 141(5), 1216-1223.
12Sekine Y, Suzuki H, Yamada Y, et al. Severity of chronic obstructive
pulmonary disease and its relationship to lung cancer prognosis after surgical resection[J]. Thorac Cardiovasc Surg, 2013, 61(2): 124-130.
13Sekine Y, Eujisawa T, Suzuki K, et al. Detection of chronic obstructive
pulmonary disease in community-dased annual lung cancer sereening: Chiba COPD lung cancer screening study group[J]. Respirology, 2014, 19(1): 98-104.
14Houghton AM. Mechanistic links between COPD and lung cancer[J]. Net Rev Cancer, 2013, 13(6): 233-245.
15Sekine Y, Sakairi Y, Yoshino M, et al. The impact of combined pulmonary fibrosis and chronic obstrucitve pulmonary disease on long-term survival after lung cancer surgery[J]. Thorac Cardiovasc Surg, 2014(in press). doi: 10.1055/s-0033-1363478.
16陈勃江, 李为民. 肺癌与慢性阻塞性肺疾病相关性的研究进展[J]. 中华结核和呼吸杂志, 2014, 37(4): 290-293.
17Grivennokov SI, Karin M. Dangerour liaisons: STAT3 and NF-kappaB
collaboration and crosstalk in cancer[J]. Cytokine Growth Factor Rev, 2010, 21(1): 11-19.
18陈灏珠, 林果为, 王吉耀. 慢性阻塞性肺疾病//[M]. 顾宇彤.实用内科学. 第14版. 北京: 人民卫生出版社, 2013: 1694-1701.
19Vermaelen K, Brusselle G. Ets xposing a deadly alliance:Novel insights
into the biological links between COPD and lung cancer [J]. Pulm Pharmacol Ther, 2013, 26(5): 544-554.
20The top 10 causes of death, programmes and programmes and projects
in World Health Organization(WHO). Heep:www.who.int/mediacentre/factsheets/fs310/en/index.html updated:5Jan 2014
21Lin HH, Murray M, Cohen T, et al. Effects of smoking and solid-fuel use on COPD, lung cancer, and tuberculosis in China: a time based, multiple risk factor, modeling study[J]. Lancet, 2008, 372(9648): 1473-1483.
22de Torres JP, Marin JM, Casanova C, et al. Lung cancer in patients with chronic obstructive pulmonary disease-incidence and predicting factors[J]. Am J Respir Crit Care Med, 2011, 184(8): 913-919.
23Kurishima K, Satoh H, Ishikawa H, et al. Lung cancer patients with
chronic obstructive pulmonary disease[J]. Oncol Rep,2001, 8(1): 63-65.
24Vineis P, Airoldi L, Veglia F, et al. Environmental tobacco smoke and rist of respiratory cancer and chronic obstructive pulmonary disease in former smokers and neve smokera in the EPIC prospective study[J]. BMJ, 2005, 330(7486): 277.
25Mannino DM. Aguayo SM, Prtty TL, et al. Low lung function and incident lung cancer in the united States:data from the first National Health and Nutrition Examination Survey fol-low-up[J]. Arch Intern Med, 2003, 163(12): 1475-1480.
26Calabro E, Randi G, La Vecchia C, et al. Lung function predicts lung cancer risk in smokers:a tool for targeting screening programs[J]. Eur Respir J, 2010, 35(1): 146-151.
27Cote ML, Kardia SL, Wenzlaff AS, et al. Risk of lung cancer among
white and black relatives of individuals with early-onset lung cancer[J]. JAMA, 2005, 293(24): 3036-3042.
28任成山, 钱桂生. 支气管肺癌研究的新思维[J/CD]. 中华肺部疾病杂志:电子版, 2009, 2(3): 143-146.
29Guerra S, Stern DA, Zhou M, et al. Combined effects of parental and active smoking on early lung function deficits:a prospective study from birth to age 26 years[J].Thorax, 2013, 68(11): 1021-1028.
30Zhai R, Yu X, Wei Y, et al. Smoking and smoking cessation in relation to the development of co-existing non-small lung cancer with chronic obstructive pulmonary disease[J]. Int J Cancer, 2014, 134(4): 961-970.
31Lubin JH, Caporaso N, Hatsukami DK, et al.The association of a tobacco-specific biomarker and cigarette consumption and its dependence on host characteristic[J]. Cancer Epidemiol Biomarkers Prev, 2007,16(9): 1852-1857.
32Tuder RM, Petrache I. Pathogenesis of chronic obstructive pulmonary
disease[J]. J Clin Invest , 2012, 122(8): 2749-2755.
33杨瑞虹. 慢性阻塞性肺疾病合并肺癌的临床特征[J]. 实用癌症杂志, 2014, 29(10):1288-1290.
34Van Pottelberge GR, Mestdagh P, Bracke KR, et al. MicroRNA expression in iduced sputum of smokers and patients with chronic obstructive pulmonary disease[J]. Am J Respir Crit Care Med, 2011, 183(7): 898-906.
35Divo M, Cote C, de Torres JP, et al. Comorbidities and risk of mortality
in patients with chronic obstructive pulmonary disease[J]. American Journal of Respiratory and Critical Care Medicine, 2012,186(2):155-161.
36Brody JS, Spira A. State of the art. Chronic obstructive pulmonary disease, inflammation, and lung cancer[J]. Proc Am Thorac Soc, 2006, 3(6): 535-537.
37Sekine Y, Katsura H, Koh E, et al. Early detection of COPD is important
for lung cancer surveillance[J]. Eur Respir J, 2012, 39(5): 1230-1240.
38Adcock IM, Caramori G, Barnes PJ. Chronic obstructive pulmonary disease and lung cancer: new molecular insights [J]. Respiration, 2011, 81(4): 265-284.
39Wess J, Sos ML, Seidel D, et al. Frequent and focal FGFR1 amplification
associates with therapeutically tractable FGFR1 dependency in squamous cell lung cancer[J]. Sci Transl Med, 2012, 2(62): 62ra93.
40Vermaelen K, Brusselle G. Exposing a deadly alliance: novel insights
into the biological links between COPDand lung cancer[J]. Pulm Pharmacol Ther, 2013, 26(5): 544-554.
41中华医学会呼吸病学分会慢性阻塞性肺疾病学组.慢性阻塞性肺疾病整治指南(2013修订版)[J]. 中华结核和呼吸杂志, 2013, 36(4): 255-264.
42Kim CF, Jackson EL, Woolfenden AE, et al. Identification of bronchioalveolar
stem cell in normal lung and lung cancer[J]. Cell, 2005, 121(6): 823-835.
43Houghton AM, Mouded M, Shapiro SD. Common origins of lung cancer
and COPD[J]. Nat Med, 2008, 14(10): 1023-1024.
44Kratz JR, Yagui-Beltran A, Jablons DM. Cancer stem cells in lung tumorigenesis[J]. Ann Thorac Surg, 2010, 89(6): S2090-2095.
45Alamgeer M, Peacock CD, Matsui W, et al. Cancer stem cells in lung cancer :evidence and controversies[J]. Respirology, 2013, 18(5): 757-764.
46Castano Z, Fillmore CM, Kim CF, et al.The bed and the bugs:interactions between the tumor microenvironment and cancer stem cells[J]. Semin Cancer Biol, 2012, 22(5-6): 462-470.
47Lee H, Herrmann A, Deng JH, et al. persistently activated Stat3 maintains constitutive NF-kappaB activity in tumors[J]. Cancer cell, 2009,15(4): 283-293.
48Young RP, Hopkins RJ. How the genetics of lung cancer may overlap
with COPD[J]. Respirology, 2011, 16(7): 1047-1055.
49Topalian SL, Hodi FS, Brahmer JR, et al. safety, activity, and immune correlates of anti-PD-1 amtibody in cancer[J]. N Eng Med, 2012, 366(26): 2443-2454.
50Sekine Y, Hata A, Koh E, et al. Lung carcinogenesis from chronic obstructive pulmonary disease: characteristics of lung cancer from COPD and contribution of signal transucers and lung stem cell in the inflammatory microenvironment[J] . Gen Thorac Cardiovasc Surg, 2014, 62(7): 415-421.
(本文编辑:黄红稷)
任成山,白莉,钱桂生. 慢性阻塞性肺疾病合并肺癌临床特征及新理念[J/CD]. 中华肺部疾病杂志: 电子版, 2015, 8(2): 137-142.
·专家论坛·
收稿日期:(2015-03-01)
文献标识码:中图法分类号: R563 A
通讯作者:白莉,Email: blpost@126.com
基金项目:国家自然科学基金面上项目(81370139)
DOI:10.3877/cma.j.issn.1674-6902.2015.02.001

